Абдурахманов д т хронический гепатит
Обновлено: 23.04.2024
Кафедра внутренних, профессиональных болезней и пульмонологии Первого МГМУ им. И.М. Сеченова
Энтекавир в лечении хронического гепатита В: многоцентровые рандомизированные исследования и реальная клиническая практика
Журнал: Терапевтический архив. 2014;86(11): 100‑104
Абдурахманов Д.Т., Отрашевская A.В. Энтекавир в лечении хронического гепатита В: многоцентровые рандомизированные исследования и реальная клиническая практика. Терапевтический архив. 2014;86(11):100‑104.
Abdurakhmanov DT, Otrashevskaia AV. Entecavir in the treatment of chronic hepatitis B: multicenter randomized trials and real clinical practice. Terapevticheskii Arkhiv. 2014;86(11):100‑104. (In Russ.).
Кафедра внутренних, профессиональных болезней и пульмонологии Первого МГМУ им. И.М. Сеченова
Аннотация. В настоящее время целью лечения хронического гепатита В (ХГВ) являются улучшение качества жизни пациента и предотвращение неблагоприятных исходов заболевания, а не элиминация вируса из организма. Достижение этой цели возможно при длительном поддержании авиремии. Согласно международным и отечественным клиническим рекомендациям, энтекавир является препаратом первого ряда для лечения больных ХГВ. За почти 10 лет в мировой клинической практике доказаны высокая эффективность и благоприятный профиль безопасности энтекавира в ряде рандомизированных клинических исследований и в реальной врачебной практике в том числе в России. Так, в исследовании БРАВО (Бараклюд: Российский Анализ Вирусологического Ответа) с участием 147 больных ХГВ из 10 городов России частота авиремии составила 85,8% (n=147), 89,9% (n=138), 89,4% (n=97) и 93,5% (n=81) через 1, 2, 3 и 4 года соответственно. Помимо вирусологической, иммунологической и биохимической эффективности также доказана эффективность энтекавира в достижении обратного развития гистологических изменений, профилактике декомпенсации цирроза и развития гепатоцеллюлярной карциномы. Представленные данные позволяют уверенно использовать энтекавир для длительной терапии ХГВ.
Кафедра внутренних, профессиональных болезней и пульмонологии Первого МГМУ им. И.М. Сеченова
Хронический гепатит В (ХГВ) остается одной из наиболее актуальных проблем современной медицины вследствие его значительной распространенности (почти 350-400 млн инфицированных в мире) и большого риска (в 25-35% случаев) развития тяжелых осложнений - цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) [1]. В России, по оценкам экспертов, число больных ХГВ составляет от 300 до 600 тыс. Заболеваемость ХГВ в России в 2012 г. составила 12,6 на 100 000 населения, а некоторых регионах, в частности в Северо-Западном федеральном округе, достигала 31,5 на 100 000 населения [2].
Изменились подходы к ведению и лечению больных ХГВ. Представляется, что полная элиминация вируса из организма практически невозможна из-за внедрения вирусной ДНК в ядро гепатоцита. В этой связи терапия направлена на улучшение качества жизни пациента и предотвращение неблагоприятных исходов ХГВ (прежде всего, ЦП и ГЦК), а не элиминацию вируса из организма. Таким образом, мы можем говорить о переходе от краткосрочной терапии к длительному управлению заболеванием [3].
Длительная терапия энтекавиром не только подавляет репликацию вируса и останавливает прогрессирование гепатита у большинства пациентов, но и приводит к обратному развитию фиброза. Это установлено при анализе гистологических изменений в сравнительно большой когорте больных ХГВ (n=57), получавших энтекавир в течение 3-7 лет. Пункционная биопсия печени проводилась больным 3 раза (исходно, затем через 1 год и 3-7 лет после начала лечения) [10]. Изучение динамики фиброза печени показало, что уменьшение воспалительной активности наблюдалось у 96% больных, а уменьшение стадии фиброза - у 88%. У 10 из 57 больных с исходно тяжелым фиброзом или ЦП (4-6 баллов по Ishak) также наблюдался регресс фиброза. В целом индекс фиброза при длительном лечении энтекавиром снизился на 1,53 балла по шкале Ishak. В другом аналогичном по структуре японском исследовании (также у всех пациентов выполнялось 3 пункционные биопсии печени) уменьшение выраженности фиброза печени наблюдалось у 63% пациентов, получавших энтекавир в течение 3 лет [11].
Пациенты, рефрактерные к ламивудину. Энтекавир, ламивудин и телбивудин относятся к одной группе препаратов - аналогов нуклеозидов - и обладают перекрестной резистентностью. Соответственно, при последовательном применении препаратов данной группы эффективность терапии может значительно снижаться. Результаты исследований позволили авторам заключить, что применение энтекавира в дозе 1 мг/сут пациентами, рефрактерными к ламивудину, приводит к улучшению клинических и вирусологических показателей [12, 13]. Тем не менее следует отметить, что согласно международным и отечественным рекомендациям препаратом выбора у пациентов с подтвержденной резистентностью к ламивудину или телбивудину является тенофовир [3].
Пациенты, получающие иммуносупрессивную терапию. Хорошо известно, что у позитивных по HBsAg пациентов, получающих химио- или иммуносупрессивную терапию, достаточно высок риск реактивации вируса и развития тяжелого, в том числе фульминантного, поражения печени, что обусловливает необходимость превентивной терапии. Существуют данные, подтверждающие эффективность энтекавира в профилактике и лечении реактивации HBV-инфекции у такой категории пациентов. В исследовании с участием 80 больных с неходжкинской лимфомой, имевших маркеры перенесенной HBV-инфекции, которым проводили химиотерапию ритуксимабом, реактивация HBV наблюдалась в 2,4% случаев (у 1 из 41 пациента) в группе энтекавира и в 17,9% случаев (у 7 из 39 пациентов) в контрольной группе (p=0,027) [14].
Пациенты с сочетанной инфекцией вируса иммунодефицита человека (ВИЧ). Согласно последним рекомендациям по терапии ВИЧ-инфекции, пациенты с сочетанной инфекцией ВИЧ и ХГВ должны получать лечение обеих инфекций одновременно. Оптимальным считается назначение тенофовира в комбинации с эмтрицитабином или ламивудином в сочетании с третьим препаратом, активным в отношении ВИЧ-инфекции. Если невозможно назначить тенофовир, например из-за патологии почек, четвертым препаратом в дополнение к трехкомпонентной схеме АРВТ может использоваться энтекавир [16].
Данные по безопасности и резистентности. В многочисленных исследованиях установлены хорошая переносимость и благоприятный профиль безопасности энтекавира. В клинических исследованиях у пациентов с компенсированным поражением печени наиболее часто отмечались головная боль (9%), слабость (6%), головокружение (4%) и тошнота (3%). Достоверных различий по частоте регистрации НЯ у пациентов, принимавших энтекавир в суточной дозе 0,5 и 1 мг, не установлено [17]. Данные 5-летнего наблюдения подтверждают регистрационные исследования и свидетельствуют о благоприятном профиле безопасности энтекавира, в том числе в долгосрочной перспективе [11]. Энтекавир обладает высоким генетическим барьером к резистентности.
У ранее не леченных больных за 6-летний период наблюдения резистентность отмечена только в 1,2% случаев [18].
Энтекавир в исследованиях реальной клинической практики. Все эти данные получены в регистрационных рандомизированных исследованиях, которые дают важную информацию об эффективности и безопасности препарата, но имеют ограничения, обусловленные достаточно строгим отбором пациентов. В этой связи большое значение имеет анализ результатов применения препарата в повседневной клинической практике. К настоящему времени за почти 10-летний период после регистрации энтекавира для лечения больных ХГВ накоплен большой опыт его использования в реальной клинической практике в мире, в том числе в России. Одно из наиболее крупных в Европе (418 пациентов, не получавших ранее аналоги нуклеоз(т)идов, из 19 центров) исследований по оценке эффективности и безопасности энтекавира в реальной клинической практике проходит в Италии. К настоящему времени подведены итоги ретро- и проспективного анализа вплоть до 5 лет терапии (у 97 пациентов). Средний возраст больных составил 58 лет, у 49% исходно имелся ЦП, в том числе у 10% - ГЦК. К 5-му году терапии авиремия (ДНК HBV
В другом крупном европейском исследовании (VIRGIL), включавшем 243 пациента, которые не получали ранее аналоги нуклеоз(т)идов, прием энтекавира привел к авиремии на 3-м году лечения у 90 и 99% позитивных и негативных по HBeAg больных гепатитом В соответственно. У 34% пациентов отмечено выведение из крови HBeAg [20].
В крупном китайском исследовании (1768 пациентов, не получавших ранее аналоги нуклеоз(т)идов, из 50 центров), проведен анализ 3-летнего лечения энтекавиром [21]. Авиремия (ДНК HBV
В исследовании в Гонконге 222 пациента, не получавших ранее аналоги нуклеозидов, принимали энтекавир в дозе 0,5 мг/сут на протяжении 4 лет [22]. Кумулятивная частота авиремии и сероконверсии HBeAg к 4-му году составила 90 и 53% соответственно.
В ретроспективном анализе терапии энтекавиром 474 больных ХГВ, проведенном в Японии, кумулятивная частота авиремии к 4-му году лечения составила 96%, сероконверсия HBeAg отмечена в 42% случаев [23]. У 5 пациентов отмечен вирусологический рецидив в ходе лечения, в том числе у 2 - развитие резистентности к энтекавиру.
В другом китайском исследовании с участием 234 ранее не леченных пациентов, к 5-му году лечения энтекавиром авиремия достигнута в 100% случаев, а частота сероконверсии HBeAg (у позитивных по HBeAg больных) составила 15% [24]. Лишь у 1 пациента отмечено развитие резистентных штаммов вируса к энтекавиру.
В исследовании на Тайване лечение энтекавиром (0,5 мг/сут) проводилось на протяжении 3 лет у 248 больных ХГВ, позитивным по HBeAg [25]. Кумулятивная частота авиремии составила 52% (111 из 213), 79% (101 из 128) и 82% (33 из 40) на 1, 2 и 3-м годах лечения соответственно. Частота сероконверсии HBeAg составила 28% (64 из 231).
В Австралийском исследовании 163 не леченных ранее пациента с ХГВ получали энтекавир на протяжении 3 лет. Частота авиремии (ДНК HBV
Большой обзор исследований по оценке эффективности и безопасности энтекавира в реальной клинической практике в различных регионах мира (всего 13 исследований с участием 4434 больных) продемонстрировал, что после 3-летней терапии у первичных больных в среднем частота авиремии составляет более 90% и сероконверсии HBeAg около 30-40% (10-15% ежегодно) [27]. Риск развития резистентности к энтекавиру составил менее 1%.
Несколько одно- и многоцентровых исследований по оценке эффективности энтекавира в повседневной клинической практике проходят в Российской Федерации. В клинике им. Е.М. Тареева УКБ №3 Первого МГМУ им. И.М. Сеченова подведены промежуточные результаты 5-летнего приема энтекавира в дозе 0,5 мг/сут у 35 первичных больных ХГВ. Кумулятивная частота авиремии (ДНК HBV
Наблюдательный анализ эффективности и безопасности энтекавира в реальной практике в России - исследование БРАВО (Бараклюд: Российский Анализ Вирусологического Ответа) - с участием 147 больных ХГВ из 10 клинических центров в различных городах России (Москва, Ставрополь, Челябинск, Иркутск, Якутск, Казань, Самара) продемонстрировал сравнимые с аналогичными исследованиями за рубежом результаты. Кумулятивная частота авиремии (ДНК HBV n=147), 89,9% (n=138), 89,4% (n=97) и 93,5% (n=81) через 1, 2, 3 и 4 года соответственно. При анализе гистологических изменений отмечена положительная динамика (уменьшение выраженности воспаления и фиброза по шкале МETAVIR). Случаев прекращения лечения или развития серьезных НЯ, которые, по мнению исследователей, связаны с приемом препарата, не отмечено.
Профилактика декомпенсации и ГЦК. Наиболее неблагоприятными исходами ХГВ являются декомпенсация заболевания печени и развитие ГЦК. К сожалению, система регистрации больных ХГВ в России делает затруднительным понимание реальной ситуации по распространенности рака печени в исходе вирусного гепатита. Вследствие этого проблема зачастую остается недооцененной. В Италии в условиях реальной клинической практики проведено исследование, в котором оценивалась 5-летняя выживаемость без осложнений у больных ЦП в исходе ХГВ, ранее не получавших противовирусное лечение. Авторы показали, что выживаемость без декомпенсации в течение 5 лет терапии энтекавиром составила 100%. Частота развития ГЦК в этой же группе составила 2,8% в год [19].
Отдельный анализ по эффективности энтекавира как профилактики ГЦК проведен в Японии. В данном исследовании группа пациентов, получавших энтекавир (n=316), сравнивалась с группой исторического контроля, подобранной в соответствии с клиническими и демографическими показателями. Исследователи показали, что заболеваемость ГЦК в группе, получавшей энтекавир, достоверно ниже, чем в контрольной группе, не получавшей лечение. Наиболее выраженная разница отмечена при отдельном анализе больных ЦП. В этой подгруппе совокупная частота развития ГЦК за 5 лет составила 38,9% в контрольной группе и только 7% в группе, получавшей энтекавир [28].
Накопленный за почти 10-летний период опыт применения энтекавира позволяет с уверенностью констатировать, что его эффективность и безопасность в рандомизированных многоцентровых исследованиях подтверждается данными реальной клинической практики, полученными в том числе в России.
Таким образом, длительное подавление репликации вируса энтекавиром приводит к нормализации или значительному улучшению гистологической картины печени (в том числе регрессу фиброза), снижению риска развития ЦП и ГЦК и соответственно увеличению качества и продолжительности жизни пациентов.
Обсуждаются перспективы лечения хронического гепатита С (ХГС) с использованием нового класса препаратов, обладающих прямым противовирусным действием. Наиболее перспективным представляется сочетание ингибиторов протеазы или полимеразы с пегилированным интерфероном альфа и рибавирином, что, как показали результаты II фазы клинических исследований, значительно увеличивает эффективность лечения больных ХГС. В статье приведены результаты исследований телапревира, R7227 и R7128 у больных ХГС.
Cочетание пегилированногоинтерферона альфа (ПЭГ-ИФН) и рибавирина (РБВ)в настоящее время представляетсобой стандарт в лечении хронического гепатита (ХГС) и обеспечивает стойкий вирусологический ответ(СВО) в среднем в 50–60 % случаев.Эффективность лечения определяется главным образом генотипом HCV (40–50 % при инфицировании генотипом 1 и 70–80 % – α генотипом 2/3), атакже исходным уровнем виремии и еединамикой в ходе лечения, возрастом,расой, генетическим полиморфизмомгена IL-28B, выраженностью фиброзапечени, приверженностью пациента лечению и некоторыми другими фак-торами. Индивидуализация лечения(оптимизация длительности терапии и доз препаратов в зависимости от вышеперечисленных факторов), повышениеприверженности пациента лечению(своевременная профилактика и коррекция нежелательных явлений, психологическая поддержка) обеспечивают повышение его эффективности, нов целом почти у 40 % пациентов с ХГСпротивовирусная терапия оказывается неэффективной.
В настоящее время изучается рядпрепаратов с различным механизмомдействия (иммуномодуляторы, терапевтические вакцины, новые молекулыинтерферонов, ингибиторы репликации вируса и блокаторы проникновения вируса в клетку). Наибольшийинтерес сегодня представляют препараты с прямым противовирусным действием, которые подавляют или блокируют ключевые внутриклеточные этапы репликации вируса, преждевсего ингибиторы протеазы и полимеразы вируса.
Механизм действия ингибиторов протеазы связан с блокадой расщепления вирусного полипротеина на структурные и неструктурные компоненты,необходимые для функционированиявируса, а ингибиторов полимеразы –с нарушением репликации вирусной РНК.
Наиболее изученным к настоящемувремени ингибитором протеазы является телапревир, который проходит III фазу клинических исследований.
Телапревир (VX-750) представляетсобой производное α-кетоамида, соединенное ковалентной обратимой связью с протеазой NS3/NS4A.
В США и Европе подведены итогидвух крупных рандомизированныхисследований (PROVE-1 и PROVE-2)эффективности телапревира в различных дозах и сочетаниях с ПЭГ-ИФН альфа-2а (Пегасис) и РБВ (Копегус) у не леченных ранее больных, инфицированных генотипом 1 HCV (рис. 1) [1, 2].
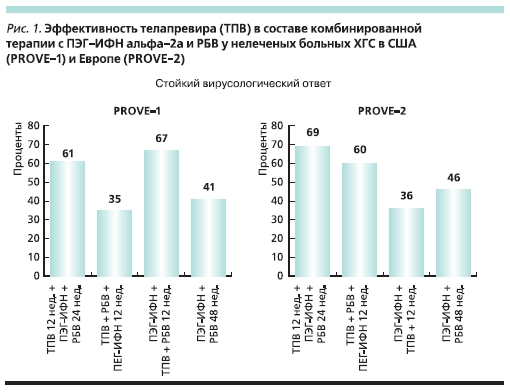
В группе больных, получавших телапревир в течение первых 12 недель в дополнение к ПЭГ-ИФН и РБВ в течени.
Кафедра внутренних, профессиональных болезней и пульмонологии Первого МГМУ им. И.М. Сеченова
Энтекавир в лечении хронического гепатита В: многоцентровые рандомизированные исследования и реальная клиническая практика
Журнал: Терапевтический архив. 2014;86(11): 100‑104
Абдурахманов Д.Т., Отрашевская A.В. Энтекавир в лечении хронического гепатита В: многоцентровые рандомизированные исследования и реальная клиническая практика. Терапевтический архив. 2014;86(11):100‑104.
Abdurakhmanov DT, Otrashevskaia AV. Entecavir in the treatment of chronic hepatitis B: multicenter randomized trials and real clinical practice. Terapevticheskii Arkhiv. 2014;86(11):100‑104. (In Russ.).
Кафедра внутренних, профессиональных болезней и пульмонологии Первого МГМУ им. И.М. Сеченова
Аннотация. В настоящее время целью лечения хронического гепатита В (ХГВ) являются улучшение качества жизни пациента и предотвращение неблагоприятных исходов заболевания, а не элиминация вируса из организма. Достижение этой цели возможно при длительном поддержании авиремии. Согласно международным и отечественным клиническим рекомендациям, энтекавир является препаратом первого ряда для лечения больных ХГВ. За почти 10 лет в мировой клинической практике доказаны высокая эффективность и благоприятный профиль безопасности энтекавира в ряде рандомизированных клинических исследований и в реальной врачебной практике в том числе в России. Так, в исследовании БРАВО (Бараклюд: Российский Анализ Вирусологического Ответа) с участием 147 больных ХГВ из 10 городов России частота авиремии составила 85,8% (n=147), 89,9% (n=138), 89,4% (n=97) и 93,5% (n=81) через 1, 2, 3 и 4 года соответственно. Помимо вирусологической, иммунологической и биохимической эффективности также доказана эффективность энтекавира в достижении обратного развития гистологических изменений, профилактике декомпенсации цирроза и развития гепатоцеллюлярной карциномы. Представленные данные позволяют уверенно использовать энтекавир для длительной терапии ХГВ.
Кафедра внутренних, профессиональных болезней и пульмонологии Первого МГМУ им. И.М. Сеченова
Хронический гепатит В (ХГВ) остается одной из наиболее актуальных проблем современной медицины вследствие его значительной распространенности (почти 350-400 млн инфицированных в мире) и большого риска (в 25-35% случаев) развития тяжелых осложнений - цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) [1]. В России, по оценкам экспертов, число больных ХГВ составляет от 300 до 600 тыс. Заболеваемость ХГВ в России в 2012 г. составила 12,6 на 100 000 населения, а некоторых регионах, в частности в Северо-Западном федеральном округе, достигала 31,5 на 100 000 населения [2].
Изменились подходы к ведению и лечению больных ХГВ. Представляется, что полная элиминация вируса из организма практически невозможна из-за внедрения вирусной ДНК в ядро гепатоцита. В этой связи терапия направлена на улучшение качества жизни пациента и предотвращение неблагоприятных исходов ХГВ (прежде всего, ЦП и ГЦК), а не элиминацию вируса из организма. Таким образом, мы можем говорить о переходе от краткосрочной терапии к длительному управлению заболеванием [3].
Длительная терапия энтекавиром не только подавляет репликацию вируса и останавливает прогрессирование гепатита у большинства пациентов, но и приводит к обратному развитию фиброза. Это установлено при анализе гистологических изменений в сравнительно большой когорте больных ХГВ (n=57), получавших энтекавир в течение 3-7 лет. Пункционная биопсия печени проводилась больным 3 раза (исходно, затем через 1 год и 3-7 лет после начала лечения) [10]. Изучение динамики фиброза печени показало, что уменьшение воспалительной активности наблюдалось у 96% больных, а уменьшение стадии фиброза - у 88%. У 10 из 57 больных с исходно тяжелым фиброзом или ЦП (4-6 баллов по Ishak) также наблюдался регресс фиброза. В целом индекс фиброза при длительном лечении энтекавиром снизился на 1,53 балла по шкале Ishak. В другом аналогичном по структуре японском исследовании (также у всех пациентов выполнялось 3 пункционные биопсии печени) уменьшение выраженности фиброза печени наблюдалось у 63% пациентов, получавших энтекавир в течение 3 лет [11].
Пациенты, рефрактерные к ламивудину. Энтекавир, ламивудин и телбивудин относятся к одной группе препаратов - аналогов нуклеозидов - и обладают перекрестной резистентностью. Соответственно, при последовательном применении препаратов данной группы эффективность терапии может значительно снижаться. Результаты исследований позволили авторам заключить, что применение энтекавира в дозе 1 мг/сут пациентами, рефрактерными к ламивудину, приводит к улучшению клинических и вирусологических показателей [12, 13]. Тем не менее следует отметить, что согласно международным и отечественным рекомендациям препаратом выбора у пациентов с подтвержденной резистентностью к ламивудину или телбивудину является тенофовир [3].
Пациенты, получающие иммуносупрессивную терапию. Хорошо известно, что у позитивных по HBsAg пациентов, получающих химио- или иммуносупрессивную терапию, достаточно высок риск реактивации вируса и развития тяжелого, в том числе фульминантного, поражения печени, что обусловливает необходимость превентивной терапии. Существуют данные, подтверждающие эффективность энтекавира в профилактике и лечении реактивации HBV-инфекции у такой категории пациентов. В исследовании с участием 80 больных с неходжкинской лимфомой, имевших маркеры перенесенной HBV-инфекции, которым проводили химиотерапию ритуксимабом, реактивация HBV наблюдалась в 2,4% случаев (у 1 из 41 пациента) в группе энтекавира и в 17,9% случаев (у 7 из 39 пациентов) в контрольной группе (p=0,027) [14].
Пациенты с сочетанной инфекцией вируса иммунодефицита человека (ВИЧ). Согласно последним рекомендациям по терапии ВИЧ-инфекции, пациенты с сочетанной инфекцией ВИЧ и ХГВ должны получать лечение обеих инфекций одновременно. Оптимальным считается назначение тенофовира в комбинации с эмтрицитабином или ламивудином в сочетании с третьим препаратом, активным в отношении ВИЧ-инфекции. Если невозможно назначить тенофовир, например из-за патологии почек, четвертым препаратом в дополнение к трехкомпонентной схеме АРВТ может использоваться энтекавир [16].
Данные по безопасности и резистентности. В многочисленных исследованиях установлены хорошая переносимость и благоприятный профиль безопасности энтекавира. В клинических исследованиях у пациентов с компенсированным поражением печени наиболее часто отмечались головная боль (9%), слабость (6%), головокружение (4%) и тошнота (3%). Достоверных различий по частоте регистрации НЯ у пациентов, принимавших энтекавир в суточной дозе 0,5 и 1 мг, не установлено [17]. Данные 5-летнего наблюдения подтверждают регистрационные исследования и свидетельствуют о благоприятном профиле безопасности энтекавира, в том числе в долгосрочной перспективе [11]. Энтекавир обладает высоким генетическим барьером к резистентности.
У ранее не леченных больных за 6-летний период наблюдения резистентность отмечена только в 1,2% случаев [18].
Энтекавир в исследованиях реальной клинической практики. Все эти данные получены в регистрационных рандомизированных исследованиях, которые дают важную информацию об эффективности и безопасности препарата, но имеют ограничения, обусловленные достаточно строгим отбором пациентов. В этой связи большое значение имеет анализ результатов применения препарата в повседневной клинической практике. К настоящему времени за почти 10-летний период после регистрации энтекавира для лечения больных ХГВ накоплен большой опыт его использования в реальной клинической практике в мире, в том числе в России. Одно из наиболее крупных в Европе (418 пациентов, не получавших ранее аналоги нуклеоз(т)идов, из 19 центров) исследований по оценке эффективности и безопасности энтекавира в реальной клинической практике проходит в Италии. К настоящему времени подведены итоги ретро- и проспективного анализа вплоть до 5 лет терапии (у 97 пациентов). Средний возраст больных составил 58 лет, у 49% исходно имелся ЦП, в том числе у 10% - ГЦК. К 5-му году терапии авиремия (ДНК HBV
В другом крупном европейском исследовании (VIRGIL), включавшем 243 пациента, которые не получали ранее аналоги нуклеоз(т)идов, прием энтекавира привел к авиремии на 3-м году лечения у 90 и 99% позитивных и негативных по HBeAg больных гепатитом В соответственно. У 34% пациентов отмечено выведение из крови HBeAg [20].
В крупном китайском исследовании (1768 пациентов, не получавших ранее аналоги нуклеоз(т)идов, из 50 центров), проведен анализ 3-летнего лечения энтекавиром [21]. Авиремия (ДНК HBV
В исследовании в Гонконге 222 пациента, не получавших ранее аналоги нуклеозидов, принимали энтекавир в дозе 0,5 мг/сут на протяжении 4 лет [22]. Кумулятивная частота авиремии и сероконверсии HBeAg к 4-му году составила 90 и 53% соответственно.
В ретроспективном анализе терапии энтекавиром 474 больных ХГВ, проведенном в Японии, кумулятивная частота авиремии к 4-му году лечения составила 96%, сероконверсия HBeAg отмечена в 42% случаев [23]. У 5 пациентов отмечен вирусологический рецидив в ходе лечения, в том числе у 2 - развитие резистентности к энтекавиру.
В другом китайском исследовании с участием 234 ранее не леченных пациентов, к 5-му году лечения энтекавиром авиремия достигнута в 100% случаев, а частота сероконверсии HBeAg (у позитивных по HBeAg больных) составила 15% [24]. Лишь у 1 пациента отмечено развитие резистентных штаммов вируса к энтекавиру.
В исследовании на Тайване лечение энтекавиром (0,5 мг/сут) проводилось на протяжении 3 лет у 248 больных ХГВ, позитивным по HBeAg [25]. Кумулятивная частота авиремии составила 52% (111 из 213), 79% (101 из 128) и 82% (33 из 40) на 1, 2 и 3-м годах лечения соответственно. Частота сероконверсии HBeAg составила 28% (64 из 231).
В Австралийском исследовании 163 не леченных ранее пациента с ХГВ получали энтекавир на протяжении 3 лет. Частота авиремии (ДНК HBV
Большой обзор исследований по оценке эффективности и безопасности энтекавира в реальной клинической практике в различных регионах мира (всего 13 исследований с участием 4434 больных) продемонстрировал, что после 3-летней терапии у первичных больных в среднем частота авиремии составляет более 90% и сероконверсии HBeAg около 30-40% (10-15% ежегодно) [27]. Риск развития резистентности к энтекавиру составил менее 1%.
Несколько одно- и многоцентровых исследований по оценке эффективности энтекавира в повседневной клинической практике проходят в Российской Федерации. В клинике им. Е.М. Тареева УКБ №3 Первого МГМУ им. И.М. Сеченова подведены промежуточные результаты 5-летнего приема энтекавира в дозе 0,5 мг/сут у 35 первичных больных ХГВ. Кумулятивная частота авиремии (ДНК HBV
Наблюдательный анализ эффективности и безопасности энтекавира в реальной практике в России - исследование БРАВО (Бараклюд: Российский Анализ Вирусологического Ответа) - с участием 147 больных ХГВ из 10 клинических центров в различных городах России (Москва, Ставрополь, Челябинск, Иркутск, Якутск, Казань, Самара) продемонстрировал сравнимые с аналогичными исследованиями за рубежом результаты. Кумулятивная частота авиремии (ДНК HBV n=147), 89,9% (n=138), 89,4% (n=97) и 93,5% (n=81) через 1, 2, 3 и 4 года соответственно. При анализе гистологических изменений отмечена положительная динамика (уменьшение выраженности воспаления и фиброза по шкале МETAVIR). Случаев прекращения лечения или развития серьезных НЯ, которые, по мнению исследователей, связаны с приемом препарата, не отмечено.
Профилактика декомпенсации и ГЦК. Наиболее неблагоприятными исходами ХГВ являются декомпенсация заболевания печени и развитие ГЦК. К сожалению, система регистрации больных ХГВ в России делает затруднительным понимание реальной ситуации по распространенности рака печени в исходе вирусного гепатита. Вследствие этого проблема зачастую остается недооцененной. В Италии в условиях реальной клинической практики проведено исследование, в котором оценивалась 5-летняя выживаемость без осложнений у больных ЦП в исходе ХГВ, ранее не получавших противовирусное лечение. Авторы показали, что выживаемость без декомпенсации в течение 5 лет терапии энтекавиром составила 100%. Частота развития ГЦК в этой же группе составила 2,8% в год [19].
Отдельный анализ по эффективности энтекавира как профилактики ГЦК проведен в Японии. В данном исследовании группа пациентов, получавших энтекавир (n=316), сравнивалась с группой исторического контроля, подобранной в соответствии с клиническими и демографическими показателями. Исследователи показали, что заболеваемость ГЦК в группе, получавшей энтекавир, достоверно ниже, чем в контрольной группе, не получавшей лечение. Наиболее выраженная разница отмечена при отдельном анализе больных ЦП. В этой подгруппе совокупная частота развития ГЦК за 5 лет составила 38,9% в контрольной группе и только 7% в группе, получавшей энтекавир [28].
Накопленный за почти 10-летний период опыт применения энтекавира позволяет с уверенностью констатировать, что его эффективность и безопасность в рандомизированных многоцентровых исследованиях подтверждается данными реальной клинической практики, полученными в том числе в России.
Таким образом, длительное подавление репликации вируса энтекавиром приводит к нормализации или значительному улучшению гистологической картины печени (в том числе регрессу фиброза), снижению риска развития ЦП и ГЦК и соответственно увеличению качества и продолжительности жизни пациентов.
ПППД — препараты прямого противовирусного действия
УВО — устойчивый вирусологический ответ
ХГС — хронический гепатит С
BAFF (B-cell activating factor) — В-лимфоцитарный активирующий фактор
HCV — вирус гепатита С
HLA — Human leukocyte antigens
В-НХЛ — В-клеточная неходжкинская лимфома
Несмотря на большие успехи, достигнутые в последние годы в лечении больных хроническим гепатитом С (ХГС) препаратами прямого противовирусного действия (ПППД) [1], лечение больных с ассоциированным с вирусом гепатита С (HCV) криоглобулинемическим васкулитом (КВ) по-прежнему представляет значительные трудности. Частота достижения устойчивого вирусологического ответа (УВО) у больных КВ меньше, при этом элиминация вируса не гарантирует отсутствие рецидива КВ [2]. Кроме того, лечение ПППД больных ХГС в настоящее время не является общедоступным. Таким образом, представляется актуальным поиск причин формирования криоглобулинемии (КГ), ассоциированной с HCV, что внесет вклад в прогнозирование течения инфекции и сыграет важную роль в персонификации лечения таких пациентов.
Если темпы прогрессирования ХГС зависят как от факторов хозяина, так и от факторов вируса, то развитие КГ и КВ, вероятно, определяется особенностями организма больного. Изучение характеристик вируса (генотип и уровень виремии) не выявило их влияния на риск и частоту развития КГ [12—14]. Дальнейшие попытки оценить вклад самого вируса в развитие КГ были направлены на поиск мутаций в гипервариабельном участке (HVR1) вируса — белке Е2, взаимодействие которого с рецептором CD-81 на поверхности В-лимфоцитов приводит к стимуляции образования B-клеточного клона, продуцирующего криоглобулины. M. Gerotto и соавт. [15] обнаружили вставочную мутацию в 385-м кодоне HVR1, ответственную, по мнению исследователей, за способность белка Е2 к дополнительной стимуляции В-лимфоцитов. Однако дальнейшие исследования показали, что мутации в HVR1HVC не ассоциированы с наличием КГ; наконец, несколько последующих исследований установили, что специфические изменения вируса в белке Е2 не являются причиной патологической В-клеточной пролиферации [16, 17].
Следующий шаг в поиске причин продукции КГ и доказательств независимости этого явления от факторов вируса сделали исследователи из Италии. Учитывая данные наблюдений о географической неоднородности выявления КГ с преобладанием последней в странах Средиземноморья, исследователи сравнили распространенность В-клеточной моноклональности при ХГС у жителей Италии и Японии. В начале эпидемиологического исследования предполагалось, что низкая частота выявления КГ у этнических японцев может быть связана с особенностью их диеты — так называемой низкоантигенной диетой, способной снизить уровень сывороточных криоглобулинов [18]. В ходе исследования было показано, что ни один из обследованных больных с ХГС из Японии не имел признаков В-клеточной моноклональности, а также между обследованными группами из двух стран отсутствовали различия по полу, возрасту, длительности и тяжести заболевания и генотипу вируса. Таким образом, авторы сделали вывод, что низкая распространенность КГ у этнических японцев связана с генетическими особенностями, а HVС способен провоцировать В-клеточную моноклональность в присутствии некоторых, пока не идентифицированных, особенностей организма человека [19]. В результате сформировалось приоритетное направление поиска генетически детерминированных факторов организма хозяина в развитии КГ.
Другим направлением изучения генетических факторов патогенеза КГ является оценка В-лимфоцитов (как главных продуцентов криоглобулинов) и факторов их регуляции. Значительный интерес представляют работы по изучению В-лимфо-цитарного активирующего фактора — (B-cellactivatingfactor — BAFF), необходимого для регуляции развития, созревания и продукции иммуноглобулинов. BAFF относится к суперсемейству α-фактора некроза опухоли и секретируется преимущественно клетками миелоидного ряда (макрофагами, моноцитами, дендритными клетками) [30]. Известно, что наличие высокого уровня BAFF в остром периоде гепатита С увеличивает риск хронизации инфекции [31]. Как показало исследование E. Toubi и соавт. [32], высокий уровень BAFF у больных ХГС ассоциирован с артралгиями и/или васкулитом, а также наличием КГ и антител к кардиолипину, что является отражением хронической неспецифической В-клеточной пролиферации и антигенной стимуляции. Эти данные подтверждены в исследовании D. Sene и соавт. [33], показавшими значительную роль BAFF в возникновении и поддержании В-клеточной клональности. В 2006 г. A. Novak и соавт. [34] проанализировали генетические полиморфизмы промотора BAFF у пациентов с хронической B-клеточной лимфоцитарной лейкемией. В результате исследования показано, что высокий уровень экспрессии BAFF достоверно коррелировал с наличием аллеля T в позиции –871; кроме того, более высокая концентрация BAFF зафиксирована у пациентов с наследственной В-клеточной лимфоцитарной лейкемией по сравнению со спорадической формой [34]. Последующие исследования подтвердили ассоциацию КГ и высокого уровня BAFF с наличием аллеля T, особенно в гомозиготном состоянии [35—37].
Наличие иммунных комплексов при КГ может быть связано не только с избыточной продукцией иммуноглобулинов, но и с нарушением их клиренса клетками иммунной системы. Эти изменения могут быть вызваны нарушением функционирования рецепторов Fc (FcRs) на поверхности клеток, осуществляющих фагоцитоз. В свою очередь правильная работа FcRs обеспечивает, помимо указанных, множество биологических функций, таких как цитолиз, дегрануляция тучных клеток, активация и пролиферация В-клеток и др. [38]. Так, известно, что при системной красной волчанке мутации в генах, кодирующих FcRs, приводят к нарушению утилизации иммунных комплексов. Вместе с тем остается открытым вопрос о роли FcRs в иммунопатогенезе КГ, ассоциированной с HCV. В литературе представлены несколько исследований по изучению ассоциации генетических полиморфизмов FcRs с развитием КГ. D. Vassilopoulos и соавт. [39], проанализировав группу пациентов с различными лимфопролиферативными нарушениями при ХГС, включая КГ, не выявили различий по распространенности конкретных аллелей генов FcRs между основной и контрольной группами. Сходные данные получены L. Gragnani и соавт. [36] на большой группе пациентов. Отсутствие превалирования тех или иных вариантных аллелей у пациентов с КГ, по мнению авторов, подвергает сомнению теорию аккумуляции иммунных комплексов при КГ вследствие генетически обусловленного низкого сродства FcRs. Между тем при ревматоидном артрите, который имеет некоторые патогенетические сходства с КГ, обнаружены вариантные аллели FcRs, предрасполагающие к развитию болезни и/или более тяжелому ее течению [36].
Кроме того, возможная причина недостаточной утилизации иммунных депозитов при КГ заключается не в нарушениях работы клеток, выполняющих элиминацию комплексов, а в особенностях самого криопреципитата. Поэтому важно изучение его состава и причин формирования. Наиболее показательные исследования в этом направлении посвящены изучению фибронектина — одного из постоянных компонентов криопреципитата [20]. Фибронектин — адгезивный гликопротеин, важнейшими функциями которого являются обеспечение связывающей способности для клеток, белков, цитокинов, а также взаимодействие с иммунными комплексами. Показано высокое сродство фибронектина гломерулярного матрикса к моноклональному компоненту IgMk-РФ криоглобулинов II типа, ведущее к формированию прочных иммунных комплексов, что может объяснять высокую нефритогенность криоглобулинов данного типа [40]. Несмотря на важную роль фибронектина в воспалении и иммунных процессах, немногочисленные исследования посвящены изучению его генетических вариаций; имеющиеся работы по генетическим полиморфизмам фибронектина рассматривают в основном, их роль в иммунопатогенезе остеоартроза и формировании фиброза легочной ткани при системной склеродермии [41, 42]. M. Fabris и соавт. [43] впервые изучили связь нескольких полиморфизмов (HaeIIIb и MspI) гена фибронектина с формированием КВ и В-НХЛ у больных ХГС с КГ II типа. Показано, что распространенность аллельных вариантов изучаемых полиморфизмов не различалась у больных с КВ и без него, а также не выявлена связь полиморфизмов с различными клиническими проявлениями КВ (артралгиями, язвенным поражением конечностей, гломерулонефритом, периферической невропатией и др.). Уровень фибронектина в плазме был выше у пациентов с КВ, однако не коррелировал с аллельными вариантами гена. Между тем исследователи впервые обнаружили полиморфизмы гена фибронектина, имеющие сильную ассоциацию с развитием В-НХЛ у пациентов с КВ: в частности, у носителей гомозиготных генотипов DD-MspI и АА-HaeIIIb риск развития лимфомы выше соответственно в 5,99 и 4,82 раза [43]. Подобный вывод в случае подтверждения дальнейшими исследованиями поможет делать прогноз развития лимфопролиферативных заболеваний у больных ХГС.
Наконец, с развитием технологий в области генетики появилась возможность большей детализации генетических факторов риска, в частности метод полногеномного анализа с выявлением нуклеотидных мутаций (GWAS — genomewideassociationstudy). Одним из классических примеров использования этого метода является обнаружение ассоциации гена интерлейкина-28 В (ИЛ-28В) с достижением УВО у пациентов, инфицированных HCV 1-го генотипа [44—46]. Важность определения генетических вариаций ИЛ-28 В также оценена для некоторых групп пациентов с модифицированным иммунным ответом, например у пациентов с сочетанной инфекцией ХГС+ВИЧ или трансплантацией печени. Однако остается открытым вопрос о возможной предикторной роли полиморфизма гена ИЛ-28 В в формировании ассоциированных с HCV лимфопролиферативных заболеваний, таких как К.Г. Основанием предполагать участие полиморфизмов гена ИЛ-28 В в индукции иммунного ответа при КГ является то, что данный ген кодирует интерферон-λ3, который играет важную роль не только в формировании противовирусного ответа, но и в регуляции созревания и дифференцировки клеток миелоидного ряда, продукции цитокинов макрофагами, таким образом являясь важной частью системы врожденного иммунитета [47]. В настоящее время в литературе представлены немногочисленные исследования по данному вопросу. При изучении аллельных вариантов гена ИЛ-28 В у 250 больных КГ, ассоциированной с HCV, и 231 пациентов с ХГС без КГ, не найдены различия между двумя группами, тем самым не подтвердилась гипотеза об участии генетических полиморфизмов ИЛ-28 В в формировании К.Г. Не подтвердилось прогностическое значение полиморфизма ИЛ-28 В в достижении УВО у пациентов с К.Г. Дальнейшие исследования позволят подтвердить или опровергнуть участие ИЛ-28 В в формировании КГ.
Методика полногеномного анализа применена при поиске полиморфизмов, ассоциированных с развитием КГ, в работе A. Zignego и соавт. [38]. Исследование включило 356 пациентов западно-европейской популяции с КВ, ассоциированным с HCV, группу контроля составили 447 больных ХГС без КГ. В результате полногеномного анализа выявлены два региона на 6-й хромосоме, имеющие однонуклеотидные полиморфизмы, ассоциированные с К.В. Каждая дополнительная копия аллеля G в позиции rs9461776 HLA-региона (между генами HLA-DQA1 и HLA-DRB1) и аллеля, А в интроне гена NOTCH4 (rs2071286) увеличивала риск развития КВ в 2,16 и 2,15 раза соответственно. Однако ввиду тесной корреляции между генотипами двух описанных полиморфизмов затруднительно оценить индивидуальный вклад каждого региона в увеличение риска развития КВ [11].
Заключение
КГ относится к частым внепеченочным проявлением HCV-инфекции и, несмотря на изначально доброкачественную лимфопролиферативную природу, может приводить к развитию злокачественных лимфом, а также значительно усугублять течение ХГС. Возможность прогнозировать подобные исходы позволит персонифицировать лечение пациентов, что является передовым подходом в современной медицине. Прогресс в этом направлении произошел с развитием современных технологий в области генетики. КГ, ассоциированная с HCV, и КВ служат примером заболеваний, в которых генетические нарушения играют особую роль в патогенезе, течении и исходах. Проведение многоцентровых исследований, включающих большие группы пациентов, с применением современных геномных технологий откроет новый этап в поиске причин формирования КГ и КВ при HCV-инфекции.
Обсуждаются перспективы лечения хронического гепатита С (ХГС) с использованием нового класса препаратов, обладающих прямым противовирусным действием. Наиболее перспективным представляется сочетание ингибиторов протеазы или полимеразы с пегилированным интерфероном альфа и рибавирином, что, как показали результаты II фазы клинических исследований, значительно увеличивает эффективность лечения больных ХГС. В статье приведены результаты исследований телапревира, R7227 и R7128 у больных ХГС.
Cочетание пегилированногоинтерферона альфа (ПЭГ-ИФН) и рибавирина (РБВ)в настоящее время представляетсобой стандарт в лечении хронического гепатита (ХГС) и обеспечивает стойкий вирусологический ответ(СВО) в среднем в 50–60 % случаев.Эффективность лечения определяется главным образом генотипом HCV (40–50 % при инфицировании генотипом 1 и 70–80 % – α генотипом 2/3), атакже исходным уровнем виремии и еединамикой в ходе лечения, возрастом,расой, генетическим полиморфизмомгена IL-28B, выраженностью фиброзапечени, приверженностью пациента лечению и некоторыми другими фак-торами. Индивидуализация лечения(оптимизация длительности терапии и доз препаратов в зависимости от вышеперечисленных факторов), повышениеприверженности пациента лечению(своевременная профилактика и коррекция нежелательных явлений, психологическая поддержка) обеспечивают повышение его эффективности, нов целом почти у 40 % пациентов с ХГСпротивовирусная терапия оказывается неэффективной.
В настоящее время изучается рядпрепаратов с различным механизмомдействия (иммуномодуляторы, терапевтические вакцины, новые молекулыинтерферонов, ингибиторы репликации вируса и блокаторы проникновения вируса в клетку). Наибольшийинтерес сегодня представляют препараты с прямым противовирусным действием, которые подавляют или блокируют ключевые внутриклеточные этапы репликации вируса, преждевсего ингибиторы протеазы и полимеразы вируса.
Механизм действия ингибиторов протеазы связан с блокадой расщепления вирусного полипротеина на структурные и неструктурные компоненты,необходимые для функционированиявируса, а ингибиторов полимеразы –с нарушением репликации вирусной РНК.
Наиболее изученным к настоящемувремени ингибитором протеазы является телапревир, который проходит III фазу клинических исследований.
Телапревир (VX-750) представляетсобой производное α-кетоамида, соединенное ковалентной обратимой связью с протеазой NS3/NS4A.
В США и Европе подведены итогидвух крупных рандомизированныхисследований (PROVE-1 и PROVE-2)эффективности телапревира в различных дозах и сочетаниях с ПЭГ-ИФН альфа-2а (Пегасис) и РБВ (Копегус) у не леченных ранее больных, инфицированных генотипом 1 HCV (рис. 1) [1, 2].

В группе больных, получавших телапревир в течение первых 12 недель в дополнение к ПЭГ-ИФН и РБВ в течени.
Читайте также:

