Аденоассоциированный вирус типа 2
Обновлено: 24.04.2024
ДНК-вирусы. Этапы репликации вирусов с ДНК геномом.
Оспо-, асфаро- и иридовирусы имеют вирионную транскриптазу (ДНК-зависимую РНК-полимеразу) и размножаются в цитоплазме. Их очень большие геномы кодируют многочисленные ферменты, которые делают их репликацию независимой от клеточного ядра. Моноцистронные мРНК транскрибируются непосредственно на вирусной ДНК.
После разрушения наружной оболочки вириона клеточными ферментами на вирусной ДНК с помощью вирионной ДНК-зависимой РНК-полимеразы синтезируются ранние мРНК. Они транслируются в вирусные белки с помощью которых вирионная ДНК полностью освобождается от белка и реплицируется по полуконсервативному механизму. Вначале синтезируются фрагменты ДНК (фрагменты Оказаки), которые затем соединяются с образованием зрелых вирусных ДНК.
Поздние моно- и полицистронные мРНК транскрибируются после начала репликации вирусной ДНК и кодируют синтез структурных белков вириона. Иридовирусы и асфаровирусы, по-видимому, обладают сходной с вирусами оспы стратегией репликации.
Герпес-, адено-, папиллома и полиомавирусы в одном отношении имеют общую стратегию репликации: вирусная ДНК транскрибируется в ядре клеточной ДНК-зависимой РНК-полимеразой II. В течение определенного промежутка времени проходит два или более циклов транскрипции различных генных единиц (групп генов под контролем одного промотора). Субгеномные полицистронные РНК-транскрипты подвергаются расщеплению и сплайсингу, превращаясь в моноцистронные мРНК.
У папиллома- и полиомавирусов транскрипционная программа состоит по крайней мере из двух циклов (ранние и поздние мРНК), а у герпес- и аденовирусов по крайней мере из трех (сверхранние, ранние и поздние мРНК). В каждом случае вирионные полипептиды синтезируются на мРНК, появляющейся в последнем цикле транскрипции (поздние мРНК). ДНК аденовирусов, папиллома- и полиомавирусов может встраиваться в геном клетки-хозяина, реплицироваться вместе с ним, передаваться дочерним клеткам и транслироваться с образованием вирусных белков.
Парво- и цирковирусы, обладающие оцДНК, реплицируются в ядре. Эти вирусы используют клеточные ДНК-полимеразы для синтеза двуспиральной ДНК, которая затем транскрибируется в ядре клеточной ДНК-зависимой РНК-полимеразой II. Синтезированные транскрипты подвергаются сплайсингу и превращаются в мРНК.
Вирионная ДНК служит матрицей для синтеза (+) и (-)ДНК. Последние включаются в вирионы в качестве генома.
Различают недефектные (автономные) и дефектные парвовирусы. Первые размножаются самостоятельно, тогда как вторые реплицируются только в присутствии вируса-помощника, которым является любой аденовирус или вирус простого герпеса. В связи с этим дефектные парвовирусы называют аденоассоциированными вирусами (ААВ). В вирионах недефектных парвовирусов содержится односпиральная линейная (+)ДНК. Дефектные парвовирусы являются уникальными в мире вирусов, поскольку комплементарные плюс- и минус-ДНК входят в различные вирионы.
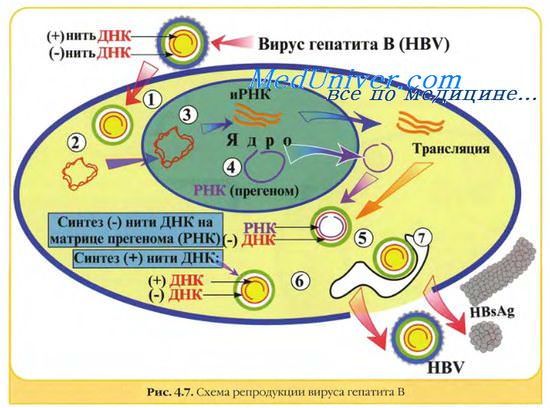
Гепаднавирусы. Частично двуцепочечная ДНК генома гепаднавирусов с помощью вирионной ДНК-полимеразы превращается в суперспирализованную двуцепочечную ДНК. Затем с помощью клеточной РНК-полимеразы II образуются мРНК для вирусных белков, в том числе для обратной транскриптазы, и полноразмерная (+)РНК, которая служит матрицей для обратной вирусной транскрипции с образованием (-)ДНК, на которой в свою очередь синтезируется частично двуцепочечная ДНК. мРНК транскрибируется на двуцепочечной ДНК, стартуя от различных промоторов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
Автор
Редакторы
Калифорнийские ученые разработали беспромоторную и безнуклеазную стратегию компенсации мутаций гена свертывающего фактора IX, тем самым избавив от повышенной кровоточивости разновозрастных мышей. Остроумный способ конструирования и введения терапевтического вектора предполагает наименьшее количество возможных побочных эффектов этиологического лечения не только гемофилии B, но и других наследственных заболеваний.

Спектр дефектов генов F8 и F9 чрезвычайно широк: потери целых генов или делеции их фрагментов, инверсии интронов, инсерции, дупликации, сплайсинг-, нонсенс- и миссенс-мутации. В зависимости от типа мутации развивается заболевание определенной тяжести.
Для гемофилий A и B характерен отсроченный геморрагический синдром, обусловленный нарушением первой фазы свертывания крови — образования активного плазменного тромбопластина. При минимальных травмах или даже спонтанно возникают болезненные кровоизлеяния: в мягкие ткани (подкожные, внутримышечные, в забрюшинное пространство, стенки кишечника и др.), в кости и суставы (инвалидизирующие гемартрозы), мозг [5]. Носовые или связанные с удалением зубов кровотечения иногда не удаётся остановить несколько часов.
Профилактика травм и заместительная терапия — все, чем на сегодняшний день располагает больной гемофилией. Замещение недостающего фактора свертывания производится в целях профилактики и купирования кровотечений свежезамороженной плазмой и концентратами человеческих (или полученных из животных) факторов VIII и IX. Но: факторы быстро выводятся из организма, существует риск переноса хронических вирусных инфекций, как и риск выработки ингибиторов — антител, нейтрализующих вводимый антигемофильный фактор. Тогда назначаются антиингибиторные комплексы, плазмаферез и даже иммунодепрессанты.
Недавно начаты клинические испытания некоторых генотерапевтических подходов, однако ни один из них пока не признан безоговорочно безопасным даже теоретически.
Как перенести терапевтический ген в нужные клетки и обеспечить его поддержание?
Аденоассоциированные вирусы (AAV), содержащие одноцепочечную ДНК, почти всем хороши: не вызывают болезней у человека (потому и иммунная система их почти игнорирует), обладают тропизмом к разным тканям, могут производить терапевтические продукты как в виде эписом, так и очень быстро и даже специфично рекомбинировав с хромосомной ДНК. Одно плохо: клонировать в такие векторы можно до 4,5 тыс. нуклеотидов — капсиды миниатюрные. И на некоторые серотипы иммунная система таки реагирует, что выяснилось уже в клинических испытаниях.
Анализ накопленного опыта применения описанных генотерапевтических подходов побудил группу Ади Барцеля, работающую с мутантными по гену F9 мышами-гемофиликами, сделать ставку на аденоассоциированные вирусы (rAAV) и специфичную интеграцию. Только ещё и беспромоторную, и осуществляемую посредством гомологичной рекомбинации без всяких нуклеаз [1].
Мы свой, мы новый ген построим.

Прежде всего ученые амплифицировали 2,7-т.п.н. участок мышиного гена альбумина, содержащий примерно в середине стоп-кодон (рис. 2), клонировали его между вирусными инвертированными концевыми повторами. А вот дальше авторы использовали новомодный трюк — непосредственно перед альбуминовым стоп-сигналом ввели оптимизированный по кодонам человеческий ген F9, а прямо перед ним — ДНК-фрагмент, кодирующий 2А-пептид (см. справку по 2А-пептидам). В целевой конструкции гены Alb и F9 должны ко-транскрибироваться с единственного Alb-промотора, а трансляция F9 следовать сразу за трансляцией Alb, но полипептиды не будут связаны физически. Специфичность интеграции в геном гепатоцитов должны обеспечивать два (5′ и 3′) плеча гомологии.
Справка по 2A-пептидам
И стар и млад мышиный рад — их гемостаз пошёл на лад

Первым делом терапевтический вектор внутрибрюшинно ввели шести двухдневным мышатам в количестве 2,5×10 11 молекул на особь, а контрольный — трем. Начиная с четвертой недели, иммуноферментным анализом (ELISA) еженедельно определяли уровни фактора IX в плазме мышат. У экспериментальной группы уже во время первого измерения они вышли на плато ( от нормы). Известно, что достижение даже может улучшить качество жизни людей, страдающих гемофилией, а радикально снизить кровоточивость. В контрольной группе плазменные уровни фактора IX оставались за пределом детекции, что указывает на отсутствие нецелевого встраивания (или его неуловимо редкие случаи). Эписомную экспрессию исключило быстрое восстановление терапевтического уровня фактора IX после удаления 2/3 печени.
Доказательств много не бывает
Да, хоть и сложно продумывать все нюансы эксперимента и доказывать его успешность, чтобы потом ни один рецензент не подкопался, но в случае генотерапии на кону стоит не только публикация в Nature, а чье-то здоровье. Потому группа А. Барцеля потрудилась на славу.
Вроде бы стройно все получается.
Сомнения и перспективы
Настоящий учёный не перестаёт сомневаться, даже если теория железобетонная и результаты экспериментов проверены и перепроверены. А. Барцеля и соавторов статьи [1], в частности, беспокоит следующее:
Несмотря на понятную осторожность, Ади Барцель и коллеги считают, что их беспромоторная и безнуклеазная интегративная rAAV-стратегия — идеальный кандидат для проведения клинических испытаний не только с целью терапии гемофилии и иных генетических дефектов, но и для компенсации каких-то состояний секрецией нужных белков. Конечно, этот подход не слишком напоминает идеал — замену бракованной детали, но сулит, возможно, самое маленькое кладбище (как у хорошего врача) по сравнению с ранними и даже зреющими методиками генной терапии.
АДЕНОАССОЦИИРОВАННЫЕ ВИРУСЫ (греческое aden — железа и латинское associare — соединять; синоним: аденосателлитные, аденоассоциированные сателлитные вирусы) — мелкие ДНК-содержащие вирусы, размножающиеся только в присутствии аденовирусов; входят в состав группы парвовирусов.
Впервые описаны итальянскими вирусологами Аркетти и Боччарелли (1963).
Аденоассоциированные вирусы обнаруживаются в культурах аденовирусов (см.), изолированных от людей и животных.
Размер частиц аденоассоциированных вирусов 22—24 нм, они обладают кубической симметрией икосаэдрального типа. Их вес 7,5 * 10 6 дальтон. Плавучая плотность большинства частиц в изопикническом градиенте хлористого цезия составляет от 1,38 (типы 1—3 и Х7) до 1,43 г/см 3 (тип 4). Кроме того, имеются более плотные частицы, диаметр которых на 12% меньше, их плавучая плотность составляет от 1,43 (вирус Х7) до 1,47 г/см 3 (А. в. тип 3). В культурах также обнаруживаются пустые капсиды с плотностью 1,33—1,36 г/см 3 .
Предполагают, что капсид аденоассоциированных вирусов состоит из 12 капсомеров. В состав вириона входят три структурных белка с молекулярным весом около 66 тыс., 80 тыс. и 92 тыс. дальтон. Аденоассоциированные вирусы типа 4 и вирус Х7 имеют гемагглютинин. Первый из них наиболее интенсивно склеивает эритроциты человека группы 0 при t° 4°, а второй — эритроциты человека, морской свинки и мыши. При t° 37° наблюдается элюция вируса без разрушения рецепторов эритроцита.
Аденоассоциированные вирусы содержат однонитчатую ДНК с молекулярным весом 1,5—1,7 * 10 6 дальтон. На нее приходится от 18,9 (тип 1) до 26,5% (тип 4) веса вириона, причем гуанин-цитозин составляет от 53% (аденоассоциированных вирусов типа 2) до 58—62% (тип 4) веса ДНК.
аденоассоциированный вирус весьма устойчивы к нагреванию: при t° 80° они инактивируются за 30 мин., а при t° 60° — лишь через 4 часа. Они не изменяются в течение 30 дней при t° 25° и 6 мес.— при t° 2—4°. Устойчивы к действию эфира. Инактивируются ультрафиолетовыми лучами.
Известно несколько серологических типов аденоассоциированного вируса. У приматов встречаются аденоассоциированный вирус четырех типов: у людей типы 1, 2, 3, у обезьян — типы 1, 2, 3, 4. У типов 2 и 3 имеется некоторая антигенная общность. Обнаружены аденоассоциированные вирусы также у крупного рогатого скота (вирус Х7), свиней, собак и кур. Клинически выраженных заболеваний аденоассоциированного вируса, по-видимому, не вызывают. Они нередко выделяются вместе с аденовирусами из глоточных и ректальных смывов у людей при аденовирусных болезнях (см.). Антитела к аденоассоциированных вирусов типов 1—3 обнаруживаются в сыворотках 20—50% людей; инфицирование происходит обычно в раннем детстве. Еще шире данные вирусы распространены среди обезьян (макаки-резусы и зеленые африканские мартышки). Вирус Х7, помимо крупного рогатого скота, может, очевидно, инфицировать людей, поскольку у них найдены соответствующие антитела.
Наличие аденоассоциированных вирусов определяется чаще всего с помощью электронной микроскопии, используется также РСК, преципитация в геле и обработка зараженных клеток флуоресцирующими иммунными сыворотками. Аденоассоциированные вирусы типа 4 и Х7 можно выявить по их способности агглютинировать эритроциты.
Библиография: Blacklow N. R., Hoggan М. D. а. МсСLanahan М. S. Adenovirus-associated viruses, Proc. Soc. exp. Biol. (N. Y.), v. 134, p. 952, 1070; Blacklow N. R. a. o. A seroepidemio-logic study of adenovirus-associated virus infection in infants and children, Amer. J. Epidemiol., r. 94, p. 359, 1971; В о u-cher D. W., Mel nick J. L. a. Mayor H. D. Nonencapsi dated infectious DNA of adeno-satelllte virus in cells coinfected with herpesvirus, Science, v. 173, p. 1243, 1971; Hogg an M. D. Adenovirus associated viruses, в кн.: Progr. med. Virol., ed. by J. L. Melnick, p. 211, MQn-chen — N. Y., 1970; Johnson F. B., Ozer H. L. a. H о g g a n M. D. Structural proteins of adenovirus-associated virus type 3, J. Virol., v. 8, p. 860, 1971; T orpl er G., D’ H a 1 1 ui n J.-C. a. Boulanger P. Electron microscopic observations of KB cells infected with adeno-associated satellite virus, J. Microec. (Paris) , v. 11, p. 259, 1971.
Аденовирусы (греч. aden — железа + вирусы) — группа возбудителей респираторных и других заболеваний, включающая около 50 разновидностей (серотипов), выделенных от людей, обезьян, собак, рогатого скота, грызунов и птиц. Резистентны к действию эфира и кислот, обладают общим групповым комплементсвязывающим антигеном, эпителиотропны.
Вызывая по преимуществу заболевания дыхательных путей, аденовирусы, в отличие от других респираторных вирусов, значительно чаще поражают другие системы организма: конъюнктиву, лимфатические узлы, желудочно-кишечный тракт (см. Аденовирусные болезни). Легко преодолевая желудочный барьер в связи с резистентностью к кислотам, аденовирусы интенсивно размножаются в кишечнике.
Независимо от первых исследователей Хиллеман и Вернер (1954), изучая этиологию заболеваний органов дыхания у военнослужащих, нашли, что часть заболеваний, протекающих по типу острых катаров дыхательных путей и атипичных пневмоний, связана с новым, ранее неизвестным вирусом, названным R1-67. Этот вирус удалось выделить от больных и вырастить в культуре ткани, в частности в клетках HeLa. В дальнейшем обе группы исследователей показали сходство изучаемых вирусов и нашли, что они могут быть выделены как от здоровых людей, так и от больных различными заболеваниями с преимущественным пораженцем дыхательных путей.


Рис. 2. Внутренние субъединицы вириона — капсомеры (негативное контрастирование фосфорно-вольфрамовой кислотой).
Содержание
Действие физических и химических факторов
Адновирусы инактивируются прогреванием и t° 56° в течение 5 мин. или 20— мин. при t° 50°; сохраняют активность в течение 7 дней при t°36°, 14 дней — при t° 22—23°, 70 дней — при t° 4°. Устойчивы в кислой зоне pH от 6,5 до 3,0; при pH 1,5—2,5 частично инактивируются в течение 30 мин. при t° 36 . При комнатной температуре хорошо сохраняются в зоне pH от 6,0 до 9,5, более чувствительны к повышению щелочной, чем кислой, границы pH. Резистентны к органическим растворителям (эфиру, хлороформу, флуорокарбону), а также к трипсину, папаину, рибонуклеазе, дезоксирибонуклеазе и к желчи.
Антигенная структура
С помощью хроматографии и электрофореза выделены три различных растворимых антигена, отличающихся по иммунологическим свойствам и связанных с различными морфологическими субъединицами вируса.
1. А-антиген, гексон,— групповой, общий для всех серотипов вируса антиген, локализованный в 240 капсомерах капсида, каждый из которых граничит с шестью соседними капсомерами, что определило название антигена (hexon). Антитела против очищенного гексонного антигена нейтрализуют инфекционные свойства только гомологичного серотипа. В то же время эта сыворотка реагирует в реакции связывания комплемента с любыми гетерологичными серотипами, так как в составе гексонного антигена имеются две реактивные группы, одна из которых стимулирует образование группоспецифических, а другая — типоспецифических антител.
2. В-антиген, пентон,— токсический антиген, вызывающий округление и скучивание (агрегация) чувствительных клеток однослойной культуры и отделение клеток с поверхности стекла. Локализован в капсомерах, расположенных на вершине двенадцати угловых участков вириона, каждый из которых граничит с пятью соседними капсомерами (pepton). Чувствителен к действию трипсина. Ингибирует активность интерферона (см.) и повышает тяжесть ассоциированных респираторных инфекций.
3. С-антиген — нитевой (fiber) антиген, имеет морфологически форму нити с узловым утолщением, прикрепленной к пентонному антигену. Представляет собой типоспецифический антиген, устойчив к действию трипсина, способствует адсорбции аденовирусов на эритроцитах обезьяны или крысы и их агглютинации.
Цикл размножения
Адсорбция аденовирусов на чувствительных клетках тканевой культуры занимает 4—6 час., после чего вирус проникает в цитоплазму с помощью пиноцитоза. Освобождение нуклеоида (депротеинизация) осуществляется в пиноцитарных вакуолях в течение 60—90 мин., вслед за чем вирусная ДНК транспортируется к ядру клетки. Латентный период репродукции продолжается от 13 до 15 час., когда в ядре синтезируется ДНК, а на цитоплазматических рибосомах — вирусные белки. Через 16 час. после заражения возникают зрелые структурные частицы, сборка которых происходит в ядрах клеток. Но более 10—15% вирусных ДНК и белков тканевой культуры используется для синтеза вирионов, вся остальная масса стимулирует поражения ядер клетки и нарушения синтеза клеточных ДНК и белков, с прекращением деления клеток через 10—11 час. после заражения культуры.
Максимальный выход вируса обеспечивается в случае массивного заражения и инкубации культуры до полного развития цитопатических поражений. Для получения максимального выхода вируса из достаточно сохранившихся клеток их разрушают повторным 3—6-кратным замораживанием и оттаиванием, гомогенизируют ультразвуком или механическим размалыванием. При этом концентрация вируса колеблется в зависимости от серотипа от тысяч до миллиардов частиц в 1 мл тканевой жидкости.
Клеточные поражения
Зараженные аденовирусами клетки округляются и формируют гроздевидные скопления различной величины, облегчающие распознавание агентов данной группы. Цитопатические изменения сопровождаются повышением гликолиза и скоплением органических кислот, подкисляющих тканевую жидкость.
Клеточный лизис отсутствует и зараженные клетки длительное время сохраняют жизнеспособность.
![]()
Рис. 3. Цитопатогенное действие аденовирусов на перевиваемые клетки амниона человека: 1 — незараженные клетки; 2 — начальная фаза дегенерации; 3 — конечная фаза дегенерации.

В процессе дегенерации клеток под действием аденовирусов различают две фазы (рис. 3): первая связана с токсическим эффектом, вторая — с истинным размножением вирусов, которое происходит внутри ядер и в цитоплазме. При этом аденовирусы образуют внутриядерные включения из вирусных частиц, которые составляют агломераты кристаллоподобного строения (рис. 4).
Электронномикроскопические исследования Перейры и Валентина (Н. G. Pereira, R. С. Valentine, 1958) показали, что одна цитопатогенная доза вируса содержит от 10 до 103 вирусных частиц.
Размножение в перевиваемых линиях клеток КВ, HeLa, а также в почечных культурах обезьян под агаровым покрытием сопровождается формированием видимых глазом колоний (бляшек) в районе пораженных клеток.
Гемагглютинирующие свойства
Все серотипы аденовируса человека, кроме типа 18, способны агглютинировать эритроциты обезьян резус или крыс. По этому признаку аденовирусы можно классифицировать на следующие четыре подгруппы: первая включает девять серотипов (3, 7, 11, 14, 16, 20, 21, 25, 28), агглютинирующих только эритроциты обезьян; вторая включает двенадцать серотипов (8, 9, 10, 13, 15, 17, 19, 22, 23, 24, 26, 27), агглютинирующих эритроциты крыс; третья — шесть серотипов (1, 2, 4, 5, 6, 12), агглютинирующих эритроциты крыс после взаимодействия с иммунной аденовирусной сывороткой против других типов (например, 6 типа); четвертая включает серотип 18, не способный к гемагглютинации.
Патогенность для человека и животных
В отличие от других респираторных вирусов, аденовирусы размножаются не только в цилиндрическом мерцательном эпителии верхних дыхательных путей, трахеи и бронхов, но и в под слизистой оболочке. С участием аденовирусов наиболее часто связано развитие острой респираторной инфекции, протекающей с явлениями ангины, фарингита, кашля, озноба, боли в мышцах, головной боли, при непостоянном насморке и повышении температуры (см. Аденовирусные болезни, Респираторные вирусные болезни).
Наиболее частыми возбудителями оказались первые семь серотипов, а также типы 14 и 21. У грудных детей часто развиваются тяжелые пневмонии, изредка с детальным исходом, вызванные серотипами 1, 2, 3, 7 и 7а.
Еще недавно считалось общепризнанным положение об отсутствии у аденовирусов человека патогенности для животных.
Многочисленные опыты заражения многих видов млекопитающих, включая обезьян, давали либо отрицательные, либо сомнительные результаты. Это остается справедливым для обычных условий получения экспериментальной инфекции, однако при изменении методов исследования получены новые данные. Дженнингс и Беттс (A. R. Jennings, А. О. Betts, 1962) адаптировали аденовирусы 1, 2, 4 и 6 серотипов к культуре ткани свиной почки. Затем интратрахеально заражали поросят, рожденных и выращенных в стерильных условиях в безмикробной внешней среде. На 4-й день после заражения у большинства животных развилась бронхопневмония с выраженной лимфоидной гиперплазией.
Интраназальное или подкожное заражение взрослых сирийских хомяков, собак, кроликов, а также новорожденных мышей и крыс вирусами 3, 4, 5, 7, 12, 18 типов приводило к развитию бессимптомных инфекций.
Заражение новорожденных хомяков серотипом 5 вызывало, по данным Перейры, смерть животных через 4 дня с типичными поражениями легких и выделением вируса. Патогенность для обезьян выделяющихся от них аденовирус не доказана.
В ряде лабораторий нередко выделяются аденовирусы от больных вирусным гепатитом как из кала, так и из крови. Возможно, аденовирусы являются спутниками истинного возбудителя, но нельзя исключить и наличие у некоторых штаммов определенного гепатотропизма. Заслуживает внимания работа Л. Г. Руденко и др. (1972), где показана восприимчивость новорожденных хомяков в возрасте до 5 суток к аденовирусу 1 типа (штамм 1237) при подкожном заражении. У зараженных хомяков развивается гепатит и происходит избирательная репродукция вируса в печени.
Онкогенные свойства
Способность аденовирусов человека вызывать развитие злокачественных опухолей (сарком) у новорожденных сирийских хомяков, зараженных подкожно массивной дозой активного вируса, впервые выявлена у серотипа 12. Онкогенные свойства подтверждены сейчас у семи других типов аденовирусов человека, а также у шести типов от обезьян и у одного от птиц. Наибольшую активность проявили серотипы 12, 18 и 31; тип 12 вызывал опухолевый рост, помимо хомяков, также у новорожденных крыс, диких африканских грызунов Mastomys и некоторых линий мышей. В образовавшихся опухолях инфекционные частицы аденовирусов отсутствовали.
Злокачественная трансформация клеток наблюдалась также в опытах in vitro при заражении типом 12 нормальных эпителиальных клеток культуры почек новорожденных сирийских хомяков, а также фибробластов зародыша крысы. Через 3—10 нед. после инокуляции культур массивной дозой вируса развивался рост опухолевых клеток, свободных от инфекционного вируса. Клетки, трансформированные in vivo или in vitro, содержали два новых антигена: Т-антиген (неоантиген) и трансплантационный (TSTA) антиген. Их продукция индуцируется частью ДНК опухолеродного А. Весьма большой мол. вес ДНК аденовируса (более 20 млн. дальтон) обеспечивает возможность кодирования синтеза более 50 различных белков. Т-антиген, обнаруживаемый нерегулярно в ранние этапы обычной цитолитической инфекции, постоянно присутствует в опухолевых клетках и стойко передается при их культивировании in vitro. Обнаруживается в реакции связывания комплемента и по иммунофлуоресценции с сыворотками хомяков с развивающейся опухолью, которые не взаимодействуют со структурными белками вирусов. Т-антиген малоустойчив к нагреванию, воздействию кислоты и щелочи, не содержит РНК или ДНК, имеет мол. вес 78 000 дальтон.
По антигенным свойствам различают Т-антиген группы А (высокоонкогенные аденовирусы 12, 18 и 31 серотипов) и группы В (слабоонкогенные аденовирусы 3, 7, 11, 14, 16 и 21 серотипов). Попытки обнаружить Т-антиген групп А и В в опухолевых клетках и гомологичные для них антитела в сыворотках людей, болеющих раком различной локализации, дали отрицательный результат. В опухолевой ткани хомяков этот антиген присутствует в весьма высокой концентрации и легко обнаруживается с помощью флуоресцирующих антител в каждой опухолевой клетке.
Выделение аденовирусов осуществляется заражением чувствительных тканевых культур отделяемым из полости носа, зева, конъюнктивы, а также кишечным содержимым. Аденовирусы лучше размножаются (с развитием характерных цитопатических изменений) в перевиваемых эпителиальных культурах (HeLa, КВ, НЕр-2), а также в первичной культуре эмбриональной почки человека; слабее размножаются в первичных эпителиальных культурах человеческой трахеи, амниона, почечной ткани обезьян и кроликов. Оптимальный метод выделения — заражение первичной клеточной культуры эмбриональной почки человека с пассажами на перевиваемых линиях после адаптации вируса.
Серологическая идентификация выделенных штаммов
Для отнесения к группе аденовирусов выделенные агенты дифференцируются иммунологически путем установления общего группового антигена в РСК или в реакции преципитация (по методу диффузия в агаровом геле). Определение серотипа проводится с помощью реакции торможения гемагглютинации или нейтрализации. Для идентификации серотипа выделенного штамма определяют его принадлежность к одной из четырех подгрупп по гемагглютинации, после чего ставят реакцию торможения гемагглютинации (РТГА) с иммунными сыворотками кроликов или лошадей, обработанными каолином и истощенными чувствительными для данной подгруппы эритроцитами. Результаты РТГА проверяют в реакция нейтрализация на тканевых культурах с гомологичной иммунной сывороткой (см. Вирусологические исследования).
В современной классификации вирусов человека аденовирусы занимают самостоятельное положение среди ДНК-содержащих вирусов, четко дифференцируясь от других сочленов этой группы по свойствам вирионов.
Библиография
Руденко Л. Г. и др. Динамика репродукции аденовируса в печени новорожденных хомяков и изменение гуморальных факторов иммунитета при экспериментальном аденовирусном гепатите, Вопр. вирусол., № 3, с. 269, 1972; Смородинцев А. А. и Коровин А. А. Грипп, с. 73, Л., 1961, библиогр.; Шубладзе А. К. и др. Некоторые итоги изучения штаммов вирусов, выделенных от больных эпидемическим гепатитом, Всстн. АМН СССР, № 6, с. 49, 1963; Buescher Е. L. Respiratory disease and adenoviruses, Med. Clin. N. Amer., v. 51, p. 779,1967; Enderb J. P. a. o. Adenoviruses, Science, v. 124, p. 119, 1956; Ginsberg H. S. Identification and classification of adenoviruses, Virology, v. 18, p. 312, 1962, bibliogr.; Hilleman M. R. a. Werner J. H. Recovery of a new agent from patients with acute respiratory illness, Proc. Soc. exp. Biol. (N. Y.), v. 85, p. 183, 1954, bibliogr.; HuebnerR. J., Rowe W. P. a. Сhanосk R. M. Newly recognized respiratory tract viruses, Ann. Rev. Microbiol., v. 12, p. 49. 1958, bibliogr.; Pereira H. G. a. Valentine R. C. Infectivity titrations and particle counts of adenovirus type 5, J. Gen. Microbiol., v. 19, p. 178, 1958, bibliogr.; Rose H. M. Adenoviruses, в кн.: Diagnostic rocedures for viral a. ricket. infections, ed. у E. H. Lennette a. N. J. Schmidt, p. 205, N. Y., 1969;Rosen L. Hemagglutination-inhibition techniques for typing adenoviruses, Amer. J. Hyg., v. 71, p. 120, 1960; Sohier R., C hard onnet Y. a. Prunieras M. Adenoviruses. Progr. med. Virol., v. 7, p. 253, 1965, bibliogr.
Адено-ассоциированный вирус (AAV). Катионные липиды в качестве векторов
Адено-ассоциированный вирус (AAV) - это дефектный парвовирус человека, свойства которого позволяют использовать его в качестве вектора для переноса генов. Вирусный вектор с высоким титром в норме для человека не патогенен, но в условиях in vitro инфицирует клетки различных типов. Геном AAV представлен одпоцепочечной линейной молекулой ДНК длиной 5 тыс. п.н. AAV дикого типа сайт-специфичным образом интегрируется в особый участок 19-й хромосомы человека длиной 7 тыс. п.н.
Геном AAV фланкирован попарно-инвертированными терминальными повторами (по 145 п.н. каждый), содержащими последовательности, необходимые для упаковки, репликации ДНК и ее интеграции. Кодирующая область содержит две открытых рамки считывания, которые в процессе конструкции вектора удаляются и заменяются одной или более молекулами кДПК вместе с транскрипционными регуляторными единицами.
AAV-векторы связывают трансгенные кассеты (упакованный генетический материал, содержащий более одного гена и предназначенный для вставки в геном клетки.) длиной не более 4-5 тыс. п.н., что лимитирует число их вариантов. Для репродукции AAV-векторов необходима сложная упаковка, включающая белки Rep и Сар, специфические для AAV, и пять аденовирусных белков (Е1А, Е1В, Е2А, Е4 и VA). Столь жесткие требования к упаковке исключают конструкцию линии клеток-хелперов AAV. В настоящее время векторы конструируют путем котрансфекции клеток AAV-всктором и неупаковываемой плазмидой, содержащей присущие AAV белки Rep и Сар.
Вслед за этим трансфектированные клетки инфицируют аденовирусом-помощником дикого типа или мутантным. AAV отделяют от аденовируса путем нагревания и центрифугирования в равновесном градиенте плотности. В работе изложены протоколы конструкции AAV-векторов.
В условиях in vitro AAV-векторы инфицируют многие типы клеток, однако возможность их применения в условиях in vivo остается неопределенной. Неясной остается возможность трансдукции сосудистых эпдотелиальных клеток и ГМК. К дополнительным ограничениям можно отнести отсутствие упаковочных клеточных линий и необходимость коинфекции с аденовирусом, что затрудняет приготовление чистых AAV-векторов в значительных количествах.

Удаление вирусных генов в процессе конструкции вектора ограничивает их способность к сайт-специфичной интеграции, по ставит вопрос о возможности инсерционного мутагенеза. Теоретически AAV векторы весьма привлекательны, однако еще многое предстоит сделать, прежде чем они найдут применение в клинике.
Катионные липиды — это препараты положительно заряженных клеток, которые спонтанно образуют комплексы с отрицательно заряженной ДНК, формируя ДНК-липидные конъюгаты. Липидный компонент способствует доставке ДНK в клетки путем слияния с мембраной плазмиды или с мембранами эндосом после завершения эпдоцитоза. После выхода из эндосом плазмидная ДНК находится вне хромосом.
Катионные липосомы были апробированы в исследованиях по переносу генов в клетки артерий на многих животных моделях, включая крыс, кроликов, собак и свиней. К преимуществам применения катионных липосом следует отнести их благоприятный профиль безопасности, отсутствие вирусных кодирующих последовательностей и ограничений на размер кДНК.
Эти липосомы отличает минимальное токсическое действие на биохимические процессы, гемодинамику и сердечную функцию как у животных, так и у человека. Эти векторы практически готовы к использованию в экспериментах и в клинике, Лимитирует их внедрение низкая эффективность трансфекции и кратковременность генной экспрессии.
Нуклеиновые кислоты и лекарственные препараты в виде полимерных гелей, которыми изнутри покрывали стенты или баллоны, вводили непосредственно в артерии. Использование многих полимеров первого поколения ассоциировалось с интенсивными воспалительными реакциями. Новые составы успешно применяют в разработке стентов с лекарственным покрытием.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

