Альбумин интерферон при гепатите с
Обновлено: 24.04.2024
Вирусный гепатит – это заболевание, которое по широте и интенсивности распространения занимает второе место в мире после гриппа и острых респираторных инфекций. Изучение особенностей нарушения звеньев минерального обмена при вирусных гепатитах позволяет детализировать общую картину этого заболевания, а значит, и оптимизировать подходы к его лечению. В статье представлена роль магния и цинка в организме человека в норме и при хронических вирусных гепатитах. Описана проблема их дефицита в организме при хронических вирусных гепатитах С и В.
Цели исследования: оценить уровень тканевых магния и цинка у пациентов с хроническими гепатитами В и С, сравнить полученные результаты с уровнем тканевых магния и цинка у здоровых людей в группе контроля.
Материал и методы: исследован магниево-цинковый статус в тканях у 119 человек с хроническими гепатитами В и С методом масс-спектрометрии. Контрольную группу составили 30 здоровых человек. Референсные значения магния в ногтях у мужчин – 45–105 мкг/г, у женщин – 90–300 мкг/г. Референсные значения цинка в ногтях у мужчин – 180–240 мкг/г, у женщин – 216–276 мкг/г. Так как референсные значения тканевого магния и цинка различались у мужчин и женщин, пациентов разделили в каждой группе по полу.
Результаты: выявлено, что хронические гепатиты В и С сопровождаются магниевой и цинковой тканевой недостаточностью. Показатели тканевого уровня магния и цинка у этих пациентов коррелировали с некоторыми биохимическими печеночными маркерами, а также с результатами оценки моторики билиарного тракта.
Выводы: полученные данные обосновывают необходимость включения в комплексное обследование пациентов, страдающих заболеваниями печени, исследование уровня тканевых магния и цинка, а применение в схемах комплексной терапии магний- и цинксодержащих препаратов способствует оптимизации лечения.
Ключевые слова: хронические вирусные гепатиты, хронический гепатит В, хронический гепатит С, магний, цинк, дефицит магния, дефицит цинка.
Для цитирования: Плотникова Е.Ю., Карягина М.С., Шамрай М.А. и др. Магниево-цинковый статус у пациентов с хроническими гепатитами В и С. РМЖ. Медицинское обозрение. 2017;25(2):60-64.
Plotnikova E.Yu. 1 , Кaryagina M.S. 2 , Shamray M.A. 2 , Zinchuk S.F. 1 , Baranova E.N. 1 , Maximov S.A. 4
1 Kemerovo State Medical University
2 Regional clinical hospital of emergency medical service named after M.A. Podgorbunsky, Kemerovo
3 Scientific research institute of Complex problems of cardiovascular diseases, Kemerovo
Viral hepatitis takes the second place in the world after the flu and acute respiratory infections in terms of the prevalence and incidence rate. The study of the peculiarities of the violation of the links of the mineral metabolism in viral hepatitis makes it possible to detail the general picture of this disease, and, therefore, to optimize the approaches to its treatment. The article presents the role of magnesium and zinc in the human body in normal and chronic viral hepatitis. The problem of their deficiency in the body with chronic viral hepatitis C and B is described.
Aim: to assess the level of tissue magnesium and zinc in patients with chronic hepatitis B and C. Compare the results with the level of tissue magnesium and zinc in healthy people in the control group.
Patients and methods: magnesium-zinc status in tissues in 119 people with chronic hepatitis B and C was studied by mass spectrometry. The control group consisted of 30 healthy people. The reference magnesium values in nails in men are 45-105 μg / g, in women 90-300 μg / g. The reference values of zinc in the nails in men are 180-240 μg / g, in women 216-276 μg / g. Since the reference values of tissue magnesium and zinc differed in men and women, in each group the patients were divided by gender.
Results: it was revealed that chronic hepatitis B and C were accompanied by tissue magnesium and zinc deficiency. The tissue levels of magnesium and zinc in these patients correlated with some biochemical hepatic markers, as well as with the results of the assessment of the motor function of the biliary tract.
Conclusions: the obtained data justify the need to include a study of the level of tissue magnesium and zinc into a complex examination of patients suffering from liver diseases, and the use of complex therapies of magnesium and zinc-containing drugs in the treatment schemes helps to optimize the treatment.
Key words: chronic viral hepatitis, chronic hepatitis B, chronic hepatitis C, magnesium, zinc, magnesium deficiency, zinc deficiency.
For citation: Plotnikova E.Yu., Кaryagina M.S., Shamray M.A. et al. The magnesium-zinc status at patients with chronic hepatitises B and C // RMJ. MEDICAL REVIEW. 2017. № 2. P. 60 –64.
Статья посвящена оценке магниево-цинкового статуса у пациентов с хроническими гепатитами В и С. Выявлено, что хронические вирусные гепатиты сопровождаются магниевой и цинковой тканевой недостаточностью. Полученные данные обосновывают необходимость включения в обследование определения уровня тканевых магния и цинка, а применение в схемах комплексной терапии магний- и цинксодержащих препаратов способствует оптимизации лечения.
Введение
Вирусный гепатит – это заболевание, которое по широте и интенсивности распространения занимает второе место в мире после гриппа и острых респираторных инфекций. Ежегодно в мире регистрируется около 1 млн заболевших вирусными гепатитами, а инфицированных вирусными гепатитами – более 1 млрд человек. Поэтому любая аналитическая работа по исследованию взаимосвязи нарушений обменных процессов организма со степенью выраженности патологических процессов у больных гепатитом всегда приветствуется специалистами различного профиля, т. к. это, несомненно, имеет широкое теоретическое и прикладное значение. Изучение особенностей нарушения звеньев минерального обмена при вирусных гепатитах позволяет детализировать общую картину этого заболевания, а значит, и оптимизировать подходы к его лечению.
Нормальный уровень магния в организме человека признан основополагающей константой, контролирующей здоровье человека. Среди катионов, присутствующих в организме человека, магний (Mg 2+ ) по концентрации занимает четвертое место, а внутри клетки – второе после калия среди других катионов (калий, натрий, кальций). В настоящее время установлено наличие более 290 генов и белковых соединений в последовательности генома человека, которые способны связывать Mg 2+ как кофактор множества ферментов, участвующих более чем в 300 внутриклеточных биохимических реакциях. Mg 2+ – естественный физиологический антагонист кальция (Са 2+ ); универсальный регулятор биохимических и физиологических процессов в организме, обеспечивает гидролиз АТФ, ингибируя разобщение окисления и фосфорилирование; регулирует гликолиз, накопление лактата; способствует фиксации калия (К + ) в клетках, поляризации клеточных мембран. Магний необходим для нормального протекания множества биохимических реакций и физиологических процессов, которые обеспечивают энергетику и функции различных органов, что определяет его ведущую роль в системном функционировании и позволяет рассматривать его как важнейший регулирующий фактор жизнедеятельности организма человека [1].
Дефицит магния
Гепатит и дефицит магния
Развитие цитолиза гепатоцитов при гепатитах связано с нарушением внутриклеточных метаболических процессов. В свою очередь, воспалительные, дистрофические и атрофические изменения со стороны гепатоцитов неизбежно сопровождаются нарушением депонирования магния в клетках и высвобождением его во внеклеточное пространство. В литературных источниках описывается незначительное выделение ионизированного магния с мочой при вирусных гепатитах, имеются отдельные данные об увеличении его ренальной экскреции в период клинического выздоровления. В результате цитолиза содержание натрия и кальция во внутриклеточном пространстве повышается, в то время как калия и магния – снижается. Это удлиняет сроки регенерации клеток вследствие дестабилизации клеточных мембран и ведет к развитию осложнений основного заболевания. Магниевая недостаточность при вирусных гепатитах связана не только с нарушениями интермедиарного обмена веществ, но и с изменением процессов синтеза витаминных коферментов, в которых принимают участие ионы магния [3, 4].
Примерно 85% случаев вирусных гепатитов протекают на фоне дефицита магния. Поэтому необходимо контролировать магниевый баланс при этом заболевании [5]. Суточная потребность в магнии повышается не только в период болезни, но и в период выздоровления минимум на 1/3. Поскольку эта повышенная потребность редко удовлетворяется за счет пищи, то содержание магния в организме снижается, и отмечается, как правило, состояние умеренной гипомагнезиемии [6].
Гепатит и дефицит цинка
Роль цинка в патогенезе гепатита С
После идентификации нового вируса в 1989 г., названного вирусом гепатита С, который оказался основной причиной заболевания среди пациентов с хроническим гепатитом, и разработки тест-систем его обнаружения продолжалось изучение уровня содержания цинка у данной группы больных [14]. Интерес к изучению уровня цинка вновь возрос в последние 10 лет, по мере накопления сведений о роли цинка в репликации вируса гепатита С (HCV), о влиянии назначения препаратов цинка на исход противовирусной терапии, особенно у пациентов с 1 генотипом, о процессах формирования фиброза и цирроза печени и новых аспектах антифибротической терапии у пациентов с хронической болезнью печени любой этиологии. В 2012 г. был опубликован подробный обзор, посвященный этой теме [15].
Данные по изучению связи между генотипом HCV, вирусной нагрузкой и уровнем цинка в сыворотке крови несколько разноречивы. По данным К. Wang-Sheng et al. (2005) [16], имелись отрицательные корреляционные связи средней силы между количеством HCV-РНК и уровнем цинка в эритроцитах. М. Moriyama et al. определили, что концентрация цинка в сыворотке крови не была связана с генотипами HCV или количеством HCV-РНК, и, таким образом существование HCV не влияло на его концентрацию. Стало известно, что концентрация цинка в сыворотке крови у нелеченных пациентов с бессимптомным течением HCV была значительно ниже, чем у здоровых людей [17]. При исследовании механизмов репликации HCV установлено, что неструктурные 2, 3 протеиназы, а также неструктурный белок 5А являются цинксодержащими белками. Высказано предположение, что добавление препаратов цинка может улучшить вирусологический ответ при лечении 1 генотипа ВГС [18].
Установлена роль цинка в процессах фиброзирования печени. С. Loguercio et al. (1997) сделали вывод, что уровень цинка в крови тесно связан с фиброзом печени в случаях хронических болезней печени, а лекарственная терапия, направленная на увеличение концентрации сывороточного цинка, может ингибировать ход фиброза печени [19]. Многие исследования, в т. ч. упомянутые выше, показывали, что патологические состояния печени тесно связаны с уровнем цинка в крови. Himoto et al. [20] выявили обратную корреляцию между стадиями фиброза печени и уровнем цинка в сыворотке при хроническом гепатите С (HCV), а также взаимосвязь дефицита цинка с резистентностью к инсулину у этих больных. Также данные авторы установили, что дефицит цинка в сыворотке крови у пациентов с циррозом печени был обусловлен снижением поглощения цинка, повышением его потери с мочой и гипоальбуминемией. Пероральное введение цинка в виде карнозина цинка сопровождалось снижением уровня аминотрансфераз в сыворотке крови у пациентов с хроническим гепатитом С, прослеживалась тенденция к уменьшению уровня коллагена IV типа в сыворотке после лечения в течение 4 нед. Влияния на показатели периферической крови, другие функциональные пробы, уровень вирусной нагрузки выявлено не было. Кроме того, S. Matsuoka et al. [21] сообщили, что добавление препаратов цинка улучшало исход хронического гепатита С и цирроза печени.
Существует ряд причин, почему препараты цинка могут быть полезны в лечении гепатита С:
– антиоксидантная функция;
– регулирование дисбаланса между Th1 и Th2 клетками;
– усиление противовирусного эффекта интерферона;
– ингибирующее влияние на репликацию вируса гепатита С;
– гепатопротекторный эффект металлотионеина [22, 23].
Несколько исследований оценили роль цинка в качестве дополнительной терапии в лечении HCV. Первоначальные исследования показали, что применение цинка в комбинации с интерфероном было более эффективным, чем применение интерферона. Тем не менее в последующих исследованиях, когда начали использовать комбинацию пегилированного интерферона и рибавирина, добавление цинка к терапии не подтвердило своей эффективности [21].
Цели исследования: оценить уровень тканевых магния и цинка у пациентов с хроническими гепатитами В и С; сравнить полученные результаты между собой и с уровнем тканевых магния и цинка у здоровых людей в группе контроля.
Материал и методы
Статистический анализ
Результаты и обсуждение
Показатели уровня тканевого магния и цинка у пациентов с хроническими вирусными гепатитами (ХВГ) отражены в таблице 1.

Анализ данных, представленных в таблице 1, показал, что уровень тканевого магния у мужчин и женщин в обеих группах с ХВГ статистически значимо (р=0,00001) ниже уровня магния в ногтях у пациентов группы контроля, причем у женщин в группе HCV дефицит магния статистически значимо (р=0,00001) более выражен, чем в группе HВV.
Уровень тканевого магния (в ногтях, мкг/г) у мужчин и женщин с хроническими гепатитами В и С, а также здоровых лиц представлен на рисунках 1, 2.
Таким образом, в группе HCV тканевый дефицит магния подтвержден у 28 человек (44,4%), в группе HВV – у 16 человек (28,6%). Показатели дефицита магния статистически значимо (р <0,05) коррелировали с повышением уровня билирубина в сыворотке крови, удлинением времени открытия сфинктера Одди (СО) и увеличением объема и удлинением времени порции А при дуоденальном зондировании у пациентов обеих групп.
Концентрация тканевого цинка (в ногтях, мкг/г) у мужчин и женщин группы контроля, больных HВV и HCV представлена на рисунках 3 и 4.
Анализируя данные таблицы 1 и рисунков 3, 4, мы видим, что уровень тканевого цинка у мужчин и женщин в обеих группах с ХВГ статистически значимо (р=0,00001) ниже уровня тканевого цинка группы контроля.
Уровень тканевого цинка в группе HВV слабо отрицательно коррелировал с уровнем аланинаминотрансферазы (АЛТ) (r = - 0,34, p<0,05), АСТ (r = - 0,30, p<0,05) и объемом порции А дуоденального зондирования (r = - 0,28, p<0,05). Данная корреляция подтверждает, что чем выше активность воспалительного процесса в клетках печени (степень цитолиза), тем сильнее дефицит цинка в организме. В группе HCV корреляционных связей с биохимическими показателями и показателями дуоденального зондирования выявлено не было.
Заключение
Таким образом, можно сделать вывод, что хронические заболевания печени, в частности хронические гепатиты В и С, сопровождаются магниевой и цинковой тканевой недостаточностью. Полученные нами данные обосновывают необходимость включения в комплексное обследование пациентов, страдающих заболеваниями печени, исследования уровня тканевых магния и цинка, а применение в схемах комплексной терапии магний- и цинксодержащих препаратов способствует оптимизации лечения.
Точные механизмы повреждающего действия при HCV-инфекции неизвестны. Предположение, что вирус обладает прямым цитопатическим действием, в отличие от HBV, подтверждается незначительной воспалительной инфильтрацией, наблюдающейся в ткани печени, 137 и зависимостью степени воспаления от концентрации вируса. 113 В то же время анализ специфических популяций Т-клеток дает основание предполагать иммунологическую опосредованность повреждения, зависящую от особенностей развития инфекции (медленная репликация, мутация вируса). 96 Иммунный ответ может быть также снижен за счет недостаточной продукции эндогенного интерферона. 140
Интерфероны представляют собой противовирусные и иммуномодулирующие белки, являющиеся частью защиты от вирусов, бактерий и других чужеродных агентов. Они взаимодействуют с клетками, связывая специфические рецепторы на их поверхности. Выделяют три субкласса интерферонов, обозначаемых как альфа, бета и гамма. 141, 142 В настоящее время интерферон альфа используется в лечении хронических гепатитов С и В. В инфицированных вирусом клетках интерфероны индуцируют продукцию противовирусных белков, подавляя синтез вирусной ДНК или РНК. Иммуномодулирующий эффект интерферона проявляется увеличением активности естественных киллеров, цитотоксических Т-лимфоцитов, а также повышением экспрессии антигенов HLA класса 1. 142 Противовирусное и иммуномодулирующее действие интерфероцов альфа играет важную роль в элиминации HCV. В настоящее время одним из широко используемых интерферонов альфа для лечения вирусных гепатитов является ИФН альфа-2b (рекомбинантный интерферон альфа-2b). ИФН альфа-2b разрешен для лечения больных с ХГС (ни А, ни В) в 42 странах, в том числе во всех странах Западной Европы и США.
Цели противовирусной терапии:
- остановить прогрессирование гепатита;
- предотвратить развитие цирроза печени и ГЦК.
- исчезновение HCV РНК из сыворотки крови и ткани печени;
- нормализация уровня аминотрансфераз;
- уменьшение/разрешение воспалительных изменений в печени;
- уменьшение фиброза;
- снижение/исчезновение инфекциозности;
- исчезновение клинической симптоматики.
РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ИФН альфа-2b
Все больные хроническим гепатитом С и выявленной репликацией HCV (наличие HCV РНК в сыворотке крови, выявленной методом ПЦР) нуждаются в лечении ИФН альфа-2b. В настоящее время известны прогностические факторы, наиболее часто сочетающиеся с хорошим ответом на интерферонотерапию:
- низкий титр HCV РНК до начала лечения; 166, 174
- уровень аминотрансфераз ( не более 2-3 норм);
- малая длительность инфекции; 175
- невыраженный фиброз; 174
- отсутствие холестаза; 175
- нормальный уровень железа в сыворотке крови и ткани печени;
- 2 и 4 генотип HCV. 7, 174
Схемы лечения ХГС ИФН альфа-2b
ИФН альфа-2b назначается в дозе 3 млн. ME 3 раза в неделю на протяжении 12 недель. При нормализации уровня трансаминаз и исчезновении или снижении концентрации HCV РНК в сыворотке крови - введение ИФН альфа-2b А продолжается в той же дозе в течение последующих 9-15 месяцев. Если через 3 месяца от начала терапии уровень АЛТ остается повышенным и продолжает определяться HCV РНК - рассматривается вопрос о повышении дозы (например, 5 млн. ME 3 раза в неделю). Лечение продолжается до 6 месяцев, и при отсутствии результатов терапия прекращается. Если же наблюдается улучшение - терапия ИФН альфа-2b продолжается в той же дозе в течение еще 6-12 месяцев (схема применения ИФН альфа-2b А показана на рис. 5).
Повторное лечение по первоначальной схеме рекомендуется больным, у которых имеет место рецидив заболевания (повышение АЛТ, сопровождающееся появлением HCV РНК и сыворотке крови) после окончания терапии. Большинство больных хорошо отвечает на повторный курс.
ИФН альфа-2b вводится подкожно или внутримышечно. Инъекция может быть выполнена больным самостоятельно. Это позволяет пациентам с ХГС (в особенности тем, у кого заболевание протекает бессимптомно или малосимптомно) лечиться амбулаторно и сохранять трудоспособность. 140
Рис. 5 Схема применения ИФН альфа-2b А при ХГС
Результаты испытаний интерферона альфа при ХГС показали, что 6-месячная терапия в дозе 3 млн. ME приводит к положительным результатам (нормализация уровня аминотрансфераз сыворотки крови, прекращение репликации HCV РНК, уменьшение числа лобулярных некрозов и воспалительной инфильтрации) примерно у 23- 48% больных. 146-153
Результаты применения ИФН альфа-2b А при ХГС отражены на рисунке 6.
Рис. 6 Результаты применения ИФН альфа-2b А при ХГС
На рисунке показана характерная кривая АЛТ у пациента, положительно ответившего на лечение. В отличие от типичного ответа на ИФН альфа-2b при хроническом гепатите В, при ХГС нет волнообразных подъемов уровня АЛТ. Устойчивое снижение АЛТ до нормальных величин происходит через 4 недели от начала лечения. Около половины больных, лечившихся по этой схеме и имевших положительный результат, сохраняли его после прекращения терапии. Имевшим рецидив назначался повторный курс в прежних дозах, что приводило к быстрой ремиссии у большинства. При сопоставлении результатов лечения в 3-х группах больных (1 группа - получающие 3 млн. ME ИФН альфа-2b А 3 раза в неделю, 2 группа - получающие 1 млн. ME ИФН альфа-2b А 3 раза в неделю, 3 группа - без лечения) наилучшие результаты наблюдались в 1 группе (рис. 7).
Рис. 7 Средний процент больных с полным ответом на лечение интерфероном альфа
Результаты длительных курсов лечения ИФН альфа-2b
В настоящее время большинство авторов считают, что более эффективны длительные курсы ИФН альфа-2b А , составляющие 12-18 месяцев. Результаты лечения ХГС ИФН альфа-2b в течение 12 месяцев и более представлены в табл. 9.
3-1 млн. ME 3 раза в неделю в течение 12 месяцев:
Среди больных ХГС без цирроза печени, лечившихся ИФН альфа-2b на протяжении 12 месяцев (6 месяцев - 3 млн. ME 3 раза в неделю, 3 месяца - 2 млн. ME 3 раза в неделю и затем 3 месяца по 1 млн. ME 3 раза в неделю), нормализация уровня АЛТ наблюдалась с большей частотой по сравнению с группой больных, получавших препарат только 6 месяцев в дозе 3 млн. ME 3 раза в неделю (22 из 37 - 59,5% против 17 из 36 - 47,2% соответственно). 143 Через 6 месяцев после прекращения лечения ИФН альфа-2b положительные результаты сохранялись у 15 из 22 ответивших больных (68%), прошедших 12-месячный курс, тогда как после 6-месячного курса - только 5 из 17 (29%).
Табл. 9 Результаты длительных курсов лечения ИФН альфа-2b
| Авторы | Дозы и длительность курса | Количество больных | Количество ответивших к концу лечения а | Количество больных с сохраняющимся ответом через 6 месяцев после окончания терапии |
| Jouet et al 143 | 3-1 ME 3 раза в неделю, 12 мес | 37 b | 23/22 (59,5%) | 15/22 (68%) |
| Piazza et al 154 | 3 ME 3 раза в неделю, 12 мес | 24 | 14/24 (58%) | 9/14 (64%) |
| Pounard et al 144 | 3 ME 3 раза в неделю, 72 недели | 103 | 56/103 (54%) | НД |
| Reichard et al 145 | 3 ME 3 раза в неделю, 60 недель | 40 | 24/40 (60%) | 15/24 (62,5%) |
а - критерий ответа-нормализация уровня АЛТ
b - отсутствие цирроза печени (исследование включало 19 больных с циррозом печени, у 3 (16%) из которых был ответ. Ответ сохранялся в течение 6 месяцев у 1 больного).
3 млн. ME 3 раза в неделю в течение 12 месяцев:
Исследования, проведенные в Италии, 154 показали, что 12-месячный курс ИФН альфа-2b в дозе 3 млн. ME 3 раза в неделю дает лучшие результаты и более стойкую ремиссию, чем курс, проведенный по схеме: 3 млн. ME 3 раза в неделю - 2 месяца и 1,5 млн. ME 3 раза в неделю - 10 месяцев. У 14 из 24 (58%) пациентов, получавших ИФН альфа-2b на протяжении 12 месяцев, имела место нормализация уровня АЛТ против 16 из 33 (48%), получавших полную дозу только 2 месяца. Устойчивый ответ на лечение ИФН альфа-2b (через 6 месяцев после окончания лечения) наблюдался у 37,5% больных из 1 группы и у 21% из 2 группы.
ИСПОЛЬЗОВАНИЕ ВЫСОКИХ ДОЗ ИФН альфа-2b
Опыт использования высоких доз ИФН альфа-2b (вплоть до 10 млн. ME 3 раза в неделю) невелик. 154, 155 Однако в настоящее время высокие дозы ИФН альфа-2b А все чаще используются у больных, инфицированных 1b генотипом HCV, не ответивших на терапию интерфероном альфа в обычных дозах и обострившихся после первого курса противовирусной терапии. 179, 180 Наиболее распространенным является следующий режим введения ИФН альфа-2b А: 6 млн. ME ежедневно в течение месяца, затем 6 млн. ME 3 раза в неделю в течение 5 месяцев и по 3 млн. МЕЗ раза в неделю 6 месяцев (всего курс терапии составляет 12 месяцев). Исчезновение НСV РНК из сыворотки крови при таком режиме наблюдается уже в течение первого месяца. 181
ОЦЕНКА ОТВЕТА НА ЛЕЧЕНИЕ ИФН альфа-2b
Примерно у 40-45% взрослых больных хроническим гепатитом С наблюдается устойчивый ответ на лечение ИФН альфа-2b в обычных дозах: 3 млн. ME 3 раза в неделю в течение 12 месяцев. Полный ответ на лечение характеризуется следующими признаками:
- исчезновение HCV РНК из сыворотки крови;
- нормализация аминотрансфераз сыворотки крови;
- исчезновение симптомов заболевания;
- улучшение гистологической картины печени.
Антитела к HCV и ответ на лечение ИФН альфа-2b
Исследования показали, что титр антител к с-100 антигену HCV уменьшается у больных, положительно ответивших на лечение ИФН альфа-2b. 152, 162
Влияние генотипа на чувствительность к интерферону
Имеется предположение, что различие в генотипах HCV влияет на чувствительность больных к терапии интерфероном альфа. Несомненно, что определенные генотипы HCV более чувствительны к интерферону альфа, чем другие (см. также "Влияние генотипа на тяжесть заболевания"). Тип 1b, по-видимому, более устойчив к действию интерферона альфа, 5, 165 особенно в сравнении с типом 4. Зависимость результатов лечения от генотипа HCV была показана во многих исследованиях. 164, 166, 167
ИФН альфа-2b и рибавирин - новое в терапии ХГС
В настоящее время предпринимаются попытки улучшения результатов стандартной терапии ИФН альфа-2b путем не только увеличения дозы ИФН альфа-2b А и длительности терапии, но и путем сочетания ИФН альфа-2b А с аналогом гуанозина - рибавирином. Показано, что комбинация ИФН альфа-2b А с рибавирином вдвое улучшает результат лечения больных ХГС, в том числе у неответчиков на монотерапию ИФН альфа-2b и больных с обострением после успешного курса этой терапии. 182, 183
ИФН альфа-2b у больных с другими патологиями
Терапия ИФН альфа-2b больных с гемофилией и ХГС дает результаты, сходные с таковыми у больных без гемофилии. 168, 169 Это важно в связи с большим количеством больных гемофилией, инфицированных HCV через контаминированные факторы свертывания в период до идентификации вируса и введения предохраняющих процедур.
Известно, что эссенциальная смешанная криоглобулинемия часто связана с ХГС. 128 Большинство больных, попавших в эту категорию, хорошо реагируют (как клинически, так и биохимически) на лечение интерфероном альфа. 125, 127, 128 В исследовании, проведенном в Италии, 127 у 26 больных, получавших ИФН альфа-2b (2 млн. ME в день в течение 1 месяца и затем через день - 5 месяцев на фоне стероидной терапии), наблюдалось уменьшение геморрагического васкулита и уровня АЛТ, исчезновение репликации HCV. 127 Предполагается, что интерферон aльфа может быть препаратом выбора у таких больных. 129
При лечении ИФН альфа-2b (5-3 млн. ME 3 раза в неделю в течение 26 недель) 9 больных с бета-талассемией и ХГС у 7 больных произошла нормализация уровня АЛТ и исчезновение репликации HCV. 5 больных имели стойкий положительный ответ, включая уменьшение портального, перипортального и лобулярного воспаления. 170
ИФН альфа-2b при ОГС
Применение ИФН альфа-2b при лечении ОГС привело к выводу, что данная терапия уменьшает вероятность хронизации инфекции. 171, 172 Целью проводимых в настоящее время работ является определение оптимальных доз и продолжительности лечения. В зависимости от переносимости препарата предлагаются различные режимы лечения ОГС:
- режим малых доз - 3 млн. ME ИФН альфа-2b А 3 раза в неделю в течение 3 месяцев;
- режим средних доз - 5 млн. ME ИФН альфа-2b А ежедневно в течение 2 месяцев, затем 3 млн. ME 3 раза в неделю в течение 4-10 месяцев;
- режим высоких доз - 10 млн. ME ИФН альфа-2b А до нормализации аминотрансфераз, далее 3 млн. ME ИФН альфа-2b А в течение 6 месяцев.
ПОБОЧНЫЕ РЕАКЦИИ
ИФН альфа-2b, как правило, хорошо переносится, и какие-либо побочные эффекты, которые могут иметь место, обычно легко купируются посредством простых профилактических мер.
Ранние побочные реакции
Ранние побочные реакции на лечение ИФН альфа-2b в виде гриппоподобного синдрома с лихорадкой, головными болями и ознобами обычно наблюдаются в течение 4- 6 часов после первых инъекций и могут быть уменьшены профилактическим приемом парацетамола. Преимущество парацетамола в том, что, будучи недорогим, он хорошо известен больному. Введение интерферона альфа непосредственно перед сном также способствует улучшению переносимости и может свести к минимуму проявления гриппоподобного синдрома. Данные проявления, как правило, полностью исчезают в течение первого месяца терапии.
Поздние побочные реакции
Поздние побочные реакции, такие как слабость, утомляемость и депрессия являются преимущественно дозозависимыми и могут регулироваться тщательным подбором дозы. Степень выраженности симптомов бывает различна, однако тяжелые проявления наблюдаются редко. Вероятность развития некоторых побочных эффектов выше у больных, имеющих аналогичные проявления до начала лечения. Например, серьезные психические отклонения имеют место, главным образом, у пациентов с предшествующими заболеваниями центральной нервной системы или психологическими проблемами. Подобно этому, у больных со склонностью к инфекциям (таким как хронический бронхит, рецидивирующая инфекция мочевых путей) увеличивается риск бактериальной инфекции. Снижение уровня лейкоцитов и тромбоцитов редко становится проблемой, если их уровень не был снижен до начала лечения. У большинства больных с тяжелыми побочными реакциями улучшение наступает сразу же после временной отмены или уменьшения дозы препарата.
Интерферонотерапия противопоказана больным с аутоиммунным гепатитом, тяжелыми заболеваниями сердца, сахарным диабетом и пациентам с выраженным нарушением синтетической функции печени.
ЭКОНОМИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ ИФН альфа-2b ПРИ ХГС
Анализ применения ИФН альфа-2b в лечении ХГС в Великобритании показал оправданность затрат. Прямые медицинские затраты оценивались за время госпитализации и амбулаторного лечения. Они включали в себя стоимость лекарств, обследований, затраты при проведении трансплантации печени у определенного процента больных с декомпенсированным циррозом печени; были учтены также затраты на уход. Затем сделана 5% скидка. У лечившихся больных смертность была ниже, реже наблюдалось прогрессирование хронического гепатита в цирроз печени, а также развитие декомпенсированной стадии заболевания. Таким образом, авторы этого исследования показали, что терапия ХГС интерфероном альфа экономически обоснована, значительно улучшает состояние больного и потенциально сокращает число инфицированных. 176
Больная С. 28 лет оперирована в 1991 г. по поводу гнойного аднексита (резекция правого яичника), проводились гемотрансфузии. В 1992 г. выполнена резекция 2-х метров тонкой кишки (острая кишечная непроходимость). В 1995 г. перенесла ОВГ А, после реконвалесценции оставалось умеренное повышение содержания билирубина. В апреле 1997 г. обнаружено повышение аминотрансфераз и наличие анти-HCV. При обследовании в гепатологическом центре г. Ростова произведена пункционная биопсия печени: хронический активный гепатит С - вирусной этиологии. Дополнительное обследование с помощью метода ПЦР позволило выявить у больной РНК HCV, генотип 1b. Больная направлена в ЦНИИГ для проведения противовирусной терапии.
Госпитализирована 24.11.97 г. При поступлении жалобы на тупые боли в правом подреберье, общую слабость. Объективно: состояние удовлетворительное. Склеры субиктеричны. Кожные покровы обычной окраски. Система дыхания и кровообращения без отклонений от нормы. Живот умеренно болезненный при пальпации в эпигастрии. Печень выступает из-под края реберной дуги по грудинно-ключичной линии на 3-4 см, несколько уплотнена. Селезенка не пальпируется. Со стороны других органов патологии не выявлено. Проведенное УЗИ органов брюшной полости выявило диффузное изменение паренхимы печени без признаков портальной гипертензии. Проведенная эзофагогастродуо-деноскопия позволила диагностировать умеренно выраженный хронический гастрит. Консультация гинеколога: хронический кольпит. Исследование крови: Нв 140 г/л; эр. 4,6; ЦП 0,92; лейкоциты 5,2; эозинофилы 2; п/я 2; с/я 58; лимфоциты 32; моноциты 6. Тромбоциты 276, СОЭ 6 мм. Протромбин 86%. Сахар 4,0 мг%. Общий билирубин 37 мкмоль/л (прямой 6,0), холестерин 4,4 мг%, щелочная фосфатаза 2,4 (N 2,2), АсАТ 0,42, АлАТ 0,58 (N 0,40), тимоловая проба 3,1, формоловая проба - отр, общий белок 78 г%, альбумины 52, глобулины 48, альфа1 - 5,2, альфа2 - 8,3, (бета - 10,9, гамма - 26,6. Маркеры вирусной инфекции: HBsAg (-), anti-HCV (+). Генотип 1b. lgM - 150 мг%, lgG - 1500 мг%, lgA - 210 мг%. РНК ПЦР HCV (+).
Клинический диагноз: Хронический активный гепатит С - вирусной этиологии, генотип Ib, фаза репликации вируса. Хронический умеренно выраженный гастрит. Хронический кольпит. Частично резецированная тонкая кишка.
Результаты обследования больной в ЦНИИ гастроэнтерологии свидетельствовали о прямых показаниях к проведению более эффективной сочетанной противовирусной терапии интерфероном и рибавирином. Интрон А (интерферон - 2бета) назначался по 3 млн. ЕД 3 раза в неделю. Рибавирин - по 200 мг 3 раза в день, ежедневно. Через 2 месяца после проводимого лечения в отделении патологии печени ЦНИИГ отмечена нормализация аминотрансфераз, методом ПЦР выявлено исчезновение РНК HCV. Рекомендовано продолжить лечение в течение 6 мес. под контролем картины периферической крови и функциональных проб печени.
Повторная госпитализация в ЦНИИГ 14.4.98 г (через 6,5 мес.). На фоне проводимого лечения больная отметила значительное уменьшение общей слабости, ноющие боли в правом подреберье приняли эпизодический характер. Объективно: состояние удовлетворительное. Склеры субиктеричны. Кожные покровы обычной окраски. Система дыхания и кровообращения без отклонений от нормы. Живот мягкий, безболезненный при пальпации во всех отделах. Печень выступает из-под края реберной дуги по грудинно-ключичной линии на 1,5-2 см. Со стороны других органов патологии не выявлено. УЗИ: признаки диффузного поражения печени. Исследование крови: Нв 115 г/л; эр. 4,0; ЦП 0,85; лейкоциты 3,8; эозинофилы 4; п/я 4; с/я 54; лимфоциты 32; моноциты 6. Тромбоциты 120. СОЭ 13 мм. Протромбин 85%. Сахар 4,3. Общий билирубин 24,0 (прямой 4,0 мкмоль/л), холестерин 3,5, щелочная фосфотаза 1,9, АсАТ 33,7, АлАТ 26,0, тимоловая проба 3,4 (N до 5), общий белок 81 г%, альбумины 49,5, глобулины 50,0, (альфа1 - 3,8, альфа2 - 9,2, бета - 11,7, гамма - 25,6. HBsAg (-), anti-HCV (+), РНК ПЦР HCV (-).
В результате сочетанного лечения интроном А и рибавирином в течение 6,5 мес. получена ремиссия, стабильность которой предполагалось оценить через 6 месяцев. Рибавирин отменен. Лечение интроном А рекомендовано продолжить в течение последующих 6 месяцев. Контрольное исследование крови, проведенное 11.11.98 г, т.е. через 11 мес. показало: анти-HCV (+), РНК ПЦР HCV (-). Общий билирубин 41,0 мкмоль/л (прямой 10,0), холестерин 2,6, щелочная фосфатаза 0,96, АсАТ 40,0, АлАТ 37,0, тимоловая проба 5,7, формоловая проба - отр. Общий белок 92,0, альбумины 50,3, глобулины 49,7, (альфа1 - 5,6, альфа2 - 9,3, бета - 13,1, гамма - 21,0.
Приводим результаты морфологического исследования ткани печени до лечения (Рис. 1) и через 6,5 мес. после лечения (Рис. 2).
Рисунок 1
Инфильтрация портального тракта лимфоцитами, проникновение инфильтрата в дольку (до лечения). Окр. гематоксилин-эозин, х 300
Рисунок 2
Незначительно выраженная лимфоидноклеточная инфильтрация портального тракта, пограничная пластинка сохранена (после лечения). Окр. гематоксилин-эозин, х 300
В первой биопсии (1997 г, до лечения) наблюдалось поражение портальных трактов. Наряду с умеренно расширенными, склерозированными и умеренно инфильтрированными портальными трактами встречались значительно расширенные и существенно инфильтрированные. В одном из них инфильтрат имел вид лимфатического фолликула. На серийных срезах можно было проследить как один из умеренно расширенных и значительно инфильтрированных портальных трактов на последующих срезах был значительно расширен, обильно инфильтрирован лимфоидными клетками, имелась выраженная пролиферация дуктул. Пограничная пластинка в некоторых портальных трактах была разрушена проникающим на небольшую глубину в дольку инфильтратом. Несмотря на незначительную инфильтрацию портальных трактов, желчные протоки в них отсутствовали или эпителий их был фрагментарно дистрофически изменен. Внутридольковые лимфо-идно-клеточные инфильтраты были единичны, "растекание" инфильтрата наблюдалось только в одном из них. Ядра многих гепатоцитов содержали крупные вакуоли. Паренхима была представлена в основном, "светлыми" клетками.
ЗАКЛЮЧЕНИЕ: Умеренно выраженный портальный, незначительно выраженный перипортальный и лобулярный гепатит С - вирусной этиологии.
Во второй биопсии, проведенной больной через год, в морфологической картине ткани печени отмечалось меньшее расширение портальных трактов, снижение интенсивности воспалительного инфильтрата, наряду с этим встречались расширенные, склерозированные, но неинфильтрированные портальные тракты. Не наблюдалось и разрушения пограничной пластинки. Желчные протоки не выявлялись только в некоторых портальных трактах. В одном незначительно инфильтрированном портальном тракте наблюдалась пролиферация дуктул. Внутридольковая инфильтрация отсутствовала. Вакуоли в ядрах наблюдались лишь в единичных гепатоцитах.
ЗАКЛЮЧЕНИЕ: Умеренно выраженный портальный гепатит. Сравнение морфологической картины обоих биоптатов позволяет сделать заключение о снижении выраженности портального воспаления, исчезновении перипортальной и внутридольковой инфильтрации, вакуолизации ядер гепатоцитов.
Обнаружение РНК HCV с помощью ПЦР не является однозначным свидетельством экспрессии вирусного генома, поэтому исследованиям, направленным на определение вируса гепатита С в клетках печени человека придается особое значение. Существует мнение, согласно которому, определение вируса в ткани печени должно быть проведено после лечения гепатита, так как критерием эффективности терапии служит отсутствие инфекционного агента в печени [15]. Специально проведенное исследование в НИИ Вирусологии РАМН с помощью моноклональных антител (А.А. Кущ и соавторы) не обнаружило в ткани печени данной больной С-вирусного белка, что позволяет с большей уверенностью допускать возможность полной элиминации вируса С из организма больной и ее выздоровления.
В заключение отметим, что в представленном случае мы располагаем ближайшими результатами сочетанного лечения интроном А и рибавирином хронического активного гепатита С - вирусной этиологии, генотип 1b, свидетельствующими о достижении клинико-лабораторно-морфологической ремиссии.
Литература
Изучение показателей белково-синтетической функции печени и портальной гипертензии у больных хроническим гепатитом С (ХГС) с декомпенсированным циррозом печени (ЦП) после успешного лечения препаратами прямого противовирусного действия.
Материалы и методы
В проспективное исследование были включены 50 больных ХГС с декомпенсированным ЦП, получавших препараты прямого противовирусного действия и достигших устойчивого вирусологического ответа (УВО). Оценивали параметры функции печени, портальной гипертензии, в том числе индексы модели терминальной стадии заболевания печени (MELD) и Чайлд-Пью, до и каждые 3-6 месяцев после противовирусной терапии (ПВТ). Медиана продолжительности наблюдения после окончания ПВТ составила 18 (6–42) месяцев.
К концу наблюдения снижение индексов MELD и Чайлд-Пью отмечено у 72% и 74% больных, соответственно. У 52% больных наблюдалась компенсация ЦП (переход в класс А по Чайлд-Пью), у 89% больных с ЦП класса С – уменьшение выраженности декомпенсации (переход в класс B), у 7,3% – ухудшение состояния (переход в класс С). Активность аланинаминотрансферазы (АЛТ) нормализовалась у 90% пациентов, у половины из них активность аспартатаминтрансферазы (АСТ) оставалась повышенной. Число тромбоцитов достоверно увеличилось (р=0,016). Асцит был купирован или уменьшился у 57% больных. По результатам многофакторного регрессионного анализа Кокса мужской пол (отношение шансов [ОШ] 5,19, p=0,003) и исходный уровень альбумина менее 32 г/л (ОШ 2,97, р=0,022) оказались независимыми факторами риска, ассоциировавшимися с отсутствием компенсации ЦП к концу наблюдения.
Эрадикация вируса гепатита С приводит к снижению индексов MELD и ЧайлдПью у большинства больных с декомпенсированным ЦП и компенсации заболевания у половины из них.
Вирус гепатита С (ВГС) является одной из основных причин цирроза печени (ЦП), гепатоцеллюлярной карциномы (ГЦК) и трансплантации печени в мире. Ежегодный риск декомпенсации ЦП (кровотечение из варикозно расширенных вен пищевода и желудка, асцит, печеночная недостаточность, печеночная энцефалопатия) и развития ГЦК составляет около 3–6% [1,2]. Смертность у таких пациентов достигает 60% в течение 5 лет [3,4]. Ранее было показано, что у больных с компенсированным ЦП эрадикация ВГС в результате лечения препаратами интерферона-альфа и рибавирина приводит к снижению риска прогрессирования заболевания и улучшению выживаемости 7.
Целью исследования было изучение основных показателей белково-синтетической функции печени и портальной гипертензии, в том числе динамики индексов MELD и Чайлд-Пью, у пациентов с декомпенсированным ЦП после эрадикации ВГС.
Материал и методы
В исследование включали больных ХГС с декомпенсированным ЦП (класс В и С по Чайлд-Пью), получавших препараты прямого противовирусного действия с сентября 2014 г. по июль 2018 г. и достигших УВО (неопределяемый уровень РНК ВГС в сыворотке крови методом полимеразной цепной реакции через 12 недель после окончания терапии).
Критериями исключения были следующие: класс А по Чайлд-Пью, другие сопутствующие причины поражения печени, наличие ГЦК или рака другого типа и локализации на момент начала ПВТ, перенесенная трансплантация печени. Демографические, клинико-лабораторные и ин стру ментальные характеристики изучали у каждого пациента не более чем за 3 месяца до начала ПВТ. У каждого пациента определяли генотип ВГС и вирусную нагрузку, показатели общего анализа крови, активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глутамилтрансферазы (ГГТ), щелочной фосфатазы (ЩФ), уровень альбумина, общего и прямого билирубина сыворотки, протромбиновый индекс (ПТИ), международное нормализованное отношение (МНО), альфа-фетопротеин. Всем больным выполняли эзофагогастродуоденоскопию, ультразвуковое исследование органов брюшной полости и/или контрастные методы визуализации (КТ, МРТ печени с контрастным усилением).
После достижения УВО у пациентов каждые 3-6 месяцев изучали параметры функции печени, портальной гипертензии и динамику баллов по шкале Чайлд-Пью и MELD. Результаты представлены в трех временных интервалах: до лечения, на момент достижения УВО и последнего обследования.
Статистический анализ выполнен с помощью программ IBM SPSS Statistics (version 21) и GraphPad Prism 8. Количественные переменные представлены в виде медианы (диапазона), категориальные – в виде числа и процента. Изучение динамики показателей проведено с помощью tкритерия Стьюдента, критериев Вилкоксона и МакНемара. Сравнительный анализ двух независимых групп проводился при помощи t-критерия Стьюдента для количественных показателей, U-критерия Манна-Уитни – для категориальных. Для сравнения качественных признаков использовали критерий c2. Регрессионный анализ Кокса применяли для выявления независимых факторов риска наступления событий. Достоверным считали уровень значимости р
Результаты
В исследование были включены 50 больных ХГС с декомпенсированным ЦП (табл. 1). Тридцать (60%) пациентов получали софосбувир + даклатасвир, 5 (10%) – даклатасвир + асунапревир, 5 (10%) – софосбувир/ ледипасвир, 5 (10%) – софосбувир/велпатасвир, 2 (4%) – паритапревир/ритонавир/омбитасвир + дасабувир, 1 (2%) – софосбувир + симепревир, 2 (4%) – софосбувир + рибавирин, 24 (48%) – дополнительно рибавирин. Продолжительность лечения составила от 12 до 24 недель, медиана продолжительности наблюдения после окончания ПВТ – 18 (6–42) месяцев.
| Параметр | Значение |
|---|---|
| Мужчины, n (%) | 29 (58) |
| Возраст, лет (диапазон) | 53,5 (33–79) |
| Индекс массы тела, кг/м 2 (диапазон) | 27,3 (19,0–39,2) |
| Сахарный диабет, n (%) | 7 (14) |
| Злоупотребление алкоголем, n (%) | 10 (20) |
| 1 генотип вируса, n (%) | 36 (72) |
| РНК ВГС, МЕ/мл (диапазон) | 2,7×104 [5600-6,8×106] |
| Не получали ранее ПВТ, n (%) | 38 (76) |
| Софосбувир-содержащие схемы, n (%) | 43 (86) |
| Рибавирин, n (%) | 24 (48) |
| Класс по Чайлд-Пью, n (%) | |
| В | 41 (82) |
| С | 9 (18) |
| Эластометрия печени, кПа, (диапазон), | 28,7 (14,6-70,0) |
| n=20 |
Биохимический ответ. Нормализация активности АЛТ и АСТ на момент последнего осмотра отмечена у 90% и 51% больных, соответственно (табл. 2). Медиана снижения активности АЛТ и АСТ к окончанию наблюдения составила 53 Ед/л и 43 Ед/л, соответственно.
Уровень общего билирубина снизился с 33,5 [12,570,6] до 25,2 [7,1-70,0] мкмоль/л (p=0,004), медиана снижения составила 7,9 мкмоль/л. Уровень общего билирубина на момент последнего осмотра нормализовался 9 (22,5%) из 40 больных.
ПТИ увеличился с 59% 80 до 66% 75 (р=0,008), медиана изменения составила +10%. ПТИ нормализовался в 10 (26,3%) из 38 случаев.
Изменения индекса MELD и Чайлд-Пью. Индекс MELD снизился у 39 (72%) пациентов, в среднем на 3 балла (от 1 до 7), увеличился – у 7 (16%), в среднем на 1,5 балла (от 1 до 6), и не изменился у 4 (12%). У 25 (80,6%) из 31 больного с исходным индексом MELD>15 баллов отмечено улучшение и у 3 (9,7%) – ухудшение показателя MELD (рис. 1).
У 26 (52%) больных отмечена компенсация заболевания (переход в класс А), у 8 (89%) больных с ЦП класса С по Чайлд-Пью – уменьшение выраженности декомпенсации (переход в класс B), у 3 (7,3%) больных – ухудшение состояния (переход в класс С). В целом, у 37 (74%) больных отмечено снижение суммы баллов по Чайлд-Пью, у 6 (12%) – увеличение, еще у 7 (14%) сумма баллов не изменилась (рис. 1).
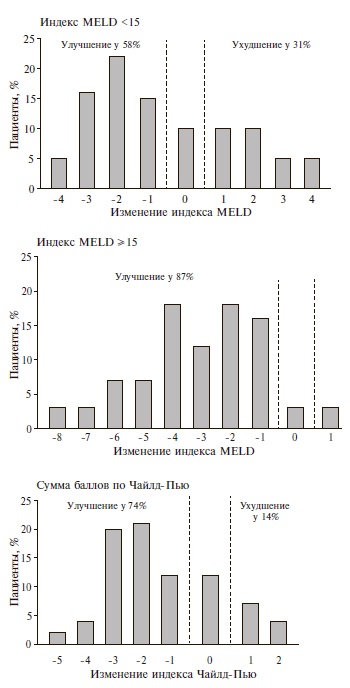
Рис. 1. Динамика индексов MELD и Чайлд-Пью
По данным однофакторного регрессионного анализа Кокса, мужской пол (отношение шансов [ОШ] 5,1, р=0,003), класс С по Чайлд-Пью (ОШ 3,51, р=0,003), индекс MELD ≥15 (ОШ 3,69, р=0,018), уровень альбумина ≤32 г/л (ОШ 2,9, р=0,025), общего билирубина ≥33,5 мкмоль/л (ОШ 3,17, р=0,011) достоверно ассоциировались с отсутствием компенсации ЦП при последнем осмотре (рис. 2). По данным многофакторного регрессионного анализа Кокса, мужской пол (ОШ 5,19, р=0,003) и уровень альбумина ≤32 г/л (ОШ 2,97, р=0,022) оказались независимыми факторами риска отсутствия компенсации ЦП (рис. 2).
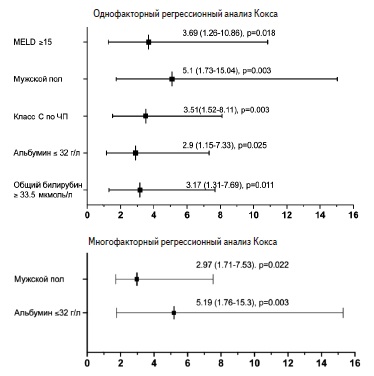
Рис. 2 Факторы, ассоциированные с отсутствием ком пенсации цирроза печени
Заключение
В нашем исследовании активность АЛТ нормализовалась у 90% больных, однако у половины из них активность АСТ оставалась повышенной, что, вероятно, связано с нарушением функции синусоидальных клеток печени при ЦП и, как следствие, снижением захвата АСТ, а также наличием у этих больных более тяжелого повреждения гепатоцитов и высвобождением в кровоток, наряду с цитоплазматической, митохондриальной фракции АСТ 22. Аналогичные результаты получены в другом исследовании, в котором среди 80 Эрадикация ВГС привела к снижению индексов MELD и Чайлд-Пью у большинства больных с декомпенсированным ЦП и компенсации заболевания (переход в класс А по Чайлд-Пью) у половины из них. Несмотря на нормализацию АЛТ у большинства больных, примерно в половине случаев АСТ оставалась повышенной. Установлено достоверное улучшение ряда параметров портальной гипертензии у большинства пациентов к концу наблюдения (повышение количества тромбоцитов, купирование или уменьшение асцита). Мужской пол и исходный уровень альбумина менее 32 г/л оказались независимыми факторами риска отсутствия компенсации ЦП. Таким образом, наше исследование демонстрирует эффективность и безопасность ПВТ у больных ХГС и декомпенсированным ЦП. Однако, требуется дальнейшее изучение влияния эрадикации вируса на прогноз и выживаемость у данной группы пациентов в рамках более крупных и длительных исследований.
Для цитирования: Широкова Е.Н. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ. ПРИМЕНЕНИЕ ИНТЕРФЕРОНА В ЛЕЧЕНИИ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА С. РМЖ. 1998;19:9.
Обычно терапия хронического гепатита С проводится лимфобластным либо рекомбинантным a-интерфероном. Отбор больных для терапии труден и учитывает много факторов. Прогностическими признаками наступления ответа на лечение интерфероном являются: женский пол, нормальная масса тела, нормальный уровень g-глютамилтранспептидазы, недавнее инфицирование, отсутcтвие цирротических изменений по данным биопсии печени, низкий уровень виремии, генотип вируса гепатита II или III, отсутствие НСV-мутантов.
Плохие результаты у больных с генотипом вируса Ib связывают с мутацией гена N55А. Результаты работы по исследованию зависимости вирусологического ответа у больных с генотипом Ia и Ib от дозы интерферона показали, что с повышением дозы до 10 МЕ можно преодолеть интерферонорезистентность у этой категории больных [1].
Общепринятый стандарт терапии – a -интерферон по 3 МЕ 3 раза в неделю в течение 6 мес. Около половины пациентов не отвечают на лечение, а у 50 – 80% ответивших после прекращения курса наступает рецидив. Устойчивый ответ определяется как нормализация уровня АЛТ, отсутствие РНК гепатита С в крови и улучшение гистологической картины печени спустя год после окончания курса интерферонотерапии. Частичный ответ определяется как улучшение, но не нормализация уровня АЛТ сыворотки. Полный ответ наступает только у 25% пациентов. Лишь у 70 – 70% больных с биохимическим ответом наблюдают вирусологический ответ. Интересно, что максимальный эффект интерферона снижается через 24 ч после введения 3 МЕ. Это может давать вирусу шанс для быстрой репликации и мутации, что, соответственно, может привести к развитию устойчивости к интерферонотерапии [1].
При использовании строгих гистологических критериев улучшения положительная динамика после лечения отмечается у 28% больных. Уровень АЛТ (биохимический ответ) не всегда отражает гистологические изменения в печени после курса интерферонотерапии. Чувствительность и специфичность этого показателя для определения гистологических изменений составляют 70% и 66% соответственно. У 17% пациентов с повышенным уровнем АЛТ после курса интерферонотерапии может наступить гистологическое улучшение. Согласно менее строгим гистологическим критериям в 62% случаев наступает улучшение гистологической картины печени, а у 51% больных с повышенным уровнем АЛТ после лечения может наступить улучшение гистологической картины [2].
Интерферонотерапия улучшает гистологическую картину (уменьшение индекса гистологической активности на 5 баллов и более по шкале Knodell) у 69% больных с положительным биохимическим ответом и у 48% с отрицательным биохимическим ответом, что обычно коррелирует с уменьшением титра РНК гепатита С. Возможно, интерферонотерапия уменьшает фиброгенез в печени, что может предотвращать прогрессирование в цирроз [3].
Пилотное исследование итальянских авторов показало, что интерферонотерапия может быть эффективной у больных хроническим гепатитом С с нормальным уровнем АЛТ в отношении достижения как кратковременного, так и устойчивого вирусологического ответа [4].
Наиболее эффективные дозы интерферона и длительность терапии окончательно не определены. Метаанализ различных режимов введения интерферона выявил наилучшее соотношение эффективность/риск для схемы 3 МЕ интерферона 3 раза в неделю в течение 12 мес для пациентов, не леченных до этого интерфероном.
В контролируемом исследовании было показано, что среди пациентов, получавших 3 МЕ 3 раза в неделю на протяжении 12 мес достоверно чаще наблюдалась нормализация уровня АЛТ, исчезновение РНК гепатита С и улучшение гистологической картины печени [5]. В другом исследовании увеличение сроков терапии с 28 до 52 нед увеличивало частоту наступления долговременного ответа с 33 до 53,5%. Длительные курсы могут быть особенно полезны у больных с высоким уровнем виремии. Однако 38% больных резистентны к продолжительной интерферонотерапии.
Устойчивый биохимический ответ после 12-месячного курса интерферонотерапии в стандартном режиме наблюдается у 41% больных, в то время как после 6-месячного курса – у 16,5%. Устойчивый биохимический ответ не тождественен вирусологическому. Только 61% пациентов с нормальным уровнем АЛТ после курса лечения были РНК-отрицательны. И лишь у 78% с устойчивым биохимическим ответом отмечается длительный вирусологический ответ [6]. У трети пациентов отмечен поздний, более чем через 3 месяца, ответ на интерферонотерапию [6].
Для того чтобы оценить, увеличивают ли большие дозы интерферона вероятность или продолжительность ответа, исследовали различные дозы интерферона a -2b (3, 5 и 10 МЕ), вводимые 3 раза в неделю. Начальный ответ на интерферонотерапию не увеличивался при повышении дозы препарата. Пациенты, не ответившие на 3 МЕ препарата 3 раза в неделю в течение 12 нед, не отвечали на терапию в прежней дозе. В то же время известно, что определенная часть не ответивших на терапию с использованием дозы 3 или 5 МЕ может ответить на большую дозу препарата. Хотя устойчивый ответ увеличивается при увеличении дозы свыше 3 МЕ 3 раза в неделю, в этом случае возникают серьезные побочные эффекты [7].
Наряду с рекомбинантным интерфероном изучаются другие типы интерферона. Проводилось мультицентровое рандомизированное исследование по сравнению эффективности интерферона-консенсус (ненатуральный рекомбинантный интерферон 1 типа) и рекомбинантного интерферона a -2b. Было показано, что схема лечения по 9 мкг интерферона-консенсус 3 раза в неделю в течение 6 мес безопасна и эффективно снижает концентрацию НСV РНК в сыворотке. Аналогичный эффект отмечен и у больных хроническим вирусным гепатитом с генотипом вируса I. Более чем у половины больных наблюдалось улучшение гистологической картины: снижение активности по меньшей мере на 2 балла по индексу Knodell [8].
Лимфобластный интерферон a -n1 улучшает отдаленный ответ после 6-месячного курса стандартной терапии по 3 МЕ 3 раза в неделю по сравнению с рекомбинантным интерфероном a -2b. Улучшение гистологической картины печени было максимальным у пациентов с нормальным уровнем АЛТ и отсутствием виремии [9].
Терапия интерфероном a -n3 (натуральный a -интерферон) у прежде не леченных интерфероном больных отличается хорошей переносимостью. Ни у одного больного не обнаружено нейтрализующих аутоантител во время или по окончании курса терапии. Доза 10 МЕ эффективна в отношении нормализации уровня АЛТ у 67% больных и исчезновении РНК НСV у 59% [10].
Ведение пациентов с рецидивом после курса интерферонотерапии или неответивших на него является трудной задачей. У части больных может быть эффективно увеличение дозы интерферона до 6 МЕ 3 раза в неделю. В других случаях можно рекомендовать комбинированную терапию интерфероном и рибавирином.
Рибавирин – циклический нуклеоизид, аналог гуанозина, с широким спектром активности против РНК- и ДНК-вирусов. У больных хроническим гепатитом С рибавирин временно снижает уровень АЛТ, улучшает гистологическую картину печени, однако, препарат не влияет на уровень виремии [11]. Механизм положительного действия рибавирина в отношении клинико-гистологической картины без уменьшения уровня виремии не совсем понятен. Возможно, имеет значение влияние рибавирина на воспалительные цитокины и апоптоз. Преимуществами рибавирина являются возможность перорального приема препарата и небольшое число побочных проявлений (умеренные дискомфорт в животе и гемолитическая анемия, гиперурикемия).
Пилотные исследования показали, что комбинированная терапия усиливает антивирусный эффект, особенно в тех случаях, когда не удается достичь устойчивого ответа при применении одного интерферона. Рибавирин принимается в дозе 1000 – 1200 мг в сутки в два приема. Доза интерферона составляет 3 МЕ 3 раза в неделю. Продолжительность курса —
24 нед. У 40% больных отмечается исчезновение НСV РНК, уменьшаются уровень АЛТ и воспалительная активность по данным биопсии печени.
Сравнительный анализ монотерапии интерфероном, рибавирином и комбинацией этих препаратов показал, что использование только рибавирина дает лишь временный эффект, в то время как комбинированная терапия повышает уровень устойчивого полного ответа, сравнимого только с интерферонотерапией. Курс комбинированной терапии в течение 6 мес приводит у 78% больных к нормализации уровня трансаминаз, сохраняющейся на протяжении 5 мес после окончания курса. При применении интерферона такой ответ зафиксирован только у 33% пациентов и ни в одном случае не наблюдался при монотерапии рибавирином.
Исследование комбинированной терапии тимозином 1 (иммуномодуляторный пептид) и интерфероном показало биохимические, гистологические и вирусологические преимущества этой комбинации по сравнению с интерферонотерапией [12].
У больных хроническим гепатитом С с выраженным синдромом холестаза используется урсодезоксихолевая кислота в сочетании с интерфероном. Такая комбинация значительно удлиняет период нормализации уровня АЛТ, однако, не влияет на уровень виремии и гистологическую картину печени.
Применение нестероидных противовоспалительных средств (теноксикама) не увеличивает эффективность интерферона в лечении хронического гепатита С [13].
1. Lam NP, Neumann AU, Gretch DR, et al. Dose-dependent acute clearance of hepatitis C genotype I virus with interferon alfa. Hepatology 1997;6(1):226–31.
2. Bonis PAL, Ioannidis JPA, Cappelleri JC, et al. Correlation of biochemical response to interferon alpha with histological improvement in hepatitis C: a meta-analysis of diagnostic test characteristics. Hepatology 1997;26(4):1035–44.
3. Shiffman ML, Hofmann CM, Thompson EB, et al. Relationship between biochemical, virological, and histological response during interferon treatment of chronic hepatitis C. Hepatology 1997;26(3):780–5.
4. Rossini A, Ravaggi A, Biasi L, et al. Virological response to interferon treatment in hepatitis C virus carriers with normal aminotransferase levels and chronic hepatitis. Hepatology 1997;26(4):1012–7.
5. Poynard T, Leroy V, Cohard M, et al. Meta-analysis of interferon randomized trials in the treatment of viral hepatitis C: effects of dose and duration. Hepatology,1996.
6. Manesis EK, Papaioannou C, Gioustozi A, et al. Biochemical and virological outcome of patients with chronic hepatitis treated with interferon alpha-2b for 6 or 12 months: a 4-year follow-up of 211 patients. Hepatology 1997;26(3):734–9.
7. Lindsay KL, Davis GL, Schiff ER, et al. Response to higher doses of interferon alpha-2b in patients with chronic hepatitis C: a randomized multicenter trial. Hepatology, 1996.
8. Tong MJ, Reddy KR, Lee WM, et al. Treatment of chronic hepatitis С with consensus interferon: a multicenter, randomized, controlled trial. Hepatology 1997;26(3)747–54.
9. Farell GC, Bacon BR, Goldn RD, et al. Lymphoblastoid interferon alpha-n1 improves the long-term response to a 6-month course of treatment in chronic hepatitis C compared with recombinant interferon alpha-2b: results of an international randomized controlled trial. Hepatology, 1998.
10. Simon DM, Gordon SC, Kaplan MM, et al. Treatment of chronic hepatitis C with interferon alpha-n3: a multicenter, randomized, open-label trial. Hepatology, 1997.
11. Bodenheimer HC, Lindsay KL, Davis GL, et al. Tolerance and efficacy of oral ribavirin treatment of chronic hepatitis C: a multicenter trial. Hepatology 1997;26(2):473–7.
12. Sherman KE, Sjogren M, Creager R et al. Combination therapy with thymosin 1 and interferon for the treatment of chronic hepatitis C infection: a randomized, placebo-controlled double-blind trial. Hepatology,1998.
13. Zarski JP, Maynard-Muet M, Chousterman S, et al. Tenoxicam, a non-steroid anti-inflammatory drug, is unable to increase the response rate in patients with chronic hepatitis C treated by alpha interferon. Hepatology, 1998.
Читайте также:

