Альфафетопротеин против гепатита с
Обновлено: 25.04.2024
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова" Минздравсоцразвития России, Москва
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова" Минздравсоцразвития России, Москва
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова" Минздрава России, Москва
Диагностическая значимость определения альфа-фетопротеина в онкологии, перинатологии и неонатологии (обзор литературы)
Журнал: Проблемы репродукции. 2012;(6): 14‑19
Иванец Т.Ю., Алексеева М.Л., Колодько В.Г. Диагностическая значимость определения альфа-фетопротеина в онкологии, перинатологии и неонатологии (обзор литературы). Проблемы репродукции. 2012;(6):14‑19.
Ivanets TIu, Alekseeva ML, Kolod'ko VG. DIAGNOSTIC VALUE OF ALFA-FETOPROTEIN IN ONCOLOGY, PERINATOLOGY AND NEONATOLOGY (A REVIEW). Russian Journal of Human Reproduction. 2012;(6):14‑19. (In Russ.).
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова" Минздравсоцразвития России, Москва
Суммированы основные сведения о структуре и функции альфа-фетопротеина, а также информативности определения концентрации этого маркера в онкологии, акушерстве, неонатологии и перинатологии.
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова" Минздравсоцразвития России, Москва
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова" Минздравсоцразвития России, Москва
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова" Минздрава России, Москва
В последнее 20-летие определение концентрации альфа-фетопротеина (АФП) широко применяется в клинической практике для дифференциальной диагностики ряда эмбриональных опухолей, мониторинга терапии, а также в качестве скринирующего теста для выявления групп риска по внутриутробной патологии плода. Однако, несмотря на большое количество исследований в данной области, многие вопросы, касающиеся биосинтеза и механизма действия АФП, остаются малоизученными и дискуссионными.
Цель настоящего обзора — попытка суммировать основные сведения об АФП и информативности использования этого маркера в онкологии, акушерстве, перинатологии и неонатологии.
Материал и методы
Последующие 5 лет ушли на разработку схем мониторинга химиотерапии больных с гепатоцеллюлярной карциномой, тератобластомами и особенно герминомами яичников. Эти исследования очень активно проводились во Франции Уриелем и соавт. [25, 41, 42].
Совершенствовались также методы определения АФП — от бумажного электрофореза в 1960 г. до иммуноферментного анализа в настоящее время.
В 1972 г. D. Brock и A. Bolton [17] обнаружили высокое содержание АФП в амниотической жидкости при наличии у плода дефекта нервной трубки. На основании этого появилась возможность использовать АФП как маркер для формирования группы повышенного риска по наличию дефекта развития нервной трубки. С 1987 г. АФП начал использоваться в качестве скринирующего теста патологии плода [12—14]. Позднее была продемонстрирована возможность пренатальной диагностики синдрома Дауна с помощью определения АФП [22, 27, 36, 44].
Структура АФП и некоторые сведения о его функции
АФП является гликопротеином с молекулярной массой 69 000 Д. Углеводная компонента — один олигосахарид (4% от общей молекулярной массы), белковая компонента — одна полипептидовая цепь (590 аминокислот), организованная в трехмерный домен [1, 31].
По физико-химическим свойствам АФП имеет много общего с сывороточным альбумином, молекула которого также представлена одной полипептидной цепью, на 70% идентичной таковой АФП. Кроме того, оба белка имеют идентичные молекулярные массы, изоэлектрическую точку, электрофоретическую подвижность. Сывороточный альбумин, однако, не содержит углеводной составляющей, вследствие чего перекрестные реакции при определении сывороточного альбумина и АФП отсутствуют, так как моноклональные антитела для определения АФП вырабатывают к нативной молекуле с учетом ее углеводной составляющей [29].
Выяснение функции АФП — наиболее запутанная часть исследований, посвященных АФП.
Представляется, что все рассуждения о функции АФП достаточно спекулятивны. На настоящий момент достоверными фактами можно считать только два:
1. АФП проявляет высокое сродство к полиненасыщенным жирным кислотам (ПНЖК) [39].
2. АФП ассоциирован с некоторыми внутренними структурами плода и активно пролиферирующими тканями [40].
Из этого с большой вероятностью следует, что АФП адсорбирует ПНЖК из циркуляции материнской крови в плаценте и переносит их в ткани эмбриона, которые не обладают способностью к эндогенному синтезу ПНЖК.
Высокое сродство АФП к эстрогенам (в экспериментах на мышах) позволяет предположить, что АФП предохраняет эмбриональные ткани от воздействия материнских эстрогенов [11, 34].
Показано также, что АФП является иммуносупрессором, однако его иммуносупрессивная активность опосредована и проявляется лишь за счет взаимодействия с такими лигандами, как ПНЖК [34, 39].
Биосинтез АФП
Синтез АФП начинается в желточном мешке одновременно с возникновением эмбрионального гемопоэза, а точнее, в висцеральном эндодерме желточного мешка. Позднее, когда эмбриональный гемопоэз трансформируется в плодовый гематопоэз, когда печень берет на себя функцию кроветворного органа, синтез АФП и других белков сыворотки крови начинает происходить в печени. В незначительных количествах АФП синтезируется также в кишечной трубке, так как висцеральный эндодерм, кишечная трубка и печень имеют одинаковое эмбриональное происхождение [27, 41].
Изучение регуляции синтеза АФП и формирование представлений о его взаимосвязи с малигнизацией тканей является наиболее притягательной областью исследований.
Ген синтеза АФП клонирован и его активные зоны выявлены. Ген АФП относится к семейству генов альбуминов. Гены синтеза сывороточного альбумина, α-альбумина, витамин D-связывающего белка у человека локализованы в той же области на 4-й хромосоме, что и ген синтеза АФП. Ген АФП состоит из 15 экзонов, объединенных с 14 нитронами [29].
Однако, несмотря на многочисленные исследования в этой области, механизм запуска и выключения синтеза АФП недостаточно изучен. Предполагают, что ингибитором синтеза АФП в ранний постнатальный период могут быть гормон-рецепторные комплексы, которые взаимодействуют с соответствующими связывающими местами на промоторе гена АФП и ингибируют экспрессию этого гена [26, 34]. С другой стороны, глюкокортикоиды действуют как активаторы экспрессии гена АФП и тогда гормон-рецепторный механизм не может рассматриваться как основной регулятор синтеза АФП [16, 28]. По-видимому, существуют множественные факторы, участвующие в регуляции синтеза АФП.
АФП и опухоли
АФП является специфическим маркером эмбриональной карциномы [1, 6, 8, 42]. К этому типу опухоли относятся гепатоцеллюлярная аденокарцинома, тератобластома, дисгерминома и стромально-клеточные опухоли. Способность этих опухолей синтезировать АФП обусловлена присутствием в них тех же самых элементов висцерального эндодерма, что и в обычных эмбрионах [30].
Концентрация АФП, продуцируемого эмбриональными карциномами, очень высока. Клетки дисгерминомы яичников содержат также элементы синцитиотрофобласта, и поэтому наряду с АФП в них синтезируется хорионический гонадотропин (ХГ). Оба этих маркера используются для дифференциальной диагностики дисгермином [1, 7, 10, 30].
Повышенный уровень АФП определяется также приблизительно у 9% пациентов с метастатическим поражением печени при злокачественных опухолях молочной железы, бронхов и колоректальной карциноме. Однако уровень АФП у таких пациентов редко превышает 100 МЕ/мл и практически никогда 400 МЕ/мл. У большинства из них выявляется очень высокий уровень раково-эмбрионального антигена (РЭА), вследствие чего сочетание определения АФП и РЭА дает возможность для дифференциации данного типа патологии от первичной гепатоцеллюлярной карциномы [42].
Повышенный уровень АФП обнаруживается и при таком доброкачественном заболевании, как гепатит, однако повышение, как правило, носит временный характер и находится в области низких значений патологического диапазона (очень редко превышает уровень 400 МЕ/мл). Такие АФП-позитивные пациенты имеют большую вероятность возникновения гепатоцеллюлярной карциномы и худший 5-летний прогноз [30, 41].
Уровень АФП (в МЕ/мл) при некоторых патологиях:
гепатоцеллюлярная карцинома >800;
гепатобластома (дети) >400;
тератобластома семенников >500;
дисгерминома яичников >1000;
метастазы в печени >10;
гепатит В и С 10—50;
острые отравления до 100.
АФП и беременность
Начало синтеза АФП у плода человека совпадает по времени с возникновением эмбрионального гемопоэза, что соответствует 3—4-й неделе внутриутробного развития. Место синтеза — висцеральный эндодерм желточного мешка. К концу I триместра беременности (12—13 нед) основным местом синтеза АФП становятся гепатоциты печени плода. Максимальная концентрация АФП в крови плода отмечается на 12—14-й неделе беременности. Максимальная концентрация в крови матери — на 30—35-й неделе беременности [20, 23].
Часть АФП, синтезированного плодом, попадает в амниотическую жидкость (АЖ), откуда через мембраны плаценты и трансцеллюлярно проникает в кровоток матери [38]. Динамика обмена АФП между плодовыми тканями и сывороткой материнской крови изучена недостаточно.
После завершения формирования маточно-плацентарного кровотока АФП в кровь матери поступает преимущественно из крови плода [33, 45].

В течение физиологической беременности современные методы определения концентрации АФП позволяют регистрировать достоверные изменения уровня АФП в крови матери, начиная лишь с 14—15-й недели беременности, т.е. с момента завершения плацентации. Данные о динамике концентрации АФП в крови беременных женщин представлены в табл. 1.
Определение АФП в сыворотке крови беременных в настоящее время рассматривается как основа скринирующих программ для обнаружения пороков развития плода. При наличии у плода таких пороков, как дефект нервной трубки, гастрошизис, крестцово-копчиковая тератома, эмбриональная грыжа, отмечается резкое повышение концентрации АФП в крови матери [12—14]. Концентрация АФП повышается также при угрозе прерывания беременности и гибели плода [3, 20]. Причинами повышения концентрации АФП в крови матери могут являться: увеличенный синтез АФП у плода (крестцово-копчиковая тератома, эмбриональная грыжа), особенности маточно-плацентарного кровотока (повышение артериального давления у плода при угрозе прерывания беременности), особенности плодового гематопоэза при открытых пороках развития у плода (дефект нервной трубки и гастрошизис) [3, 24].
Эффективность определения анэнцефалии в сроки до 24 нед беременности составляет в среднем 85,7%, при открытой и закрытой spina bifida — 62,5%, при энцефалоцеле — 100% [15, 17]. Считается, что при открытых пороках нервной трубки происходит просачивание белка из сосудистого русла плода в АЖ через образовавшиеся дефекты, в результате чего уровень АФП в ней возрастает в несколько раз [38].
У женщин, родивших детей с дефектами нервной трубки, риск развития в дальнейшем этой патологии сохраняется. Даже при нормально развивающемся плоде уровень АФП в крови у этих женщин в последующих беременностях, как правило, превышает нормативные показатели [24].
При двойнях уровень АФП в среднем в 2 раза выше, чем при беременности одним плодом. Повышение концентрации АФП более чем в 3 раза, кроме перечисленных выше состояний, также встречается при дефектах передней брюшной стенки, атрезии пищевода и/или двенадцатиперстной кишки и омфалоцеле, врожденном нефрозе (финский тип), поликистозе почек, агенезии почек, при повышенной эхогенности кишечника плода (по данным УЗИ) [3, 19, 20]. При простом буллезном эпидермолизе, когда поражена слизистая желудочно-кишечного тракта, уровень АФП значительно возрастает в АЖ [27, 38].
Повышение концентрации АФП в сыворотке крови женщин во II и III триместрах беременности определяется при тяжелой гемолитической болезни и при гибели плода. Полагают, что повышенние уровня АФП связано с лизисом клеток плода, в частности цитолизом печени [45].
Увеличение концентрации АФП отмечается при синдроме Шерешевского—Тернера, а также при некоторых видах акушерской патологии.
Следует особо отметить, что при синдроме Дауна концентрация АФП в крови матери значительно снижена [3, 12, 21, 22, 36]. Этот факт положен в основу пренатальной диагностики данного синдрома. Эффективность диагностики по этому показателю, однако, не превышает 60%, так как снижение концентрации АФП в крови матери, характерное для синдрома Дауна, может не выявляться по ряду причин. Одна из них — токсикоз беременных. В этом случае концентрация АФП в крови матери может быть повышена за счет синтеза АФП ее печенью; другой возможной причиной может являться неблагополучное течение беременности — угроза прерывания, как упоминалось ранее, сопровождается повышением артериального давления у плода и тем самым избыточным поступлением АФП в кровоток матери. Установлено также, что при синдроме Дауна концентрация АФП снижена не только в крови матери, но и в АЖ и в крови плода [28]. Причина снижения активности синтеза АФП у плодов-даунов до настоящего времени однозначно не установлена [2, 45].
Такие заболевания, как системная красная волчанка [35], острая экзема, дерматиты [20] во время беременности, также приводят к повышению содержания АФП в крови женщин. У беременных с СД концентрация АФП находится, как правило, на нижней границе нормы [32].
Проводились работы по выявлению взаимосвязи между содержанием АФП в крови беременных и состоянием новорожденных.
Установлено, что в день родоразрешения в крови женщин, беременность которых протекала без осложнений и разрешилась в сроки 38—40 нед рождением здоровых детей, концентрация АФП составляла 100—160 МЕ/мл, в АЖ — 100—300 МЕ/мл, а в пуповинной крови новорожденного — 85 000—110 000 МЕ/мл. Сопоставление состояния новорожденного с данными о концентрации АФП в его крови, крови матери и АЖ позволило установить следующее.
При концентрации АФП в пуповинной крови от 85 000 до 110 000 МЕ/мл в 81% случаев отмечено рождение здоровых детей с оценкой по шкале Апгар 8—9 баллов. Ранний неонатальный период у них протекал без осложнений.
При значениях АФП в крови матери 100—160 МЕ/мл здоровые дети родились в 77% случаев. При наличии нормативных значений концентрации АФП во всех трех средах частота рождения здоровых детей составила 83%.
Наличие повышенной концентрации АФП в крови новорожденного, матери и АЖ в 58% случаев совпадало с развитием осложнений у детей в ранний неонатальный период.
Обнаружение низких значений концентрации АФП во всех средах в 71—74% случаев совпадало с наличием патологии у детей [2, 4, 5].
Наиболее информативным прогностическим тестом являлась концентрация АФП в пуповинной крови. Одновременное определение концентрации АФП в крови матери и новорожденного повышало чувствительность теста не более чем на 3—4%.
По-видимому, на начальном этапе неблагоприятного воздействия на плод активируется эмбриональный синтез АФП, тогда как длительное неблагоприятное воздействие приводит к истощению компенсаторных резервов, что и проявляется резким снижением уровня АФП в крови плода и новорожденного. Очевидно, что именно поэтому при таких видах патологии, как внутриутробная инфекция, задержка внутриутробного развития и хроническая гипоксия плода, низкие значения концентрации АФП регистрируются чаще [2, 4].
При неонатальной желтухе концентрация АФП повышена, кроме того, у этих детей отмечалась анемия новорожденных, что подтверждает теорию об общности механизмов регуляции процессов эмбрионального эритропоэза и синтеза АФП в печени плода.

Динамика концентрации АФП в крови здоровых новорожденных в течение раннего неонатального периода представлена в табл. 2.
В образцах сыворотки крови пожилых пациентов с положительным, отрицательным и неопределенным результатом исследования в иммуноферментных тест-системах планшетного формата с раздельным определением антител к структурным (Core) и неструктурным (NS3, NS4, NS5) антигенам вируса гепатита С была исследована концентрация α-фетопротеина (АФП). Показано, что концентрация АФП повышена в пробах, содержащих антитела высокой оптической плотности к структурным и неструктурным антигенам ВГС, по сравнению с концентрацией АФП в пробах, результаты исследования которых в иммуноферментных тест-системах были противоречивыми и неопределенными, а также в пробах с антителами к ВГС низкой оптической плотности. В образцах сыворотки крови пожилых людей без антител к ВГС наблюдались значительные колебания концентрации АФП. Таким образом, в лабораторной диагностике гепатита С необходима комплексная оценка серологических и биохимических маркеров ВГС-инфекции с учетом возрастной категории пациента.

антитела к вирусу гепатита С; иммуноферментный анализ; неопределенные результаты; α-фетопротеин; пожилые пациенты
Выявление антител к вирусу гепатита С (анти-ВГС) в крови пациентов методом иммуноферметного анализа (ИФА), которое является первым шагом лабораторной диагностики ВГС-инфекции, наиболее эффективно при обследовании людей без иммунодефицитного состояния в фазу развернутой продукции антител. На раннем этапе заражения ВГС и после выздоровления [8], а также при патологических и физиологических, в частности, возрастных, иммунодефицитных состояниях результаты исследования анти-ВГС в ИФА могут быть позитивными, но с низкой оптической плотностью, или противоречивыми [6]. В то же время вследствие широкого распространения и социальной значимости ВГС-инфекции необходимость в правильной интерпретации результатов исследования возникает уже на этапе первичного скрининга. Развитие гепатита С сопровождается определенными биохимическими изменениями сыворотки крови, в частности, увеличением концентрации аланинаминотрансферазы и α-фетопротеина (АФП) [3, 9]. Некоторые из биохимических маркеров повреждения печени могут быть обнаружены в сыворотке крови с неопределенным результатом исследования анти-ВГС в иммуноблоте [5]. В РФ в качестве подтверждающих тест-систем используются не только иммуноблоты, но и тест-системы для ИФА (ИФТС) в планшетном формате с раздельным определением антител к ряду антигенов ВГС. Относительно биохимической характеристики сыворотки крови с неопределенным результатом исследования анти-ВГС в планшетных ИФТС в литературе имеются единичные данные [5].
Целью представленной работы было определение концентрации α-фетопротеина в сыворотке крови пациентов пожилого возраста с различным, в том числе неопределенным, результатом исследования анти-ВГС в подтверждающих тест-системах планшетного формата с раздельным определением антител к антигенам ВГС.
Материалы и методы
Результаты были получены при исследовании 82 образцов сыворотки крови пожилых людей, направленных на определение наличия в них маркеров вирусных гепатитов.
Полученные результаты
После исследования в образцах сыворотки крови наличия анти-ВГС были выделены следующие группы:
1) при отсутствии анти-ВГС в скрининговой тест-системе образцы были признаны не содержащими анти-ВГС (группа Анти-ВГС-);
2) при выявлении в первичной скрининговой и в подтверждающей тест-системе анти-ВГС с высокой оптической плотностью (ОП не менее 2,0, КП не менее 8) образцы были признаны анти-ВГС-содержащими (группа Анти-ВГС+).
Следующие две группы были выделены при дальнейшем исследовании позитивных образцов с низкой ОП в ИФТС для первичного скрининга (ОП менее 1,4, КП менее 5), а именно:
3) при выявлении анти-ВГС с низкой ОП и соответственно с низким КП в двух подтверждающих ИФТС разных производителей и определения низкой или высокой авидности анти-ВГС образцы признавались анти-ВГС-низкопозитивными (группа Анти-ВГС низк+);
4) при выявлении анти-ВГС только в одной из двух подтверждающих ТС либо при выявлении анти-ВГС в двух подтверждающих ТС разных производителей, но при отсутствии положительного результата в ЛИА и при определении авидности анти-ВГС, результат исследования анти-ВГС рассматривался как неопределенный в ИФТС, но отрицательный в ЛИА (группа Анти-ВГС но/-).
Группу Анти-ВГС- составили 16 образцов сыворотки крови пациентов (средний возраст 74,5 ± 7,45 лет), у которых отсутствовали указания на факторы высокого риска инфицирования ВГС. В группе анти-ВГС средняя величина концентрации АФП составляла 8,25 МЕ/мл (от 3,741 до 29,71 МЕ/мл, σ = 6,266 МЕ/мл).
Группу Анти-ВГС+ составили 30 образцов (средний возраст пациентов 73,6 ± 5,5 лет). Образец №8 был получен от пациента с заболеванием печени, образец №22 - от пациента с наркоманией. В 28 из 30 образцов в подтверждающей ТС были обнаружены анти-Core и анти-NS ВГС с ОП в первичной и подтверждающей ИФТС не менее 2, КП не менее 8. В образце №18 определялись только анти-Core с ОП 2,0 и КП 8,0, в образце №7 определялись только анти-NS с ОП 2,7 и КП 10,8. Во всех образцах данной группы анти-ВГС были высокоавидными. Средняя концентрация АФП в группе Анти-ВГС+ составляла 14,725 МЕ/мл (интервал от 3,804 до 111,815 МЕ/мл, σ = 22,02 МЕ/мл).
В группу Анти-ВГСнизк+ (11 образцов, средний возраст пациентов 71,5 ± 6,4 года) образцы были отобраны согласно ранее разработанному алгоритму: либо при обнаружении только анти-Core с КП менее 2; либо при обнаружении только анти-NS ВГС (табл. 1). Средняя величина КП анти-NS в каждой ИФТС не превышала 5, однако КП анти-NS в разных ИФТС могли отличаться (образец №2). В 8 из 11 образцов авидность анти-ВГС была высокой, в трех - низкой. В 6 из 11 образцов были обнаружены только высоко- или низкоавидные анти-NS4 ВГС. Указаний на наличие факторов высокого риска инфицирования ВГС не было ни у одного пациента. Среднее значение концентрации АФП в группе анти-ВГСнизк+ было равно 7,045 МЕ/мл (от 4,06 до 24,06 МЕ/мл; σ = 5,773 МЕ/мл).
Результаты исследования 25 образцов (средний возраст пациентов 75,4 ± 7,0 лет) в ИФТС планшетного формата были противоречивыми (табл. 2). Из 25 образцов в двух (№3 и №18) были обнаружены высокоавидные анти-ВГС, в шести образцах (№№ 1, 2, 6, 9, 16, 19) авидность анти-ВГС была низкой. Все вышеперечисленные образцы в ИФТС другого производителя и в ЛИА были определены как анти-ВГС-негативные (группа Анти-ВГСно/-). Средняя величина концентрации АФП в образцах Анти-ВГСно/- была равна 11,187 МЕ/мл (от 2,941 до 83,16 МЕ/мл, σ = 16,642 МЕ/мл).
При сравнении сывороточной концентрации АФП по критерию Манна-Уитни было обнаружено, что группа образцов, не содержащих анти-ВГС, не отличается ни от одной из исследованных групп. Различия по концентрации АФП были обнаружены:
1) между группами Анти-ВГС+ и Анти-ВГСнизк+ (p = 0,024);
2) между группами Анти-ВГС+ и Анти-ВГСно/- (p = 0,045).
У пациентов пожилого возраста в г. Москве инфицирование вирусом гепатита С является наиболее частой причиной хронического гепатита (69,3% больных) [2]. При инфицировании ВГС в возрасте старше 50 лет цирроз печени формируется вдвое быстрее, чем у лиц, инфицированных до 50 лет. Осложнения ВГС-инфекции выявляются у пожилых в основном в далеко зашедших формах вследствие того, что длительная бессимптомная персистенция вируса и стертые клинические проявления заболевания приводят к позднему обращению больных к врачу [2]. Повышение специфичности лабораторной диагностики ВГС-инфекции как на раннем этапе инфицирования, так и при возрастной недостаточности иммунного ответа возможно при расширенных исследованиях анти-ВГС-позитивных образцов с низкой ОП в ИФА. Сравнивая результаты исследования проб пожилых людей с ранее полученными результатами исследования проб молодых мужчин [5], можно отметить следующее. Из общего количества образцов с неопределенными результатами исследования в ИФТС позитивными при дальнейшем исследовании признается не более 1/3 как в группе молодых мужчин, так и людей старше 65 лет. Различия между группами проявились, во-первых, в спектре выявляемых антител. В пробах, полученных от пожилых людей, в ИФТС с низкой ОП могли определяться анти-NS3, -NS4 и -NS5 раздельно и в различных сочетаниях; в ИБ/ЛИА наличие анти-ВГС в пробах данной подгруппы не подтверждалось. В пробах, полученных от молодых мужчин, практически во всех образцах с неопределенным результатом исследования анти-ВГС в ИФТС выявлялись только анти-NS4 ВГС; в дальнейших исследованиях в иммуноблоте наличие анти-ВГС не подтверждалось. Во-вторых, различие между группами выявилось по авидности антител: анти-NS4 у пожилых пациентов могли быть как высоко-, так и низкоавидными, а при обнаружении в пробе молодого пациента только анти-NS4 авидность антител не определялась. В-третьих, согласно нашим данным, изменение концентрации АФП в зависимости от результата тестирования анти-ВГС (позитивного, негативного и неопределенного) в группах проб молодых и пожилых пациентов было различным. Концентрация АФП в анти-ВГС-негативных образцах сыворотки крови молодых мужчин была ниже, чем в анти-ВГС-позитивных образцах и в образцах с неопределенными в ИФТС и неотрицательными в иммуноблоте результатами. В двух последних подгруппах концентрация АФП не различалась [5], что подтверждает вывод Rios [10] об эпидемиологической близости групп с анти-ВГС-позитивными и неопределенными результатами. В отличие от этого, группа образцов пожилых людей с отрицательными результатами тестирования анти-ВГС была крайне гетерогенной по концентрации АФП, по-видимому, вследствие разнообразных приобретенных заболеваний и наличия иных, кроме ВГС, гепатотоксических факторов, вследствие чего не отличалась ни от одной из исследованных групп по концентрации АФП. Отмеченное превышение сывороточной концентрации АФП в анти-ВГС-высокопозитивных образцах над концентрацией АФП в анти-ВГС-низкопозитивных образцах может быть обусловлено длительностью инфекционного процесса, в течение которого наиболее выраженное повышение уровня АФП наблюдается на стадии тяжелого фиброза с последующим снижением при трансформации в цирроз печени (частом осложнении хронического гепатита С у пожилых людей) [3]. Кроме того, в низкопозитивных на наличие анти-ВГС-образцах отсутствие подъема концентрации АФП может быть обусловлено начальным этапом инфекционного процесса (с анти-ВГС низкой авидности) либо выздоровлением (с остаточными анти-ВГС высокой авидности) с нормализацией биохимических показателей. Образцы с противоречивыми в ИФТС, но отрицательными в иммуноблоте и в тесте на авидность результатами, по-видимому, проявляли в ИФТС ложную позитивность.
Таблица 1
Концентрация α-фетопротеина в образцах сыворотки крови пожилых людей,
содержащих высоко- и низкоавидные анти-ВГС (соответственно ВА и НА)
с низким коэффициентом позитивности (значение КП указано).

Среди известных на сегодняшний день онкомаркеров особое значение имеет группа эмбриональных антигенов — белков, которые в норме функционируют лишь у плода, а в сыворотке крови взрослого человека обнаруживаются в следовых количествах. Повышение уровня этих белков, как правило, свидетельствует о тяжелой патологии, а наиболее часто — о наличии опухоли того или иного органа. Одним из самых известных эмбриональных антигенов и онкомаркеров является альфа-фетопротеин человека.
Альфа-фетопротеин (АФП) принадлежит к семейству белков-продуктов альбуминоидных генов, которое также включает в себя альбумин, альфа-альбумин и переносчики витамина D. У человека АФП обнаруживается в нескольких молекулярных формах. Одними из первых были открыты лектин-связывающие изоформы, которые имеют единый аминокислотный состав и отличаются строением углеводной части. Используя электрофорез, АФП подразделяют на три основных подтипа, отличающихся способностью связывать лектины — белки, участвующие в распознавании клеток и агглютинации эритроцитов.
Подтип L1 не имеет аффинитета к лектинам и обнаруживается в сыворотке крови млекопитающих при неопухолевых воспалительных поражениях печени. Подтип L2 демонстрирует избирательный аффинитет к лектинам и ассоциирован с опухолью желточного мешка. Подтип L3 демонстрирует высокую степень связывания с лектинами и обнаруживается в крови у пациентов с гепатоцеллюлярной карциномой и метастатическим поражением печени. Именно этот подтип АФП является маркером для ранней диагностики опухолевого поражения печени. Реже сывороточный АФП и его подтипы используют как маркеры некоторых патологий плода.
В организме плода АФП вырабатывается тканью желточного мешка и печенью и функционирует как транспортная молекула для билирубина, жирных кислот, стероидов, тяжелых металлов, флавоноидов и других соединений. Кроме того, получены данные о роли АФП в процессах пролиферации, дифференцировки и апоптоза клеток.
Альфа-фетопротеин имеет и иммуносупрессивный эффект, защищая плод от иммунных атак организма матери. Печень взрослого человека в норме не синтезирует эмбриональные антигены, однако при развитии гепатоцеллюлярной карциномы такая способность появляется, что оказывается крайне необходимым для роста опухоли и метастазирования.

Рисунок 1 ❘ Основные причины повышения уровня АФП в крови. Пунктиром отмечены ожидаемые уровни АФП, сплошными линиями — обнаруживаемые значения
Возрастающая продукция АФП при гепатоцеллюлярной карциноме способствует изменению иммунных функций организма, снижая выраженность иммунного ответа за счет индукции апоптоза антигенпрезентирующих клеток. Наиболее чувствительными к усилению активности проапоптотических белковых факторов оказываются дендритные клетки. Формирующаяся таким образом дисфункция антигенпрезентирующих клеток существенно облегчает опухолевую прогрессию.
Гепатоцеллюлярная карцинома является одной из наиболее активно кровоснабжаемых опухолей, и в процессе ангиогенеза в ее ткани также играет роль альфа-фетопротеин. Его повышенная продукция ведет к усилению выработки металлопротеиназ, эндотелиальных факторов роста и их рецепторов, что в конечном итоге ускоряет ангиогенез и процесс метастазирования.
Кроме того, в патогенезе гепатоцеллюлярной карциномы участвует несколько сигнальных путей, в том числе и широко изученный PI3K/AKT. Было отмечено, что АФП может ускорять пролиферацию клеток опухоли и снижать степень их апоптоза путем воздействия на комплексы каспаз и данный сигнальный путь.

Рисунок 2 ❘ Упрощенная схема участия АФП в пролиферации клеток и метастазировании гепатоцеллюлярной карциномы
Определение уровня сывороточного АФП имеет огромное значение в ранней диагностике гепатоцеллюлярной карциномы, а также используется для обнаружения ее рецидивов после проведения радикальных хирургических вмешательств. Низкий послеоперационный уровень сывороточного АФП положительно коррелирует с длительной выживаемостью пациентов.
Высокий уровень АФП, напротив, обусловливает раннее рецидивирование и обнаружение большего числа метастазов, что в конечном итоге формирует неблагоприятный прогноз. Кроме подсчета сывороточного АФП, в настоящее время проводят комплексные дополнительные исследования с определением его мРНК методом ПЦР и различных гликоформ протеина с использованием электрофоретических методов. Однако золотым стандартом ранней диагностики гепатоцеллюлярной карциномы по-прежнему остается определение уровня сывороточного АФП с дальнейшим уточнением преобладающей фракции.
В последние годы активно разрабатывается роль АФП как мишени терапии гепатоцеллюлярной карциномы. Установлено, что подавление выработки АФП в ткани пораженной печени ведет к снижению скорости ангиогенеза и пролиферации опухолевых клеток, а также к увеличению интенсивности их апоптоза.
Этот эффект достигается как за счет устранения негативного влияния альфа-фетопротеина на иммунную систему пациента, так и вследствие изменения активности сигнальных путей, которые утрачивают регуляторный эффект данного эмбрионального антигена. Не вызывает сомнений тот факт, что учеными будут разрабатываться новые пути воздействия на АФП, что поможет достичь значимых успехов в лечении пациентов с агрессивными формами гепатоцеллюлярной карциномы.
Московский научно-практический центр дерматовенерологии и косметологии
Московский научно-практический центр дерматовенерологии и косметологии
Возрастной аспект изменения сывороточной концентрации альфа-фетопротеина при неопределенном результате исследования антител к вирусу гепатита С
Журнал: Клиническая дерматология и венерология. 2011;9(6): 10‑13
Потекаев Н.Н., Потапова А.А., Науменко В.А. Возрастной аспект изменения сывороточной концентрации альфа-фетопротеина при неопределенном результате исследования антител к вирусу гепатита С. Клиническая дерматология и венерология. 2011;9(6):10‑13.
Potekaev NN, Potapova AA, Naumenko VA. Age-specific changes of serum alpha-fetoprotein levels in the subjects with inconclusive results of the detection of antibodies against hepatitis C virus. Klinicheskaya Dermatologiya i Venerologiya. 2011;9(6):10‑13. (In Russ.).
Цель представленной работы - изучение изменения концентрации альфа-фетопротеина (АФП) в сыворотке крови молодых и пожилых людей с неопределенными результатами исследования анти-ВГС в подтверждающих тест-системах для иммуноферментного анализа (ИФА) планшетного формата с раздельным определением антител к Core, NS3, NS4 и NS5 протеинам ВГС. Обнаружено, что в анти-ВГС-позитивных с высокой оптической плотностью в ИФА образцах сыворотки крови молодых мужчин концентрация АФП выше, чем в анти-ВГС-негативных образцах (12,57 и 4,37 МЕ/мл соответственно, p=0,045). В образцах с неопределенным результатом в планшетных тест-системах для ИФА и неотрицательным результатом в иммуноблоте, содержащих в основном антитела к Core и к NS3 протеинам ВГС, концентрация АФП (7,41 МЕ/мл) была также выше, чем в образцах, анти-ВГС-негативных в иммуноферментных тест-системах планшетного характера (р=0,008). Среди аналогичных групп пожилых пациентов подобных закономерностей не обнаружено, что свидетельствует о необходимости комплексной оценки серологических и биохимических маркеров ВГС-инфекции с учетом возрастной категории пациента.
Московский научно-практический центр дерматовенерологии и косметологии
Московский научно-практический центр дерматовенерологии и косметологии
Основными путями заражения вирусом гепатита С (ВГС) признаны совместное использование игл и шприцев при внутривенном введение наркотиков, переливание зараженной крови и ее продуктов, оперативные вмешательства и косметические процедуры, связанные с нарушением целостности кожи, например, нанесение татуировок. Значимость полового пути передачи ВГС существенно меньше, однако о его реализации свидетельствуют, в частности, особенности внутрисемейного инфицирования: распространение антител к ВГС (анти-ВГС) среди родителей и детей инфицированных лиц примерно в 4 раза ниже, чем среди супругов (0,87, 0,79 и 3,39% соответственно) [1]. Повышение распространения анти-ВГС в среде гомосексуалистов и женщин, занятых в сфере сексуальных услуг [2], а также среди пациентов дерматовенерологических лечебных учреждений России и других стран, например, США [3, 4], возможно, объясняется не только передачей вируса половым путем, но и наличием у этих контингентов дополнительных факторов высокого риска заражения (прием наркотиков и др.) [4]. Необходимость обследования пациентов с инфекциями, передаваемыми половым путем, на маркеры вирусного гепатита С (ГС) приобретает особое значение при наличии ВИЧ-инфекции и гепатита В, вследствие наличия ассоциаций между этими инфекциями и влияния микстинфицирования на клиническую картину, лечение и результат лабораторного исследования [5, 6].
Первым этапом лабораторной диагностики вирусного ГС является определение анти-ВГС в сыворотке крови пациента методом иммуноферментного анализа (ИФА). Кроме позитивного и негативного результата ИФА, в иммуноблотах (ИБ) и иммуноферментных тест-системах планшетного формата (плИФТС) с раздельным выявлением спектра антител возможен неопределенный результат исследования. В основном неопределенный результат характерен для образцов сыворотки крови с пограничной позитивной оптической плотностью (ОП) в скрининговых плИФТС [7]. Для решения вопроса о причине неопределенного результата необходимы дополнительные лабораторные исследования, в первую очередь поиск специфических (РНК ВГС) и неспецифических серологических маркеров ГС. Известно, что сыворотка крови людей, инфицированных ВГС, характеризуется определенными изменениями биохимического профиля, в частности, увеличением концентрации альфа-фетопротеина (АФП) [8]. В отношении образцов с неопределенным результатом исследования подобные сведения в литературе единичны.
Цель работы — изучение изменения концентрации АФП в сыворотке крови молодых и пожилых людей с неопределенными результатами исследования анти-ВГС в подтверждающих плИФТС с раздельным определением антител к антигенам ВГС.
Материал и методы
Исследованы 65 образцов сыворотки крови мужчин моложе 60 лет и 82 образца сыворотки крови людей старше 60 лет, направленных в клинико-иммунологическую лабораторию по диагностике ВИЧ-инфекции Кожно-венерологического диспансера №1 Департамента здравоохранения Москвы, в которой проводится скрининг на маркеры вирусных гепатитов В и С.
Расчеты по определению критической ОП (ОПкр) проводили в автоматическом режиме во время регистрации результатов анализа. Значение коэффициента позитивности (КП) рассчитывали по отношению величины ОП образца к ОПкр. Статистическую обработку результатов проводили с помощью компьютерных программ Excel и Биостатистика [11] для определения достоверности различий групп с помощью непараметрического критерия Манна—Уитни.
Результаты
В результате исследования образцов сыворотки крови молодых мужчин (возраст 17—60 лет, средний возраст 33,6±12,9 года) были выделены следующие группы:
1) образцы (n=18) без анти-ВГС на первом этапе скрининга (Анти-ВГС–);
2) образцы (n=20) с высоким КП (более 6) как на этапе первичного скрининга, так и на этапе обязательного подтверждения (Анти-ВГС);
3) образцы (n=7) с низким КП в скрининге (менее 3) и в обязательном подтверждении, результат исследования которых в плИФТС с расширенным спектром определяемых антител был неопределенным; в дополнительных исследованиях в ИБ или в ЛИА — неопределенным или позитивным (Анти-ВГС:ИБнеопр/ + );
4) образцы (n=19) с неопределенным результатом исследования в ИФТС; признанные анти-ВГС-отрицательными (Анти-ВГС:ИБ-) в дополнительных исследованиях в ИБ или в ЛИА данные образцы.
По составу определяемых в ИФТС антител между группами наблюдались следующие различия. Из 20 образцов группы Анти-ВГС + в 18 образцах обнаружены анти-Core и анти-NS ВГС с КП более 6, в 2 образцах — только анти-Core ВГС с КП более 4.
В 7 образцах Анти-ВГС:ИБнеопр/ + выявлялись антитела только к одному антигену ВГС; в 3 образцах это были анти-Core, в 3 других — анти-NS3; в одном образце — анти-NS4. В образцах Анти-ВГС:ИБ-, как правило, в ИФТС выявлялись антитела только к одному антигену ВГС; в 17 из 19 образцов это были анти-NS4 (89%), в одном — анти-NS5 (5%). В одном образце Анти-ВГС:ИБ- были обнаружены антитела к NS4 и к NS5 антигенам с ОП в так называемой серой зоне (ниже ОП критической на 15%).

Данные о концентрации АФП в группах сыворотки крови молодых мужчин с разными результатамм исследования анти-ВГС представлены в таблице.
Обнаружено, что по концентрации АФП различаются следующие группы. Во-первых, в образцах Анти-ВГС + концентрация АФП выше, чем в образцах Анти-ВГС– (p=0,036). Во-вторых, в образцах с неопределенным результатом исследования в плИФТС и неотрицательным (положительным и неопределенным) результатом исследования в ИБ (Анти-ВГС:ИБнеопр/ низк+ ) концентрация АФП была также выше, чем в образцах Анти-ВГС– (р=0,008). Между остальными группами образцов, полученных от молодых мужчин, различий по концентрации АФП не обнаружено.
При исследовании анти-ВГС в образцах сыворотки крови людей старше 60 лет (от 60 до 93 лет, средний возраст 74±6,5 года) были выделены группы, аналогичные группам образцов сыворотки крови молодых мужчин: Анти-ВГС- (n=16), Анти-ВГС + (n=30), Анти-ВГС:ИБнеопр/ + (n=11), Анти-ВГС:ИБ- (n=25). По спектру выявляемых антител между группами пожилых пациентов обнаружены следующие различия. В 7 из 11 образцов группы Анти-ВГС:ИБнеопр/ + в плИФТС с расширенным спектром определения анти-ВГС выявлялись с низким КП антитела только к одному антигену, в 4 образцах — антитела к 2-3 антигенам ВГС. В группе Анти-ВГС:ИБ- результат исследования как анти-Core, так и анти-NS, в подтверждающих ИФТС разных производителей был противоречивым (позитивным и негативным). В группе Анти-ВГС:ИБ- в плИФТС с раздельным определением анти-Core, анти-NS3, анти-NS4 и анти-NS5 в 16 из 25 образцов (64%) определялись антитела к трем антигенам ВГС. Концентрация АФП в группах с разными результатами тестирования анти-ВГС была следующей: в группе Анти-ВГС- — 8,24 МЕ/мл (3,74—29,71 МЕ/мл), в группе Анти-ВГС + — 14,73 МЕ/мл (3,8—111,82 МЕ/мл), в группе Анти-ВГС:ИБнеопр/ + — 7,05 МЕ/мл (4,06—24,06 МЕ/мл), в группе Анти-ВГС:ИБ- — 11,19 МЕ/мл (2,94—83,16 МЕ/мл). В двух последних группах концентрация АФП была ниже, чем в группе Анти-ВГС + (p=0,024, p=0,045). Группа Анти-ВГС- по концентрации АФП не отличалась ни от одной из исследованных групп.
При сравнении концентрации АФП в разновозрастных группах обнаружено, что концентрация АФП в образцах сыворотки крови без анти-ВГС (Анти-ВГС–) пожилых людей выше, чем в образцах сыворотки крови без анти-ВГС людей моложе 60 лет (p<0,004). Различий по концентрации АФП между другими аналогичными группами молодых и пожилых людей не обнаружено.
Ранее было показано, что среди пациентов кожно-венерологических диспансеров г. Москвы анти-ВГС распространены достаточно широко (в 2004 г. обнаруживались у 8,18% обследованных) [3]. Примерно у 2,5% образцов, позитивных в первичном скрининге, при исследовании в подтверждающих тест-системах результат исследования оказывается неопределенным [10]. Неопределенный результат в плИФТС и в ИБ может быть как следствием неспецифической реакции (т.е. ложно-позитивным), так и свидетельствовать о наличии небольшого количества антител в раннем периоде инфицирования или при выздоровлении [7]. В большинстве случаев причина неопределенного результата остается неясной, а проведение во всех случаях дополнительного исследования в ИБ является чрезвычайно дорогостоящим. В представленной работе проведена оценка концентрации АФП, известного биохимического маркера повреждения печени, в образцах сыворотки крови с неопределенным результатом исследования анти-ВГС в плИФТС с широким спектром выявляемых антител к ВГС в качестве значительно более дешевых аналогов ИБ. Согласно полученным нами результатам, в образцах с неопределенными в плИФТС и неотрицательными в ИБ результатами (как правило, связанными с обнаружением анти-NS3 или анти-Core), повышение концентрации АФП свидетельствует о наличии некоторого повреждения печени. В группе образцов молодых мужчин с неопределенными результатами, обусловленными выявлением только анти-NS4 в плИФТС, но отрицательными в ИБ, концентрация АФП не отличалась от нормы. По результатам длительного наблюдения за донорами крови с неопределенным результатом исследования в ИБ RIBA-3 был сделан вывод о том, что реактивность к С100, который является фрагментом NS4 протеина ВГС, — менее значимое свидетельство инфекции, чем реактивность к С33с (фрагменту NS3 протеина) или С22 (фрагменту Core протеина), и в большинстве случаев может быть расценена как неспецифическая реакция [12]. Вероятно, неспецифической реакцией объясняются результаты, полученные в плИФТС 1-го поколения, основанных на использовании С100 как единственного сорбента анти-ВГС: распространение анти-ВГС в среде гомосексуалов составляло 6,9% (в среде гетеросексуалов 1%, p<0,0001), а при использовании RIBA-2 — 2,2% и 0,4% соответственно (p<0,02) [5]. Таким образом, полученные нами данные о концентрации АФП в сыворотке крови молодых мужчин согласуются с выводом M. Rios и соавт. [13] об эпидемиологической близости группы с неопределенными результатами тестирования анти-ВГС к группе с анти-ВГС-позитивными результатами, но только в отношении группы с неопределенными результатами по наличию анти-NS3 или анти-Core, но не анти-NS4 ВГС. При инфицировании ВГС в возрасте старше 50 лет цирроз печени формируется в 2 раза быстрее, чем у лиц, инфицированных до 50 лет, а осложнения ВГС-инфекции выявляются у пожилых в основном в далеко зашедших формах вследствие того, что длительная бессимптомная персистенция вируса и стертые клинические проявления заболевания приводят к позднему обращению больных к врачу [14]. В то же время для пожилых пациентов в большей мере, чем для молодых мужчин, характерны ложно-позитивные серологические реакции, что в нашем исследовании проявилось в выявлении в плИФТС антител к нескольким антигенам ВГС при отсутствии подтверждения наличие анти-ВГС в ИБ. В наших исследованиях в группе анти-ВГС-негативных образцов сыворотки крови пожилых людей концентрация АФП была выше, чем в аналогичной группе образцов сыворотки крови молодых мужчин, по-видимому, вследствие разнообразных приобретенных заболеваний и наличия других, кроме ВГС, гепатотоксических факторов у пожилых пациентов. Таким образом, в лабораторной диагностике ГС необходима комплексная оценка серологических и биохимических маркеров ВГС-инфекции с учетом возрастной категории пациента.
Что такое гепатит Б? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит В (Б) — острое и хроническое инфекционное заболевание, вызываемое вирусом гепатита В, с гемоконтактным механизмом передачи (через кровь), протекающее в различных клинико-морфологических вариантах, и возможным развитием цирроза печени и гепатоцеллюлярной карциномы. Всего в мире, по самым скромных оценкам, инфицировано более 250 млн человек.
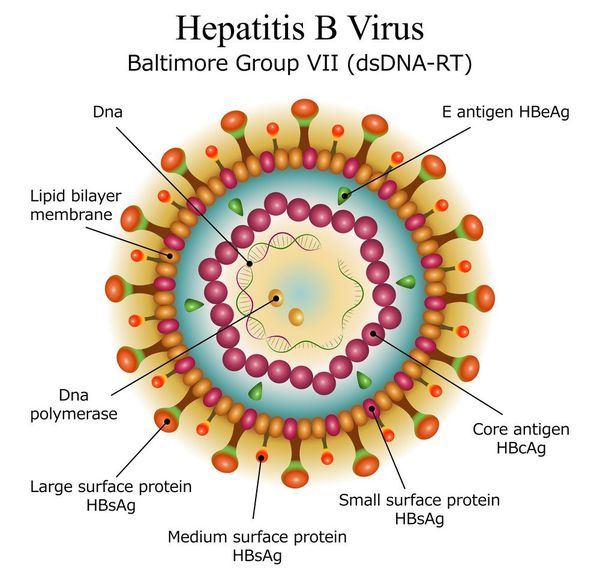
Этиология
вид — вирус гепатита В (частица Дейна)
Развитие вируса гепатита Б происходит в гепатоцитах (железистых клетках печени). Он способен к интеграции в ДНК человека. Имеются 9 генотипов вируса с различными подтипами — генетическая изменчивость позволяет вирусу образовывать мутантные формы и ускользать от действия лекарств.
Имеет ряд собственных антигенов:
- поверхностный HbsAg (австралийский). Появляется за 15-30 дней до развития болезни, свидетельствует об инфицировании (не всегда). Антитела к HbsAg выявляются через 2-5 месяцев от начала заболевания, а сам HbsAg исчезает из крови (при благоприятном течении процесса);
- сердцевинный HbcorAg (ядерный, коровский). Появляется в инкубационном периоде и совместно с ним появляются антитела (HbcorAb). Длительное присутствие HbcorAg в крови свидетельствует о вероятной хронизации процесса (неадекватный иммунный ответ);
- антиген инфекциозности и активного размножения вируса (HbeAg). Появляется совместно с HbsAg и отражает степень инфицированности. Его продолжительная циркуляция в крови является свидетельством развития хронизации процесса, а антитела к нему являются благоприятным прогностическим признаком (не всегда, но по меньшей мере указывают на возможность более благоприятного процесса, срок их циркуляции после выздоровления окончательно не определён, но не более пяти лет после благоприятного разрешения процесса);
- HbxAg — регулятор транскрипции, способствует развитию гепатокарциномы.
Вирус гепатита В чрезвычайно устойчив к действию всевозможных естественных факторов окружающей среды, инактивируется при 60 °C за 10 часов, при 100 °C за 10 минут, при оптимальной температуре сохраняется до 6 месяцев, при автоклавировании погибает за 5 минут, в сухожаровом шкафу — через 2 часа, 2% раствор хлорамина убивает вирус за 2 часа. [1] [3]
Эпидемиология
Источник инфекции — только человек, больной острой или хронической формой инфекции.
Механизм передачи: гемоконтактный и вертикальный (от матери к ребёнку), не исключается трансмиссивный механизм передачи (например, при укусах комаров в результате раздавливания и втирания инфицированного тела комара в поврежденную ткань человека).
Пути передачи: половой, контактно-бытовой, гемотрансфузионный (например, при переливании крови или медицинских манипуляциях). Восприимчивость всеобщая. Заболеваемость — 30-100 человек на 100 тысяч населения (зависит от страны). Летальность от острых форм — до 2%. После перенесённого острого заболевания при условии выздоровления иммунитет стойкий, пожизненный.
Для заражения характерна малая заражающая доза (невидимые следы крови). [1] [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита Б
Инкубационный период гепатита В длится от 42 до 180 дней (следует иметь в виду, что наличие клинической симптоматики характеризует лишь незначительную долю всех случаев заболевания).
Начало постепенное. Характерные синдромы:
- общей инфекционной интоксикации (проявляется как астеноневротический синдром);
- холестатический (нарушение секреции желчи);
- артрита;
- нарушения пигментного обмена (появление желтухи при уровне общего билирубина свыше 40 ммоль/л);
- геморрагический (кровоточивость кровеносных сосудов);
- экзантемы;
- отёчно-асцитический (скопление жидкости в брюшной полости);
- гепатолиенальный (увеличение печени и селезёнки).
При первых признаках гепатита B нужно обратиться к доктору.
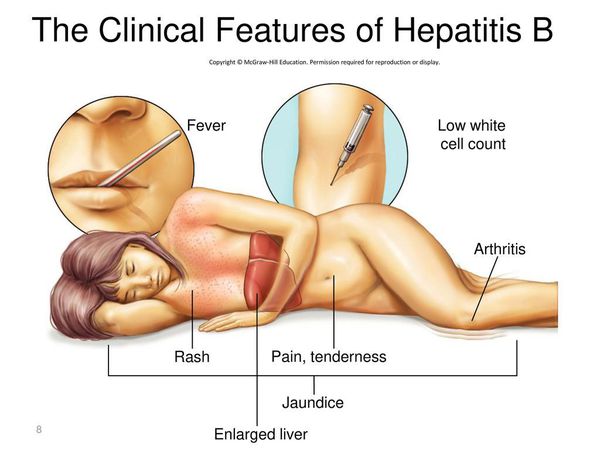
Первые признаки гепатита B
Начальный (преджелтушный) период продолжается 7-14 дней. Чаще протекает по многообразному типу с болевыми ощущениями в различных суставах по ночам и утром, уртикарными высыпаниями, астеновегетативными проявлениями (снижение аппетита, апатия, нервозность, слабость, разбитость, повышенная утомляемость). Изредка развивается синдром Джанотти-Крости — симметричная, яркая пятнисто-папулёзная сыпь. Не исключены умеренные диспептические явления (расстройства пищеварения). К концу периода происходит потемнение мочи, обесцвечивание кала.
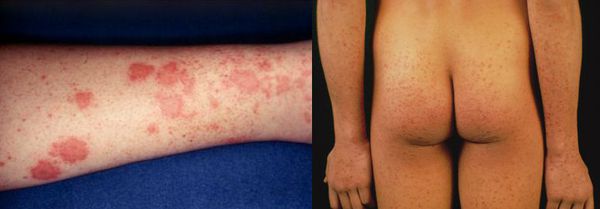
Желтушный период
Этот период продолжительностью около одного месяца характеризуется возникновением желтушного окрашивания кожи (различных оттенков) на фоне продолжающегося или ухудшающегося общего состояния. Характерна длительность и стойкость симптоматики. Появляется тяжесть и болезненность в правом подреберье, горечь во рту, тошнота, выражённый зуд кожи (практически не снимаемый никакими средствами). На фоне усиления астеноневротического компонента появляются геморрагические проявления, урежение пульса, гипотензия, отёки (отражает степень интоксикации и нарушения функций печени).
Выздоровление
Следующим этапом в развитии болезни является нормализации общего состояния, спадение желтухи и реконвалесценция, которая в зависимости от конкретной ситуации и состояния иммунной системы может закончиться как выздоровлением, так и движением развития заболевания в хроническое течение, характеризующееся маловыраженой неусточивой симптоматикой, преимущественно в виде слабости, периодического дискомфорта в правом подреберье, бурно сигнализирующим лишь на стадии цирроза и полиорганных осложнений.
- гепатиты другой этиологии;
- желтухи другой этиологии (например, гемолитическая болезнь, токсическое поражение, опухоли);
- малярия; ;
- лептоспироз;
- ревматоидный артрит.
Гепатит В у беременных
Острый гепатит характеризуется более тяжёлым течением у беременной, возникновении повышенного риска преждевременных родов, аномалий развития плода на ранних сроках и кровотечений. Вероятность передачи при острой форме зависит от сроков беременности: в первом триместре риск 10% (но более тяжёлые проявления), в третьем триместре — до 75% (чаще бессимптомное течение после родов). У большинства детей при заражении во внутриутробном и постнатальном периодах происходит хронизация инфекции. [1] [3] [6]
Патогенез гепатита Б
С движением кровяной массы вирус попадает в печеночную ткань, где локализуется в гепатоцитах и теряет свою протеиновую сферу в лизосомах. Происходит выход вирусной ДНК с последующим ресинтезом аномальных протеинов LSP, а параллельно образование новых частиц Дейна.
В процессе эволюции вирусчеловеческого взаимодействия возможно развитие двух вариантов:
При репликативном пути происходит следующее: белки LSP совместно с HbcorAg вызывают увеличение продукции гамма-интерферона, что приводит к активации главного комплекса гисотсовместимости (HLA), проистекает преобразование молекул гистосовместимости 1 и 2 классов, в результате чего клетка становиться для организма враждебной в антигенном формате.
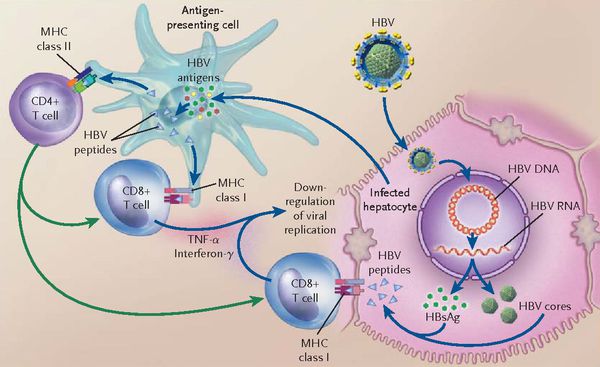
Антигенпрезентирующие макрофаги содействуют изменению В-лимфоцитов в плазматические клетки и экспрессии ими агрессивных белков-антител к посторонним антигенам. В итоге на поверхности печёночных клеток формируются вирусспецифические иммунные комплексы (антиген + антитело + фракция комплемента С3в).
В динамике может реализоваться два сценария:
- в первом варианте запуск каскада комплимента ведёт к появлению в составе иммунных комплексов агрессивной фракции С9 (мембранатакующий комплекс) — наблюдается значительный некроз гепатоцитов без участия лимфоцитов (молниеносная форма гепатита В);
- при альтернативной варианте (наблюдающимся в большинстве случаев) каскад комплемента в силу иммуноиндивидуалистических свойств не активируется — тогда идёт умеренное разрушение Т-киллерами меченых антителами заражённых вирусом гепатоцитов. Образуются ступенчатые некрозы с образованием на месте гибели гепатоцитов соединительной ткани — рубцов (то есть острый гепатит В при плохом иммунном ответе постепенно переходит в хронический).
Непременным атрибутом патогенеза является формирование иммунопатологического процесса. Гибель гепатоцитов, инфицированных вирусом гепатита В, следует за счёт иммунокомпетентных частиц, Т-киллеров и макрофагальных элементов.
Серьёзным значением является нарушение свойств мембраны клеток печени, что сопровождается экскрецией (выделением) лизосомальных ферментов, разрушающих гепатоциты. Сообразно этому, гибель гепатоцитов происходит за счёт иммунокомпетентных клеток, лизосомальных ферментов и противопечёночных гуморальных аутоантител, то есть острая болезнь наступает (и благоприятно заканчивается) только при хорошем иммунитете, а при плохом идёт хронизация.
При тяжёлом цитолитическом синдроме (массивные некрозы гепатоцитов) возникает гипокалиемический алкалоз, острая печёночная недостаточность, печёночная энцефалопатия (ПЭП), церебротоксическое действие, нарушение функции обмена нервной ткани. [2] [3] [6]
Классификация и стадии развития гепатита Б
По цикличности течения:
- острый;
- острый затяжной;
- хронический.
По клиническим проявлениям:
- субклинический (инаппарантный);
- клинически выраженный (желтушный, безжелтушный, холестатический, фульминантный).
По фазам хронического процесса:
Группы риска хронического гепатита B
Хроническим гепатитом чаще страдают дети младше шести лет. При заражении в первый год жизни он развивается в 80–90 % случаев, от года до шести лет — в 30–50 %, у взрослых без сопутствующих заболеваний — менее чем в 5 %. [7]
Осложнения гепатита Б
Чем опасен гепатит Б
Заболевание может привести к острой печёночной недостаточности (синдрому острой печеночной энцефалопатии).
Выделяют четыре стадии болезни:
Диагностика гепатита Б
Многообразие форм, тесная взаимосвязь с иммунной системой человека и зачастую достаточно высокая стоимость исследований часто затрудняют принятие конкретного решения и диагноза в стационарный отрезок времени, поэтому во избежание роковых (для больного) ошибок следует подходить к диагностике с учётом всех получаемых данных в динамическом наблюдении:
- общеклинический анализ крови с лейкоцитарной формулой (лейкопения, лимфо- и моноцитоз, уменьшение СОЭ, тромбоцитопения);
- общий анализ мочи (появление уробилина);
- биохимический анализ крови (гипербилирубинемия в основном за счёт связанной фракции, повышение уровня АЛТ и АСТ, ГГТП, холестерина, щелочной фосфатазы, снижение протромбинового индекса, фибриногена, положительная тимоловая проба);
- маркеры гепатита В: HbsAg, HbeAg, HbcorAg, HbcorAb IgM и суммарные, HbeAb, anti-Hbs, ПЦР в качественном и количественном измерении);
- УЗИ органов брюшной полости, КТ и МРТ диагностика;
- фиброскан (применяется для оценки степени фиброза). [3][4]
Скрининг при хроническом гепатите
Пациентам с хроническим гепатитом В рекомендуется не реже чем раз в полгода проходить обследование: УЗИ органов брюшной полости, клинический анализ крови, АЛТ, АСТ, тест на альфа-фетопротеин. Скрининг позволяет вовремя заметить обострение болезни и начать специфическую терапию.
Лечение гепатита Б
Лечение острых форм гепатита В должно осуществляться в стационаре (учитывая возможность быстрых и тяжёлых форм болезни), хронических — с учётом проявлений.
Диета и режим при гепатите В
В острый период показан постельный режим, печёночная диета (№ 5 по Певзнеру): достаточное количество жидкости, исключение алкоголя, жирной, жареной, острой пищи, всё в мягком и жидком виде.
Медикаментозная терапия
При лёгкой и средней тяжести острого гепатита этиотропная противовирусная терапия (ПВТ) не показана. При тяжёлой степени и риске развития осложнений назначается специфическая противовирусная терапия на весь период лечения и возможно более длительное время.
В лечении хронических форм гепатита показаниями к назначению ПВТ является наличие уровня DNA HBV более 2000 МЕ/мл (при циррозе печении независимо от уровня), умеренное и высокое повышение АЛТ/АСТ и степени фиброза печёночной ткани не менее F2 по шкале METAVIR, высокая вирусная нагрузка у беременных женщин. В каждом конкретном случае показания определяются индивидуально, в зависимости от выраженности процесса, временной тенденции, пола, планирования беременности и другого.
Существует два пути противовирусного лечения:
- терапия пегилированными интерферонами (имеет ряд существенных противопоказаний и серьёзных побочных эффектов — не менее 12 месяцев);
- нуклеозидно-аналоговой терапии NA (используются препараты с высоким порогом резистентности вируса, длительно — не менее пяти лет, удобство применения, хорошая переносимость).
В отдельных случаях может рассматриваться применение комбинированной терапии.
Из средств патогенетической терапии в острый период используются внутривенно вводимые растворы 5% глюкозы, дезинтоксикантов, антиоксидантов и витамины. Показан приём энтеросорбентов, ферментных препаратов, при выраженном холестазе применяются препараты Урсодезоксихолевой кислоты, при тяжёлом течении — глюкокортикостероиды, методы аппаратного плазмофереза.
В хронической стадии заболевания при наличии соответствующей активности процесса и невозможности назначения ПВТ может быть показан приём групп гепатопротекторов и антиоксидантов. [1] [3]
Прогноз. Профилактика
Основное направление профилактики на сегодняшний день — это проведение профилактической вакцинации против гепатита В в младенческом возрасте (в том числе усиленная вакцинация детей, рождённых от матерей с гепатитом В) и далее периодические ревакцинации раз в 10 лет (или индивидуально по результатам обследования). Достоверно показано, что в странах, где была введена вакцинация, резко сократилось количество вновь выявленных случаев острого гепатита В.
Вторая составляющая стратегии профилактики включает обеспечение безопасности крови и её компонентов, использование одноразового или стерилизованного инструментария, ограничение числа половых партнёров и использование барьерной контрацепции. [1] [2]
Читайте также:

