Анализ конъюнктивы на вирусы
Обновлено: 14.05.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Конъюнктивит: причины появления, классификация, симптомы, диагностика и способы лечения.
Определение
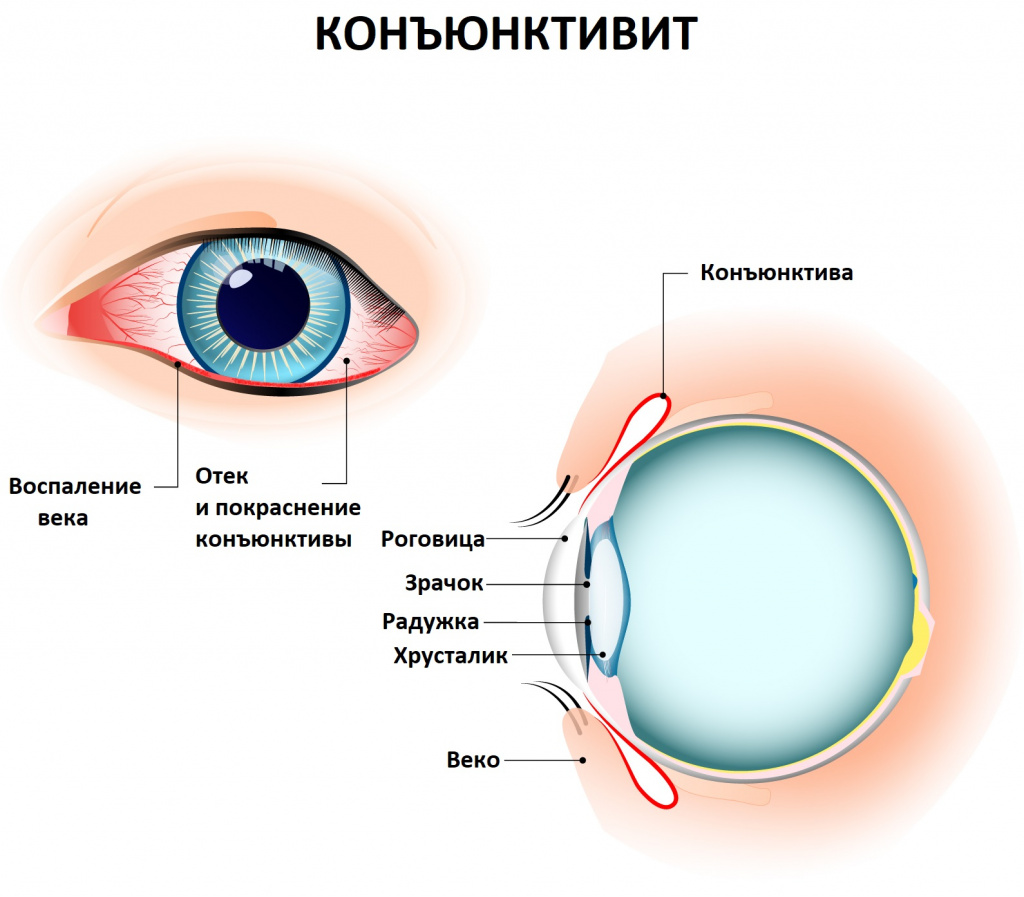
Конъюнктивит – воспалительное заболевание наружной слизистой оболочки глазного яблока и внутренней поверхности век различной природы.
Конъюнктивиты занимают третье место по встречаемости в глазных болезнях, причем у детей инфекция чаще носит бактериальный характер.
По определению, используемому российскими офтальмологами, конъюнктивит – это раздражение конъюнктивы глаза в ответ на воздействие различных факторов, проявляющееся покраснением (гиперемией), отеком и зудом век, нередко осложняющееся нарушением зрения из-за распространения патологического процесса на роговицу – наружную оболочку глаза (с развитием кератоконъюнктивита).
Причины появления конъюнктивита
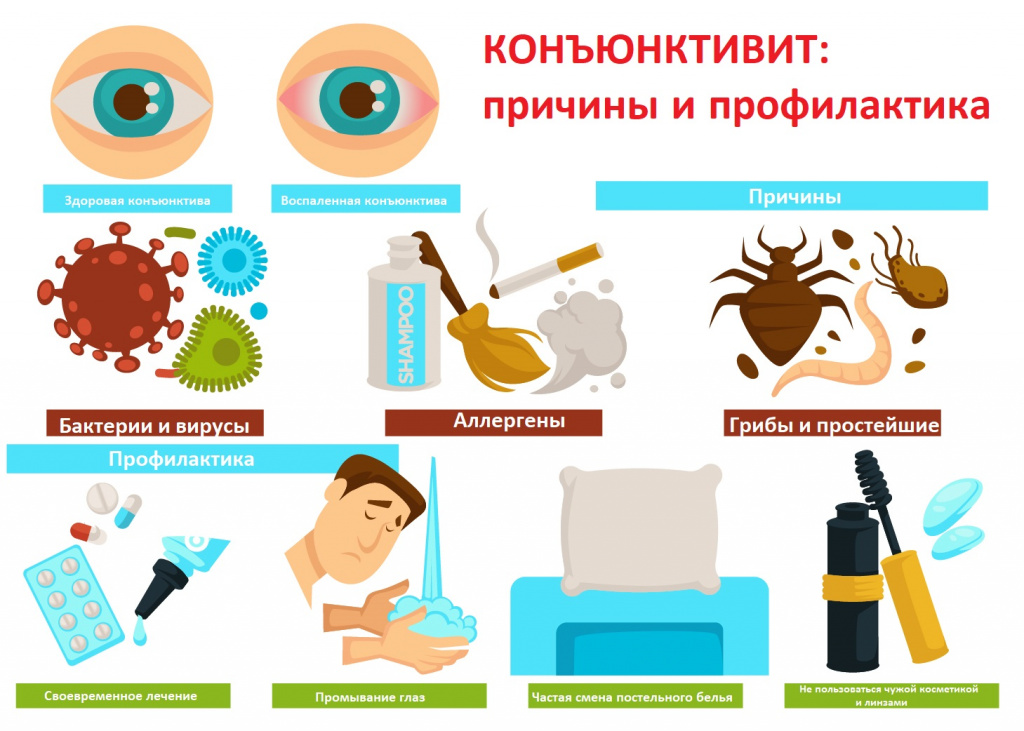
К причинам появления конъюнктивита относят несоблюдение правил личной гигиены (инфекции попадают на слизистую глаза через грязные руки), снижение местного и общего иммунитета, наличие аллергических заболеваний, а также использование линз, неправильный уход за ними и эксплуатация поврежденных или просроченных линз.
Классификация конъюнктивита
По длительности течения выделяют:
- Острый – симптомы заболевания беспокоят менее 4 недель.
- Хронический – заболевание длится более месяца.
- Вирусный (основные причины – аденовирус, вирус герпеса человека, энтеровирус, вирус контагиозного моллюска и т.д.).
- Бактериальный. Обычно бактериальные формы конъюнктивита развиваются в результате присоединения вторичной инфекции к уже текущему вирусному конъюнктивиту. У детей диагностируются чаще, чем у взрослых. К бактериям, вызывающим развитие этой патологии, относятся золотистый стафилококк, гемофильная палочка, гонококк, стрептококк.
- Аллергический. Аллергический конъюнктивит может быть как самостоятельным заболеванием, так и наблюдаться совместно с другими аллергическими проявлениями (например, при поллинозе). Выделяют следующие виды аллергического конъюнктивита – сезонный (например, при цветении сорных трав и деревьев), круглогодичный (если аллерген постоянно циркулирует в воздухе – перхоть животных, пылевые клещи), контактный (например, аллергическая реакция на декоративную косметику).
- Физический (вследствие физического или химического воздействия). При воздействии на слизистую оболочку глаза химического (некачественной косметики, средств бытовой химии и т.д.) или физического агента (света чрезмерной интенсивности, радиации, механического воздействия на слизистую глаза) развивается неспецифическое воспаление.
- Аутоиммунный (уретроокулосиновиальный синдром, например, при мочеполовой или кишечной инфекции).
Возникновение светобоязни чаще всего свидетельствует о вовлечении в процесс роговицы, что чревато значительным снижением зрения при отсутствии правильного лечения.
- Герпетический конъюнктивит проявляется поражением сначала одного глаза, затем инфекция может перейти на второй. Развитие заболевания вялое, симптомы неярко выражены. Характерно появление отечности и красноты века, могут быть типичные герпетические пузырьки с прозрачным содержимым, при присоединении вторичной инфекции появляется слизисто-гнойное отделяемое.
- Аденовирусная инфекция (фарингоконъюнктивальная лихорадка) – остро протекающее заболевание, сопровождающееся насморком, лихорадкой, болью в горле с возможным увеличением шейных лимфоузлов. Поражение глаз, как правило, ступенчатое – сначала поражается один глаз, а через 72 часа – второй.
- При конъюнктивите, вызванном вирусом контагиозного моллюска, беспокоят выделение слизи из глаза, формирование узелков с вогнутым центром на веках.
- Для вирусных конъюнктивитов также характерно быстрое распространение в скученных коллективах (в детских садах, школах).
Отличительным симптомом является трудность размыкания век после сна из-за обильного гнойного отделяемого, на ранних стадиях болезни – появление белых нитей при открывании глаз.
Для бактериальных конъюнктивитов характерно резкое покраснение конъюнктивы глаза, жжение в глазу, чувство инородного тела (песка), появление патологического отделяемого (гноя).
У новорожденных детей гонококковый конъюнктивит может развиться из-за инфицирования во время родов. Чаще проявляется на 2–5-й день жизни. Аналогичная картина и при инфицировании ребенка хламидиями.
Аллергический конъюнктивит
Развитие симптомов болезни наступает сразу после контакта с аллергеном или по истечении непродолжительного времени (до 48 часов). Наблюдается обильное слезотечение. Со временем выделяемое загустевает, при присоединении вторичной инфекции мутнеет, становится гнойным. Больной жалуется на зуд, жжение в глазах, покраснение век (поражение чаще симметричное (сразу оба глаза)). Вскоре к этим симптомам может присоединиться насморк (это связано с отеком носослезного канала), светобоязнь (при вовлечении в процесс роговицы), снижение остроты зрения.
По течению заболевания выделяют острый аллергический конъюнктивит (если контакт с аллергеном однократный или очень редкий, такое заболевание быстро проходит, в легких случаях достаточно просто прекратить контакт с аллергеном) и хронический (в этом случае контакт регулярный, симптомы имеют волнообразный характер и мало выражены, - чаще при аллергии на клещей домашней пыли).
Симптомы данного заболевания развиваются сразу после воздействия раздражающего агента: жжение, дискомфорт, зуд, ощущение инородного тела в глазу, слезотечение, покраснение век и глазного яблока.
Уретроокулосиновиальный синдром (ранее носивший название синдрома Рейтера) развивается в ответ на проникновение в организм инфекций, передающихся половым путем (в частности, хламидий), аутоиммунного воспаления, когда собственные клетки синовиальной оболочки сустава, слизистой оболочки глаза и уретры воспринимаются организмом как чужеродные. Помимо глазных симптомов конъюнктивита пациента беспокоит боль и отечность крупных суставов. Конъюнктивит при этом чаще носит гнойный характер. Возможно развитие иридоциклита – воспаления средней (сосудистой) оболочки глаза, в том числе радужки, при этом возникает боль в глазном яблоке и его гиперемия (покраснение), помутнение роговицы, характерны слезотечение, светобоязнь.
Диагностика заболевания строится, прежде всего, на осмотре пораженного глаза, сборе анамнестических данных для выявления фактора, вызвавшего развитие конъюнктивита. Обязательной частью диагностических мероприятий является проверка остроты зрения. При необходимости проводится забор соскобов слизистой конъюнктивы (в частности, для выявления ДНК микроорганизмов), посев патологического отделяемого из глаза, в том числе на расширенный спектр антибиотиков и для выявления контагиозного моллюска. Часто требуются консультации смежных специалистов (например, отоларинголога, аллерголога, ревматолога, педиатра ).
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Применение методов лабораторной диагностики инфекционных заболеваний глаз порой является единственным и незаменимым способом определения, а иногда и подтверждения этиологии заболевания. Поэтому одним из важных методов диагностики и тактики лечения в работе практикующего офтальмолога является использование основных методов и принципов лабораторной диагностики, а также наличие практических навыков забора клинического материала, направляемого на исследование в клиникобактериологические лаборатории ЛПУ.
ЭТИОЛОГИЯ ИНФЕКЦИОННЫХ ВОСПАЛЕНИЙ ГЛАЗ
Возбудителями глазных инфекций являются вирусы, бактерии, грибы и простейшие. В таблице 1 приведен список наиболее частых возбудителей, которые вызывают инфекционно-воспалительные поражения век, слезоотводящих путей, конъюнктивы, роговицы, сосудистой оболочки, стекловидного тела, сетчатки, диска зрительного нерва и глазницы.
I. ДИАГНОСТИКА ВИРУСНЫХ ИНФЕКЦИЙ
Использование методов лабораторной диагностики имеет большое значение для подтверждения этиопатогенеза вирусных заболеваний глаз, дифференциации активной и хронической фаз инфекции, а также выбора наиболее эффективного метода лечения.
Лабораторная диагностика вирусных заболеваний глаз основана на использовании прямых и непрямых методов исследований материала, полученного путем соскобов с поверхности роговицы и конъюнктивы, а также содержимого передней камеры.
ПРЯМЫЕ МЕТОДЫ ДИАГНОСТИКИ КЛИНИЧЕСКОГО МАТЕРИАЛА
Прямые методы позволяют обнаружить вирус, вирусный антиген или вирусную нуклеиновую кислоту непосредственно в клиническом материале, то есть являются наиболее быстрыми (2–24 ч). Однако из-за ряда особенностей вирусов прямые методы имеют свои ограничения (возможность получения ложноположительных и ложноотрицательных результатов). Поэтому они часто требуют подтверждения непрямыми методами.
Электронная микроскопия. Электронная микроскопия была предложена как быстрый диагностический метод для обнаружения вирусов без их типирования. Этот метод рекомендуется для диагностики герпетических заболеваний глаз. Вариантом электронной микроскопии является иммунная электронная микроскопия, при которой применяются специфические антитела к вирусам.
Реакция иммунофлюоресценции (РИФ). Это метод наиболее быстрой диагностики и основан на использовании антител, связанных с флюорохромом. При обработке препарата флюорохромом акридиновым-оранжевым ДНК вируса светится ярко-зеленым цветом, а РНК — рубиново-красным.
Иммуноферментный анализ (ИФА). Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на метке антител ферментами. Выявляемость герпетического антигена в слезной жидкости больных при проведении ИФА достигает 100%.
Радиоиммунный анализ (РИА). Метод основан на метке антител радиоизотопами, по чувствительности и специфичности равен ИФА.
Молекулярные методы. Классическим методом выявления вирусного генома считался высокоспецифичный метод гибридизации нуклеиновых кислот, в настоящее время все шире используется выделение геномов вируса с помощью полимеразной цепной реакции (ПЦР). Разработан вариант количественной ПЦР, позволяющий определять число копий ДНК. С помощью данного метода можно обнаружить ДНК вируса в слезной жидкости, камерной влаге, стекловидном теле и в тканях глаза, в частности в роговице.
Цитологические методы в настоящее время имеют ограниченное диагностическое значение, но еще по-прежнему применяются. Исследование соскоба с поверхности роговицы имеет диагностическое значение при поверхностных формах герпетического кератита и при метагерпетическом поражении. Обнаружение вируса простого герпеса при глубоких кератитах встречается крайне редко.
Метод Иммуноблота (Westernblot и Line-blot, последний отличается от Westernblot нанесением на мембрану диагностически значимых белков) — тест, позволяющий раздельно определять IgM, IgG к отдельным антигенам (белкам возбудителей оппортунистических инфекций), следить в динамике за сменой белков в сыворотке крови и (или) слезной жидкости. Этот метод можно использовать в диагностике ЦМВ-инфекции, ВЭБ-инфекции, ВПГ-инфекции, хламидийной инфекции, токсоплазмоза.
Экспресс-диагностика проводится с помощью RPS Аденодетектора на основе качественного анализа аденовирусных антигенов — гексон-протеинов в слезной жидкости. Действие RPS Аденодетектора базируется на принципе латеральной проточной иммунохроматографии. Избирательность: все известные серотипы аденовируса. Для анализа требуется до 10 мкл слезной жидкости. Продолжительность анализа — 10 минут. Чувствительность теста составляет 89%, его специфичность — 94%. Исследование возможно в кабинете офтальмолога без лабораторного оборудования.
II. ДИАГНОСТИКА БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ
Метод бактериоскопической диагностики. Микроскопия патологического материала является первым этапом микробиологического обследования больных с воспалительными заболеваниями глаз. Его задачей является раннее обнаружение возбудителя. Метод основывается на прямом выявлении микроорганизмов на слизистой оболочке глаза с помощью различных приемов микроскопии. Для этого используются различные красители (основные и кислые). Способы окрашивания препаратов бывают простые (ориентировочные) и сложные (дифференциальные).
Культуральный метод (микробиологическое исследование).
Материал для исследования берут с помощью стерильных ватных тампонов, одноразовых и многоразовых микробиологических петель и сразу же высеивают на питательные среды. В течение трех часов материал передают в бактериологическую лабораторию.
Выделение и идентификация микроорганизмов от больных с инфекционно-воспалительными поражениями глаз. Определение антибиотикочувствительности. Для выделения патогенных и условно-патогенных микроорганизмов наиболее часто в офтальмологической практике применяют жидкую питательную среду — тиогликолиевый бульон, а из плотных питательных сред — кровяной агар, желточно-солевой агар, шоколадный агар и агар Сабуро.
Наиболее частым методом определения антибиотикочувствительности возбудителей заболеваний является диск-диффузионный метод с использованием стандартных дисков, содержащих в них определенное количество антибиотика в мкг. Для определения антибиотикочувствительности за рубежом используют Е-тест, представляющий собой пластиковую полоску c нанесенным градиентом концентрации антибиотика. Этот метод основан на диффузии антибиотиков в агар. Современные лаборатории все чаще оснащаются автоматизированными системами для идентификации и определения антибиотикочувствительности микроорганизмов с использованием готовых тест-систем.
III. ЛАБОРАТОРНАЯ ДИАГНОСТИКА ХЛАМИДИЙНОЙ ИНФЕКЦИИ
Лабораторные методы диагностики являются наиболее востребованными при хламидийной инфекции. Это продиктовано стертостью и, порой, неспецифичностью клинической картины заболевания. В настоящее время для диагностики заболеваний хламидийной природы используют бактериоскопический, бактериологический, серологический методы, иммуноферментный анализ антигена, а также ДНК-диагностику.
Бактериоскопические методы предполагают выявление хламидий и их морфологических форм в патологическом материале при помощи различных видов микроскопии. Исследуется соскоб слизистой конъюнктивы. После окраски материала выявляются включения — тельца Провачека — темно-синие, темно-фиолетовые. Однако чувствительность метода составляет всего лишь 15%.
Более перспективна бактериоскопия хламидий методом флюоресцирующих антител (МФА). Чувствительность метода достигает 92-95%, а применение моноклональных антител обусловливает высокую специфичность.
Иммуноморфологические методы. Эти методы основаны на обнаружении антигенных субстанций хламидий в эпителии и других тканях путем обработки препаратов специфическими антителами. Прямая иммунофлюоресценция (ПИФ) предусматривает прямое выявление антигенов хламидий. Непрямой метод иммунофлюоресценции применяют в тех случаях, когда невозможно провести прямой метод.
Культуральный метод. При помощи данного метода можно изолировать возбудитель из материала больного путем заражения лабораторных животных, куриных эмбрионов и перевиваемых культур клеток. Культуральный метод является достаточно трудоемким и сложным, но и пока единственным, позволяющим дифференцировать жизнеспособные хламидии от погибших в результате лечения, поэтому его целесообразно применять для контроля лечения.
Серологическая диагностика хламидиозов основана на выявлении специфических антител в сыворотке крови. Для серодиагностики используют реакцию связывания комплемента (РСК), реакцию непрямой гемагглютинации (РИГА), микроиммунофлюоресцентный и иммуноферментный анализ (ИФА). Серологические методы диагностики в офтальмологии являются вспомогательными, т.к. у большинства больных антитела не вырабатываются вследствие слабой иммунной активности антигена.
Лигазная цепная реакция (ЛЦР). Чувствительность и специфичность метода составляет 94,7% и 99,8% соответственно по сравнению с культуральным методом.
Метод гибридизации ДНК. Для определения ДНК хламидий часто используют весьма информативный метод точечной гибридизации (дот-гибридизации) нуклеиновых кислот на твердой фазе с использованием ДНК-зонда, меченого биотином. Из исследуемых образцов выделяют суммарную ДНК.
IV. ЛАБОРАТОРНАЯ ДИАГНОСТИКА АКАНТАМЕБНОГО КЕРАТИТА
Для подтверждения диагноза акантамебного кератита проводят бактериологические и гистохимические исследования. В настоящее время широко применяется ЛЦР для исследования образцов роговичного эпителия и слезной жидкости.
Микроскопическая диагностика. Сбор материала с роговицы и конъюнктивы производится затупленным офтальмологическим скальпелем. Соскоб фиксируется и окрашивается различными методами: окраска по Граму и Романовскому-Гимзе может маскировать акантамебы как лейкоциты, PAS-метод окрашивает стенки цист акантамебы в красный цвет, калькофлюор белый окрашивает стенки амебных цист в ярко-зеленый цвет. Метод окрашивания акридиновым оранжевым применяется для экспресс-диагностики акантамебного кератита.
Гистохимическое исследование. Акантамебы вызывают поверхностные поражения с глубокой инвазией и формированием цист. Поэтому в начале заболевания результаты исследования соскобов с роговицы могут быть отрицательными. В случае отрицательного результата требуется биопсия роговицы для обнаружения акантамеб в глубоких слоях стромы.
Молекулярно-биологический метод. Метод ЛЦР способен обнаружить ДНК акантамебы в образцах роговицы и слезы при минимальном содержании в объеме от 1 до 5 амеб.
Конфокальная микроскопия. Наиболее перспективный метод прижизненной неинвазивной экспресс-диагностики. Метод позволяет увидеть высококонтрастное изображение трофозоитов и цист в срезах роговицы на видеомониторе.
V. ЛАБОРАТОРНАЯ ДИАГНОСТИКА ГРИБКОВЫХ ИНФЕКЦИЙ
Метод определения Исследование проводят методом посева на плотные питательные среды. Идентификацию микроорганизмов проводят методом масс-спектрометрии с помощью прибора Microflex Brucker Daltonik MALDI Biotyper, BRUKER, Германия. Определение чувствительности к антимикробным препаратам проводят диско-диффузионным методом с использованием анализатора ADAGIO, BIO-RAD, Франция.
Бактериологическое исследование отделяемого из глаза с целью выделения и идентификации этиологически значимых микроорганизмов − возбудителей инфекций глаз (конъюнктивит, кератит, блефарит и др.) − с определением чувствительности выделенных патогенов к стандартному спектру антимикробных препаратов (антибиотиков, АМП).
Синонимы: Eye Culture, Routine. Aerobic Bacteria Identification and Antibiotic Susceptibility testing.
Основными клиническими формами глазных инфекций по локализации являются конъюнктивит (66,7% общего числа пациентов с воспалительными заболеваниями глаз) и блефарит (23,3%), реже встречается кератит (4,2%).
На долю заболеваний роговицы приходится не менее 25% всей глазной патологии. Кератиты чаще встречаются у пациентов с ослабленным иммунитетом (вне зависимости от возраста и пола). Постоянное наличие микрофлоры в конъюнктивальной полости часто оказывается опасным даже при минимальной травме роговицы. Первое место (до 70–80%) принадлежит вирусным кератитам. Язва роговицы относится к разряду тяжелых глазных заболеваний, трудно поддающихся лечению и почти всегда заканчивающихся нарушением зрения, вплоть до слепоты. Среди воспалительных заболеваний глаз наибольшие трудности в лечении представляют кератиты и язвы роговицы бактериальной этиологии, составляющие 12,9% среди патологии роговицы. Тяжелые случаи бактериальных язв могут приводить к перфорации роговицы, эндофтальмиту и потере глаза.
Данный тест включает в себя полуколичественное бактериологическое исследование отделяемого из глаза с целью выделения и идентификации этиологически значимых бактерий – возбудителей конъюнктивита, кератита, блефарита и других гнойно-воспалительных заболеваний глаз с определением их чувствительности к стандартному спектру антимикробных препаратов (антибиотиков, АМП).
Важно! Определение вида грибов и постановка чувствительности к антимикотическим препаратам в этот анализ не входят (при подозрении на грибковую инфекцию следует заказать тест № 442).
Антибиотики относятся к лекарственным препаратам, эффективность которых является наиболее очевидной для лечения бактериальной инфекции. Основным ограничением эффективности антимикробных препаратов является способность микроорганизмов формировать устойчивость (резистентность) к их действию. Этот естественный процесс многократно ускоряется при необоснованном и избыточном применении антимикробных препаратов в качестве средств профилактики в медицине, средств самолечения широкими кругами населения. Учитывая наличие указанных проблем, антимикробный препарат следует назначать только при наличии обоснованных показаний (подтвержденная или предполагаемая бактериальная инфекция) и с учетом результатов определения чувствительности к нему выделенного возбудителя.
Выделяемые микроорганизмы и возбудители:
- стафилококки (Staphylococcus aureus, Staphylococcus epidermidis и др.);
- стрептококки (Streptococcus pyogenes, Streptococcus pneumoniae, Streptococcus viridans);
- гемофильная палочка (Haemophilus influenza);
- моракселлы (Moraxella lacunata, Moraxella (Branhamella) catarrhalis);
- синегнойная палочка (Pseudomonas aeruginosa);
- грамотрицательные бактерии семейства Enterobacteriaceae (Escherichia coli, Proteus, Klebsiella pneumonia и др.);
- нейссерии (Neisseria spр.);
- коринебактерии (Corynebacterium xerosis, Corynebacterium pseudodiphtheriticum и др.);
- дрожжеподобные грибы (Candida spp.), скрининговое обнаружение.
Внимание! Данное исследование не предусматривает выявление таких значимых возбудителей инфекций глаза, как вирусы, хламидии, некоторые виды патогенных грибов (кроме Candida spp.), клещи Demodex и др.
Посев отделяемого из глаза на микрофлору и определение чувствительности к антимикробным препаратам проводят с целью установления причины гнойно-воспалительных воспалительных глаза, имеющих инфекционное происхождение, а также для обоснования рациональной антибиотикотерапии.
Исследование проводят методом посева на плотные питательные среды. Идентификацию микроорганизмов проводят методом масс-спектрометрии с помощью прибора Microflex Brucker Daltonik MALDI Biotyper, BRUKER, Германия. Определение чувствительности к антимикробным препаратам проводят на автоматических анализаторах серии VITEK 2, bioMerieux, Франция, и/или диско-диффузионным методом с использованием с использованием анализатора ADAGIO, BIO-RAD, Франция.
Бактериологическое исследование отделяемого из глаза с целью выделения и идентификации этиологически значимых микроорганизмов − возбудителей инфекций глаз (конъюнктивит, кератит, блефарит и др.) − с определением чувствительности выделенных патогенов к расширенному спектру антимикробных препаратов (антибиотиков, АМП) на автоматическом анализаторе.
Синонимы: Eye Culture, Routine. Aerobic Bacteria Identification. Antibiotic Susceptibility, enlarged testing.
Основными клиническими формами глазных инфекций по локализации являются конъюнктивит (66,7% общего числа пациентов с воспалительными заболеваниями глаз) и блефарит (23,3%), реже встречается кератит (4,2%).
На долю заболеваний роговицы приходится не менее 25% всей глазной патологии. Кератиты чаще встречаются у пациентов с ослабленным иммунитетом (вне зависимости от возраста и пола). Постоянное наличие микрофлоры в конъюнктивальной полости часто оказывается опасным даже при минимальной травме роговицы. Первое место (до 70–80%) принадлежит вирусным кератитам. Язва роговицы относится к разряду тяжелых глазных заболеваний, трудно поддающихся лечению и почти всегда заканчивающихся нарушением зрения, вплоть до слепоты. Среди воспалительных заболеваний глаз наибольшие трудности в лечении представляют кератиты и язвы роговицы бактериальной этиологии, составляющие 12,9% среди патологии роговицы. Тяжелые случаи бактериальных язв могут приводить к перфорации роговицы, эндофтальмиту и потере глаз.
Данный тест включает в себя полуколичественное бактериологическое исследование отделяемого из глаза с целью выделения и идентификации этиологически значимых бактерий – возбудителей конъюнктивита, кератита, блефарита и других гнойно-воспалительных заболеваний глаз с определением их чувствительности расширенному спектру антимикробных препаратов (антибиотиков, АМП).
Важно! Определение вида грибов и постановка чувствительности к антимикотическим препаратам в этот анализ не входят (при подозрении на грибковую инфекцию следует заказать тест № 442).
Антибиотики относятся к лекарственным препаратам, эффективность которых является наиболее очевидной для лечения бактериальной инфекции. Основным ограничением эффективности антимикробных препаратов является способность микроорганизмов формировать устойчивость (резистентность) к их действию. Этот естественный процесс многократно ускоряется при необоснованном и избыточном применении антимикробных препаратов в качестве средств профилактики в медицине, средств самолечения широкими кругами населения. Учитывая наличие указанных проблем, антимикробный препарат следует назначать только при наличии обоснованных показаний (подтвержденная или предполагаемая бактериальная инфекция) и с учетом результатов определения чувствительности к нему выделенного возбудителя.
Определение чувствительности в данном исследовании проводится с помощью автоматических анализаторов серии VITEK 2, bioMerieux, Франция. Метод основан на определении минимальной концентрации антибиотика, подавляющей рост и размножение микроорганизма, что позволяет более точно определить не только чувствительность к отдельному препарату, но также оценить механизм устойчивости (фенотип) и спрогнозировать чувствительность к другим препаратам той или иной группы.
Выделяемые микроорганизмы и возбудители:
- стафилококки (Staphylococcus aureus, Staphylococcus epidermidis и др.);
- стрептококки (Streptococcus pyogenes, Streptococcus pneumoniae, Streptococcus viridans);
- гемофильная палочка (Haemophilus influenza);
- моракселлы (Moraxella lacunata, Moraxella (Branhamella) catarrhalis);
- синегнойная палочка (Pseudomonas aeruginosa);
- грамотрицательные бактерии семейства Enterobacteriaceae (Escherichia coli, Proteus, Klebsiella pneumonia и др.);
- нейссерии (Neisseria spр.);
- коринебактерии (Corynebacterium xerosis, Corynebacterium pseudodiphtheriticum и др.);
- дрожжеподобные грибы (Candida spp.), скрининговое обнаружение.
Внимание! Данное исследование не предусматривает выявление таких значимых возбудителей инфекций глаза, как вирусы, хламидии, некоторые виды патогенных грибов (кроме Candida spp.), клещи Demodex и др.
Посев отделяемого из глаза на микрофлору и определение чувствительности к антимикробным препаратам проводят с целью установления причины гнойно-воспалительных воспалительных глаза, имеющих инфекционное происхождение, а также для обоснования рациональной антибиотикотерапии. Данное исследование целесообразно назначать пациентам с хроническими инфекциями, которые длительное время получают антибактериальную терапию, поскольку в таких случаях высока вероятность формирования устойчивости возбудителя к антибиотикам.
Техника забора материала для бакпосева с глаз. Методы исследования глазных мазков
При заборе клинического материала от больного и при последующей работе с ним необходимо помнить о потенциальной опасности любых биологических материалов, полученных от инфекционных больных. Использование защитной спецодежды, как минимум, перчаток и халата, а в случае возможности возникновения аэрозолей — защитных очков или масок, является обязательным. Направляемый на исследование заразный материал должен быть соответствующим образом упакован для предотвращения заражения окружающих и контаминации самого материала посторонними биологическими агентами. На каждую пробу, направляемую в лабораторию, заполняется соответствующее направление.
При определении перечня необходимых лабораторных исследований учитывают необходимость этиологической расшифровки диагноза и установления ведущих патогенетических звеньев данного заболевания, а также предполагаемый дифференциальный диагноз.
Забор клинического материала следует производить до назначения антимикробных (антибактериальных или противовирусных) препаратов. Основное внимание необходимо обратить на получение материала из основного очага локализации предполагаемого возбудителя. Кратность проведения исследования зависит от метода исследования, сроков забора материала, особенностей заболевания и т. д. Количество клинического материала определяется выбором методов исследования и разумной достаточностью, поскольку недостаточное количество материала может определять ложноотрицательный результат.
При взятии материала приготавливают мазки для первичной бактериоскопии и производят высевы на сывороточный и тиогликолевый бульоны (2 пробирки). Мазки высушивают, стекло маркируют. Нативный материал (тампон с материалом в пробирке) и посевы доставляют в лабораторию для дальнейшего бактериологического исследования.
Методы исследования глазных мазков
Проведение традиционных бактериологических исследований при инфекционных поражениях глаз не отличается от аналогичных исследований при бактериальных инфекциях другой локализации.
Для диагностики вирусных инфекций наряду с традиционными иммунологическими исследованиями с целью обнаружения специфических антител чаще всего используют метод флюоресцирующих антител. Материалом для исследования являются соскобы конъюнктивы или эпителия роговицы.
Вирусный антиген обнаруживается в соскобах эпителия конъюнктивы и роговицы больного глаза при поверхностных и глубоких кератитах, при иридоциклитах. Специфическое свечение в ряде случаев может выявляться даже у реконвалесцентов, перенесших вирусную инфекцию с поражением глаз.
В повседневной практике применяют как прямой, так и непрямой метод флюоресцирующих антител. Непрямой метод не уступает прямому в частоте выявления вирусного антигена, однако при нем фоновое свечение и неспецифическая флюоресценция выражены сильнее, что затрудняет оценку результатов. Использование специфических антител позволяет проводить серотипирование возбудителя без выделения самого вируса.
Еще одним методом диагностики вирусных поражений органа зрения является традиционная реакция непрямой гемагглю-тинации. В качестве метода экспресс-диагностики она может быть использована, например, для диагностики герпетических поражений глаза, особенно на поздних этапах заболевания. Для анализа получают небольшое количество слезной жидкости, в которой определяют наличие антигена вируса герпеса. Для РНГА используют герпетический гамма-глобулиновый эритроцитарный диагностикум.
Метод выделения вируса может быть использован только при наличии специальной вирусологической лаборатории. Он дорогостоящ, занимает достаточно длительное время и требует высокой квалификации специалистов. В качестве исходного материала могут использоваться смывы с конъюнктивы, соскобы с конъюнктивы и роговицы, мазки-отпечатки и т. д.
Цитологический метод исследования глазных мазков. Исследование фиксированных и окрашенных соскобов конъюнктивы и роговицы может служить вспомогательным методом в диагностике вирусных поражений глаз. Одновременно отмечается усиление амитотического деления эпителиальных клеток и появление многоядерных клеток. При этом регулярно отмечаются базофилия их цитоплазмы, наличие внеклеточного детрита. Внутриядерные включения были описаны в роговичных соскобах кроликов, зараженных вирусом простого герпеса.
Определенные трудности связаны с диагностикой паразитарных заболеваний глаза. Так, при онхоцеркозе используют обнаружение микрофилярий в срезах кожи, в тканях и средах глаза, в моче и крови. Выявление паразитов в глазу позволяет установить диагноз и оценить тяжесть поражения органа зрения и при других паразитарных заболеваниях. Для диагностики ряда паразитарных инвазий применяют внутрикожные пробы (лоаоз и др.).
Серологические методы исследования глазных мазков позволяют выявить в сыворотке крови специфические антитела. Определенное диагностическое и прогностическое значение имеет изучение иммуноглобулинов в слезной жидкости.
В большинстве случаев диагностика инфекционных поражений органа зрения проводится в соответствии с рекомендациями, приведенными в указаниях и рекомендациях по диагностике той или иной конкретной инфекции с обязательными дополнительными исследованиями биологических материалов, полученных при проведении осмотра пораженного глаза.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

