Анализы на вирусы при рассеянном склерозе
Обновлено: 18.04.2024
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
КГБУЗ "Красноярский краевой Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями"
Кафедра неврологии и нейрохирургии Российского национального исследовательского медицинского университета
Вирус Эпштейна-Барр в патогенезе рассеянного склероза (обзор)
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(2‑2): 29‑34
Попова Е.В., Бойко А.Н., Хачанова Н.В., Шаранова С.Н. Вирус Эпштейна-Барр в патогенезе рассеянного склероза (обзор). Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(2‑2):29‑34.
Popova EV, Boĭko AN, Khachanova NV, Sharanova SN. Epstein-Barr virus in the pathogenesis of multiple sclerosis (a review). Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(2‑2):29‑34. ().
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
Рассеянный склероз (РС) в настоящее время рассматривается как заболевание, в основе которого лежит генетическая предрасположенность, а триггерным механизмом развития являются различные экзогенные факторы. В данной работе в качестве пускового механизма рассматривается вирусная инфекция, а именно вирус Эпштейна-Барр. В обзоре приведены данные о возможных путях влияния вируса Эпштейна-Барр на развитие РС.
Кафедра нервных болезней факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
КГБУЗ "Красноярский краевой Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями"
Кафедра неврологии и нейрохирургии Российского национального исследовательского медицинского университета
Рассеянный склероз (PC) - это тяжелое хроническое аутоиммунное заболевание центральной нервной системы (ЦНС), характеризующееся разрушением миелиновой оболочки, хроническим воспалением с изменениями аксонов и олигодендроцитов и прогрессирующим неврологическим дефицитом. Речь идет о том, что в основе данного заболевания прежде всего лежат процессы демиелинизации и разной степени выраженности нейродегенерации [1, 2]. PC считается мультифакториальным заболеванием. Важную роль в его этиологии играет взаимодействие внешних факторов и особенностей структуры большого количества генов, принимающих участие в регуляции иммунных процессов в организме. За последнее десятилетие представления об этиологии и патогенезе PC претерпели значительные изменения. К настоящему времени ни у кого не вызывает сомнения, что в этиологии PC существенную роль играют внешние факторы. Среди наиболее вероятных, участвующих в запуске иммунопатологического процесса, традиционно перечисляются различные инфекции и интоксикации. Наиболее активно обсуждается персистирующая инфекция в ЦНС или в организме в целом, что может являться мощным пусковым механизмом иммунопатологического ответа как напрямую, так и через активацию каскада аутоиммунных процессов [3].
Несмотря на пристальное внимание к данному вопросу, недостаточно изученным остается вклад в развитие РС одного специфического вируса или совокупности вирусных агентов [4]. В результате ряда ранее проведенных исследований 8, одним из потенциальных кандидатов в качестве персистирующей инфекции, которому на протяжении последних лет уделяется повышенное внимание, является вирус Эпштейна-Барр (ЭБВ). В течение последних двух десятилетий серо-эпидемиологические исследования 12 убедительно продемонстрировали практически 100% частоту выявления антител к ЭБВ у взрослых пациентов с PC по сравнению с контролем. Интересно, что подобные высокие серо-положительные показатели не наблюдаются в отношении других изучаемых вирусов [11, 13, 14]. Несмотря на то что появляется все больше данных, указывающих на одну из ведущих ролей ЭБВ в патогенезе PC, остается недостаточно ясным, является ли ЭБВ основным пусковым механизмом или действует в сочетании с другими факторами, активирующими иммунопатологические процессы, лежащие в основе PC [8, 15].
Вирусология и биология ЭБВ-инфекции
ЭБВ, открытый в 1964 г. М. Эпштейном и И. Барр, относится к γ-герпес-вирусам. ЭБВ имеет в своем составе 3 антигена: капсидный (VCA), ранний (ЕА) и ядерный (EBNA). Своеобразие патологического процесса при ЭБВ-инфекции определяется способностью этого вируса к пожизненной персистенции в организме человека, индукции вторичного иммунодефицитного состояния, аутоиммунных реакций, злокачественных опухолей и, в отличие от других вирусов герпеса, не вызывать гибель В-клеток, а, наоборот, активировать их пролиферацию и трансформацию. Известно, что первично входными воротами ЭБВ-инфекции является носоглоточная лимфоидная ткань, где и происходит инфицирование В-клеток [16]. Контакт с инфекционным агентом обычно случается в детском возрасте, в результате чего происходит трансформация В-клеток в В-лимфобласты с ограниченным количеством необходимого вирусного генетического продукта (ядерный антиген-1б - EBNA-16, латентный мембранный белок 1, 2а и 2b - LMP1, 2a, 2b, некодируемый малый РНК - EBER и несколько микро-РНК) 19. Инфицирование ЭБВ имеет достаточно широкое распространение у людей, но довольно часто оно приобретает латентную форму, при которой имеет место формирование пула специфичных В-клеток памяти [21, 22]. Этот тип ЭБВ-инфицирования (латентная инфекция) также был получен in vitro в ростке лимфобластов и обычно не вызывает продуцирования вируса [22]. Данное ЭБВ-инфицирование В-лимфобластов стимулирует здоровый Т-клеточный ответ, затрагивающий около 60% всех Т-лимфоцитов, большинство из которых уничтожается впоследствии [23, 24]. Цитокины, продуцируемые в ходе данного процесса, вызывают развитие клинического синдрома инфекционного мононуклеоза. Впоследствии формируется пожизненно персистирующий клон В-клеток памяти к ЭБВ, и процесс сопровождается немым носительством большинства генов вируса, при котором экспрессируется только некодируемый малый РНК [25, 26]. В связи с выключением большинства ЭБВ-кодируемых антигенов, ЭБВ-специфические В-клетки памяти становятся невидимыми для иммунной системы и перманентно циркулируют в кровеносном русле в малом, но стабильном количестве для поддержания жизни клона клеток [27]. При пролиферации данные В-клетки памяти могут продуцировать EBNA-1, который играет решающую роль в поддержании вирусного эпитопа [28]. В-клетки памяти преимущественно локализуются в лимфатических узлах и могут экспрессировать латентные мембранные протеины и EBNA-1, подвергаться ограниченной активации и пролиферации в рамках латентного состояния [29, 30]. В настоящее время остается еще недостаточно изученным механизм проникновения ЭБВ в пул В-клеток памяти. Обсуждается 3 равноценных версии: вирус может инфицировать уже сформированные В-клетки памяти как первичная инфекция; может инфицировать наивные В-клетки, которые в дальнейшем дифференцируются в В-клетки памяти посредством естественных физиологических процессов; или ЭБВ при инфицировании наивных В-клеток может запускать механизмы формирования пула ЭБВ-специфичных В-клеток памяти [17, 31-34].
В норме ЭБВ-инфекция находится под строгим контролем ЭБВ-специфичных иммунных реакций, особенно под контролем CD8+ Т-лимфоцитов, которые элиминируют пролиферирующие и литически инфицированные В-клетки [24]. В развивающихся странах большинство детей инфицируются в первые 3 года жизни, и антитела к ЭБВ обнаруживаются у 100% детей уже в первую декаду жизни [35]. Подобная ранняя инфекция практически всегда протекает бессимптомно. В противоположность этому в развитых странах около половины детей к концу первой декады жизни остаются серонегативными к ЭБВ, их инфицирование происходит только в подростковом или юношеском возрасте [35]. Примерно в 50% случаев отсроченная первичная инфекция протекает в форме инфекционного мононуклеоза. Незначительное физиологическое воздействие, включающее выработку стрессовых гормонов, может быть триггером для реактивации ЭБВ из латентного состояния, что приводит к увеличению экспрессии вирусных генов и запуску иммунопатологических реакций [36] при генетической предрасположенности, в основе чего лежит несостоятельность контроля Т-клетками пула В-клеток памяти.
Нарушение иммунного ответа к ЭБВ и риск РС
Известно, что повышенный риск развития PC ассоциируется с перенесенным инфекционным мононуклеозом в анамнезе 37 и более высоким уровнем сывороточных анти-ЭБВ-антител [5, 40-43]. К примеру, в недавно проведенном метаанализе исследований по методу случай-контроль и когортных исследований (всего 18 работ), перенесенный инфекционный мононуклеоз ассоциировался с двукратным увеличением риска PC (относительный риск 2,17, 95% ДИ 1,97-2,39) [44]. Кроме того, повышение титров анти-ЭБВ-антител, в особенности антител IgG к ядерному антигенному комплексу ЭБВ (EBNA) и EBNA-1, в течение нескольких лет предшествует появлению первых симптомов PC [41, 42, 45]. Эти антитела у пациентов с мононуклеозом появляются только в период выздоровления, а затем сохраняются на стабильном уровне в течение многих лет, что является маркером перенесенной инфекции. Среди тех людей, у которых разовьется PC, по всей вероятности возникнет повторное (т.е. несвязанное с первичной ЭБВ-инфекцией) повышение титра анти-EBNA-l-антител в возрасте 17-29 лет [42]. Интересно, что в одном недавно проведенном анализе уровня ЭБВ-антител с использованием двух независимых методов измерения (ELISA и иммунофлюоресценция) было показано, что относительный риск развития PC при серонегативном статусе равен нулю (95% ДИ 0-0,43) [46]. В другом исследовании ЭБВ-серонегативных участников по первому тесту крови была продемонстрирована 100% сероконверсия всех случаев еще до развития PC по сравнению с 35,7% в группе контроля в течение одинакового периода времени (p<0,0001) [47].
В работе K. Simon и соавт. [48] было показано, что высокие титры анти-EBNA у здоровых людей достаточно сильно коррелируют с высоким риском развития PC в будущем. Также отмечено, что повышенные титры анти-EBNA-1-антител коррелируют с радиологической активностью заболевания [49], но серологические признаки реактивации ЭБВ-инфекции (антитела к раннему антигену) не ассоциируются с клинической активностью у больных PC [50]. Кроме того, была продемонстрирована связь между повышенными титрами анти-EBNA-антител и риском PC как у HLA-DRB1*15-негативных, так и HLA-DRB1*15-позитивных лиц. По всей вероятности, аллель DR15 и титры анти-EBNA-антител выступают независимыми факторами риска с мультипликативными эффектами [51].
Также накапливаются данные, указывающие, что для пациентов с PC характерен более высокий ЭБВ-специфичный клеточный иммунный ответ на уровне как CD4 + , так и CD8 + Т-клеток 53.
В настоящее время известно, что ЭБВ запускает ряд механизмов, нарушающих иммунную систему, включающих молекулярную мимикрию, белки теплового шока и суперантигены, провоспалительные цитокины и формирование клона В-клеток памяти. В отношении молекулярной мимикрии более ранние исследования показали, что основной белок миелина (ОБМ) и специфический клон Т-клеток, полученные от пациента с PC, перекрестно реагируют с ДНК-полимеразным пептидом вируса Эпштейна-Барр [8, 57, 58]. ЭБВ-специфичные Т-клетки, перекрестно реагирующие с ОБМ, также были обнаружены в ЦСЖ больных PC [56, 59].
В 2011 г. группой российских исследователей из ЦСЖ больных PC было выделено 13 клонов клеток, специфичных к ОБМ, которые продуцировали антитела как к фрагментам 65-92 и 130-156 ОБМ, так и к мембранному белку ЭБВ LMP1 [60]. Альтернативно или в дополнение к этому хроническая персистенция ЭБВ-инфицированных В-клеток в ЦНС, возможно ассоциируемая с литической реактивацией, может непосредственно инициировать каскад иммунопатологических реакций, вызывающих повреждение ткани ЦНС у пациента. Подобное предположение подтверждается аккумуляцией ЭБВ-специфичных CD8 + Т-клеток в ЦСЖ больных PC [53].
Кроме того, известно, что в ЦСЖ больных PC присутствует большое количество В-клеток памяти 61, а наличие олигоклональных IgG является характерным признаком PC. Так, при изучении специфичности олигоклональных антител IgG у пациентов с PC в отношении ЭБВ были выделены 2 наиболее частых PC-специфичных и высокоаффинных эпитопа вируса - EBNA-1 и другой, менее характерный структурный ЭБВ-протеин BRRF2 [64], а также повышенная частота EBNA-1-специфичных антител IgG в ЦСЖ [65]. На основании полученных данных высказывается предположение не только о системном повышении, но и существенной продукции ЭБВ-специфичных антител в ЦСЖ больных PC, что, возможно, влияет на патологические процессы в мозговой ткани [66].
Потенциальные механизмы участия ЭБВ-инфекции в патогенезе РС
Первые доказательства роли ЭБВ-инфекции в развитии PC появились в 1979 г., когда K. Fraser и соавт. [67] отметили факт повышенной тенденции к спонтанной in vitro ЭБВ-индуцированной трансформации периферических В-лимфоцитов крови больных PC с клинически активным заболеванием. Первоначально предпочтение отдавалось гипотезе молекулярной мимикрии между ЭБВ и антигенами ЦНС, ведущей к иммунологической перекрестной реактивности с последующим аутоиммунным повреждением ткани ЦНС [57]. Согласно этой гипотезе, присутствие ЭБВ-инфицированных В-лимфоцитов в ЦНС не обязательно, поскольку активация иммунологической перекрестной реактивности происходит в периферических лимфоидных органах.
В 2003 г. была предложена новая гипотеза, согласно которой РС вызывается аккумуляцией ЭБВ-инфицированных аутореактивных В-лимфоцитов в ЦНС - благодаря им в ЦСЖ присутствуют олигоклональные группы IgG, происходит синтез патогенных аутоантител и формирование ко-стимулирующих сигналов для выживания аутореактивных Т-клеток [68]. Кроме того, считалось, что предрасположенность к развитию хронического аутоиммунного заболевания после ЭБВ-инфекции зависит от генетически детерминированного количественного дефицита цитотоксичных CD8 + Т-клеток, которые в норме осуществляют строгий контроль за ЭБВ-инфекцией. Исходом подобного нарушения является постоянная циркуляция В-клеток иммунологической памяти, а также возможное их проникновение и активация в ЦНС, ведущие к запуску хронического воспалительного процесса с развитием РС [15, 68, 69]. В подтверждение данной гипотезы были опубликованы результаты исследований с использованием иммуногистохимии с антителами, специфичными к ЭБВ-белкам, и реакций гибридизации in situ к ЭБВ-некодируемым малым РНК на образцах ткани, полученных посмертно от 22 пациентов с вторично-прогрессирующим PC. В работе была отмечена высокая частота встречаемости ЭБВ-специфических В-клеток памяти, инфильтрирующих очаги в белом веществе головного мозга, в отличие от других воспалительных заболеваний ЦНС, а ЭБВ был обнаружен в 95% образцов ткани, взятой из очагов демиелинизации [70].
В 2007 г. другой группой авторов было рассмотрено 4 возможных сценария, объясняющих нарушение гуморальных и клеточно-опосредованных иммунных реакций против ЭБВ при различных аутоиммунных заболеваниях, в том числе и при PC, и его потенциальное участие в патогенезе болезни: 1) ЭБВ-специфичные Т-клетки или антитела могут перекрестно реагировать с аутоантигенами, экспрессированными в ЦНС, и атаковать миелиновую оболочку аксонов. При этом усиленная реактивность ЭБВ-специфичных CD4 + Т-клеток является результатом повышенной реактивации вируса из аутоагрессивных В-клеток как компенсации ослабленных ЭБВ-специфичных реакций со стороны CD8 + Т-лимфоцитов; 2) ЭБВ помогает в поддержании аутореактивности В-клеток; 3) ЭБВ трансактивирует экпрессию элементов эндогенных ретровирусов человека (HERV), которые являются цитотоксичными для олигодендроцитов; 4) нарушенные иммунные реакции против ЭБВ как непатогенный эпифеномен. В подобном сценарии можно предположить, что нарушенные иммунологические реакции в отношении ЭБВ являются результатом действия других факторов, предопределяющих развитие аутоиммунного заболевания, и они могут непосредственно не участвовать в патогенезе PC. К примеру, повышенная стимуляция В-клеток аутоантигенами стимулирует усиленную репликацию вируса, вследствие чего увеличиваются нагрузка вирусными антигенами и противирусные иммунные реакции. Альтернативно аутоиммунитет, развивающийся в результате дисрегуляции регуляторных Т-клеток, может также вести к усиленным ЭБВ-специфичным иммунным реакциям, и без которых ответственен за патогенез PC [66].
Относительно недавно на основании нескольких работ была высказана очередная гипотеза, согласно которой вирус-инфицированных клеток может быть совсем мало, однако эти клетки могут продуцировать достаточное количество провоспалительных цитокинов, что может вести к развитию болезни. Подобное предположение основано, во-первых, на данных, свидетельствующих о первичной ЭБВ-инфекции эндотелиальных клеток микрососудов мозга человека in vitro, во-вторых, на эффективности препаратов β-интерферона в предотвращении развития обострений PC посредством подавления репликации вируса и последующего выброса цитокинов [71].
Присутствие ЭБВ в ткани ЦНС у больных РС
К настоящему времени доказательства присутствия ЭБВ-инфицированных клеток в мозге больных PC остаются противоречивыми. Некоторыми группами авторов [1, 69, 70, 72-77] отмечено, что В-лимфоциты и плазматические клетки являются неотъемлемой частью воспалительных инфильтратов в белом веществе и оболочках головного мозга при РС, особенно у пациентов с прогрессирующим течением заболевания при достаточно тяжелом воспалительном и нейродегенеративном процессах [70, 74, 75, 78, 79]. Другими авторами 81 в последующих исследованиях с использованием аналогичных технологий лишь в единичных случаях были описаны подобные изменения и доказательства присутствия ЭБВ в мозговой ткани больных РС.
Для обоснования столь противоречивых результатов в июле 2010 г. в Вене состоялось 2-дневное заседание рабочей группы исследователей, изучающих роль ЭБВ в патогенезе PC. После разностороннего и углубленного изучения всех опубликованных результатов участники рабочей группы не смогли дать независимого подтверждения наличия ЭБВ-ассоциированной инфекции в ЦНС при PC. По мнению членов рабочей группы, для подтверждения присутствия вируса в мозговой ткани больных PC, по всей видимости, следует не только проводить исследования с использованием всех трех существующих технологий (гибридизация in situ, иммуногистохимия и ПЦР), но и отправлять исследуемые образцы в независимые лаборатории [84]. Также не стоит забывать, что при применении одинаковых технологий возможны методологические различия, ведущие к разной чувствительности используемых тестов. Кроме того, существует богатый спектр патологических признаков очагов PC в зависимости от типа и тяжести течения заболевания, равно как и от стадии бляшки [2, 85], влияющих на полученные результаты.
Несмотря на достаточно пристальное внимание к этиологии PC, в настоящее время остается недостаточно изученной связь между персистирующей ЭБВ-инфекцией и типом манифестации и течения РС. Дальнейшее более глубокое изучение тонких механизмов воздействия ЭБВ-инфекции на генетически предрасположенный к несостоятельности иммунного ответа организм с учетом имеющихся современных знаний о патогенезе PC поможет приблизиться к пониманию возможных механизмов различных типов манифестации и прогрессирования РС, что, в свою очередь, будет способствовать разработке адекватной профилактики возникновения и прогрессирования данного заболевания.
В нашей клинике Вы можете сдать анализ 7 дней в неделю. По Вашему желанию мы предложим Вам консультацию врача соответствующей специальности: иммунолога, терапевта, невролога, ревматолога.
Ревмопробы и диагностика аутоиммунных заболеваний
Ревмопробы – это исследование крови, показывающее степень активности и распространенности воспалительного процесса, поражающего суставы, органы и ткани организма. Ревмопробы – первичные лабораторные тесты на аутоиммунные заболевания (ревматизм, артроз, ревматоидный артрит и т.д.). Для того что бы подтвердить или, наоборот, опровергнуть эти заболвания, врач назначает анализ на ревмопробы. С помощью анализа на ревмопробы врач видит динамику воспалительного процесса (если он есть) и корректирует, при необходимости, назначенное лечение.
Что входит в анализ на ревмопробы. Кровь для ревмопробы сдается один раз и делиться на несколько частей, что бы определить все необходимые параметры:
- Ревматоидный фактор
- Антитела к стрептококку (АСЛО, антистрептолизин -О)
- С-реактивный белок
- Определение уровня белка плазмы
- В некоторых случаях бывает нужен анализ на содержание в крови мочевой кислоты, мочевины, креатинина, белковых фракций
Ревматоидный фактор – это белок, на который действуют вирусы и бактерии. Иммунная система воспринимает ревматоидный фактор как чужеродную частицу и начинает вырабатывать антитела. Анализ на ревматоидный фактор – это и есть определение этих антител. Как правило, обнаружение ревматоидного фактора говорит о ревматоидном артрите. Норма ревматоидного фактора
Антитела к стрептококку (Антистрептолизин-О, АСЛО) – обнаружение антител к стрептококку говорит о том, что есть определенный риск развития таких болезней как ревматизм, гломерулонефрит и т.д. Основной маркер наличия стрептококковой инфекции – антистрептолизин-О (АСЛО). Анализ на антистрептолизин-О помогает отличить ревматизм от ревматоидного артрита, т.к. концентрация антистрептолизина-О (АСЛО) в крови при этих болезнях различаются. Норма антистрептолизина-О (АСЛО) в крови от 0 до 200 ед\мл.
С-реактивный белок – белок, который выводит из организма продукты распада клеток и стимулирует захват микробов клетками иммунной системы. Повышение уровня С-реактивного белка говорит о наличии какого-то заболевания. Особенно возрастает уровень С-реактивного белка при остром воспалительном процессе, в т.ч. и при ревматических заболеваниях. Норма С-реактивного белка 0-5 мг\л. По изменению количества С-реактивного белка можно судить о нарастании или снижении активности ревматического заболевания.
Уровень белка в плазме – когда в организме человека начинают развиваться болезни, иммунная система вырабатывает к ним антитела и белок в плазме крови увеличивается. Таким образом, высокий уровень белка плазмы крови говорит о наличии воспалительного процесса. Важно учитывать, что уровень белка в плазме также может меняться и при полном здоровье. Белок плазмы может снизиться у кормящей грудью матери, у людей, которые курят, а при обезвоживании, наоборот, уровень белка плазмы повышен. По содержанию разных фракций белка можно косвенно судить о причинах воспалительного процесса.

Анализ мочевой кислоты, креатина, мочевины, креатинина необходим для оценки функции почек и для того, чтобы понять, вовлечены почки в воспалительный процесс или нет.Ревмопробы: норма, таблица:
| Ревматоидный фактор | |
| Антистрептолизин-О (АСЛО) | 0-200 ед\мл |
| С-реактивный белок | 0-5 мг\л |
Сдать анализ на ревмопробы. В нашей клинике Вы можете сдать анализ на ревмопробы 7 дней в неделю. Мы рекомендуем за пару дней до исследования ограничить физические нагрузки и не употреблять лекарственные препараты и алкоголь. Кровь на ревмопробы нужно сдавать натощак.Основные показания к анализу на ревмопробы:
- Боль в одном или нескольких суставах
- Боль в спине
- Тугоподвижность суставов и их отечность
- Головная боль, при которой не помогают обезболивающие
- Повышение температуры тела без видимой причины
- Контроль динамики течения заболевания и его лечения
Лабораторное иммунологическое обследование при эндогенных психических заболеваниях
Известно, что функции нервной и иммунной систем взаимосвязаны. При эндогенных психических заболеваниях могут быть актуальны отклонения в работе иммунной системы с активацией иммунитета против аутоантигенов нервной системы и/или подавление некоторых механизмов противомикробной защиты организма. И состояние иммунитета и инфекционный статус – параметры, поддающиеся качественной и количественной оценке лабораторными методами. Ниже на этой странице стандартный план иммунологического обследования, принятый в нашей клинике. Процессы лечения тоже взаимосвязаны: восстановление работы иммунитета в “штатном” режиме обычно благотворно сказывается на течении эндогенного заболевания, а восстановление способности нервной системы к выходу из стрессорных реакций, особенно восстановление физиологической структуры сна, благотворно влияет на работу иммунитета.
План нейроиммунологического обследования
Эти данные будут положены в основу Вашей персональной схемы лечения.Наше стандартное иммунологическое обследование при эндогенном психическом заболевании
| Иммунограмма и аутоиммунные маркеры |
| IgA, IgM, IgG общие |
| Иммунологическая панель 1го уровня (Т-клетки общие, Т-хелперы, Т-цитотоксические лимфоциты, В-клетки, NK-клетки) |
| Наивные клетки / клетки памяти |
| В1 клетки (CD19CD5) |
| Общий анализ крови |
| Белковые фракции |
| Антитела к кардиолипину IgA+IgM+IgG |
| АНФ / Антинуклеарный фактор |
| Ревматоидный фактор |
| АСЛО |
| СРБ |
| HLA B27 |
| Активность АПФ |
| Показатель повреждения гематоэнцефалического барьера |
| Белок S-100 |
| Боррелиоз, нейроборрелиоз |
| IgM к боррелии – анализ крови |
| IgG к боррелии – анализ крови |
| Иммуночип IgM и IgG к боррелиям гаринии и афзелии (borrelia garinii, borrelia afzelii) – анализ крови |
| Менингококк |
| Анализ крови на антитела к менингококку – анализ крови |
| Листериоз |
| Антитела к листерии – анализ крови |
| Герпес 1 и 2 типов, герпес 6 типа, Эпштейн-Барр вирус, Цитомегаловирус, вирус Варицелла-Зостер |
| ПЦР из биоматериала слюны на вирус Варицелла-Зостер |
| ПЦР из биоматериала слюны на вирус простого герпеса 1го и 2го типов |
| ПЦР из биоматериала слюны на герпес 6 типа, Эпштейн-Барр вирус, Цитомегаловирус |
| ВИЧ. |
| Антитела к вирусу иммунодефицита человека (ВИЧ) |
| Вирусные гепатиты B, C, G. |
| Кровь методом ПЦР на вирус гепатита С |
| Кровь методом ПЦР на вирус гепатита В |
| Кровь методом ПЦР на вирус гепатита G |
| Токсоплазмоз. |
| IgM к токсоплазме |
| Авидность IgG к токсоплазме |
| Хламидии и микоплазмы. |
| Антитела IgA к хламидии трахоматис |
| Антитела IgA к хламидии пневмонии |
| Антитела IgA к микоплазме пневмонии |
| Антитела IgA к микоплазме хоминис |
| Cифилис |
| TPHA (РПГА) полуколичественным методом |
| Бруцеллез |
| Антитела к бруцеллам |
| Сальмонеллез |
| Антитела к сальмонелле А, В, С, D, E |
| Шигеллез |
| Антитела к шигелле |
| Йерсиниоз |
| Антитела к йерсиниям |
| Бакпосевы |
| Бакпосев из глотки с определением чувствительности к стандартному набору антибиотиков |
| Бакпосев из носа с определением чувствительности к стандартному набору антибиотиков |
| Бакпосев мочи с определением чувствительности к стандартному набору антибиотиков |
С готовыми результатами обследования целесообразна консультация врача иммунолога. В нашей клинике, в случае эндогенного психического заболевания, врач иммунолог работает в партнерстве с врачом психиатром. Лечение в таком режиме проходит более согласованно и комфортно.
Типичные результаты иммунологического обследования при эндогенном психическом заболевании
Что ещё обычно входит в план обследования при эндогенных психических заболеваниях
Важно исключить эпилепсию и органические заболевания центральной нервной системы (рассеянный склероз, нейроинфекцию, последствия травмы головы, сосудистые нарушения, опухоли мозга и др.).
Обычно план обследования такой:
- ЭЭГ (электроэнцефалография) рутинная (30 минут). При подозрении на эпилепсию может понадобиться более продолжительная запись (1,5 часа, дневной или ночной ЭЭГ виеомониторинг). Подробнее… на предмет повышения внутричерепного давления, рассеянного склероза и других органических заболеваний.
- Осмотр офтальмологом на предмет состояния глазного дна. По картине сосудов глазного дна можно судить о состоянии сосудов всего головного мозга, повышении внутричерепного давления, венозном застое. . .
- Осмотр неврологом.
- Осмотр психиатром.
Анализ крови на антиспермальные антитела
Антиспермальные антитела – это антитела к сперматозоидам. Антиспермальные антитела цепляются к оболочке сперматозоидов и нарушают их функции: снижают скорость движения сперматозоидов и не дают им проникнуть в маточную слизь и вступить в контакт с яйцеклеткой (делают невозможным процесс оплодотворения). Таким образом, определение антиспермальных антител может открыть причину ранее необъяснимого бесплодия супружеской пары. Анализ на антиспермальные антитела нужен для выяснений причины бесплодия, особенно, если есть подозрение, что к бесплодию привели проблемы с иммунитетом.
Антиспермальные антитела могут быть у женщин и у мужчин. В норме, антиспермальные антитела чужеродны для нашего организма и у человека есть специальные механизмы, которые препятствуют их образованию. Но при наличии острого или хронического воспалительного процесса, иммунная система ослабевает и в работе защитных механизмов происходит сбой.
Сдать анализ на антиспермальные антитела. В нашей клинике Вы можете сдать материал для исследования 7 дней в неделю. Как правило, сдается кровь на антиспермальные антитела, но исходя из целей поиска, Ваш врач может назначить Вам анализ на антиспермальные антитела в сперме. Специальная подготовка для анализа на антиспермальные антитела не требуется.
Основные показания к анализу на антиспермальные антитела:
- Обследование бесплодной пары
- Отклонения в посткоитальном тесте
- Изменения в спермограмме
Олигоклональные антитела. Исследование олигоклонального IgG в ликворе и сыворотке крови
В нашей клинике Вы можете выполнить исследование олигоклональных иммуноглобулинов IgG (олигоклональных антител IgG) для диагностики рассеянного склероза, энцефаломиелита и других воспалительных болезней центральной нервной системы. Люмбальную пункцию и взятие ликвора на анализ мы выполняем в амбулаторном режиме, в условиях строгой асептики, одноразовой иглой минимально возможного диаметра, с последующим наблюдением в палате. Подробнее о люмбальной пункции исследование ликвора на ряд нейроинфекций, способных протекать под маской рассеянного склероза.
Мы предлагаем определение олигоклонального IgG в ликворе и сыворотке крови в сомнительных и сложных случаях, для диагностики рассеянного склероза и других болезней ЦНС, сопровождающихся демиелинизацией нервных волокон. Особенно актуально это исследование при сомнениях в диагнозе, когда трудно различить между собой рассеянный склероз, нейроинфекцию, нейросаркоидоз, нейролейкоз. Применение магнитно-резонансной томографии в совокупности с результатами исследования олигоклонального IgG позволяет почти всегда однозначно определить верный диагноз и проводить лечение в верном направлении.
Антитела используются иммунной системой для определения и нейтрализации чужеродных объектов, например, вирусов. Если иммунная система длительно атакует мозг (рассеянный склероз, рассеянный энцефаломиелит) – образуются олигоклональные антитела IgG (олигоклональные иммуноглобулины IgG), агрессивные в отношении антигенов собственного головного и спинного мозга. Поэтому наличие олигоклонального IgG указывает на хроническое воспаление в центральной нервной системе.
Зачем исследовать олигоклональный IgG одновременно в ликворе и сыворотке крови? При анализе результатов исследования важно сравнить клональность IgG в ликворе и сыворотке крови. Олигоклональный IgG может проникать в ЦНС из сыворотки крови при системных воспалениях аутоиммунной или инфекционной природы (ревматические заболевания и системные васкулиты, инфекционных энцефалитах, нейроборрелиозе и т.д.). Воспалительный процесс при рассеянном склерозе протекает за гематоэнцефалическим барьером, защищающим мозг от различных опасных для мозга веществ в периферической крови. Если воспалительный процесс идет в веществе головного мозга, т.е. за гематоэнцефалическим барьером, концентрация олигоклонального иммуноглобулина IgG в ликворе и сыворотке крови будет различным. Расчет этого соотношения – важный диагностический критерий. Исследование олигоклонального IgG в ликворе (цереброспинальной жидкости) позволяет определить характер воспаления в центральной нервной системе и диагностировать рассеянный склероз на всех стадиях его развития.
Подготовка к исследованию олигоклонального Ig G в ликворе и сыворотке крови. Мы рекомендуем сдавать кровь не ранее чем через 3 часа после последнего приема пищи.
Основные показания к исследованию олигоклонального Ig G:
Приведенные здесь исследования вовсе не обязательно выполнять в полном наборе. Обычно врач, исходя из клинической картины, рекомендует обоснованный перечень исследований. Ниже мы привели встречающиеся в нашей практике варианты демиелинизирующих заболеваний и наиболее рациональные, на наш взгляд, способы их дифференциальной диагностики. Будем рады Вам помочь!
В нашей клинике работает опытная слаженная команда опытных специалистов (неврологи, иммунологи). При необходимости Ваш лечащий врач привлечет к лечению и других необходимых специалистов: ревматолога, эндокринолога и т.д.
В большинстве случаев добиться стойкой и длительной ремиссии – задача вполне реальная.
Специфическое лабораторное исследование на предмет рассеянного склероза: исследование олигоклонального IgG в ликворе. В бесспорных случаях, когда картина МРТ явно соответствует рассеянному склерозу, данное исследование не целесообразно. Подробнее об исследованиях ликвора
Иммунный статус при рассеянном склерозе и рассеянном энцефаломиелите
Бывает так, что одно ослабленное звено иммунитета может вызывать компенсаторную гиперактивацию другого звена, с нарастанием аутоиммунной реактивности и обострением рассеянного склероза (рассеянного энцефаломиелита). Особенно это актуально в присутствии инфекции, требующей активного иммунного ответа. Исследование иммунного статуса во многих случаях помогает подобрать схему лечения, способную предотвращать атаки рассеянного склероза.
| ИММУНОГРАММА ПРИ ДЕМИЕЛИНИЗИРУЮЩЕМ ЗАБОЛЕВАНИИ |
| Основные субпопуляции лимфоцитов (Т-лимфоциты с субпопуляциями, В-лимфоциты, естественные киллеры, нейтрофилы и др.) |
| В-1 клетки CD19+CD5+ (В-лимфоциты с потенциальными аутореактивными свойствами) |
| IgA, IgG, IgM общие |
| IgE общий |
| Компоненты комплемента С3 и С4 |
| Фагоцитоз |
Ниже приведены часто используемые в нашей клинике исследования. Некоторые инфекции можно обнаружить при исследовании ликвора. В большинстве случаем мы не назначаем весь перечень исследований: целесообразнее выбрать наиболее актуальные позиции, исходя из результатов осмотра и изучения истории заболевания.
| НАИБОЛЕЕ АКТУАЛЬНЫЕ ИССЛЕДОВАНИЯ НА НЕЙРОИНФЕКЦИИ И ИНФЕКЦИИ, СПОСОБНЫЕ АКТИВИРОВАТЬ АУТОИММУНИТЕТ | |
| Хронический боррелиоз, нейроборрелиоз | |
| IgG к боррелии – анализ крови | |
| Иммуночип IgM и IgG к боррелиям гаринии и афзелии (borrelia garinii, borrelia afzelii) – анализ крови | |
| Тропическая спастическая параплегия / Тропический спастический парапарез | |
| Антитела IgG к Т-лимфотропному вирусу человека типа 1 и 2 (HTLV 1,2) | |
| Менингококк | |
| Анализ крови на антитела к менингококку – анализ крови | |
| Листериоз | |
| Антитела к листерии – анализ крови | |
| Герпес 1 и 2 типов, герпес 6 типа, Эпштейн-Барр вирус, Цитомегаловирус | |
| ПЦР из биоматериала слюны на вирус простого герпеса 1го и 2го типов | |
| ПЦР из биоматериала слюны на герпес 6 типа, Эпштейн-Барр вирус, Цитомегаловирус | |
| ВИЧ. Энцефалиты и энцефалопатии и нейроинфекции, ассоциированные с ВИЧ. | |
| Антитела к вирусу иммунодефицита человека (ВИЧ) | |
| Вирусные гепатиты B, C, G. | |
| Кровь методом ПЦР на вирус гепатита С | |
| Кровь методом ПЦР на вирус гепатита В | |
| Кровь методом ПЦР на вирус гепатита G | |
| Токсоплазмоз и носительство токсоплазмы | |
| IgM к токсоплазме | |
| IgG к токсопалме – авидность | |
| Парвовирус 19 | |
| Антитела IgM к парвовирусу 19 в анализе крови | |
| Энтеровирусы (к ним относится также вирус полиомиелита) | |
| РНК энтеровируса в анализе крови | |
| РНК энтеровируса в анализе кала | |
| Клещевой энцефалит – острая и хроническая формы | |
| Антитела IgM к ТВЕ | |
| Антитела IgG к ТВЕ | |
| Хламидии и микоплазмы. | |
| Антитела IgА к хламидии трахоматис | |
| Антитела IgА к хламидии пневмонии | |
| Антитела IgА к микоплазме пневмонии | |
| Антитела IgА к микоплазме хоминис | |
| Сифилис и нейросифилис | |
| TPHA (РПГА) полуколичественным методом | |
| Антитела к кардиолипину IgA+IgM+IgG | |
| Бруцеллы | |
| Бруцелла (Brucella), полуколичественное определение антител | |
| Стрептококк бета-гемолитический группы А | |
| АСЛО (антистрептолизин О) | |
| Сальмонеллез | |
| Антитела к сальмонелле А, В, С, D, E | |
| Йерсиниоз | |
| Антитела к йерсиниям | |
| Бакпосевы на инфекции глотки и носа | |
| Бакпосев из глотки с определением чувствительности к стандартному набору антибиотиков | |
| Бакпосев из носа с определением чувствительности к стандартному набору антибиотиков | |
Паранеопластический энцефаломиелит
| АНАЛИЗЫ НА ПАРАНЕОПЛАСТИЧЕСКИЕ ЭНЦЕФАЛИТЫ И ПОЛИНЕВРИТЫ |
| Антитела к NMDA рецептору, сыворотка (анти- NMDAR, N-methyl-D-Aspartate Receptor Antibody). Тест, используемый для диагностики аутоиммунного анти- NMDAR энцефалита. |
| Антинейрональные антитела, панель (лайн-блот: Hu (ANNA 1), Yo-1 (PCA1), CV2, Ма2, Ri (ANNA2), амфифизин). Тест для диагностики паранеопластических энцефалитов. |
| Антитела к ганглиозидам. Тест для диагностики полинейропатий. |
| Антитела к аквапорину 4. Диагностика нейрооптикомиелита. |
| Электрофорез белков (белковые фракции), исследование бета-2 микроглобулина, тест на предмет моноклональной гаммапатии. Диагностика нейролейкоза. |
Ревматические заболевания с вовлечением нервной системы
| АНАЛИЗЫ – РЕВМАТОЛОГИЯ, ВАСКУЛИТЫ, САРКОИДОЗ |
| Антинуклеарный фактор (АНФ) |
| Антитела к кардиолипину скрининг – IgG, IgA, IgM |
| Антинейтрофильные цитоплазматические антитела (АНЦА), IgG, панель. |
| Активность ангиотензин-превращающего фермента сыворотки (АПФ). Диагностика саркоидоза. |
| С-реактивный белок, ревматоидный фактор |
Некоторые актуальные витамины и инсулинорезистентность
| ВИТАМИНЫ и ГОРМОНЫ |
| Витамины В1, В6, В12 и фолиевая кислота – их дефицит может приводить к неврологическим нарушениям |
| Дефицит витамина Д – часто выявляется при рассеянном склерозе и может требовать коррекции |
| Индекс инсулинорезистентности – при инсулинорезистентности процессы регенерации в нервной системе идут медленнее |
Подготовка к лабораторным исследованиям
Анализы в нашей клинике можно сдать ежедневно, включая субботу и воскресенье, с 9 до 14:00 или 21:00 (различные позиции).
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Рассеянный склероз: причины появления, симптомы, диагностика и способы лечения.
Определение
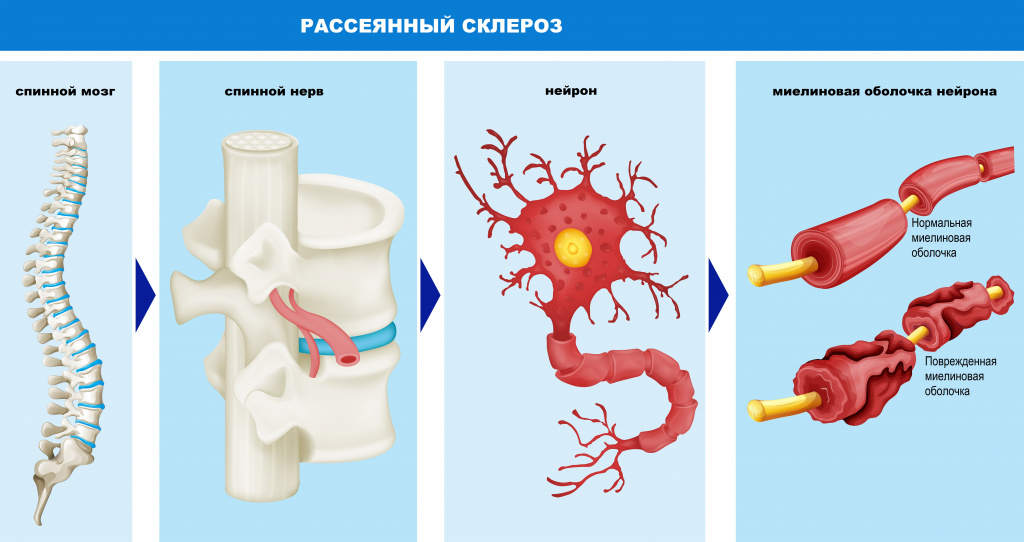
Рассеянный склероз (множественный склероз, Multiple Sclerosis) – это хроническое прогрессирующее нейродегенеративное аутоиммунное заболевание центральной нервной системы, которое поражает головной мозг, спинной мозг и зрительные нервы.
Причины появления рассеянного склероза
Большинство нервных волокон покрыто миелиновой оболочкой. Мозг направляет электрические импульсы по нервам в различные части тела. Данные импульсы управляют всеми нашими произвольными и непроизвольными движениями. Здоровые нервы изолированы при помощи миелиновой оболочки, которая является защитным слоем, обеспечивает питание аксона, поддерживает его структуру, предохраняет от повреждения, ускоряет передачу нервного импульса.
При рассеянном склерозе собственная иммунная система человека ошибочно атакует и разрушает миелиновую оболочку нервных волокон.
В области потери миелина образуется рубцовая соединительная ткань, которая может исказить либо полностью заблокировать передаваемые импульсы. Какое-то время нервная система компенсирует сбои, но по мере прогрессирования заболевания выраженность симптоматики неуклонно нарастает от легкого онемения конечностей до паралича и/или слепоты.
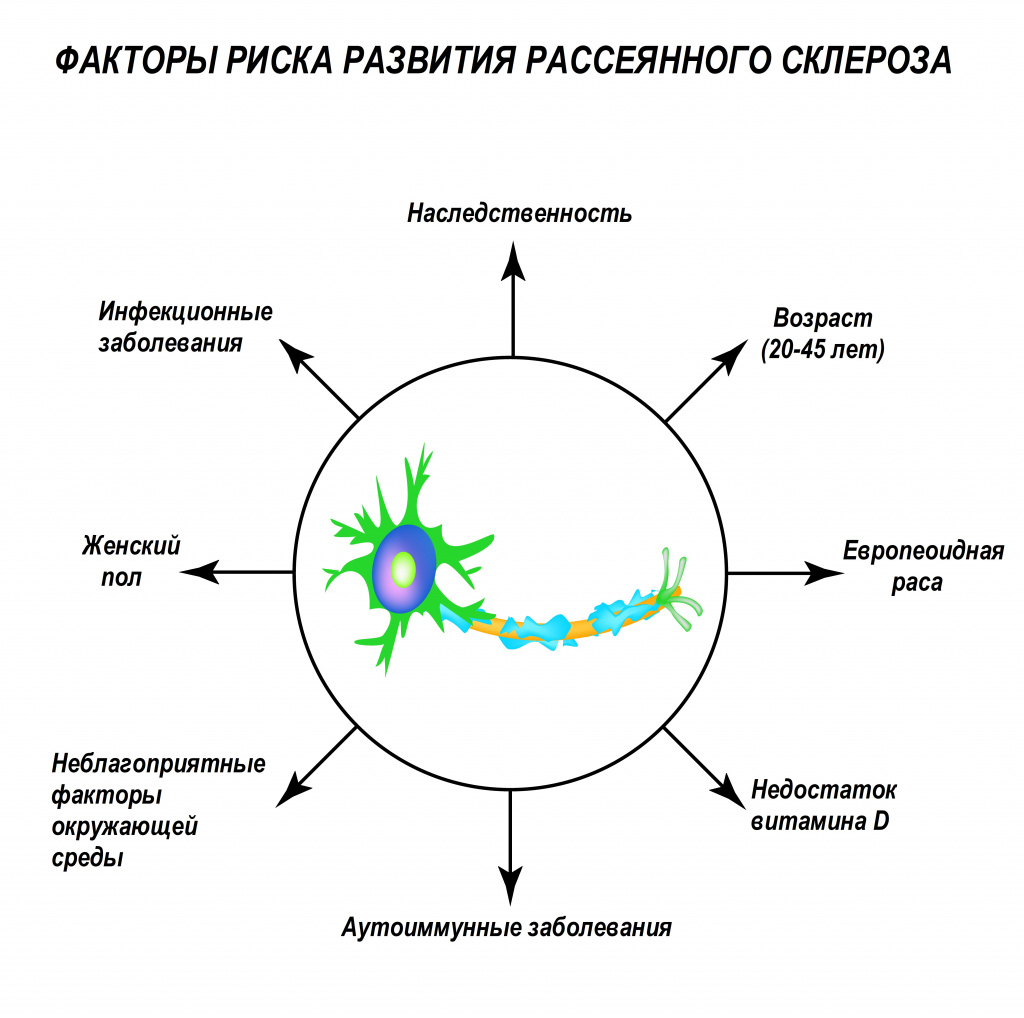
До сих пор не известна причина, по которой иммунные клетки начинают атаковать нервные волокна своего же организма. Существует мнение, что на развитие заболевания могут влиять многие факторы: генетическая предрасположенность, активное и пассивное курение, дефицит витамина D, воздействие ретровирусов, вируса герпеса человека, в частности Эпштейна-Барр, бактериальные инфекции (стафилококки, стрептококки), высокое содержание соли в продуктах питания, плохая экология, травмы головного мозга (сотрясения, ушибы), повреждения позвоночного столба, избыточный вес (особенно у подростков и детей), стрессы, некоторые аутоиммунные заболевания. Повышенному риску развития рассеянного склероза подвержены жители северных регионов и представители европеоидной расы.
Заболевание чаще диагностируют в возрасте 20–45 лет, но может встречаться и у детей. Мужчины болеют в 2 раза реже женщин, но именно у них патология протекает тяжелее и хуже поддается терапии.
Классификация заболевания
Выделяют некоторые типичные варианты течения рассеянного склероза:
- Ремиттирующее течение – наиболее частый вариант в дебюте заболевания. Характеризуется периодами обострений, чередующихся с периодами ремиссий (с полным или неполным восстановлением функций в периоды между обострениями), отсутствием нарастания симптомов в периоды ремиссий. У многих пациентов ремиттирующее течение в последующем переходит во вторичное прогрессирование (с обострениями или без обострений);
- Прогрессирующее течение:
- первично-прогрессирующее – с самого начала заболевания в течение не менее одного года наблюдается нарастание тяжести симптомов заболевания без периодов улучшения;
- вторично-прогрессирующее – тяжесть симптомов заболевания нарастает на протяжении не менее 6 месяцев без стабилизации или улучшения после ремиттирующей фазы болезни, возможно прогрессирование с обострениями или без них.
- активный рассеянный склероз (при наличии обострений или признаков активности заболевания по данным МРТ);
- неактивный рассеянный склероз (без обострений и без признаков активности по данным МРТ);
- рассеянный склероз с прогрессированием (выявляются новые очаги поражения);
- рассеянный склероз без прогрессирования (новые очаги поражения нервной системы не выявлены).
- злокачественная форма (болезнь Марбурга) характеризуется очень быстрым прогрессированием без периодов ремиссии, в самых тяжелых случаях может приводить к смерти пациента;
- агрессивная, или быстропрогрессирующая форма, при которой в течение года наблюдается два и более эпизода обострения, ведущих к нарастанию уровня инвалидизации;
- высокоактивная форма характеризуется двумя и более обострениями за год и значительным увеличением очагов поражения нервной системы по данным МРТ.
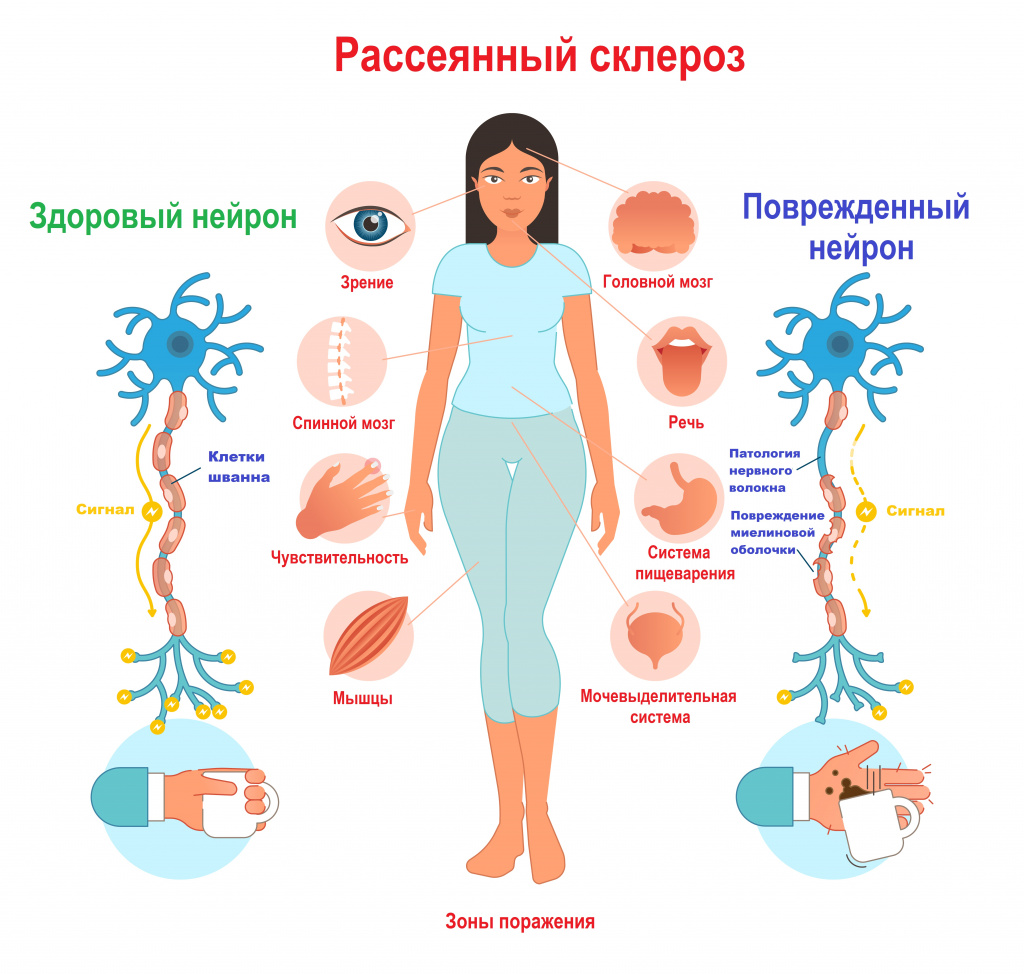
Признаки рассеянного склероза зависят от локализации основной части патологических очагов. По мере поражения новых зон симптоматика нарастает и становится более разнообразной.
Поражение мозжечка и его путей: выраженное напряжение в ногах или в руках (за счет повышения мышечного тонуса), возможны параличи, нарушение координации движений, пошатывание при ходьбе, непроизвольные движения, тремор рук и ног, нарушение речевой функции, головокружения.
Поражение зрительного нерва: снижение зрения на один глаз вплоть до полной слепоты; черная точка в центре поля зрения; ощущение мутного стекла, пелены перед глазом - это проявления ретробульбарного неврита (патологии зрительного нерва на участке за глазным яблоком в результате поражения его миелиновой оболочки). Возникает нарушение движения глазного яблока, развивается двоение изображения (диплопия).
Поражение спинного мозга: постоянная усталость и утомляемость, потеря контроля над опорожнением кишечника и мочевого пузыря, запоры и задержка мочеиспускания, изменения сексуальной функции, радикулопатии, симптом Лермитта (при наклоне головы вперед возникает ощущение прохождения электрического тока по позвоночнику, иногда отдающее в конечности), чувство жжения или боль в ответ на прикосновение, покалывание или онемение в конечностях, развитие спастического парапареза.
Поражение ствола головного мозга: слабость или спазм мышц лица, перемежающееся онемение одной половины лица, центральный или периферический парез лицевого нерва, снижение слуха, снижение вкусовой чувствительности.
Поражение больших полушарий головного мозга: снижение памяти и внимания, скорости выполнения нейропсихологических тестов, нарушения поведения, излишняя тревожность, плохое настроение, депрессия или эйфория.
Это необходимо учитывать и стараться избегать перегрева, который может спровоцировать приступ. Лишенные миелиновой оболочки нервные волокна крайне чувствительны к повышению температуры.
Диагностика рассеянного склероза
В целом клинические проявления болезни очень разнообразны, что затрудняет постановку диагноза. Два основных клинических признака, подтверждающие наличие рассеянного склероза:- симптомы проявляются в различных отделах центральной нервной системы;
- наличие по крайней мере двух приступов болезни, возникновение которых разделено по времени периодом не менее одного месяца.
Методы диагностики:
Оценка жалоб, симптоматики, клинических нарушений.
При неврологическом осмотре врач проверяет функцию нервной системы: рефлексы, равновесие, координацию и зрение, а также проводит поиск областей онемения.
Офтальмологическое обследование с обязательной оценкой остроты зрения, полей зрения, состояния глазного дна.Пациенту с подозрением на рассеянный склероз рекомендованы следующие лабораторные анализы для оценки общего состояния организма и определения возможности назначения последующей терапии:
-
клинический анализ крови развернутый;
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Complete blood count (CBC) with differential white blood cell coun.
Читайте также:

