Антибиотик при инфицированном ожоге
Обновлено: 26.04.2024
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов. Ведущим ограничением в выборе антибактериальных препаратов в настоящее время является широкое распространение полирезистентных микроорганизмов. Это значительно сужает выбор как системных, так и местных препаратов эмпирической антибактериальной терапии ран. В настоящее время в целях профилактики прогрессирования раневой инфекции находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов.
К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран, можно отнести сульфаниламид (Ранавексим), сульфатидин серебра, неомицин с бацитрацином. Местная терапия инфицированных ран должна базироваться на этиологических и анамнестических характеристиках раны, фазе раневого процесса и объеме поражения. Местное применение антибактериальных препаратов (например, сульфаниламида) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги).
Ключевые слова: раны, антибактериальная терапия, полирезистентность, местное применение антибиотиков, сульфаниламид.
Для цитирования: Левчук И.П., Костюченко М.В. Антибактериальные препараты для местной терапии ранений различной этиологии //РМЖ. Медицинское обозрение. 2018. № 00. С. 1-6.
Antibacterial drugs for topical therapy of the wounds of various etiologies
Levchuk I.P., Kostyuchenko M.V.
Pirogov Russian National Research Medical University, Moscow
Abstract
The article deals with modern problems of antibiotic therapy of the wounds of various etiologies, possibilities and limitations of the use of topical antibiotics. Currently, the main limitation in the choice of antibacterial drugs is the widespread use of multiresistant microorganisms. This fact significantly reduces the choice of both systemic and topical drugs for empirical antibiotic therapy of wounds. At present, topical antibiotics are often used to prevent the progression of wound infection, which often allows to avoid systemic side effects. Topical antibacterial preparations most actively used for outpatient management of wounds can be attributed to a sulfanilamide (Ranavexim), sulfatides silver, neomycin with bacitracin. Topical therapy of wounds should be based on etiological and anamnestic characteristics of the wound, phase of the wound process and the extent of the lesion. Topical use of antibacterial drugs (e. g. sulfanilamide) is possible with small lesions without an active infectious process in the wound (such as abrasions, scratches, small cuts and burns).
Key words: wounds, antibacterial therapy, multidrug resistance, topical application of antibiotics, sulfonamide.
For citation: Levchuk I.P., Kostyuchenko M.V. Antibacterial drugs for topical therapy of the wounds of various etiologies // RMJ. Medical Review. 2018. № 00. P. 1-6.
Все раны, полученные в нестерильных условиях, являются инфицированными, рост бактериальной флоры в ране провоцирует развитие воспалительного процесса, сопровождающегося повышением местной температуры, гиперемией, болью и нарушением функции части тела, на которой находится рана. Частота развития инфекционных осложнений остается весьма значительной и достигает в целом 45%. Наиболее подвержены развитию инфекционных осложнений раны, загрязненные землей, с нарушением кровоснабжения в области непосредственно самого повреждения или всей части тела, огнестрельные и минно-взрывные раны, укусы животных и человека. В зависимости от вида повреждения и условий окружающей среды в раны могут попадать различные микроорганизмы: резидентные - постоянно живущие и размножающиеся на коже (преимущественно коагулазонегативные кокки, например Staphylococcus epidermidis, S. aureus, и дифтeроиды, например Corinebacterium spp., реже - грамотрицательные бактерии), и транзиторные - в норме отсутствующие и попадающие на кожу после контакта с контаминированными объектами окружающей среды и больными людьми. В зависимости от области тела (голова, конечности, перианальная область и т. д.) спектр резидентной микрофлоры может быть различным. Транзиторная флора также неодинакова по составу, который зависит от характера раны, этиологии, окружающей среды и может быть представлен различными инфекционно-опасными микроорганизмами (Escherichia coli, Klebsiella spp., Pseudomonas spp., Salmonella spp. и другими грамотрицательными бактериями, S. aureus, вирусами и грибами, Candida albicans, ротавирусами и др.). При повреждении кожи транзиторные микроорганизмы способны длительно колонизировать и инфицировать кожу, формируя при этом новую, гораздо более опасную резидентную (но не нормальную) флору. В большинстве случаев инфицирование обусловливается микробными ассоциациями. Так, укусы собак сопровождаются инфекционным осложнением примерно в 20% случаев, кошек - до 30-50%, человека - 70-80% 1.
Из-за изменения гистохимических параметров тканей в результате повреждения и разрушения защитной барьерной функции кожи даже непатогенные микроорганизмы могут стать причиной выраженных воспалительных, гнойных процессов. Для выбора оптимальной антибактериальной терапии необходимо учитывать возможный микробный спектр раны (табл. 1).
Таблица 1. Этиология и микробный спектр ран
| Этиология ран | Спектр возбудителей раневых инфекционных осложнений |
| Раны в результате несчастных случаев | Чаще встречаются Enterobacteriaceae spp. и S. aureus, в т. ч. возможны и внебольничные MRSA-штаммы, Staphylococcus spp. [4]. При ранах в области верхних конечностей, особенно кистей рук, преобладают кокковые формы: 90% стафилококк (57% в чистой культуре и 33% - в ассоциации со спороносными палочками); реже обнаруживаются дифтероиды, аэробные спороносные палочки и различные сапрофиты воздушного происхождения; при травме нижних конечностей встречаются кишечная палочка и протей -13,5%, реже - анаэробы [5]. В перианальной области в ране содержатся разнообразные комбинации грамположительных кокков (стафилококки, стрептококки и энтерококки) и энтеробактерий (кишечная палочка, клебсиелла, энтеробактер и др.) в возможной ассоциации с анаэробами (пептострептококки, бактероиды, фузобактерии, клостридии и др.) [6]. При ранении в морской воде - Vibrio spp, Mycobacterium marinun, в пресной воде - Pseudomonas aeruginosa, Aeromonas spp. и Mycobacterium spp. (чаще - M. marinum, Mycobacterium avium), Vibrio spp, Enterobacteriaceae spp. [7, 8]. Повреждения, сопровождающиеся нарушением кровоснабжения и резким снижением оксигенации тканей, наиболее благоприятны для развития C. perfringens, C. novyi, C. septicum, C. hystoliticum, C. bifermentans [6]. |
| Ожоговые раны | Чаще всего рану колонизируют стафилококк, вегетирующий в виде сапрофитной флоры на неповрежденной коже, и стрептококк. На госпитальных этапах - нозокомиальные инфекции (больничная полирезистентная флора), частота MRSA-штаммов -37-50% [9]. Монокультуры микроорганизмов встречаются в 57% случаев, микробные ассоциации - в 43%, они включают: S. aureus и Proteus vulgaris; S. aureus и S. epidermidis; S. aureus и P. aeruginosa; P. vulgaris, E. coli, S. aureus; P. aeruginosa, K. pneumonia, S. aureus (Моррисон В.В., 2015). |
| Укушенные раны | При укусах животных первое место по числу занимают микробные аэробно-анаэробные ассоциации - 50-65%, Pasteurella spр. - 2075% (Pasteurella multocida - 60% и P. canis - 18%), а также Peptostreptococcus spp, S. aureus - 20-40% и Streptococcus mitis, Moraxella spp, Corynebacterium spp. и Neisseria spp. 9. При укусах кошки: P. multocida, S. aureus, MRSA, Cl. tetani; при укусах свиньи: полимикробная флора (грамположительные кокки, грамотрицательные палочки, Pasteurella spp. + анаэробы, Cl. tetani); при укусах крысы: S. moniliformis, Cl. tetani; при укусах змеи: Pseudomonas spp, Enterobacteriaceae spp., Clostridium spp. [1, 4]. При укусах человека спектр возбудителей представлен преимущественно Streptococcus spp. (17-90%), S. aureus (13-50%), Eikenella corrodens (10-29%), Haemophilus influenza (17-26%), Bacteroides spp, Fusobacterium spp. (12-33%), Peptostreptococcus spp. (22%), преобладает смешанная флора [4, 9-10, 12]. Возможны внебольничные MRSA-штаммы, особенно при укусах животных [13]. |
| Раны после разделки мяса или рыбы | Erysipelothrixrhusiopathiae [7]. |
| Раны, полученные в результате боевых действий и других ЧС | Часто грамотрицательные аэробные возбудители: Enterobacteriaceae spp, Pseudomonas spp, а также Staphylococcus spp. При повреждениях полых органов, например при проникающих абдоминальных ранениях: контаминация раны грамотрицательными возбудителями из семейства Enterobacteriaceae и анаэробами [4]. При глубоких ранах, загрязненных землей, с нарушением кровоснабжения и резким снижением оксигенации тканей: C. perfringens, C. novyi, C. septicum, C. hystoliticum, C. bifermentans [6]. |
| Послеоперационные раны | S. aureus - 20% (в т. ч. MRSA-штаммы), коагулазонегативные стафилококки - 14%, энтерококки - 12%, E. coli - 8%, P. aeruginosa - 8%, Enterobacter spp. - 7%, P. mirabilis - 3%, K. pneumoniae - 3%, C. albicans - 3-9,5%, другие грамположительные аэробы - 2%, Bacteroides fragilis - 2% [1, 4]. |
Антибактериальная терапия
В настоящее время внебольничные штаммы остаются чувствительными к большому числу антибиотиков, в т. ч. ß-лактамам. До конца 1990-х годов метициллин-резистентные микроорганизмы (MRSA) были исключительно внутрибольничной проблемой с преимущественным распространением в Европе. Однако в настоящее время имеются сведения и о внебольничных резервуарах полирезистентного стафилококка зоонозного происхождения, который составляет в общей массе до 50% и более на юге Европы и 10-25% в Центральной Европе и Великобритании [14]. В России в амбулаторных условиях частота встречаемости MRSA не превышает 3,8%, однако в условиях стационара частота встречаемости этих микроорганизмов, а также устойчивых к цефалоспоринам грамотрицательных E. coli и Klebsiella spp. достигает 60,4-84,9%. При выявлении высокого риска инфицированности MRSA-штаммами необходимо включить анти-MRSA-препарат в схему лечения 6.
В целях профилактики прогрессирования раневой инфекции в настоящее время находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов. Системной антибактериальной терапии не требуется при очагах менее 5 см после адекватной хирургической обработки [6].
Таблица 2. Характеристика антибактериальных препаратов для наружного применения
Примечание: ПАБК - парааминобензойная кислота
В случае обширных раневых дефектов, клинических проявлений инфекции, включая системные признаки воспаления (повышение температуры тела >38° С или снижение 12*10 9 /л или лейкопения 90 уд./мин; одышка >24 дыханий/мин), иммунодефицитного состояния необходимо системное применение антибиотиков [7]. Местные лекарственные формы с антибактериальным компонентом при этом также находят место в протоколах лечения.
Активно применяющиеся в настоящее время антибактериальные препараты, при кажущемся на первый взгляд многообразии, с учетом современной концепции лечения инфицированных ран и требований, предъявляемых к подобным препаратам, имеют существенные ограничения. Спектр действия большей части широко известных препаратов значительно сузился для стационарного применения в связи с полирезистентностью микроорганизмов (табл. 2) и ограничением из-за побочных эффектов при больших раневых поверхностях (табл. 3).
Таблица 3. Показания, побочные эффекты и ограничения для антибактериальных препаратов для наружного применения
Многие местно применяемые антибактериальные препараты имеют достаточно жесткие ограничения для стационарного применения в связи с резистентностью микрофлоры, а также по площади раневой поверхности из-за активного всасывания и токсичности при попадании в системный кровоток [20]. К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран с целью профилактики развития раневой инфекции, можно отнести сульфаниламид, сульфатидин серебра, неомицин с бацитрацином, при риске негоспитальных устойчивых штаммов - мупироцин и фузидовую кислоту. Сульфаниламид не потерял актуальности и характеризуется противомикробным действием по отношению к негоспитальным штаммам грамположительных и грамотрицательных кокков, E. coli, Shigella spp., Vibrio cholerae, Haemophilus influenzae, Clostridium spp., Bacillus anthracis, Corynebacterium diphtheriae, Yersinia pestis, а также Chlamydia spp., Actinomyces spp., Toxoplasma gondii и некоторым другим бактериям при ранах и ожогах, полученных в результате несчастных случаев и в чрезвычайных ситуациях [15-16, 21].
Применяя местные антибактериальные препараты, которые непосредственно контактируют с раной, необходимо учитывать их форму выпуска и состав вспомогательных веществ, соотнося их с фазами раневого процесса.
В первой фазе раневого процесса рекомендуются для местного применения препараты на водорастворимой основе с сульфаниламидом [6]. Сульфаниламид в виде порошка для местного применения (Ранавексим в банке с дозатором) поглощает раневой экссудат, не травмирует ткани раневой поверхности, препятствует развитию микрофлоры в ране и вторичному инфицированию [21, 22]. При использовании лекарственной формы в упаковке с дозатором легко контролируются дозировка лекарственного вещества и равномерность нанесения порошка без контакта с раневой поверхностью, что уменьшает риск побочных эффектов.
При глубоких ранениях в полость раны вносят 5-15 г порошка для наружного применения (Ранавексим), при этом максимальная суточная доза для взрослых составляет 15 г, для детей старше 3-х лет - 300 мг, при местном применении в виде порошка (непосредственном нанесении на раневую поверхность) препарат не обладает раздражающим ткани действием [15, 21, 23].
Во второй фазе раневого процесса следует отдавать преимущество формам, не наносящим ущерба грануляциям.
Учитывая мультирезистентность микроорганизмов, в настоящее время эмпирические схемы антибактериальной терапии претерпевают значительные изменения. Давно известные и широко используемые антибиотики остаются, как правило, препаратами выбора лишь для ведения небольших ран в амбулаторных условиях у пациентов с низким риском инфицирования MRSA и другими устойчивыми штаммами. Раны, требующие хирургического лечения в условиях стационара, автоматически переводят пациентов в группу риска, и выбор препарата меняется. При этом антибактериальный спектр применяемого препарата должен включать возможных возбудителей с учетом этиологических и анамнестических характеристик раны.
Заключение
Таким образом, при назначении антибактериальной терапии ран необходимо учитывать этиологию и обстоятельства, при которых было получено повреждение, возможный спектр возбудителей, лечение амбулаторное или стационарное, риск инфицирования резистентной микрофлорой, особенности хирургического лечения раны и фазу раневого процесса. При этом, несмотря на широкое использование местных форм антибактериальных препаратов, в настоящее время отсутствуют четкие стандартизированные подходы относительно фаз раневого процесса. Только местное применение антибактериальных препаратов (например, сульфаниламида в форме порошка для наружного применения - Ранавексима) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги). При глубоких и обширных раневых дефектах после хирургической обработки применяется системная антибактериальная терапия, дополняемая при необходимости местными лекарственными формами.
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов. Ведущим ограничением в выборе антибактериальных препаратов в настоящее время является широкое распространение полирезистентных микроорганизмов. Это значительно сужает выбор как системных, так и местных препаратов эмпирической антибактериальной терапии ран. В настоящее время в целях профилактики прогрессирования раневой инфекции находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов.
К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран, можно отнести сульфаниламид (Ранавексим), сульфатидин серебра, неомицин с бацитрацином. Местная терапия инфицированных ран должна базироваться на этиологических и анамнестических характеристиках раны, фазе раневого процесса и объеме поражения. Местное применение антибактериальных препаратов (например, сульфаниламида) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги).
Ключевые слова: раны, антибактериальная терапия, полирезистентность, местное применение антибиотиков, сульфаниламид.
Для цитирования: Левчук И.П., Костюченко М.В. Антибактериальные препараты для местной терапии ранений различной этиологии. РМЖ. Медицинское обозрение. 2018;2(2(II)):64-68.
Levchuk I.P., Kostyuchenko M.V.
Pirogov Russian National Research Medical University, Moscow
The article deals with modern problems of antibiotic therapy of the wounds of various etiologies, possibilities and limitations of the use of topical antibiotics. Currently, the main limitation in the choice of antibacterial drugs is the widespread use
of multiresistant microorganisms. This fact significantly reduces the choice of both systemic and topical drugs for empirical antibiotic therapy of wounds. At present, topical antibiotics are often used to prevent the progression of wound infection, which often allows to avoid systemic side effects. Topical antibacterial preparations most actively used for outpatient management of wounds can be attributed to a sulfanilamide (Ranavexim), sulfatides silver, neomycin with bacitracin. Topical therapy
of wounds should be based on etiological and anamnestic characteristics of the wound, phase of the wound process and the extent of the lesion. Topical use of antibacterial drugs (e. g. sulfanilamide) is possible with small lesions without an active infectious process in the wound (such as abrasions, scratches, small cuts and burns).
Key words: wounds, antibacterial therapy, multidrug resistance, topical application of antibiotics, sulfanilamide.
For citation: Levchuk I.P., Kostyuchenko M.V. Antibacterial drugs for topical therapy of the wounds of various etiologies // RMJ. Medical Review. 2018. № 2(II). P. 64–69.
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов
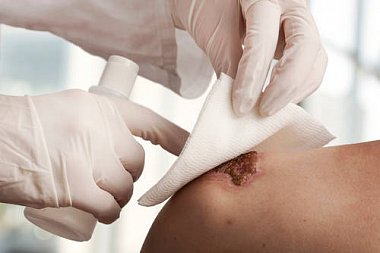
Все раны, полученные в нестерильных условиях, являются инфицированными, рост бактериальной флоры в ране провоцирует развитие воспалительного процесса, сопровождающегося повышением местной температуры, гиперемией, болью и нарушением функции части тела, на которой находится рана. Частота развития инфекционных осложнений остается весьма значительной и достигает в целом 45%. Наиболее подвержены развитию инфекционных осложнений раны, загрязненные землей, с нарушением кровоснабжения в области непосредственно самого повреждения или всей части тела, огнестрельные и минно-взрывные раны, укусы животных и человека. В зависимости от вида повреждения и условий окружающей среды в раны могут попадать различные микроорганизмы: резидентные — постоянно живущие и размножающиеся на коже (преимущественно коагулазонегативные кокки, например Staphylococcus epidermidis, S. aureus, и дифтeроиды, например Corinebacterium spp., реже — грамотрицательные бактерии), и транзиторные — в норме отсутствующие и попадающие на кожу после контакта с контаминированными объектами окружающей среды и больными людьми. В зависимости от области тела (голова, конечности, перианальная область и т. д.) спектр резидентной микрофлоры может быть различным. Транзиторная флора
также неодинакова по составу, который зависит от характера раны, этиологии, окружающей среды и может быть представлен различными инфекционно-опасными микроорганизмами (Escherichia coli, Klebsiella spp., Pseudomonas spp., Salmonella spp. и другими грамотрицательными бактериями, S. aureus, вирусами и грибами, Candida albicans, ротавирусами и др.). При повреждении кожи транзиторные микроорганизмы способны длительно колонизировать и инфицировать кожу, формируя при этом новую, гораздо более опасную резидентную (но не нормальную) флору. В большинстве случаев инфицирование обусловливается микробными ассоциациями. Так, укусы собак сопровождаются инфекционным осложнением примерно в 20% случаев, кошек — до 30–50%, человека — 70–80% [1–3].

Из-за изменения гистохимических параметров тканей в результате повреждения и разрушения защитной барьерной функции кожи даже непатогенные микроорганизмы могут стать причиной выраженных воспалительных, гнойных процессов. Для выбора оптимальной антибактериальной терапии необходимо учитывать возможный микробный спектр раны (табл.1).
Антибактериальная терапия
В настоящее время внебольничные штаммы остаются чувствительными к большому числу антибиотиков, в т. ч. β-лактамам. До конца 1990-х годов метициллин-резистентные микроорганизмы (MRSA) были исключительно внутрибольничной проблемой с преимущественным распространением в Европе. Однако в настоящее время имеются сведения и о внебольничных резервуарах полирезистентного стафилококка зоонозного происхождения, который составляет в общей массе до 50% и более на юге Европы и 10–25% в Центральной Европе и Великобритании [14]. В России в амбулаторных условиях частота встречаемости MRSA не превышает 3,8%, однако в условиях стационара частота встречаемости этих микроорганизмов, а также устойчивых к цефалоспоринам грамотрицательных E. coli и Klebsiella spp. достигает 60,4–84,9%. При выявлении высокого риска инфицированности MRSA-штаммами необходимо включить анти-MRSA-препарат в схему лечения [6–7].
В целях профилактики прогрессирования раневой инфекции в настоящее время находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов. Системной антибактериальной терапии не требуется при очагах менее 5 см после адекватной хирургической обработки [6].
В случае обширных раневых дефектов, клинических проявлений инфекции, включая системные признаки воспаления (повышение температуры тела >38° С или снижение 12×10 9 /л или лейкопения 90 уд./мин; одышка >24 дыханий/мин), иммунодефицитного состояния необходимо системное применение антибиотиков [7]. Местные лекарственные формы с антибактериальным компонентом при этом также находят место в протоколах лечения.
Активно применяющиеся в настоящее время антибактериальные препараты, при кажущемся на первый взгляд многообразии, с учетом современной концепции лечения инфицированных ран и требований, предъявляемых к подобным препаратам, имеют существенные ограничения. Спектр действия большей части широко известных препаратов значительно сузился для стационарного применения в связи с полирезистентностью микроорганизмов (табл. 2) и ограничением из-за побочных эффектов при больших раневых поверхностях (табл. 3).
Многие местно применяемые антибактериальные препараты имеют достаточно жесткие ограничения для стационарного применения в связи с резистентностью микрофлоры, а также по площади раневой поверхности из-за активного всасывания и токсичности при попадании в системный кровоток [20]. К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран с целью профилактики развития раневой инфекции, можно отнести сульфаниламид, сульфатидин серебра, неомицин с бацитрацином, при риске негоспитальных устойчивых штаммов — мупироцин и фузидовую кислоту. Сульфаниламид не потерял актуальности и характеризуется противомикробным действием по отношению к негоспитальным штаммам грамположительных и грамотрицательных кокков, E. coli, Shigella spp., Vibrio cholerae, Haemophilus influenzae, Clostridium spp., Bacillus anthracis, Corynebacterium diphtheriae, Yersinia pestis, а также Chlamydia spp., Actinomyces spp., Toxoplasma gondii и некоторым другим бактериям при ранах и ожогах, полученных в результате несчастных случаев и в чрезвычайных ситуациях [15–16, 21].
Применяя местные антибактериальные препараты, которые непосредственно контактируют с раной, необходимо учитывать их форму выпуска и состав вспомогательных веществ, соотнося их с фазами раневого процесса.
В первой фазе раневого процесса рекомендуются для местного применения препараты на водорастворимой основе с сульфаниламидом [6]. Сульфаниламид в виде порошка для местного применения (Ранавексим в банке с дозатором) поглощает раневой экссудат, не травмирует ткани раневой поверхности, препятствует развитию микрофлоры в ране и вторичному инфицированию [21, 22]. При использовании лекарственной формы в упаковке с дозатором легко контролируются дозировка лекарственного вещества и равномерность нанесения порошка без контакта с раневой поверхностью, что уменьшает риск побочных эффектов. При глубоких ранениях в полость раны вносят 5–15 г порошка для наружного применения (Ранавексим), при этом максимальная суточная доза для взрослых составляет 15 г, для детей старше 3-х лет — 300 мг, при местном применении в виде порошка (непосредственном нанесении на раневую поверхность) препарат не обладает раздражающим ткани действием [15, 21, 23].
Во второй фазе раневого процесса следует отдавать преимущество формам, не наносящим ущерба грануляциям.
Учитывая мультирезистентность микроорганизмов, в настоящее время эмпирические схемы антибактериальной терапии претерпевают значительные изменения. Давно известные и широко используемые антибиотики остаются, как правило, препаратами выбора лишь для ведения небольших ран в амбулаторных условиях у пациентов с низким риском инфицирования MRSA и другими устойчивыми штаммами. Раны, требующие хирургического лечения в условиях стационара, автоматически переводят пациентов в группу риска, и выбор препарата меняется. При этом антибактериальный спектр применяемого препарата должен включать возможных возбудителей с учетом этиологических и анамнестических характеристик раны.
Заключение
Таким образом, при назначении антибактериальной терапии ран необходимо учитывать этиологию и обстоятельства, при которых было получено повреждение, возможный спектр возбудителей, лечение амбулаторное или стационарное, риск инфицирования резистентной микрофлорой, особенности хирургического лечения раны и фазу раневого процесса. При этом, несмотря на широкое использование местных форм антибактериальных препаратов, в настоящее время отсутствуют четкие стандартизированные подходы относительно фаз раневого процесса. Только местное применение антибактериальных препаратов (например, сульфаниламида в форме порошка для наружного применения — Ранавексима) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги). При глубоких и обширных раневых дефектах после хирургической обработки применяется системная антибактериальная терапия, дополняемая при необходимости местными лекарственными формами.

1. Алексеев А.А. Основные статистические показатели работы ожоговых стационаров Российской федерации за 2009 год / А.А. Алексеев, Ю.И. Тюрников // III съезд комбустиологов России 15-18 ноября 2010: сб. науч. трудов. – М., 2010. – С. 4–6.
2. Алексеев А.А. Антибактериальная терапия в комплексном лечении и профилактике инфекционных осложнений при ожогах / А.А. Алексеев, М.Г. Крутиков, В.П. Яковлев // Русский Медицинский журнал. – М., 1997. – № 5. – С. 24–30.
3. Избранные труды по комбустиологии / под ред. Островского Н.В. – Саратов: Научная книга, 2009. – С. 269.
4. Интенсивная терапия ожоговой болезни / Е.Н. Клигуненко с соав. // М.: МЕДпресс-информ, 2005. – С. 61–75.
7. Практическое руководство по антиинфекционной химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. – Смоленск: МАКМАХ, 2007. – 464 с.
8. Хирургические инфекции кожи и мягких тканей. Российские национальные рекомендации / под ред. В.С. Савельева с соав. – М.: Компания БОРГЕС, 2009, – С. 78–82.
9. Hemdon D. Modern burn care / D. Hemdon, M. Spies // Semin Pediatr Surg. – 2001. – Vol. 10, № 1. – P. 28–31.
10. Magliacani G. Antmicrobial therapy problems in burn sepsis / G. Magliacani, M. Stella, M. Calcagni // Ann Medit Burns Club. – 1994. – Vol. 7, № 2.
11. Pruitt B.A., Use of wound biopsies in the diagnosis and treatment of burn wound infection / B.A. Pruitt, A.T. McManus, S.H. Kim and W.G. Cioffi // US Army Institute of Surgical Research, Fort Sam Houston, USA. – Steinkopff Verlag Darmstadt. – 1993. – Р. 55–63.
Ожоги являются одним из наиболее часто встречающихся видов травматизма. Так, по данным 30 ожоговых центров за год за помощью обратилось около 157000 пострадавших, из них было госпитализировано 22057 пациентов, из которых у 1919 (8,7 %) больных травма закончились летальным исходом [1]. Для сравнения, в Соединенных Штатах Америки ежегодно около 2 млн человек получают ожоги, из которых приблизительно 100 тыс. требуют госпитализации и до 5000 случаев заканчиваются летально. При этом наиболее частой причиной смерти пострадавших от ожогов остаются инфекция и инфекционные осложнения ожоговой болезни, из которых превалируют пневмония и сепсис [8].
Общеизвестно, что все ожоги либо первично инфицированы, либо бактериальная обсемененность раны наступает уже в первые часы после травмы. Кроме непосредственной угрозы для жизни больного, имеющаяся инфекция значительно замедляет эпителизацию ожоговых ран, в том числе препятствуя своевременному оперативному лечению по восстановлению кожного покрова, а также ведет к формированию гипертрофических и келоидных рубцов. Инфекция ожоговых ран при длительном существовании может осложняться генерализацией, развитием сепсиса, ведет к развитию системного воспалительного ответа, результатом которого может явиться полиорганная недостаточность и смерть [2, 3, 4. 8]. Факторами риска летальности при ожогах являются:
• Неадекватная антибактериальная терапия, либо адекватная, но начало которой отсрочено более чем на 24 часа.
• Имеющиеся MRSA (метициллин-резистентные) и MRSE (аминогликозидустойчивые) штаммы микроорганизмов.
• Возраст (дети до 10 лет и взрослые старше 60 лет).
• Бактериемия, пневмония, наличие сопутствующих заболеваний.
• Не санированный первичный локус инфекции.
• Продолжительность антибактериального лечения менее 14 дней.
Таким образом, одной из основных составляющих лечения больных с термической травмой является адекватная антибактериальная защита пациента.
Инфекции у обожженных разделяют на три типа (по G. Magliacani и M.Stella, 1994) [10]:
1. Нозокомиальные инфекции, связанные с окружающей средой больницы, полирезистентной флорой, характеризующейся перекрестным инфицированием через определенные источники.
2. Ятрогенные инфекции, связанные с инвазивными диагностическими и лечебными процедурами.
3. Оппортунистические инфекции, связанные с обычной флорой и иммунокомпрометированным хозяином.
По гистологическим признакам ожоговой раневой поверхности различают стадии развития инфекционного процесса в ране (B.A. Pruitt, 1993; М.Г. Крутиков, 2000) [2, 11]:
а) поверхностная – микробы на ожоговой раневой поверхности;
б) проникновение – микроорганизмы в толще ожогового струпа;
в) пролиферация – появление и изменение численности микробов в пространстве под струпом.
а) микроинвазия – мелкие фокусы микрооргинизмов в измененной ткани соседнего с подструпом пространства;
б) генерализация – микрофокальное или широко распространенное проникновение микробов глубже в измененную подкожную ткань;
в) микрососудистая – вовлечение небольших кровеносных и лимфатических сосудов.
Условно-патогенная микрофлора выявляется на ожоговой поверхности уже в первые сутки с момента травмы. В последующем бактерии могут проникать в разрушенные волосяные фолликулы, а при глубоких ожогах ‒ в подкожно-жировую клетчатку и далее по кровеносным и лимфатическим сосудам разноситься по всему организму, вызывая генерализованную микробную инвазию. Генерализация инфекции наиболее часто происходит при площади ожоговых ран более 15 % поверхности тела (у детей до 12 лет – более 5 % поверхности тела), при площади глубоких ожоговых ран более 5 % поверхности тела, при наличии сопутствующих заболеваний (сахарный диабет, ОРВИ, пневмония, другие очаги острой и хронической инфекции), при иммунодефицитных состояниях, базисном лечении иммунодепрессантами и кортикостероидами, а также при сочетании с термоингаляционной травмой. Все перечисленные состояния требуют назначения антибактериальных препаратов по абсолютным показаниям, причем начало системной терапии антибиотиками должно происходить в первые 12–24 часа после травмы для предотвращения генерализации [4].
Адекватная стартовая антибактериальная терапия является основным фактором лечения ожоговой болезни и выживаемости пациентов. При этом при назначении антибиотиков выбранные препараты должны по возможности охватывать весь спектр потенциальных возбудителей инфекции и выбираться с учетом риска мультирезистентности возбудителей.
Цель ‒ определение оптимальных схем назначения, длительности и эффективности использования того или иного антибактериального препарата, схем перехода между препаратами и явилось целью нашей работы.
Материалы и методы исследования
За период с 2009 по 2012 гг. нами было обследовано 118 пациентов в возрасте от 18 до 65 лет с ожогами от 10 % до 35 % поверхности тела. Из них 72 пациента (61 %) были мужчины и 46 (39 %) – женщины. Из общего числа пациентов более половины (81 больной – 68,6 %) изначально при поступлении в стационар были госпитализированы в отделение реанимации и интенсивной терапии для ожоговых больных, где находились до стабилизации состояния от 8 до 35 дней. Из общего числа обследованных больных у 32 (27,1 %) были выявлены различные сопутствующие заболевания, у 26 (22 %) пациентов имелась термоингаляционная травма.
До начала антибактериальной терапии в течение первых суток с момента получения травмы у всех исследованных пациентов (100 %) был проведен бактериальный мониторинг раневых поверхностей. В последующем бактериологическое обследование повторялось каждые 5–7 дней до излечения пациента и выписки из стационара. Исследование выполнялось диско-диффузионным методом (в соответствии со стандартом NCCLS). Кроме раневого отделяемого исследовались кровь, моча, экссудат трахеобронхеального дерева, удаленные магистральные катетеры. Также использовался метод определения минимальной подавляющей концентрации препарата (МПК).
Микрофлора ожоговых ран была представлена, как правило, ассоциациями грамположительных и грамотрицательных микроорганизмов, а также грибов. Наиболее часто встречались St. aureus (40,4 %), Ps. Aeruginosa (31,6 %), реже встречались St. saprophyticus, Proteus, Candida albicans и tropicalis, Acinetobacter baumannii. Из комбинаций наиболее часто встречались Staph. aureus и Ps. Aeruginosa (41,3 %). Кроме того, в процессе лечения ожоговой травмы из всех выявленных штаммов стафилококка у 61,7 % больных выявлялись так называемые MRSA штаммы (рис. 1). Устойчивость синегнойной палочки выявлена была в 37,7 % случаев (рис. 2).
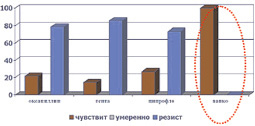
Рис. 1. Резистентность штаммов St. aureus
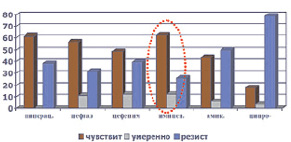
Рис. 2. Резистентность госпитальных штаммов Ps. aeruginosae
В последующем при сохраняющихся ожоговых поверхностях, при снижении чувствительности микроорганизмов к проводимой терапии, на 10–14 сутки выполнялся переход на цефалоспорины III–IV поколения (Цефотаксим, Цефепим) в сочетании с аминогликозидами (Амикацин), фторхинолоны I–II поколения (Ципрофлоксацин). Показаниями для смены антибактериального препарата были отсутствие чувствительности выделенной флоры к используемому препарату, а также отсутствие положительной динамики состояния пациента, нарастание симптомов системной воспалительной реакции через 48–72 часа.
В дальнейшем при выявлении MRSA и MRSE микроорганизмов, снижении чувствительности к вводимым антибиотикам (повышении МПК > 1 мг/л), что наблюдалось к 22–26 суткам, используемые препараты меняли на гликопептиды (Ванкомицин) и фторхинолоны III–IV поколения (Левофлоксацин, Моксифлоксацин) в качестве монотерапии, либо назначалось сочетание цефалоспоринов III–IV поколения (Цефоперазон+сульбактам, Цефепим) с гликопептидом (Ванкомицин). В некоторых случаях применялись карбапенемы (Имипинем, Меропенем) – при сохранении к ним чувствительности микроорганизмов. Использование подобной терапии осуществлялось еще в течение 8–12 дней. Кроме того, начиная с 8–10 дня от начала антибактериальной терапии из-за снижения колонизационной резистентности желудочно-кишечного тракта и повышения риска развития кандидоза, использовались противогрибковые препараты (Нистатин, Флюконазол) и пробиотики (эубиотики).
Таким образом, в процессе исследования мы, как правило, следовали классической схеме ЭСКАЛАЦИОННОЙ антибиотикотерапии, т.е. назначали изначально антибиотики с относительно нешироким спектром активности, предполагая малую вероятность наличия у пациента в ранние сроки после травмы устойчивых возбудителей [2, 4, 6, 8], а затем переходили на препараты резерва.
Увеличение продолжительности применения антибактериальных средств более 10–14 дней (несмотря на приведенные в аннотации к препаратам и описанные в руководствах по использованию лекарственных средств сроки [7]) проводилось также под контролем бактериального исследования пациентов, и было обусловлено длительностью течения болезни и особенностью лечения больных с термической травмой. Учитывалось общее состояние больного, показатели лабораторных и клинических исследований.
Критериями эффективности антибактериальной терапии явились:
• Регресс системной полиорганной недостаточности.
• Отсутствие нагноения в ране (стерильные посевы на 3,7 сутки).
• Отсутствие генерализации инфекции и вторичных очагов.
Доза вводимого препарата в некоторых случаях увеличивалась в 1,5–2,0 раза, что создавало адекватную подавляющую концентрацию препарата в крови и тканях. Увеличение дозы обусловлено не только ростом резистентности микроорганизмов, но и измененной фармакокинетикой у ожоговых больных, о чем писал Zaske et al. еще в 1976 г. К тому же бактериальный киллерный эффект не является зависимым от концентрации, а является функцией времени, в течение которого поддерживаются концентрации на уровне, приблизительно в 4 раза превышающем МПК. В то же время нет никаких доказательств того, что токсичность препарата соответствует высоким его концентрациям (Moellering R.C., 1994) [5].
Исходя из данных постулатов, в среднем, прием антибиотиков одной группы и поколения (например, цефалоспоринов II–III поколения + аминогликозида) продлевался до 30 ± 5 дней. При исследовании именно к этому времени чувствительность имеющихся на ранах микроорганизмов к данным препаратам приближалась к минимальной. Однако при увеличении длительности использования одного препарата или сочетания препаратов сохранялась возможность продолжить адекватную терапию пациентам, переходя на описанные выше схемы по эскалационной программе, не теряя возможность в случае крайней необходимости использовать препараты резерва и не формируя к ним антибиотикорезистентности.
Результаты исследования и их обсуждение
Анализируя полученные результаты исследования, нами составлены схемы оптимальной системной антибактериальной терапии ожоговой болезни (табл. 1 и 2).
На сервисе СпросиВрача доступна консультация хирурга онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Здравствуйте, Ксюша, ещё раз !
Если это возможно, то сделайте, пожалуйста фото ожога из нескольких ракурсов и прикрепите к вопросу ! Мне нужно знать приблизительную площадь и глубину ожога !
Если у мамы дома имеется амбулаторная карта или сертификат прививок, то посмотрите , пожалуйста, когда в последний раз она была привита против столбняка !
Яков, здравствуйте, прививку не делала никогда, фото в разных ракурсах смогу прикрепить только после 22:30 по московскому времени, прививку от столбняка обязательно нужно делать при ожогах кипятком? Пьем антибиотик

По поводу фото ,ничего страшного нет, торопиться некуда , подождём ! Ничего страшного,что время будет позднее , я отвечу !
Теперь ,что касается столбняка ! Уже прошло 7 дней с дня получения ожога , потому вероятность того, что она может заболеть , - ничтожно мала , т. к. инкубационный период столбняка хоть и колеблется от 2-х дней до 3- х недель, но в подавляющем большинстве случаев он составляет 2 - 7 дней !
Но если чётко выполнить приказ по столбняку , то вводить нужно обязательно и более того, если она не прививалась более 10 лет , то нужно сразу 2 препарата : ПСС (Противостолбнячная Сыворотка ) И АС (Анатоксин Столбнячный ) !
Дело в том , что столбняк включен в национальный календарь прививок и в плановом порядке, начиная с детского возраста люди прививаются ! А когда случается экстренная ситуация, как в Вашем случае, то принимается решение исходя из следующего правила :
- ЕСЛИ ЧЕЛОВЕК С ДЕТСТВА РЕГУЛЯРНО ПРИВИВАЛСЯ ПРОТИВ СТОЛБНЯКА И ПОСЛЕ ПОСЛЕДНЕЙ ПРИВИВКИ ПРОШЛО НЕ БОЛЕЕ 5 ЛЕТ, ТО НЕТ НЕОБХОДИМОСТИ ЕМУ ПРИВИВАТЬ ;
- ЕСЛИ ПОСЛЕ ПОСЛЕДНЕЙ ПРИВИВКИ ПРОШЛО ОТ 5 ДО 10 ЛЕТ, ТО НУЖНО ПРИВИВАТЬ И ДЕЛАЕТСЯ ТОЛЬКО ОДИН УКОЛ , - СТОЛБНЯЧНЫЙ АНАТОКСИН ;
- ЕСЛИ ПОСЛЕ ПОСЛЕДНЕЙ ПРИВИВКИ ПРОШЛО БОЛЕЕ 10 ЛЕТ, ТО ТАКОЙ ЧЕЛОВЕК РАСЦЕНИВАЕТСЯ КАК НЕ ПРИВИТЫЙ , СЛЕДОВАТЕЛЬНО СНАЧАЛА ВВОДИТСЯ ПРОТИВОСТОЛБНЯЧНАЯ СЫВОРОТКА И СЛЕДОМ, - СТОЛБНЯЧНЫЙ АНАТОКСИН.
ПРИВИВКИ ПРИ ПОВРЕЖДЕНИЯХ ДОЛЖНЫ ВЫПОЛНЯТЬСЯ В МАКСИМАЛЬНО РАННИЕ СРОКИ , НО НЕ ПОЗДНЕЕ 21 СУТОК !
Я, Вам написал как нужно по правилам и одновременно говорю свою позицию, что если за неделю не случилось ничего, то и дальше маловероятно ,что можете заболеть столбняком!
Сходить в больницу, сделать или нет, - оставляю на Ваше усмотрение !
Что же касается лечения , то я подробно Вам напишу после просмотра фото !

Вы уже поместили фото !
Ожог глубокий , в основном третьей "А", местами, - третьей "Б"степени ! Третья "Б" означает ,что кожа обожжена на всю толщину , заживать будет долго (около месяца ) и после себя оставит не грубый , но рубец !
Я, про столбняк Вам уже написал, полагаю ,что было бы правильнее если бы Вы обратились к хирургу для решения сразу 2 - х задач :
- В СТЕРИЛЬНЫХ УСЛОВИЯХ, СТЕРИЛЬНЫМИ ИНСТРУМЕНТАМИ УДАЛИТЬ ОСТАТКИ ОТСЛОИВШЕГОСЯ ЭПИДЕРМИСА ;
- РЕШЕНИЕ ВОПРОСА С СТОЛБНЯКОМ .
Определяйтесь, пожалуйста будете обращаться в больницу или нет , чтобы мне знать какой объём помощи Вам пошагово написать !

Лечение :
- ПЕРЕД ПЕРЕВЯЗКАМИ , МИНУТ ЗА 30 - 40 МАМА ПУСТЬ ПРИНИМАЕТ ЛЮБОЙ ОБЕЗБОЛИВАЮЩИЙ ПРЕПАРАТ, КОТОРЫЙ ОНА ПРИНИМАЛА РАНЕЕ И ЗНАЕТ, ЧТО ПЕРЕНОСИТ ХОРОШО (Если не принимала ранее ничего, то могу порекомендовать КЕТОНАЛ по 50МГ.) ;
- НАДЕВАЙТЕ ВЫ МАСКУ, ОБРАБОТАЙТЕ ВАШИ РУКИ , ОБЫЧНЫЕ СРЕДНИХ РАЗМЕРОВ НОЖНИЦЫ И ПИНЦЕТ (Если нет медицинского пинцета, то можно из набора косметики) ЭТИЛОВЫМ СПИРТОМ , ЕСЛИ ЕГО НЕТ , ТО ДВАЖДЫ ОБИЛЬНО ОБРАБОТАЙТЕ ВОДКОЙ ;
- ПОСАДИТЕ МАМУ НА ДИВАН , ПОЛОЖИТЕ НОЖКУ НА СТУЛ ПЕРЕД ДИВАНОМ ;
- ОБИЛЬНО ПРОМОЙТЕ РАНУ И ОКРЕСТНОСТИ РАСТВОРОМ МИРАМИСТИНА ИЛИ ХЛОРГЕКСИДИНА И СРАЗУ ЖЕ ВСЁ ПРОСУШИТЕ СТЕРИЛЬНЫМИ МАРЛЕВЫМИ САЛФЕТКАМИ ;
- ПИНЦЕТОМ АККУРАТНО , НО РИСКОВАННО БЕРЁТЕ ЗА ПРОВИСАЮЩИЕ КРАЯ ОТСЛОИВШЕГОСЯ ЭПИДЕРМИСА (В центральной части раны её нет, она уже удалилась ! речь идёт только о сохранившихся остатках, идужиз в заднем направлении, к ахиллово сухожилию и в нижнем направлении в сторону стопы ! ) И ЛИБО ТАК ПИНЦЕТОМ И ОТРЫВАЕТЕ , ЛИБО МЕСТАМИ ИСПОЛЬЗУЕТЕ НОЖНИЦЫ (Не переживайте, это не больно, т. к. в эпидермисе живых нервных окончаний нет) ;
- ПОСЛЕ УДАЛЕНИЯ ЭПИДЕРМИСА РАНУ ЕЩЁ РАЗ ПРОМЫВАЕТЕ МИРАМИСТИНОМ , ОБИЛЬНО , С ПОМОЩЮ ШПАТЕЛЧЯ НАНОСИТЕ МАЗЬ ЛЕВОМЕКОЛЬ ИЛИ ЛЕВОСИН НА МАРЛЕВЫЕ САЛФЕТКИ (достаточно, 2 -х салфеток) , САЛФЕТКИ С МАЗЬЮ ПРИКЛАДЫВАЕТЕ К РАНЕ , ПОВЕРХ НИХ КЛАДЁТЕ ЕЩЁ 2 , НО СУХИЕ САЛФЕТКИ И НЕ ТУГО БИНТУЕТЕ ;
- В ДАЛЬНЕЙШЕМ , ПЕРЕВЯЗКИ , ПОНЯТНО, ЧТО УЖЕ БЕЗ ПРОЦЕДУРЫ СРЕЗАНИЯ ЭПИДЕРМИСА , ЕСЛИ СЕГОДНЯ ВАМ УДАСТСЯ ИХ СРЕЗАТЬ , ПОВТОРЯЕТЕ 2 РАЗА В ДЕНЬ ;
- ДЛИТЕЛЬНОЕ СТОЯНИЕ НА НОГАХ ИЛИ ДЛИТЕЛЬНОЕ СИДЕНИЕ С СВИСАНИЕМ НОГИ ВАМ НЕ ЖЕЛАТЕЛЬНО, А КОГДА ЛЕЖИТЕ, ТО ЛУЧШЕ НОГУ ДЕРЖАТЬ ЧУТЬ ВЫШЕ УРОВНЯ ВАШЕГО ТЕЛА, НАПРИМЕР, НА ПОДУШКЕ , НО В ТО ЖЕ ВРЕМЯ АКТИВНОСТЬ НУЖНА (ПОХОДИТЬ ПО КОМНАТЕ , ПРОЯВЛЯТЬ АКТИВНОСТЬ НОГАМИ В ПОЛОЖЕНИИ ЛЁЖА, - КРУТИТЬ"ВЕЛОСИПЕД") ;
- СУПРАКС 400МГ. , ПО 1 КАПСУЛЕ 1 РАЗ В ДЕНЬ , 6 ДНЕЙ (Это сильный антибиотик из группы ЦЕФАЛОСПОРИНОВ) .
Вот такое лечение на ближайшие 7 - 10 дней , а потом посмотрим, будет видно по ситуации !
Если ,что не понятно , в процессе лечения , - напишите !
Удачи Вам !
Рана в целом спокойная, но по всей верятности глубокая. Поэтому аб все же лучше подавать. Супракс переносится хорошо. Аналог Амоксиклава Аугментин. Если найдете можно его. Но клавулановая кислота в составе очень часто дает зеленый жидкий стул. Поэтому я за Супракс. Заклевать пока не начнет формироваться рубчик, чтобы не занести инфекции. Следуйте рекомендации(с Мирамистином или Хлоргексидином).



Здравствуйте
Вам назначили хороший,безопасный аб,просто его принимают 5-7дней и в дозировке 250-действительно 3раза в день.
Иногда врач находится в рамках протокола,согласно которому можно назначить только конкретный антибиотик
Можно заменить на иную группу-сумамед по 500-однократно,по сути три дня,но иногда продлевают до 6 дней.
Выздоравливайте


Посмотрела фото-лучше оставить Амоксиклав
Обработка раны-ежедневная до следующего визита к хирургу на осмотр


Здравствуйте. Короче курс- не значит лучше. Амоксициллин хороший антибиотик, активен в отношении многих микроорганизмом и в Вашем случае тоже будет эффективен. Использовать более сильные антибиотики - возможность получить нечувствительность микроорганизмов к ним при других инфекцекциях. 250 мг амоксициллина-это детская доза. Вы можете купить 500 и просто делить таблетку на 2 приема

Амоксиклав самый правильный при ранах.Пейте 5 дней, если не будет нагноения, то достаточно 5 дней. Перевязки 1 раз в день, либо то, что написал доктор, либо мы рекомендуем мазь левомеколь.

Раньше антибиотик присоединялся,если рана имела признаки воспаления.Считаю не обоснованным назначение антибиотика.Достаточно местной обработки.

Здравствуйте!
При таких ранах назначение антибиотикотерапии обязательно.Антибиотик назначили хороший.Если не можете найти данную дозировку,то можно просто приобрести 500мг и делить напополам,либо можно заменить на Флемоксин салютаб.Просто совместно с антибиотиком принимайте хилак форте например.Наблюдение и перевязки должны быть в стоматологической поликлинике по месту жительства,у хирурга-стоматолога.Областью лица занимается стоматология.Холод местно первые 3 суток по 10мин через каждые 2 часа по возможности(обязательно через ткань).При болях нурофен.
Мария, спасибо за ответ, ничего страшного если начнем принимать антибиотик завтра днём? сегодня не купили уже. И ещё подскажите, останется ли шрам от такой раны?

Да,можете начать с завтрашнего дня,только обязательно.Рубец конечно будет,но учитывая возраст,у деток все лучше восстанавливается,в будущем будет практически незаметен.Нужно будет во время восстановления(т.е когда еще наложены швы) и после эпителизации пройти курс физиолечения и будет как будто ничего и не было.

Магнитолазер когда швы, лазер сразу после снятия швов и очень хорошо электрофорез с лидазой через время,когда рубец в стадии формирования,можно сделать и в течении 4 месяцев,не обязательно сразу.

Наталия, здравствуйте !
Доктор прав как в вопросе назначения антибиотика , так и в его суточной дозе ! Единственное , что можно было бы изменить , - это количество дней приёма ! Их можно сократить до з- х !
Антибиотик нужен, т. к . кроме наличия самой раны имеется гематома, распространяющаяся на верхнее веко ! Как правило, гематомы рассасываются, но без антибиотика , есть риск её нагноения , а этого допустить нельзя, т. к. т.к. рубец будет грубый ,сильно заметный !
Что касается выбора самого антибиотика , то тоже удачный , т. к. антибиотики пенициллинового ряда к которому относится Амоксиклав токсичностью никакой не обладают !
Всё правильно , продолжайте лечение , сократив количество дней приёма до 5!
Удачи Вам !
Возникнут вопросы, - напишите !
Читайте также:

