Антитела против вируса вич
Обновлено: 18.04.2024
Егор Воронин — нью-йоркский вирусолог, специалист в области вакцинопрофилактики. Более двадцати лет он занимался исследованиями ВИЧ, его эволюцией и репликацией. С 2018 по 2020 год он возглавлял биотехнологическую компанию Worcester HIV Vaccine, занимающуюся разработкой вакцины от ВИЧ. В своем блоге shvarz Егор публикует массу интересных фактов о вакцинах, ВИЧ, о вирусах в целом, а в последние полтора года и о новом коронавирусе: он умеет рассказывать простым языком о сложном.
— Наверное, тот факт, что сейчас все следят за вакцинами, позволит объяснить это проще.
— Это единственная проблема?
— Нет. Вторая проблема: как мы все уже знаем в отношении коронавируса — созданные против него вакцины хорошо предотвращают тяжелое течение болезни и смерть, но гораздо хуже защищают от заражения. Для COVID-19, как все же быстротечной болезни, это нормально: даже если вирус попадет в привитый организм, он не вызовет тяжелую болезнь, организм силами иммунной системы быстро его поборет, и человек скоро выздоровеет, вирус исчезнет.
С ВИЧ же совершенно другая ситуация. Он приспособлен к тому, чтобы жить в организме очень долго и ускользать от иммунной системы годами. Если мы не предотвратили его попадание в организм, то без терапии он будет в нем реплицироваться и в конце концов вызовет СПИД. Будучи привитыми от коронавируса, вы можете все равно им заразиться, но лишь чуть-чуть поболеете или даже не заметите, что вирус был, организм его вычистит, — а с ВИЧ это не работает. На ранних этапах разработки вакцин пытались измерять их эффективность именно по способности предотвращать не заражение ВИЧ, а последующее развитие СПИДа, но сейчас уже ясно, что если ВИЧ попал в организм, то без терапии СПИД неизбежно разовьется. Значит, в отношении ВИЧ нам нужна вакцина, которая будет полностью предотвращать само попадание вируса в организм, а это гораздо более высокая планка.
— Но с точки зрения обывателя все кажется просто: есть вирус ВИЧ, он выделен и хорошо известен. Так возьмите его, убейте, и убитый, обезвреженный вирус введите человеку — пусть организм вырабатывает иммунный ответ. Ведь так делались все классические вакцины. На каком этапе оказалось, что с ВИЧ это не работает?
— Над вакциной от ВИЧ работают уже не первый десяток лет. При этом были сделаны какие-то побочные открытия, которые можно применять в других областях? Например, в нынешней борьбе с коронавирусом?
— Попытки создать вакцины от ВИЧ начались сразу же, как только вирус был впервые выделен. Пытались сделать вакцины на основе убитого вируса, на основе рекомбинантных белков, продолжают активно работать над векторными вакцинами. А когда появился COVID-19, практически все мои коллеги, кто занимался вакцинами от ВИЧ, перекинулись в область коронавируса. Я смотрю на научные статьи о коронавирусе — там все знакомые имена.
Я уже упоминал, что технология стабилизации спайкового белка была разработана для ВИЧ, это был один из главных прорывов в вакцинологии за последние десять лет, и она нашла отличное применение в вакцинах от COVID-19.
Известный вирусолог Барни Грэм, который занимался именно стабилизацией вирусного белка у ВИЧ и у респираторно-синцитиального вируса, сыграл важную роль в разработке одной из самых популярных в мире вакцин от COVID-19 компании Moderna.
Мишель Нуссенцвайг, который выделил нейтрализующие антитела к коронавирусу, разработал технологию выделения этих антител в ходе многолетних исследований антител к ВИЧ и вирусу иммунодефицита обезьян. Памела Бьоркман, ведущий специалист Caltech по структуре вирусных белков, раньше изучала в том числе и ВИЧ.
— Это известные имена, но применяются ли отработанные на ВИЧ методики?
— Сами методы тестирования на нейтрализующие антитела были разработаны для ВИЧ, а теперь применяются для COVID-19. В области тестирования вакцин существует огромная сеть клинических центров и лабораторий и в США, и в Африке, и по миру — она была создана для ВИЧ-инфекции, после начала пандемии ее просто взяли и перепрофилировали под коронавирус, а заведуют ею те же самые ученые.
С другой стороны, технологии, нашедшие применение в вакцинах от COVID-19, сейчас интересуют и исследователей ВИЧ: технология мРНК вакцин разрабатывалась и для ВИЧ, но сейчас работы в этой области существенно активизировались.
— Кто-нибудь из российских ученых занимается разработками вакцины от ВИЧ?
— В России разработки вакцин от ВИЧ ведутся, но их немного. Есть три исследовательские группы: в Москве, Петербурге и в Новосибирске. У них есть определенные наработки, но пока они не прошли дальше первой фазы испытаний.
Вопрос в большей мере этический. Раз уж существуют эффективные методы предотвращения ВИЧ-инфекции, то нельзя не делать их доступными участникам клинических испытаний. Но если мы предоставляем их всем участникам клинических испытаний (и плацебо-группе, и группе, получающей вакцину), то количество новых инфекций будет чрезвычайно мало в обеих группах, и эффективность вакцины будет невозможно измерить. Или придется делать испытания еще обширнее и еще длинней, что еще больше повысит их стоимость.
Перспективы разработки вакцины от ВИЧ тают с каждым днем именно потому, что сложно их тестировать, не подвергая людей риску заразиться в ситуации, когда есть готовые способы избежать этого риска. Но нельзя сказать, что ученые полностью потеряли надежду. Уже ведутся активные обсуждения новых подходов к проведению клинических испытаний ВИЧ-вакцин в будущем.

Борьба с вирусом иммунодефицита человека (ВИЧ) не прекращается, и пока он остается нерешенной проблемой человечества. Современные методы лечения продлевают жизнь инфицированных людей практически до продолжительности жизни здоровых, но при этом они лишь подавляют репликацию вируса, не позволяя добиться полного излечения. Некоторая доля зараженных ВИЧ клеток не погибает и становится латентным (скрытым) резервуаром вируса. Ученые из США разработали специальные антитела, направляющие цитотоксичные Т-клетки на атаку латентных ВИЧ-клеток. Перспективы прямого применения этого подхода не очевидны, но полученные результаты могут оказаться важным шагом на пути разработки средств и методов полного излечения от СПИДа.
По данным Всемирной организации здравоохранения, на конец 2014 года с момента определения вируса иммунодефицита человека в 1981 году в мире заразились ВИЧ-инфекцией более 70 миллионов человек. Из них более 35 миллионов умерли, почти 37 миллионов живут инфицированными. Из-за широкого распространения и относительно быстрого роста числа зараженных ВИЧ присвоен статус пандемии (см. Epidemiology of HIV/AIDS). Особенно широко ВИЧ распространен на юге Африки (в некоторых странах этого региона, например в ЮАР и Ботсване, заражено больше 20% населения). В России, по данным на начало 2016 года, зафиксировано около миллиона ВИЧ-инфицированных, но по статистике только около половины больных знает о том, что они заражены ВИЧ, так что реальная картина может оказаться гораздо хуже.
ВИЧ заражает клетки иммунной системы и перестраивает их функции под свои потребности. В результате иммунная система подавляется и развивается синдром приобретенного иммунного дефицита (СПИД). Организм больного теряет возможность защищаться от инфекций и опухолей. Без лечения человек, зараженный ВИЧ, погибает в течение 9–11 лет от так называемых оппортунистических заболеваний, с которыми здоровый организм обычно успешно справляется.
ВИЧ во внешней среде нестабилен и передается только через кровь или биологические жидкости. Заражение происходит через поврежденные кожу и слизистые оболочки или при медицинских процедурах. В цикле репродукции ВИЧ вирусная РНК с помощью вирусной обратной транскиптазы превращается в ДНК и включается в геном клетки (рис. 2). Затем она транскрибируется в РНК, которая направляет синтез вирус-специфических белков, обеспечивающих размножение вируса и формирующих вирусную частицу, которая затем отпочковывается от клетки.

На разработку вакцин против ВИЧ были брошены значительные силы и средства, но об окончательной победе остается только мечтать. Причины неудач — в удивительной способности вируса изменять иммунологические свойства и таким образом уклоняться от действия антител, индуцированных вакциной.
Впрочем, в последние годы достигнут значительный прогресс в поддержании качества жизни больных СПИДом. Применение высокоэффективной комбинированной терапии, направленной против вирусных обратной транскриптазы и протеазы, при условии своевременного диагноза заражения позволяет продлить жизнь инфицированных людей практически до продолжительности жизни здоровых. Но некоторая доля клеток, зараженных ВИЧ (примерно одна из миллиона), не погибает и остается латентным резервуаром вируса, в котором ДНК ВИЧ интегрирована в геном, — и если противовирусную терапию прекратить, резервуар может активироваться и болезнь возобновится. Поэтому терапию приходится продолжать на протяжении всей жизни зараженного человека. Но противовирусная терапия стоит весьма дорого и может быть сопряжена с нежелательными побочными эффектами. Поэтому разработка подходов для ликвидации ВИЧ-резервуаров весьма актуальна и с медицинской, и с экономической точки зрения.
Недавно два коллектива исследователей, независимо друг от друга, практически одновременно опубликовали статьи, в которых описали оригинальный подход для ликвидации латентных ВИЧ-клеток. Обе статьи подготовлены научными коллективами из США. В обсуждаемых работах сделана попытка подойти к решению этой проблемы с помощью биспецифических антител (bi-specific antibodies).
Разработку биспецифических антител можно считать одним из наиболее важных достижений последнего времени в иммунологии и медицине, особенно в лечении онкологических заболеваний. Такой подход к лечению стали изучать в середине 80-х годов ХХ века, и довольно быстро исследования in vitro показали, что у него большой потенциал. В отличие от обычных природных антител (рис. 3), биспецифические антитела представляют собой искусственные белковые конструкции состоящие из фрагментов двух различных антител (рис. 4) и поэтому связывающиеся с двумя различными антигенами. Наиболее часто и успешно они используются для лечения рака. В этих случаях они чаще всего устроены так, что связывают цитотоксические Т-клетки (T-киллеры) иммунной системы (по их поверхностному антигену CD3) с раковыми клетками-мишенями, подлежащими уничтожению (по их поверхностному антигену).





Рис. 6. А, B — схема строения искусственно сконструированных биспецифических антител к антигену CD3 цитотоксических Т-клеток и поверхностному антигену ВИЧ; вариабельный домен из тяжелой белковой цепи (VH) соединен с вариабельным доменом из легкой цепи (VL). C — схема атаки клеток, зараженных ВИЧ. Изображение из обсуждаемой статьи J. Sung et al.
Авторы обеих работ полагают, что созданные ими биспецифические антитела потенциально могут стать эффективным иммунотерапевтическим средством для истребления латентных резервуаров ВИЧ. И научное сообщество, и общество в целом должны приветствовать и поддерживать исследования, направленные на полное излечение от ВИЧ. Но в данном случае перспективы клинического применения описанного подхода пока не вполне очевидны, необходимы дополнительные детальные исследования. Описанные исследования проводились in vitro, и неизвестно, в какой мере достигнутые эффекты будут иметь место в организме. Известно, что иммунотерапия с помощью чужеродных антител вызывает в организме иммунный ответ, направленный против этих антител. И такой побочный эффект действительно наблюдался группой A. Pegu et al. в опытах на обезьянах.
Агент, который бы индуцировал продукцию антигенов ВИЧ в латентно зараженных клетках, не повреждая при этом здоровые клетки, пока неизвестен. Более того, латентные резервуары ВИЧ могут находиться, например, в центральной нервной системе, куда проникновение белковых молекул затруднено из-за наличия гематоэнцефалического барьера. В общем, до применения полученных результатов пока очень далеко, и необходимо провести еще много исследований. Тем не менее, обсуждаемые работы представляются важным шагом на пути разработки средств и методов полного избавления от ВИЧ.
Источники:
1) Julia A. M. Sung et al. Dual-Affinity Re-Targeting proteins direct T cell-mediated cytolysis of latently HIV-infected cells // The Journal of Clinical Investigations. 2015. V. 125. P. 4077–4090.
2) Amarendra Pegu et al. Activation and lysis of human CD4 cells latently infected with HIV-1 // Nature Communications. 2015. V. 6. Article number: 8447.
3) Douglas D. Richman. HIV: Cure by killing // Nature. 2015. V. 528. P. 198–199. (Популярный синопсис к обсуждаемым статьям.)
Вячеслав Калинин
Снеер 17.02.2016 12:32 Ответить
ВИЧ/СПИД - РЕАЛЬНОСТЬ ИЛИ ВЫМЫСЕЛ?
Борьба со СПИДом идёт во всём мире уже более 30 лет. Однако, есть и такое мнение, что вируса иммунодефицита человека не существует в природе, и поэтому вся эта борьба совершенно бессмысленна.
Это альтернативное мнение разделяют тысячи людей по всему миру, включая известных учёных, врачей, журналистов, а также тех, кто лично столкнулся с этой проблемой, получив диагноз ВИЧ-инфекция, или этот диагноз был поставлен их близким.
Большинству людей практически ничего не известно об этом альтернативном мнении. И когда им предлагают, а зачастую можно сказать навязывают пройти обследование на ВИЧ-инфекцию, они делают это, совершенно не зная о том, какие последствия может вызвать это обследование. Причём эти последствия могут оказаться весьма и весьма неприятными, и даже трагическими.
Противники официальной теории ВИЧ/СПИДа считают, что тестирование на ВИЧ необходимо немедленно прекратить, а также прекратить назначение ВИЧ-позитивным пациентам так называемой антиретровирусной терапии против ВИЧ. По их мнению, эта практика, основанная на ложной ВИЧ/СПИД-теории, не несёт населению ничего, кроме геноцида.
Чтобы каждый человек смог самостоятельно разобраться в этой проблеме, и сделать для себя свои собственные выводы, и решить, стоит ли ему когда-либо тестироваться на ВИЧ-инфекцию или принимать лекарственные препараты против ВИЧ, стоит ознакомиться с этим альтернативным мнением. Ниже по ссылкам Вы можете найти 6 книг, 6 статей и 6 фильмов, достаточно подробно раскрывающих это мнение.
Если ранее Вы были абсолютно уверены в истинности официальной ВИЧ/СПИД-теории, то Вам стоит обратить внимание на эти материалы, чтобы избежать возможных негативных последствий, связанных с тестированием на ВИЧ или приёмом антиретровирусной терапии.
protopop " />
Снеер 17.02.2016 15:40 Ответить
Grecko " />
Снеер 19.02.2016 22:04 Ответить
Докажите делом, сходите в центр ВИЧ-профилактики, введите себе пару кубиков инфицированной крови и ни в коем случае не начинайте антиретровирсную терапию. Если это всё "миф" и "заговор", то Вам ничего не грозит, кроме всемирного признания и Нобелевки за опровержение вирусной теории ВИЧ/СПИД. Как, слабО?
aa 19.02.2016 01:04 Ответить
Может не совсем по теме - но так, задумался. Мы все знаем, что человек не может жить без кожи. Не только человек, но всякий зверь, даже гидра имеет свою примитивную кожу. Если объяснения появления мембраны у клетки еще как -то есть, например, пропусканием ультразвука
через раствор - подобие "липосом". Но то далекое и очень далекое подобие реальной клеточной мембраны. А как же быть с многоклеточными? Неужели, появление "кожи" объясняется только через начальный "симбиоз"? Конечно, мы то знаем, что мир был сотворен Богом. Но иногда интересно немного пофантазировать и конечно, теория эволюции является подходящей.
Gli4i " />
aa 20.02.2016 18:21 Ответить
aa 19.02.2016 01:10 Ответить
Хотя, в наше время, наверно, даже школьнику ясно, что если человек говорит, что все появилось случайно, а сам не сможет "создать" даже блошиной лапки - то тот человек просто умничает, либо шутит.
Grecko 19.02.2016 22:02 Ответить
Но если ВИЧ постоянно мутирует, то а) в организме с большой вероятностью одновременно будут сосуществовать несколько генетически различных линий вируса, и как результат б) данные антитела либо не будут действовать вообще, либо будут быстро "выдыхаться" в силу "генетического убегания" вируса. По-моему, это гораздо более серьёзный барьер для их перспективы, чем гематоэнцефалический.
Перед тем как говорить о вакцине против ВИЧ, стоит начать с более общего вопроса: что мы понимаем под прививками и вакцинами с научной точки зрения?
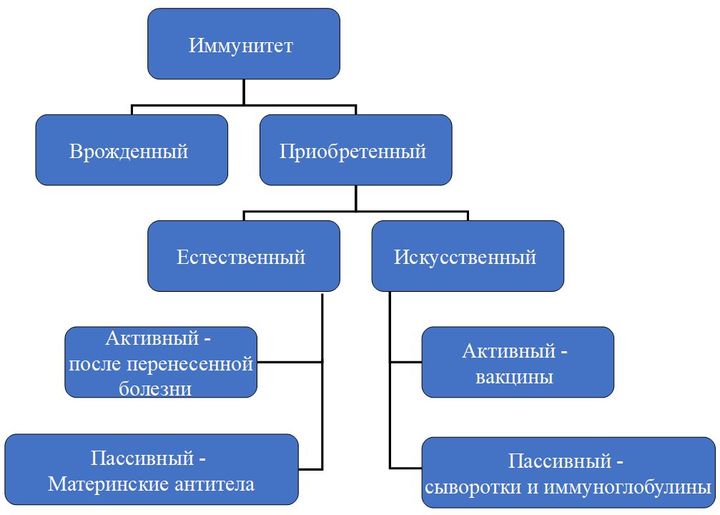
По механизму возникновения иммунитет делится на два вида: врожденный и приобретенный. Первый есть у каждого человека с рождения, он выработан эволюционно. Благодаря нему человек не болеет многими болезнями, которыми, например, страдают животные.
Второй возникает в течение жизни и у каждого может отличаться в зависимости от того, с какими возбудителями человеку довелось встретиться.
по теме
Лечение
Как устроен иммунитет: Объясняем по пунктам
Приобретенный иммунитет может быть активным (он возникает вследствие реакции организма на перенесенную болезнь, присутствие возбудителя в организме), а может быть пассивным, когда антитела, например, передаются от матери ребенку во время беременности.
Именно по этим антителам, как правило, и ставится диагноз, если мы пользуемся экспресс-тестами. В случае с ВИЧ существует и пассивный иммунитет. Но при передаче вируса от матери ребенку, к сожалению, он не обладает достаточным защитным эффектом.
Еще одно направление — это искусственный иммунитет. Он тоже бывает активным и пассивным. Пассивный — это иммуноглобулины, выработанные либо у лабораторных животных, либо у других иммунизированных лиц, и сыворотки. Активный же достигается собственно путем вакцинации.
Вакцины бывают профилактические (защитные) и лечебные. Они различаются по типу воздействия на организм и по своим результатам.
Пассивный иммунитет возникает быстрее, сразу после того, как в организм ввели чужие антитела. Однако он бывает совсем недолговременным. Активный иммунитет держится долго, чаще — пожизненно, но и возникает не сразу.
Иммунный ответ: как это все работает?
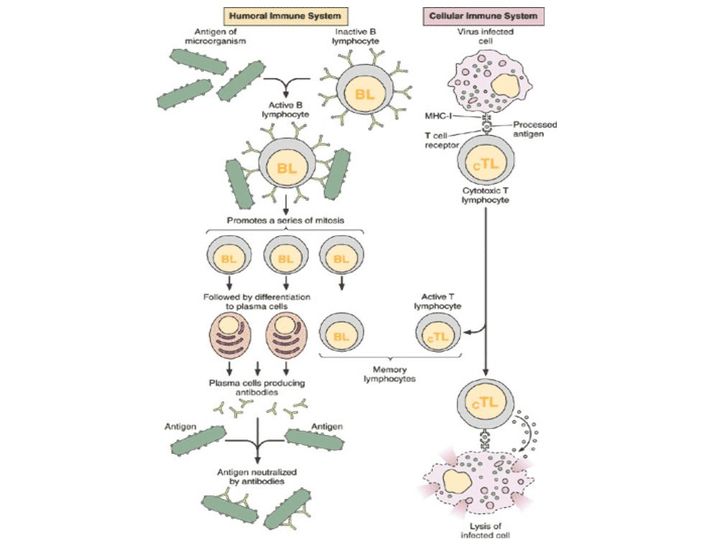
Ученые обычно говорят о гуморальном и клеточном иммунитете. Принцип работы гуморального заключается в следующем: в нашем организме есть специальные клетки — лимфоциты. Они постоянно циркулируют в крови и проверяют все, что попадается им на пути, по принципу свой/чужой.
по теме

Лечение
Гид по вакцинам. Когда и какую прививку сделать? А главное: надо ли вообще прививаться? (Спойлер: конечно, надо)
Например, антитела к ВИЧ-инфекции появляются где-то через месяц после заражения, соответственно, все это время вирус может циркулировать в организме. Почему они неэффективны? Во-первых, потому что появляются слишком поздно.
Во-вторых, потому что вирус, с которым мы имеем дело, очень изменчив. Если даже В-клетки обнаружили его антиген, выработали к нему антитела, способные нейтрализовать заразу, то за время, которое ушло на все это, сам вирус успевает мутировать и оказаться неуязвимым для выработанного организмом оружия.
Когда мы говорим о клеточном иммунитете, речь идет об уничтожении тех вирусов, которые преодолели гуморальный барьер и успели забраться в саму клетку.
Клетки CD4 частично регулируют весь процесс и выполняют функцию клеток памяти. Их принято называть хелперами. CD8 — собственно занимаются уничтожением, за это их зовут киллерами.
ВИЧ — единственный вирус, который поражает не просто клетки организма, а собственно клетки иммунной системы. Той самой, которая с вирусом должна, по идее, бороться.
Именно поэтому против ВИЧ-инфекции иммунитет не может сработать так, как это было бы с любым другим вирусом.
Какие возникают трудности при создании вакцины против ВИЧ?
На данный момент в рамках более ста испытаний уже протестировано более сорока видов вакцин с участием тысяч добровольцев, и есть целая система, в которой регистрируются все исследования по вакцинации от ВИЧ.
Последнее время в разного рода СМИ регулярно появляется информация, что той или иной компанией разрабатывается новая вакцина против ВИЧ. Однако обнадеживающих результатов не так уж и много. Почему?
На конференции Кори, руководивший исследованием (исследование назвали AMP — the Antibody Mediated Prevention Trial, исследование профилактики с помощью антител), рассказал, что в течение 20 месяцев участники каждые 2 месяца получали инъекции антител VRC01 внутривенно. И хотя эти антитела не защищают от большинства штаммов ВИЧ (только 30 % штаммов чувствительны к ним), это первый случай в истории, когда показано, что вещество, производимое человеческим организмом, может предотвращать инфицирование ВИЧ.
Конечно, нейтрализующие антитела, используемые в этом исследовании, были получены в лаборатории, но в отличие от большинства фармацевтических препаратов, они могут естественным образом вырабатываться в теле человека.
Что такое нейтрализующие антитела широкого спектра действия и что эти результаты означают для профилактики ВИЧ?
Широкий спектр действия этих антител критически важен, поскольку ВИЧ постоянно мутирует. Существует много штаммов ВИЧ, и для борьбы с ними важно иметь вид антител, нейтрализующих сразу многие штаммы или соответствующую смесь антител:
Работающий и безопасный метод
Двойное слепое рандомизированное контролируемое исследование AMP показало, что введенные антитела в 74 % случаев защищали от 30 % штаммов ВИЧ, воздействию которых подвергались участники исследования.
Это может показаться небольшой победой, но это очень важный результат. Впервые было показано, что использование нейтрализующих антител широкого спектра является работающим и безопасным методом профилактики ВИЧ.
Как и с препаратами АРВТ, используемыми в комбинации, ученые считают, что потребуется коктейль из нескольких видов нейтрализующих антител для обеспечения защиты от широкого спектра штаммов вируса, говорит Беккер.
Отбор самых эффективных антител
По словам Уоррена, это принципиально важно, поскольку «невозможно тестировать все имеющиеся комбинации антител, тратя на каждое испытание по 100 миллионов долларов, поэтому нам нужен способ отбора тех антител, которые вообще имеет смысл тестировать в более крупных исследованиях.
Улучшение применимости метода в реальных условиях
Насчет возможности использования нейтрализующих антител для предотвращения ВИЧ-инфекции есть другие вопросы, которые пока остаются без ответа.
По словам Беккер, способ введения антител следует модифицировать, чтобы сделать методику более легкодоступной: например, сделать инъекции подкожными (именно так вводят себе инсулин люди с диабетом), чтобы их могли вводить как сами пациенты, так и медработники.
Другая проблема — частота введения. Как говорит Кори, в текущих исследованиях уже изучают, будут ли инъекции антител каждые 4 или 6 месяцев (а не каждые 2, как было показано в AMP) так же эффективны для предотвращения инфекции. Это особенно важно для жителей таких стран, как ЮАР, где у многих людей нет возможности часто посещать клинику.
Какое место займут антитела в современной профилактике ВИЧ?
Но зачем вообще инвестировать в разработку нейтрализующих антител, если у нас уже есть антиретровирусные препараты для профилактики ВИЧ (так называемая доконтактная профилактика), эффективность которых при правильном применении приближается к 100 %? Особенно учитывая, что стоимость производства антител остается относительно высокой. Другими словами, какое место могут занять нейтрализующие антитела в современном инструментарии профилактики ВИЧ?
Уоррен настроен более оптимистично и считает, что стоимость антител снизится, как это произошло с препаратами АРВТ: когда только они появились на рынке, большинство людей в мире не могли их себе позволить, но благодаря популяризации и политическому давлению их стали продавать по цене, доступной для многих стран.
Роль в лечении
Еще одна захватывающая идея, исследуемая учеными, состоит в том, могут ли нейтрализующие антитела играть роль в лечении ВИЧ.
Но что это значит для обычного человека? Как долго нам придется ждать, пока нейтрализующие антитела появятся в наших клиниках?

Новость
Комплекс-белок Cas9/sgRNA/viral RNA (слева) и модель вируса иммунодефицита человека (справа), построенная коллективом Visual science.
Автор
Редактор

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсор публикации этой статьи — Виктор Татарский.
Врага нужно знать в лицо
Об иммунитете, апоптозе и вообще.
Иммунная система развивалась сотни миллионов лет. По типу реакции ее обычно делят на врожденный (неспецифичный) и приобретенный (специфичный) иммунитет [1], [2]. Считается, что специфичный (то есть вырабатываемый к конкретному патогену) иммунитет впервые появился у челюстноротых (рыб и всех вышестоящих по эволюционному древу таксонов) после отделения от бесчелюстных (миног и миксин), хотя у вторых имеется аналогичная система защиты [3]. К клеткам специфичного иммунитета относят В-лимфоциты, Т-лимфоциты и NK-клетки (естественные киллеры, natural killer cells). Помимо этого существуют моноциты, которые хоть и не являются истинными инструментами приобретенного иммунитета, однако выполняют некоторые функции по нейтрализации патогена: фагоцитоз, презентация антигена, выделение бактерицидных веществ и цитокинов.

Рисунок 1. Взаимодействия Т-киллеров (слева) и Т-хелперов (справа) с зараженными клетками. Для передачи сигнала о заражении необходимо выполнение двух условий: контакт комплекса МНС-патоген с TcR (T-cell Receptor, рецептор Т-клеток) и CD. Двигаясь по организму, Т-лимфоциты проверяют каждую клетку на предмет наличия у нее антигена в комплексе с МНС. Их можно сравнить с подслеповатой глуховатой бабушкой, пришедшей забирать дитятко из детского сада. Для опознания ей надо подойти вплотную и по нескольким (в данном случае по двум) признакам определить, ее ли это чадо или нет.
Т-лимфоциты, в свою очередь, необходимы для уничтожения клеток, зараженных внутриклеточными паразитами, и опухолевых клеток. Они делятся на два основных типа в зависимости от класса рецепторов, находящихся на внешней стороне их мембраны.
Т-киллеры несут CD8 рецепторы и отвечают за:
Т-хелперы имеют CD4 рецепторы и ответственны за секрецию цитокинов, которые:
- активируют макрофаги для борьбы с внутриклеточными паразитами;
- способствуют продукции антител В-лимфоцитами.
Но не менее важна роль Т-хелперов в подготовке зрелых Т-киллеров из клеток-предшественниц, активации NK-клеток и моноцитов.
Как же происходит опознавание антигена на молекулярном уровне? Здесь надо упомянуть еще об одном очень важном классе рецепторов — МНС (Major Histocompability Complex или главном комплексе гистосовместимости). Они бывают двух классов: I и II. МНС I присутствует на поверхности всех ядерных клеток организма человека. Он необходим для опознавания клетки натуральным киллером и Т-киллером (рис. 1, 2). Если по какой-то причине МНС I изменен, несет на себе антиген или отсутствует, клетка будет подвергнута апоптозу. МНС II находится на поверхности В-лимфоцитов, макрофагов и дендритных клеток. Он необходим для презентации антигена Т-хелперам (рис. 1, 2). Жизнь пула Т-хелперов можно представить как прогулку с ребенком в зоопарке, только вместо животных — антигены, вместо ребенка — Т-хелпер, а вместо взрослых, объясняющих, кто есть кто, — три перечисленных типа клеток.

Рисунок 2. Процесс передачи сигнала Т-киллеру и Т-хелперу. Первый этап — сборка комплекса МНС-антиген, второй этап — презентация комплекса на поверхности клетки.
Первый этап проникновения вируса в клетку — взаимодействие вирусного белка gp120 (рис. 3) с рецептором CD4. Отсюда понятно, почему ВИЧ размножается именно в Т-хелперах. Взаимодействию способствуют корецепторы CCR5 и CXCR4 [8]. В норме они являются рецепторами цитокинов, а при взаимодействии ВИЧ с клеткой их связь является необходимым условием проникновения вируса внутрь. Мутации в генах этих рецепторов обеспечивают частичную устойчивость носителей таких мутаций (таких людей около 2%, причем некоторые штаммы вируса все равно могут их поражать) [9]. Затем в мембрану клетки погружается белок gp41, после чего мембрана вируса сливается с клеточной, и происходит распаковка генетического материала. По принципу обратной транскрипции с РНК-матрицы вируса с помощью фермента ревертазы (обратной транскриптазы) синтезируются молекулы кДНК (комплементарной ДНК). Синтезированная кДНК вставляется вирусной интегразой в геном клетки хозяина. После попадания в геном хозяина вирус может никак себя не проявлять до нескольких лет — протекает так называемый инкубационный период. Только когда клетки активно пролиферируют, а значит, синтезируют белки на матрице ДНК, начинается сборка вирусных частиц , выход их из клеток и гибель последних (так как каждая частица забирает с собой часть клеточной мембраны клетки, вирусы попросту разрывают клетку).

Рисунок 3. Строение ВИЧ. Белки gp120 и gp41 участвуют в рецепции вируса клеткой и проникновении вирусной частицы внутрь. Липидная оболочка захватывается от клетки хозяина вместе с частью мембранных белков. Белки матрикса синтезируются в клетке после встраивания кДНК в геном в момент наработки клеточных белков для деления. Протеаза, возможно, необходима для разрезания противоапоптотического фактора Bcl-2 [9]. Ферменты обратная транскриптаза и интеграза создают кДНК на матрице РНК и встраивают кДНК в геном Т-хелпера соответственно. Tat — белок, вовлеченный в индукцию апоптоза. Нуклеокапсид — комплекс из РНК и белков вируса, представляющий собой компактную упакованную форму генома. Капсид — белковая оболочка, защищающая содержимое от воздействия внешних условий.
Как иммунитет бактерий правит геномы
Система редактирования геномов CRISPR/Cas известна уже довольно давно (впервые локус описал в 1987 году Есизуми Исино из университета Осаки), но только недавно (в 2005 году) ученые поняли ее истинное предназначение [11], [12].
Как вы уже поняли, система состоит из двух компонентов: CRISPR-локуса (Clustered Regularly Interspaced Short Palindromic Repeats или сгруппированные и регулярно разделенные короткие палиндромные повторы) и белков Cas, которые, являются нуклеотид-специфичными эндонуклеазами (а название получили за работу в команде с CRISPR — Crispr associated).
Помимо CRISPR-локуса и блока генов Cas в ДНК бактерии (не обязательно в нуклеоиде [12]) находится ген tracrРНК (transactivated crispr RNA), частично комплементарной палиндромам.
Для формирования специфичной устойчивости к вирусу бактерия, как и человек, должна встретиться с ним дважды.
Первый раз после внедрения вирусной ДНК в клетку происходит разрезание ДНК белками Cas1 и Cas2 на протоспейсеры и встраивание их в начало CRISPR-локуса. Cas1 и Cas2 формируют при этом комплекс, причем Cas2 играет только структурную роль, удерживая ДНК, тогда как Cas1 встраивает ее. Каждый протоспейсер вставляется в CRISPR-локус так, чтобы от другого (уже имеющегося) спейсера его отделял палиндром.
Соответственно, после транскрипции ДНК всего комплекса образуются три продукта (рис. 4):
- tracrРНК;
- РНК белка Cas (наиболее изученным является Cas9, поэтому далее повествование пойдет о нем), далее транслирующаяся;
- pre-crРНК (poly-spacer precursor crRNA или многоспейсерный предшественник crРНК), которая представляет собой транскрипт спейсеров, разделенных образовавшимися из палиндромов шпильками или петлями.

Рисунок 4. Строение CRISPR-локуса и результат транскрипции. leader — лидерная последовательность, отвечающая за начало транскрипции, со стороны которой вставляется новый спейсер. repeat — палиндромный повтор, который после транскрипции превращается в шпильку или петлю.
Второй этап — образование комплекса pre-crРНК/Cas9/РНКаза III. Очевидно, что вся длинная pre-crРНК не может участвовать в опознавании инвазивной ДНК, так как, во-первых, очень длинна, что конформационно неудобно, а во-вторых, при сравнении спейсеров РНК с протоспейсерами инвазивной ДНК длинный транскрипт начнет путаться и в итоге образует клубок, непригодный для дальнейшей работы. Самое логичное — разделить длинную последовательность на короткие участки, которые могли бы проверятся на соответствие инвазивной ДНК белком Cas9. И тащить за собой не надо, и не запутается.
С помощью фермента РНКазы III и при участии tracrРНК pre-crРНК разделяется по границам повторов так, что в белково-нуклеиновый комплекс входят один спейсер и один повтор, комплементарно связанный с tracrРНК (рис. 5) [13]. Повтор полностью теряет свою вторичную структуру, tracrРНК же оставляет несколько шпилек (обычно три).

Рисунок 5. Белково-нуклеиновый комплекс после созревания транскрипта. crРНК состоит из спейсера (слева) и повтора, соединенного с частью tracrРНК (справа). Три петли на tracrРНК нужны для удержания ее эндонуклеазой Cas9.
- комплементарность спейсера комплекса Cas9/crРНК/tracrРНК протоспейсеру инвазивной (например, вирусной) ДНК;
- наличие в геноме вируса около протоспейсера последовательности из трех нуклеотидов — РАМ (Protospacer Adjacent Motif, прилежащий к протоспейсеру мотив).
Таким образом клетка страхуется от уничтожения своей ДНК. Но даже просто разрезанная в одном месте вирусная ДНК может представлять опасность, поэтому завершает инактивацию негомологическое сращивание концов (non-homologous end joining, NHEJ). При этом происходит инсерция/делеция одного или нескольких нуклеотидов, что приводит к потере инфекционности.

Рисунок 6. Полная схема механизма работы CRISPR/Cas9 системы. а — Транскрипция CRISPR локуса с образованием pre-crРНК. б, в — Разрезание РНК РНКазой III и образование комплексов Cas9/tracrРНК/crРНК. г — Вторичное проникновение в клетку чужеродной ДНК. д — Соединение комплекса с инвазивной ДНК. е — Образование двухнитевого разрыва в протоспейсере.
А где же тут редактирование геномов? А вот где:
- во-первых, таким образом можно просто нокаутировать целевой ген и добиться прекращения экспрессии того или иного белка;
- во-вторых, после создания двухцепочечного разрыва в образовавшуюся брешь можно вставить нужный нам ген и заставить организм синтезировать нужный нам белок.

Рисунок 7. Сравнение искусственной (а) и естественной (б) систем CRISPR/Cas9. Отличие состоит лишь в том, что искусственная РНК едина, а природная — состоит из двух частей, гены которых разделены.
Битва века
Однако вернемся к теме этой статьи.
Так как система редактирования геномов может помочь в избавлении от ВИЧ? Очень просто: вирус можно вырезать! Нацелив Cas9, путем создания sgРНК с последовательностью, комплементарной вирусной кДНК.
Некоторое время назад группа ученых из немецкого Института экспериментальной вирусологии и иммунологии уже пыталась использовать инструмент редактирования геномов для удаления ВИЧ из культуры HeLa [15]. Они модифицировали Cre-рекомбиназу методом направленной эволюции и один из полученных вариантов использовали для удаления вируса путем контролируемой рекомбинации [16]. Однако надо учитывать, что между Т-хелперами и опухолевой HeLa есть немало различий, к тому же, авторы не предлагают вариантов доставки или экспрессии гена Tre-рекомбиназы (усовершенствованный вариант фермента Cre).
С другой стороны, группа американских исследователей опубликовала в марте этого года статью [17], где подробно описывались метод доставки и механизм удаления вируса. Ученые ставили перед собой задачу не только полностью избавить клеточную культуру Т-хелперов от вируса, но и проверить отсутствие цитотоксического действия самой CRISPR/Cas9 системы. Единственный недостаток этого геномного инструмента в том, что из-за сравнительно небольшой длины спейсера, даже при наличии страхующего элемента PAM, в больших геномах могут быть найдены нецелевые сайты, подверженные разрезанию (off-target sites). Именно поэтому исследователи уделяли данной проблеме немало внимания.
Работа проводилась с использованием штамма ВИЧ-1 и клеточной линии Т-хелперов 2D10, зараженной вирусом в покоящейся стадии. Доставка и экспрессия sgРНК/Cas9 осуществлялась с помощью лентивирусного вектора.
Для оценки того, вырезался ли вирус из двух мест встраивания (1-я и 16-я хромосомы), было проведено полногеномное секвенирование. Оно показало, что в клетках, где экспрессировались и гены Cas9, и sgРНК, провирусная ДНК отсутствует.
Был проведен анализ того, могут ли гены, куда встроился провирус (RSBN1 и MSRB1), и близлежащие гены нормально транскрибироваться после его вырезания. Ученые показали, что как RSBN1, так и MSRB1 нормально экспрессируются. Соседние гены также не претерпели изменений.
С помощью биоинформатических методов и анализа баз данных было показано, что sgРНК/Cas9 не проявляет активности по отношению к нецелевым сайтам.
Таким образом, можно с уверенностью сказать, что группа Камински впервые успешно удалила ВИЧ из культуры зараженных Т-хелперов. Данное достижение приблизило человечество к победе на ВИЧ. Да, это только культура клеток. Да, до внедрения данной техники в медицину пройдут годы, а может и десятки лет, но данная работа является уникальной в своем роде, ибо ученые не только бросили вызов одному из страшнейших заболеваний на планете, но и смогли победить его — пусть даже масштаб сражения пока невелик.
Перспективы применения данной технологии очевидны: введя пациенту вектор, содержащий гены Cas9 и sgРНК, мы добьемся их экспрессии и полного удаления вируса из клеток. Современная терапия, направленная против ретровирусов, являющаяся основным средством борьбы с ВИЧ, не удаляет вирус из клеток, так как провирус остается встроенным в ДНК хозяина. В свою очередь, данный подход не оставляет вирусу шансов укрыться.
Читайте также:

