Атипичный вирус пситтакоза вызывает развитие
Обновлено: 23.04.2024
Орнитоз (синоним: пситтакоз) — острое инфекционное заболевание, характеризуется лихорадкой, общей интоксикацией, поражением лёгких, центральной нервной системы, увеличением печени и селезёнки.
Возбудителем заболевания является хламидия (лат. Chlamydia psittaci ), в организме человека развивается внутриклеточно, во внешней среде сохраняется до 2-3 недель.
Резервуаром возбудителя и источником заражения являются домашние и дикие птицы. Наибольшее эпидемиологическое значение имеют домашние птицы — особенно утки и индюшки; комнатные птицы — попугаи, волнистые попугайчики, канарейки; городские голуби.
Наиболее подвержены заболеванию лица, постоянно контактирующие с птицами: работники птицефабрик, мясокомбинатов и др. При бытовом инфицировании в основном наблюдаются единичные заболевания, но могут быть и семейные вспышки (чаще через 1-2 недели после приобретения инфицированных птиц). Заболевание чаще встречается в холодное время года.
Заражение в большинстве случаев происходит аэрогенным (воздушно-пылевым) путем — при вдыхании пыли, содержащей хламидии (высохшие частички испражнений птиц, а также выделения из клюва, загрязненные частицы пуха). Больные орнитозом опасности для окружающих не представляют.
Инфекция проникает в организм через слизистую оболочку дыхательных путей. Возбудитель внедряется в мелкие бронхи и бронхиолы, самые мелкие пылевые частицы могут достигать альвеол, вызывая воспалительный процесс. Затем хламидии проникают в клетку, где и начинается их размножение. Очень быстро хламидии проникают в кровь, вызывая симптомы общей интоксикации и поражение различных органов — печени, селезенки, нервной системы, надпочечников. Интоксикация обусловлена токсическим влиянием самого возбудителя и вырабатываемого им токсина.
Реже воротами инфекции служит слизистая оболочка пищеварительного тракта — тонкого кишечника. В этом случае возбудитель также попадает в кровь, вызывая интоксикацию и поражая ряд органов и систем, но пневмонии при этом не бывает.
Иммунитет после перенесенной острой инфекции кратковременный и нестойкий, могут быть случаи повторных заболеваний.
Содержание
Симптомы и течение
Хроническая форма заболевания может протекать как хроническая орнитозная пневмония и как хронический орнитоз без поражения легких.
Острый орнитоз
Типичная форма орнитоза начинается остро — среди полного здоровья и хорошего самочувствия быстро, с ознобом, повышается температура тела (выше 39 градусов). С первых часов болезни появляются общая слабость, разбитость, сильная головная боль, боль в мышцах спины и конечностей. Аппетит понижен почти у всех больных. В первые дни болезни практически не бывает насморка, заложенности носа, сухости и першения в горле, покраснения зева, а также признаков, указывающих на поражение легких и плевры. Печень и селезенка в первые дни еще не увеличены.
Примерно на 2-4 день болезни появляются признаки поражения легких — сухой кашель, иногда колющая боль в груди, усиливающаяся при дыхании, затем начинает выделяться небольшое количество слизисто-гнойной мокроты, иногда — с примесью крови. Интоксикация и лихорадка удерживаются на том же уровне или несколько возрастают.
В конце первой недели у большинства больных увеличивается печень и селезенка, при этом желтуха не возникает. Интоксикация наблюдается до 7-10-го дня болезни, затем начинает постепенно уменьшаться. Для данного заболевания характерно, что даже после нормализации температуры тела, самочувствие больного еще долго остается плохим. Отмечается слабость, вегетативно-сосудистые расстройства, быстрое утомление даже при небольших физических нагрузках.
При тяжелых и среднетяжелых формах орнитоза полное восстановление сил наступает лишь через 2-3 месяцев. У некоторых больных заболевание может принять хроническое течение. Атипичное течение острого орнитоза может проявляться менингеальным синдромом на фоне орнитозной пневмонии — менингопневмония, которая сочетает все признаки пневмонической формы орнитоза с картиной серозного менингита. Заболевание протекает длительно, лихорадка сохраняется до 3-4 недель, стойких изменений в ЦНС не наблюдается.
Орнитозный менингит — одна из атипичных форм острого орнитоза, встречается редко. Начинается остро с повышения температуры тела и появления симптомов интоксикации. В течение ближайших 2-4 суток присоединяются менингеальные симптомы (сильная головная боль, ригидность мышц затылка, положительные симптомы Кернига, Брудзинского и др.). Изменений в легких нет. Орнитоз без поражения легких начинается остро с повышения температуры тела (обычно выше 39 °C) и появления признаков общей интоксикации. Больные жалуются на головную боль, понижение аппетита, задержку стула, иногда ломящие боли во всем теле. К концу первой недели определяется увеличение печени и селезенки.
Кроме того, острый орнитоз может протекать без каких-либо клинических проявлений — иннапарантная форма. Такая форма болезни чаще наблюдается у лиц молодого возраста при хорошей реактивности организма.
Хронический орнитоз
Хронические формы развиваются после перенесенного острого орнитоза, чаще при неправильном лечении.
Хроническая орнитозная пневмония, сопровождается симптомами бронхита. Температура тела не превышает 38 градусов, при этом сохраняется интоксикация (слабость, быстрая утомляемость). Заболевание может продолжаться 3-5 лет и более.
Хронический орнитоз может протекать и без поражения легких. Проявляется в виде длительного повышения температуры тела не выше 38 градусов, симптомов хронической интоксикации, вегето-сосудистых расстройств, увеличения печени и селезенки. Может длиться в течение многих лет.
Осложнения
Наиболее опасными осложнениями являются миокардит (воспаление сердечной мышцы) с развитием острой сердечной недостаточности, тромбофлебиты (образование тромбов в венах) с последующей тромбоэмболией легочной артерии, гепатит. При присоединении вторичной инфекции возникает гнойный отит (воспаление уха), невриты.
При возникновении заболевания у беременной женщины, внутриутробного инфицирования не происходит, уродства развития не возникают. Тяжелое течение болезни на ранних сроках беременности может привести к самопроизвольному аборту.
Диагностика
Распознавание болезни основано на эпидемиологических — контакты с домашними и дикими птицами (охотники), комнатными птицами (особенно волнистыми попугайчиками и попугаями), городскими голубями и клинических данных.
Для диагностики важно, что у больных с легочными формами орнитоза нет признаков поражения верхних дыхательных путей (ринита, фарингита, ларингита и трахеита). Характерно увеличение печени у большинства больных.
Методы лабораторной диагностики: иммуноферментный метод ИФА — выявление хламидий по наличию в крови специфических антител, самый чувствительный метод — идентификация хламидий по специфическому ферменту молекулы ДНК в мазке (ПЦР, полимеразная цепная реакция).
Лечение
Назначают антибиотики группы тетрациклина: Вибрамицин, Доксициклин, Тетрациклин по 0,3-0,5 г 4 раза в сутки до 4-7-го дня нормальной температуры, при необходимости лечение продолжают до 9-10-го дня нормальной температуры. При непереносимостми препаратов группы тетрациклина можно назначать Левомицетин и Эритромицин, но эффективность их несколько меньше. Пенициллин, стрептомицин и сульфаниламиды (Бисептол) при орнитозе не эффективны.
Профилактика
Борьба с орнитозом среди домашних птиц, регулирование численности голубей, ограничение контакта с ними. На птицефермах и предприятиях, занимающихся переработкой пера и пуха, необходимо проводить санитарно-ветеринарные мероприятия. При ввозе в страну птиц следует применять карантинные меры. Эффективной вакцины для профилактики орнитоза не существует.
Оппортунистические инфекции – это большая группа инфекционных заболеваний, которые развиваются у пациентов с различными типами иммунодефицитов и нехарактерны для людей с нормальным иммунным статусом. Патологии поражают любую систему органов и вызывают соответствующую симптоматику. К общим клиническим проявлениям относят длительный субфебрилитет, лимфаденопатию, астенический синдром. Диагностика оппортунистических инфекций включает серологические, молекулярно-генетические, бактериологические и другие методы детекции патогенных возбудителей. Программы лечения сочетают длительную этиотропную терапию с методами иммунокоррекции.
МКБ-10


Общие сведения
Проблема оппортунистических инфекций (ОПИ) становится все более актуальной, что вызвано ростом числа ВИЧ-инфицированных людей, разработкой эффективных, однако агрессивных методов лечения онкопатологии. При этом многие люди являются бессимптомными носителями возбудителей ОПИ: 60% инфицированы цитомегаловирусом, 90% – герпесвирусами 1 и 2 типов, около 30% – токсоплазмой. Учитывая клинический полиморфизм и отсутствие специфических симптомов, диагностика и лечение оппортунистических болезней представляет серьезную мультидисциплинарную проблему.

Причины
Для манифестации оппортунистических инфекций необходимо заражение патогенным микроорганизмом: вирусом, бактерией, грибком или простейшим. Известно более 20 типичных возбудителей ОПИ, в современной инфектологии этот перечень постоянно дополняется. Болезнь возникает при активации латентного очага, реже выступает следствием текущего заражения. Первостепенную важность играет нарушение иммунного статуса вследствие следующих патологий:
- ВИЧ-инфекция. Самая частая причина, поскольку на определенном этапе снижения числа CD4-клеток ОПИ развиваются у каждого больного. Инфекционные болезни используются для диагностики заражения ВИЧ и определения стадии заболевания, поэтому в данном контексте они называются СПИД-ассоциируемыми или СПИД-индикаторными патологиями.
- Злокачественные новообразования. Патофизиология любого опухолевого процесса предполагает угнетение собственной иммунной системы пациента и снижение ее ответа на чужеродные агенты. При этом уменьшается число Т-клеток, угнетаются процессы фагоцитоза. Проблема наиболее выражена при гемобластозах – лейкозах и лимфомах.
- Хроническая соматическая патология. Угнетение активности клеточного и гуморального иммунитета происходит при эндокринных заболеваниях (сахарный диабет, гипотиреоз), почечной недостаточности, тяжелых воспалительных патологиях ЖКТ.
- Ятрогенные факторы. Применение цитостатиков и других видов иммуносупрессоров является важным предиктором развития оппортунистических инфекций. Подобная ситуация наблюдается в группе пациентов после лучевой терапии, трансплантации органов и костного мозга.
- Первичные иммунодефициты. В эту группу относят все виды иммунной недостаточности, которые имеют генетический характер или возникают внутриутробно под влиянием тератогенов. Они манифестируют в раннем детском возрасте, проявляются затяжными оппортунистическими болезнями, которые с трудом подаются терапии.
Патогенез
Хотя возбудители оппортунистических инфекций таксономически неоднородны, в развитии заболеваний большую роль имеют общие особенности их патогенности и вирулентности. К свойствам микроорганизмов, вызывающих ОПИ, относят возможность длительного и даже пожизненного персистирования в организме человека, внутриклеточное паразитирование, склонность к поражению клеток моноцитарно-макрофагальной системы.
Инфекции активизируются при иммунодефицитах любой этиологии и склонны к хроническому течению с периодическими обострениями, поражением жизненно важных органов. Для оппортунистических болезней характерна лимфогенная и гематогенная диссеминация микроорганизмов, образование эктопических очагов. Собственный иммунитет пациента не способен оказать должное сопротивление инфекционному агенту, лекарственные средства не всегда эффективны.
Сложность и опасность оппортунистических инфекций заключается еще и в том, что они способны подавлять естественный иммунитет. В последние годы говорят о возможности пожизненной иммуносупрессии при персистировании герпесвирусов. Таким образом, формируется порочный круг, когда иммунодефицит провоцирует активацию возбудителей ОПИ, которые усугубляют явления иммунной недостаточности и потенциируют дальнейшие полиорганные нарушения.

Классификация
Единой систематизации оппортунистических инфекций на сегодня не существует. Условно возбудителей объединяют в 3 группы: патогены, которые поражают лиц с нарушениями иммунитета и здоровых людей; микробы, встречающиеся только при иммунодефицитах; вакцинные штаммы микроорганизмов. Общепринятой является классификация ОПИ согласно типу возбудителя:
Симптомы оппортунистических инфекций
В инфектологии выделяют общую группу клинических признаков, которая встречается при любом варианте ОПИ. Наиболее типичным симптомом признан длительный субфебрилитет, которые возникает без видимой причины и беспокоит пациента больше 1 месяца. Нередко повышение температуры возникает после перенесенного ОРВИ или кишечной инфекции, которые выступают пусковым фактором активации оппортунистического заболевания.
Вторым настораживающим симптомом считается лимфаденопатия – увеличение лимфатических улов. Чаще всего в процесс вовлекается лимфоидная ткань шейно-подчелюстной, подмышечной и паховой зоны. Лимфоузлы достигают диаметра около 1 см, имеют плотноэластическую консистенцию, не спаяны с окружающими тканями и безболезненны при ощупывании.
Третью группу общей симптоматики оппортунистических инфекций составляет астенический синдром. Он включает слабость, повышенную утомляемость, снижение переносимости умственных и физических нагрузок. Зачастую пациенты жалуются на ночную потливость, головокружения и головные боли, нарушения сна. При длительном существовании таких признаков наблюдается когнитивная дисфункция, эмоциональная подавленность, стойкое снижение работоспособности.
Пациента с иммуносупрессией должен насторожить кашель и одышка – типичные признаки туберкулеза и пневмоцистной пневмонии (ПЦП), снижение остроты зрения – возможное проявление цитомегаловирусного ретинита, длительно сохраняющаяся диарея – признак криптоспоридиоза, микроспоридиоза. Жжение и сухость полости рта в комбинации с эрозиями и белыми налетами на слизистых указывают на орофарингеальный кандидоз.
Оппортунистические болезни не имеют четко выраженного тропизма. Один и тот же вид возбудителя может вызывать миокардит, плеврит, артрит, менингит и другие нозологические формы. Зачастую они имитируют симптомы хронических соматических заболеваний, с которыми пациенты длительно и безрезультатно посещают врачей разных специальностей. Исключение составляет пневмоцистоз, который в основном поражает легкие с развитием ПЦП.
Осложнения
Оппортунистические инфекции – тяжелые и потенциально смертельные заболевания. Среди пациентов с терминальными стадиями ВИЧ-инфекции ОПИ составляют 90% в структуре летальности, оставшиеся 10% приходятся на саркому Капоши, лимфомы и прочие неинфекционные последствия СПИДа. Смертность при церебральном токсоплазмозе составляет около 33%, при криптококковом менингите – 20-30%, при пневмоцистной пневмонии – 10-20%.
Особую тревогу вызывает сочетание нескольких видов оппортунистических заболеваний у одного пациента. Микробные ассоциации более характерны для позднего периода и хронического течения основной патологии, вызвавшей иммунодефицит. Сочетанное инфицирование типично для иммунокомпрометированных пациентов, пребывающих на стационарном лечении: у 40-50% больных в послеоперационном периоде, у 70-80% при перитонитах и плевритах.
Распространение оппортунистических инфекций негативно сказывается на репродуктивном здоровье населения. Они обуславливают многие случаи самопроизвольного прерывания беременности, эмбриопатий и фетопатий, задержки внутриутробного развития. Дети, рожденные от матерей с ОПИ, находятся в группе риска развития заболеваний новорожденных, перинатальных энцефалопатий.

Диагностика
Обследование пациентов проводится мультидисциплинарной командой врачей, в которую входят врач-инфекционист, иммунолог, онколог и другие узкопрофильные специалисты. Большое клиническое значение имеет выяснения времени и условий появления симптоматики, характера течения заболевания, наличия факторов риска иммунодефицитных состояний. Для подтверждения оппортунистических инфекций проводятся следующие методы диагностики:
Лечение оппортунистических инфекций
В процессе лечения практикующие инфекционисты сталкиваются с такими нюансами, как множественная лекарственная устойчивость патогенов, гетерогенность популяции возбудителей, низкая активность естественных иммунных факторов. Основу терапии составляет прием этиотропных противомикробных препаратов: антибиотиков, антимикотиков, противопротозойных и противовирусных. Лечение ОПИ имеет ряд особенностей:
- в основном назначаются комбинации из 2-3 препаратов для повышения их эффективности;
- продолжительность противомикробной терапии повышается в 1,5-2 раза и более в сравнении с лечением инфекционных болезней у иммунокомпетентных лиц;
- при подборе терапии ориентируются не только на клиническую картину болезни, но и на текущий иммунный статус пациента;
- при вирусных инфекциях обязательно назначаются этиотропные препараты, тогда как у людей без иммуносупрессии противовирусные средства используют только по показаниям.
Для успешного лечения ОПИ требуется максимально возможное восстановление иммунной функции. В группе пациентов с ВИЧ-инфекцией назначаются протоколы антиретровирусной терапии (ВААРТ), чтобы повысить число CD4-клеток и улучшить отдаленные прогнозы. При ведении онкологических больных используются персональные схемы иммуномодуляторов, экспериментальные направления иммунотерапии и регенеративной медицины с применением стволовых клеток.
Прогноз и профилактика
Течение любой инфекции на фоне иммуносупрессии является сложным и непредсказуемым, однако усовершенствованные протоколы лечения позволяют достичь стойкой ремиссии или даже полного излечения. К прогностически неблагоприятным факторам относят пожилой и старческий возраст, неправильно подобранную терапию, невозможность проведения иммунокоррекции основного заболевания.
При иммунодефицитах показана первичная медикаментозная профилактика оппортунистических инфекций. Применяют сульфаниламиды, макролиды‑азалиды, противогрибковые средства. При положительной пробе Манту или недавнем контакте с больным туберкулезом назначается химиопрофилактика сроком на 6 месяцев. Также пациентам рекомендовано строго соблюдать противоэпидемические меры, в периоде резкой иммуносупрессии необходимо пребывание в стерильных боксах.
3. Клинические особенности сочетанных оппортунистических инфекций (обзор)/ В.В. Шкарин, Н.В. Саперкин// Медицинский альманах. – 2017. – №4.
4. Оппортунистические инфекции: проблемы и перспективы/ Под общ. ред. проф. Ю.В. Редькина, О.А. Мирошника, В.В. Лобова. – 2002.
Цитомегалия – это инфекционное заболевание вирусного генеза, передающееся половым, трансплацентарным, бытовым, гемотрансфузионным путем. Симптоматически протекает в форме упорной простуды. Отмечается слабость, недомогание, головные и суставные боли, насморк, увеличение и воспаление слюнных желез, обильное слюноотделение. Часто протекает бессимптомно. Опасна цитомегалия беременных: она может вызывать самопроизвольный выкидыш, врожденные пороки развития, внутриутробную гибель плода, врожденную цитомегалию. Диагностика осуществляется лабораторными методами (ИФА, ПЦР). Лечение включает противовирусную и симптоматическую терапию.
МКБ-10
Общие сведения
Другие названия цитомегалии, встречающиеся в медицинских источниках, - цитомегаловирусная инфекция (ЦМВ), инклюзионная цитомегалия, вирусная болезнь слюнных желез, болезнь с включениями. Цитомегалия является широко распространенной инфекцией, и многие люди, являясь носителями цитомегаловируса, даже не подозревают об этом. Наличие антител к цитомегаловирусу выявляется у 10—15% населения в подростковом возрасте и у 50% взрослых людей. По некоторым источникам, носительство цитомегаловируса определяется у 80% женщин детородного периода. В первую очередь это относится к бессимптомному и малосимптомному течению цитомегаловирусной инфекции.

Причины
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: при сексуальных контактах через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, иногда - при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Нередко цитомегаловирус находится в организме многие годы и может ни разу не проявить себя и не нанести вреда человеку. Проявление скрытой инфекции происходит, как правило, при ослаблении иммунитета. Угрожающую по своим последствиям опасность цитомегаловирус представляет у лиц со сниженным иммунитетом (ВИЧ-инфицированных, перенесших трансплантацию костного мозга или внутренних органов, принимающих иммунодепрессанты), при врожденной форме цитомегалии, у беременных.
Патогенез
Попадая в кровь, цитомегаловирус вызывает выраженную иммунную реакцию, проявляющуюся в выработке защитных белковых антител – иммуноглобулинов М и G (IgM и IgG) и противовирусной клеточной реакцией - образованием лимфоцитов CD 4 и CD 8. Угнетение клеточного иммунитета при ВИЧ-инфекции приводит к активному развитию цитомегаловируса и вызываемой им инфекции.
Даже при бессимптомном течении инфекции носитель цитомегаловируса является потенциально заразным для неинфицированных лиц. Исключение составляет внутриутробный путь передачи цитомегаловируса от беременной женщины плоду, который происходит в основном при активном течении процесса, и лишь в 5% случаев вызывает врожденную цитомегалию, в остальных же носит бессимптомный характер.
Симптомы цитомегалии
Врожденная цитомегалия
В 95% случаев внутриутробное инфицирование плода цитомегаловирусом не вызывает развития заболевания, а протекает бессимптомно. Врожденная цитомегаловирусная инфекция развивается у новорожденных, матери которых перенесли первичную цитомегалию. Врожденная цитомегалия может проявляться у новорожденных в различных формах:
- петехиальная сыпь – мелкие кожные кровоизлияния - встречается у 60-80% новорожденных;
- недоношенность и задержка внутриутробного развития плода - встречается у 30% новорожденных;
- желтуха;
- хориоретинит – острый воспалительный процесс в сетчатке глаза, часто вызывающий снижение и полную потерю зрения.
Летальность при внутриутробном инфицировании цитомегаловирусом достигает 20-30%. Из выживших детей большая часть имеет отставание в умственном развитии или инвалидность по слуху и зрению.
Приобретенная цитомегалия у новорожденных
При инфицировании цитомегаловирусом в процессе родов (при прохождении плода по родовым путям) или в послеродовом периоде (при бытовом контакте с инфицированной матерью или грудном вскармливании) в большинстве случаев развивается бессимптомное течение цитомегаловирусной инфекции. Однако у недоношенных младенцев цитомегаловирус может вызывать затяжную пневмонию, к которой часто присоединяется сопутствующая бактериальная инфекция. Часто при поражении цитомегаловирусом у детей отмечается замедление в физическом развитии, увеличение лимфоузлов, гепатит, сыпь.
Мононуклеозоподобный синдром
У лиц, вышедших из периода новорожденности и имеющих нормальный иммунитет, цитомегаловирус может вызывать развитие мононуклеозоподобного синдрома. Течение мононуклеазоподобного синдрома по клинике не отличается от инфекционного мононуклеоза, вызываемого другой разновидностью герпесвируса – вирусом Эбштейна-Барр. Течение мононуклеозоподобного синдрома напоминает упорную простудную инфекцию. При этом отмечается:
- длительная (до 1 месяца и более) лихорадка с высокой температурой тела и ознобами;
- ломота в суставах и мышцах, головная боль;
- выраженные слабость, недомогание, утомляемость;
- боли в горле;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания, напоминающие сыпь при краснухе (обычно встречается при лечении ампициллином).
В отдельных случаях мононуклеозоподобный синдром сопровождается развитием гепатита – желтухой и повышением в крови печеночных ферментов. Еще реже (до 6% случаев) осложнением мононуклеозоподобного синдрома служит пневмония. Однако у лиц с нормальной иммунной реактивностью она протекает без клинических проявлений, выявляясь лишь при проведении рентгенографии легких.
Длительность течения мононуклеозоподобного синдрома составляет от 9 до 60 дней. Затем обычно наступает полное выздоровление, хотя на протяжении нескольких месяцев могут сохраняться остаточные явления в виде недомогания, слабости, увеличенных лимфоузлов. В редких случаях активизация цитомегаловируса вызывает рецидивы инфекции с лихорадкой, потливостью, приливами и недомоганием.
Цитомегаловирусная инфекция у лиц с ослабленным иммунитетом
Ослабление иммунитета наблюдается у лиц, страдающих синдромом врожденного и приобретенного (СПИД) иммунодефицита, а также у пациентов, перенесших пересадку внутренних органов и тканей: сердца, легкого, почки, печени, костного мозга. После пересадки органов пациенты вынуждены постоянно принимать иммунодепрессанты, ведущие к выраженному подавлению иммунных реакций, что вызывает активность цитомегаловируса в организме.
У пациентов, перенесших трансплантацию органов, цитомегаловирус вызывает поражение донорских тканей и органов (гепатит – при пересадке печени, пневмонию при пересадке легкого и т. д.). После трансплантации костного мозга у 15-20% пациентов цитомегаловирус может привести к развитию пневмонии с высокой летальностью (84-88%). Наибольшую опасность представляет ситуация, когда инфицированный цитомегаловирусом донорский материал пересажен неинфицированному реципиенту.
Цитомегаловирус поражает практически всех ВИЧ-инфицированных. В начале заболевания отмечаются недомогание, суставные и мышечные боли, лихорадка, ночная потливость. В дальнейшем к этим признакам могут присоединяться поражения цитомегаловирусом легких (пневмония), печени (гепатит), мозга (энцефалит), сетчатки глаза (ретинит), язвенные поражения и желудочно-кишечные кровотечения.
У мужчин цитомегаловирусом могут поражаться яички, простата, у женщин – шейка матки, внутренний слой матки, влагалище, яичники. Осложнениями цитомегаловирусной инфекции у ВИЧ-инфицированных могут стать внутренние кровотечения из пораженных органов, потеря зрения. Множественное поражение органов цитомегаловирусом может привести к их дисфункции и гибели пациента.
Диагностика
С целью диагностики цитомегаловирусной инфекции проводится лабораторное обследование. Постановка диагноза цитомегаловирусной инфекции основана на выделении цитомегаловируса в клиническом материале или при четырехкратном повышении титра антител.
- ИФА-диагностика. Включает определение в крови специфических антител к цитомегаловирусу - иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении цитомегаловирусом либо о реактивации хронической ЦМВИ. Определение высоких титров IgМ у беременных может угрожать инфицированию плода. Повышение IgМ выявляется в крови спустя 4-7 недель после заражения цитомегаловирусом и наблюдается на протяжении 16-20 недель. Повышение иммуноглобулинов G развивается в период затухания активности цитомегаловирусной инфекции. Их наличие в крови говорит о присутствии цитомегаловируса в организме, но не отражает активности инфекционного процесса.
- ПЦР-диагностика. Для определения ДНК цитомегаловируса в клетках крови и слизистых (в материалах соскобов из уретры и цервикального канала, в мокроте, слюне и т. д.) используется метод ПЦР-диагностики (полимеразной цепной реакции). Особенно информативно проведение количественной ПЦР, дающей представление об активности цитомегаловируса и вызываемого им инфекционного процесса.
В зависимости от того, какой орган поражен цитомегаловирусной инфекцией, пациент нуждается в консультации гинеколога, андролога, гастроэнтеролога или других специалистов. Дополнительно по показаниям проводится УЗИ органов брюшной полости, кольпоскопия, гастроскопия, МРТ головного мозга и другие обследования.
Лечение цитомегаловирусной инфекции
Неосложненные формы мононуклеазоподобного синдрома не требует специфической терапии. Обычно проводятся мероприятия, идентичные лечению обычного простудного заболевания. Для снятия симптомов интоксикации, вызываемой цитомегаловирусом, рекомендуется пить достаточное количество жидкости.
Лечение цитомегаловирусной инфекции у лиц, входящих в группу риска, проводится противовирусным препаратом ганцикловиром. В случаях тяжелого течения цитомегалии ганцикловир вводится внутривенно, т. к. таблетированные формы препарата обладают лишь профилактическим эффектом в отношении цитомегаловируса. Поскольку ганцикловир обладает выраженными побочными эффектами (вызывает угнетение кроветворения - анемию, нейтропению, тромбоцитопению, кожные реакции, желудочно-кишечные расстройства, повышение температуры и ознобы и др.), его применение ограничено у беременных, детей и у людей, страдающих почечной недостаточностью (только по жизненным показаниям), он не используется у пациентов без нарушения иммунитета.
Для лечения цитомегаловируса у ВИЧ-инфицированных наиболее эффективен препарат фоскарнет, также обладающий рядом побочных эффектов. Фоскарнет может вызывать нарушение электролитного обмена (снижение в плазме крови магния и калия), изъязвление половых органов, нарушение мочеиспускания, тошноту, поражение почек. Данные побочные реакции требуют осторожного применения и своевременной корректировки дозы препарата.
Прогноз
Особую опасность цитомегаловирус представляет при беременности, так как может провоцировать выкидыш, мертворождение или вызывать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с герпесом, токсоплазмозом и краснухой, относится к числу тех инфекций, обследоваться на которые женщины должны профилактически, еще на этапе планирования беременности.
Профилактика
Особенно остро вопрос профилактики цитомегаловирусной инфекции стоит у лиц, входящих в группу риска. Наиболее подвержены инфицированию цитомегаловирусом и развитию заболевания ВИЧ-инфицированные (особенно больные СПИДом), пациенты после трансплантации органов и лица с иммунодефицитом иного генеза.
Неспецифические методы профилактики (например, соблюдение личной гигиены) неэффективны в отношении цитомегаловируса, так как заражение им возможно даже воздушно-капельным путем. Специфическая профилактика цитомегаловирусной инфекции проводится ганцикловиром, ацикловиром, фоскарнетом среди пациентов, входящих в группы риска. Также для исключения возможности инфицирования цитомегаловирусом реципиентов при пересадке органов и тканей необходим тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей? Какие патогенные факторы играют существенную роль? Как вести больных? Респираторные заболевания являются частой причиной обращения к врачу в Великобритании,
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей?
Какие патогенные факторы играют существенную роль?
Как вести больных?
 |
Респираторные заболевания являются частой причиной обращения к врачу в Великобритании, причем в большинстве случаев они относятся к инфекционным [1]. Трем четвертям пациентов, обращающихся с признаками острого заболевания нижних дыхательных путей, врач общей практики назначает антибиотики, хотя лишь в немногих случаях удается выделить возбудителя и антибиотики или вообще не влияют, или мало влияют на естественный ход заболевания [2,3].
Назначая антибиотики, врач руководствуется ожиданиями пациента и старается действовать согласно определенной терапевтической стратегии, хотя зачастую, выписывая рецепт, чувствует, что при этом состоянии антибиотики будут неэффективны [4,5].
Причины, по которым пациент первый раз приходит на прием к своему врачу и затем повторно обращается за консультацией, довольно сложны и часто никак не соотносятся с течением болезни. Как правило, они обусловлены обеспокоенностью своим здоровьем или давлением со стороны друзей, семьи и сотрудников.
При необходимости назначить антибиотик для лечения инфекции нижних дыхательных путей обычно выбирают амоксициллин. Пациенты, повторно обращающиеся к врачу, скорее всего, получат другой антибиотик, например эритромицин или новейшее средство из группы макролидов, хинолонов или пероральный цефалоспорин [3,6].
Проведенные нами недавно исследования показали, что повторное обращение пациентов с инфекциями нижних дыхательных путей, уже получивших назначения на первичном приеме, никак не связано с антибиотикотерапией. Только у 4% таких больных сохранялась бактериальная инфекция и ни у одного из них не было устойчивости к амоксициллину [7]. Повторно приходить на прием побуждают пациентов немедицинские факторы, такие как привычка обращаться к врачу.
Таблица 1. Почему пациенты повторно обращаются к врачу при острой инфекции нижних дыхательных путей
- Пациент неверно представляет себе естественное течение болезни
- Пациент продолжает беспокоиться по поводу симптомов болезни
- Пациенту нравится ходить на прием к врачу
- По настоянию членов семьи, друзей, сотрудников
- У пациента появились соображения, касающиеся важности симптомов
- Инфекция хронизируется или к ней присоединяется другая инфекция
- Проявляется серьезное основное заболевание
При повторном обращении по поводу респираторного заболевания врач общей практики прежде всего должен попытаться установить причину такого обращения (табл. 1). Вполне возможно, что оно вызвано необоснованными ожиданиями пациента, и наилучшим средством здесь было бы объяснение нормальных сроков выздоровления от простуды. Или же есть какое-то основное заболевание, не распознанное на первичной консультации, например астма, недолеченное хроническое обструктивное легочное заболевание, рак или бронхоэктазы.
В том случае если врач считает, что причина в продолжающейся инфекции, необходимо определить возможного возбудителя и выбрать соответствующий антибиотик (табл. 2). Ниже мы обсудим некоторые сложные случаи, которые необходимо иметь в виду [8,9]. Однако нужно помнить, что наиболее распространенными возбудителями остаются Streptоcoccus pneumoniae и респираторные вирусы, а сложные случаи составляют скорее исключение, чем правило в ежедневной общей практике.
Пенициллин-резистентный Streptococcus pneumoniae. Хотя число случаев развития лекарственной устойчивости неуклонно возрастает и представляет серьезную проблему для целого ряда европейских стран, в Англии антибиотикорезистентность пока не считается причиной неудачного лечения инфекций дыхательных путей. Нужно убеждать врачей общей практики проводить пневмококковую вакцинацию населения, входящего в группу риска, а антибиотики назначать строго по показаниям и в адекватной дозе.
Амоксициллин-резистентный Haemophilus influenzae. Haemophilus influenza (Hi) является частой бактериальной причиной обострения хронических обструктивых заболеваний легких (ХОЗЛ), а также вызывает персистирующий бронхит у здоровых взрослых людей. Некоторые антибиотики, такие как эритромицин и цефалоспорины первого поколения, недостаточно эффективны в отношении Hi. Наличие b-лактамазы объясняет отсутствие реакции на амоксициллин. Такие штаммы называются амоксициллин-резистентными Hi (АRHi).
Таблица 2. Возможная причина отсутствия цикла терапии острой инфекции нижних отделов дыхательных путей, назначенной на первом приеме*
Заболеваемость, обусловленная АRHi, растет и составляет сегодня в Великобритании 10-25% общего числа респираторных заболеваний в зависимости от региона. В других странах, таких как Испания, Португалия и некоторые районы Франции, уровень лекарственной устойчивости гораздо выше — это нужно иметь в виду в тех случаях, когда пациент мог заразиться зарубежом.
Об этом возбудителе следует помнить, если у пациента с ХОЗЛ после лечения часто повторяющимися курсами амоксициллина сохраняются симптомы заболевания и гнойная мокрота. В данном случае целесообразным будет недельный курс хинолона или коамоксиклава. От назначения ципрофлоксацина следует воздержаться, если пациент принимает теофиллин.
Moraxella catarrhalis. Некоторым название этого микроорганизма может показаться незнакомым, поскольку раньше его относили к роду Neisseria вида Branhamella.
Это грамотрицательный диплококк, входящий в нормальную микрофлору молодых и пожилых людей. Вслед за Haemophilus influenza и Streptococcus pneumoniae он является третьей по распространенности причиной обострения ХОЗЛ и часто поражает пациентов с тяжелыми хроническими легочными заболеваниями или раком легких.
Обнаружение этого микроорганизма служит показателем тяжести процесса. Сообщалось о недавнем наблюдении 42 случаев пневмонии, вызванной M. catarrhalis, когда около половины пациентов погибло от основного заболевания в течение трех месяцев после обнаружения инфекции.
Важно и то обстоятельство, что практически все штаммы сегодня являются b-лактамазопродуцирующими и соответственно амоксициллинорезистентными. Имеется предположение, что b-лактамаза, продуцируемая M. Catarrhalis, обеспечивает устойчивость к амоксициллину в норме чувствительных респираторных возбудителей, таких как S. pneumoniae и H. influenzae. Проводимая терапия не отличается от той, которая применяется в случаях АРHi (см. выше).
Pseudomonas aeruginosa. Об этом возбудителе нужно помнить в связи с возможностью развития бронхоэктазов и кистозной болезни. Стоит один раз заразиться Pseudomonas aeruginosa, и рецидивы могут следовать один за одним. В настоящее время единственным эффективным пероральным средством является ципрофлоксацин, но к нему быстро развивается устойчивость, и пациентов приходится госпитализировать для проведения внутривенной антибиотикотерапии и физиотерапии.
Другие бактериальные возбудители. Изредка выделяют грамотрицательную кишечную палочку, или Staphylococcus aureus. Эти возбудители чаще связаны с больничными пневмониями, но иногда обнаруживаются у пациентов, недавно выписавшихся из больницы.
Под атипичными обычно подразумеваются инфекции, вызываемые Mycoplasma pneumoniae, Chlamydia psittaci, Chlamydia pneumoniae, Coxiella burnetti и Legionella pneumophila. Лихорадка Q, возбудителем которой служит Coxiella burnetti, встречается редко (как правило, в сельской местности), поэтому не будет упоминаться в дальнейшем. Все атипичные инфекции трудно поддаются распознаванию на ранних стадиях; серологические исследования, проведенные как в острый период, так и в период реконвалесценции, редко дают положительный ответ и не представляют клинической ценности.
Ни один из возбудителей атипичных инфекций не поддается воздействию b-лактамных антибиотиков, что объясняет отсутствие эффекта от назначения амоксициллина.
Mycoplasma pneumoniae. Эпидемия, вызванная этим возбудителем, случается каждые три-четыре года, и в такой период может составлять значительную часть всех респираторных заболеваний.
Обычно она охватывает школьников, студентов и людей среднего возраста; маленькие дети и старики страдают редко.
В отличие от бактериальных инфекций, заболевание начинается постепенно, через 10-14 дней после заражения, проявляясь сухим кашлем или выделением скудной чистой мокроты. Общее недомогание и повышение температуры тела обычно умеренные, при исследовании грудной клетки обнаруживаются незначительные изменения. Иногда такие проявления, как сыпь, буллезный мирингит, а также выявление холодовых агглютининов помогают поставить диагноз.
Микоплазменную инфекцию следует заподозрить, если взрослый человек, до этого не жаловавшийся на здоровье, при отсутствии серьезных патологических симптомов и признаков интоксикации не поддается лечению амоксициллином. В этом случае имеет смысл попробовать назначить антибиотик из группы макролидов; альтернативный подход — тетрациклины. Кашель, как правило, медленно поддается лечению.
Хламидии. Большинствo врачей общей практики время от времени сталкиваются со случаями пситаккоза, вызванного длительным контактом с какой-нибудь любимой домашней птичкой. В последние годы установлено, что наиболее распространенным возбудителем инфекций дыхательных путей является Chlamydia pneumoniae, передающаяся от человека к человеку [10]. Эта инфекция проявляется такими же стертыми симптомами, как и микоплазменная, среди которых выделяются кашель и фарингит. Но, в противоположность микоплазменной инфекции, данное заболевание поражает и пожилых людей, часто вследствие реинфекции.
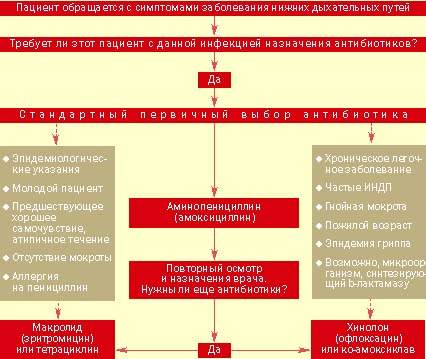 |
| Рисунок 2. Тактика ведения больного с выраженными клиническими показаниями для назначения антибиотиков при остром заболевании нижних дыхательных путей |
В некоторых исследованиях обнаружена связь между Chlamydia pneumoniaе и болезнями коронарных артерий и бронхиальной астмой, возможно обусловленная наличием хламидиального антигена, прикрепляющегося к эндотелию и эпителию. Рекомендуемое лечение — антибиотик из группы макролидов или тетрациклинов.
Legionella pneumophila. Болезнь легионеров все еще находится в центре внимания. Легионелла — редкий возбудитель пневмонии, развивающейся в местах большого скопления людей. Похоже, что легионелла не вызывает такие менее тяжелые заболевания дыхательной системы, как бронхит или инфекции верхних дыхательных путей. Состояние пациентов с болезнью легионеров достаточно тяжелое; обычно им требуется лечение в условиях стационара.
Известна связь этого заболевания с зараженными легионеллами источниками воды, поэтому упоминание пациента о заграничной поездке, пребывании в отеле или больнице, ванне джакузи помогает врачу общей практики правильно поставить диагноз. Нередко встречаются такие осложнения, как дыхательная недостаточность и энцефалит, поэтому все больные, даже в сомнительных случаях, должны быть направлены на госпитальное обследование.
- Практические советы по ведению больных с инфекциями дыхательных путей
Назначение антибиотиков. Подход к ведению больных с острыми инфекциями нижних дыхательных путей представлен на рис. 2. Ключевым моментом является принятие решения о назначении или неназначении антибиотиков. Большинство врачей общей практики считают необходимым применение антибиотиков при серьезных системных нарушениях, постоянном выделении гнойной мокроты, появлении местных признаков поражения легких и отягощенности предшествующими заболеваниями. Если уже решено использовать этот вид лечения, выбор нужного препарата не представляет особого труда.
 |
| Рисунок 3. Пациентам, входящим в группу риска, необходимо провести пневмококковую вакцинацию |
В большинстве случаев назначается амоксициллин. Согласно последним рекомендациям, доза амоксициллина принята равной 500 мг (а не 250 мг, как было раньше), чтобы снизить частоту развития резистентности пневмококков. Однако эта проблема лучше разрешается путем уменьшения общего количества назначений антибиотиков при инфекциях нижних дыхательных путей.
Врач общей практики не должен рекомендовать больному прием антибиотиков просто потому, что это самый легкий способ, или в случае, когда нет четких клинических показаний для их назначения. Проблемы резистентности возбудителей инфекций дыхательных путей решаются при назначении антибиотиков, обусловленном строгими показаниями. Снабжение пациентов простыми информационными листками значительно снижает необходимость повторных консультаций.
Литература
1. Office of Population Censuses and Surveys. Morbidity statistics from general practice: foutrh national study 1992. London: HMSO, 1995 (Series MB5;3).
2. Orr P. H., Scherer K., Macdonald A., Moffatt M. E. Randomosed placebo controlled trials of antibiotics for acute bronchitis: a critical review of the literature. J Fam Pract 1993; 36:507–512.
3. Macfarlane J. T., Holmes W. F., Macfarlane R. M., Lewis S. Contemporary use of antibiotics in 1089 adults presenting with acute lower respiratory tract illness in general practice in the UK: implications for developing managment guidelines. Respiratory Medicine, 1997; 91:427–434.
4. Holmes W. F., Macfarlane J. T., Macfarlane R. M., Lewis S. The influence of antibiotics and other factors on reconsultation for acute lower respiratory tract illness in primary care. Br J Gen Pract (in press).
5. Macfarlane J. T., Holmes W. F., Macfarlane R. M. Acutr lower respiratory tract illness in general practice; a study of the view on 787 patients and their influence on antibiotic prescribing. BMJ, 1997; 315:1211–1214.
6. Macfarlane J. T, Colville A., Guion A., Macfarlane R. M., Rose D. H. Prospective study of aetiology and outcome of adult lower respiratory tract infection in the community. Lancet, 1993; 341:511–514.
7. Macfarlane J., Prewett J., Rose D., Gard P., Guion A., Cunnigham R., Myint S. A prospective, case control study of the aetiology of community acquired lower respiratory tract infections in adult who felt to improve with initial antibiotics. BMJ, 1997; 315:1206–1210.
8. Venkatesan P., Innes J. A. Antibiotic resistance in common acute respiratory pathogenes. Thorax, 1995; 50:481–483.
9. Anon. Lower respiratory tract infections. MeReC Bulletin 1994; 5:5–8.
10. Torres A., ElEbiary M. Relevance of Chlamydia pneumoniae in community acquired respiratory infections. Eur Respir J, 1993; 6:7–8.
11. Macfarlane J. T., Holmes W. F., Macfarlane R. Reducing reconsultations for acute lower respiratory tract illness with an information leaflet. Br J Gen Pract, 1997; 47:710–722.
Орнитоз – инфекционное заболевание, известное также как пситтакоз — вызывается хламидиями и передается человеку от птиц. Пситтакоз у детей проявляется поражением легких и симптомами интоксикации.
Эпидемиология
Инфекция хранится и размножается в организмах домашних и диких птиц. В основном это чайки, голуби, утки, попугаи, воробьи. Заболевание у них протекает в скрытой форме – без проявления симптомов. Есть вероятность эпизоотии среди птиц, а также вероятность трансовиральной передачи потомству инфекции. Возбудитель выделяется у птиц с секретом дыхательных путей, но в основном – с фекалиями. Основными путями передачи инфекции являются воздушно-пылевой и воздушно-капельный.
Дети могут заразиться, контактируя с комнатными и домашними птицами, такими как канарейки, попугаи, снегири, индейки, куры, утки и т. д. В городах угрозу представляют голуби, т. к. их фекалии загрязняют подоконники, карнизы, балконы.
Регистрируются разрозненные случаи среди детей, но есть вероятность эпидемических вспышек, которые бывают в детских коллективах, если в помещении содержат больных зараженных птиц. Восприимчивость к орнитозу высокая, но точная заболеваемость не установлена, поскольку диагностика данной болезни довольно затруднительна.
Иммунитет
С 5 по 7 день после начала заболевания в крови больного ребенка появляются специфические антитела. На 4-6 неделе болезни фиксируют максимальный титр антител. Потом напряженность гуморального иммунитета снижается, он сохраняется около 2—3 лет, после этого срока возможны повторные случаи заболевания орнитозом у детей.
Классификация
Орнитоз бывает двух форм:
К типичным случаям причисляют те, при которых случилось поражение легких. Атипичные формы – стертые, протекают по типу ОРВИ, субклинические (симптомы не проявляются), а также сюда относится орнитозный менингоэнцефалит. Типичный орнитоз может быть легким, среднетяжелым и тяжелым.
Орнитоз может быть (классификация по течению): острый (длится 1-1,5 месяца), затяжной (длится до 3 месяцев), хронический (протекает более 3 месяцев). При остром орнитозе период лихорадки длится 1-2 недели. Изменения в легких находят на протяжении 3-4 недель. После выздоровления могут быть рецидивы и обострения. При хроническом течении бывают частые рецидивы, длительно сохраняющиеся астеновегетативные нарушения, хронические изменения в дыхательных путях и легких с возможным формированием пневмосклероза. В литературе зафиксированы хронические орнитозные гепатиты и артриты.
Что провоцирует / Причины Орнитоза у детей:
Возбудитель орнитоза – хламидия Chlamydia psittaci – проникает в организм ребенка из внешней среды, где она способна сохраняться до 2-3 недель, развивается внутри клеток.

Патогенез (что происходит?) во время Орнитоза у детей:
Инфекция попадает в организм через дыхательные пути. Возбудитель размножается в клетках альвеолярного эпителия, эпителиальных клетках бронхиол, бронхов и трахеи. Как следствие – разрушаются пораженные клетки, из которых высвобождаются хламидии, а также его токсины и продукты клеточного распада. Всё это поступает в кровь, приводя к токсемии, вирусемии и сенсибилизации.
Симптоматически это проявляется симптомами общей интоксикации и поражением легких. Хламидии могут быть занесены в паренхиматозные органы (а также в миокард и ЦНС) с кровью, что приводит к тяжелым случаям орнитоза у детей. У больных с нарушенной реактивностью очищение организма от хламидий часто задерживается. Возбудитель долгое время сохраняется в клетках ретикулоэндотелия, эпителиальных клетках дыхательных путей, макрофагах. При неблагоприятных для микроорганизмов условиях возбудитель может выйти в кровь, что приводит к рецидиву или обострению заболевания.
Патоморфология
Самые большие изменения происходят в легких. Там наблюдаются мелкие, плотные, хорошо очерченные очажки красновато-фиолетового или серого оттенков (иногда они могут сливаться, поражая всю долю).
В очагах содержатся значительное количество геморрагического экссудата, нейтрофилов, спущенных клеток альвеолярного эпителия, макрофагов, скопления лейкоцитов. На плевре могут быть фибринозные наложения, случаются мелкоочаговые кровоизлияния под плевру и в ткань легких.
Такие же изменения могут быть в надпочечниках, миокарде, головном мозге, селезенке и печени. Лимфатические узлы бифуркации трахеи увеличены, полнокровны.
Симптомы Орнитоза у детей:
От 5 дней до 1 месяца длится инкубационный период, в среднем он составляет от одной до двух недель. Болезнь начинается остро, температура тела ребенка повышается до 38—39 °С, в редких случаях до 40 °С. Ребенок жалуется на головные боли, боли в мышцах, озноб. Появляются такие симптомы:
- сухой кашель
- боли в горле (иногда – рвота)
- бессонница
- общая слабость
- инъекция сосудов склер и конъюнктив
- гиперемия слизистых оболочек и ротоглотки.
Повышение температуры может быть с ремиссиями (периодически повторяющееся) или постоянное. На коже в некоторых случаях бывает пятнисто-папулезная или розеолезная аллергическая сыпь. Изменения в легких становятся все большими. Сначала врачи фиксируют явления трахеобронхита, а мелкоочаговая, сегментарная или сливная пневмония преимущественно в нижних отделах легких возникает на 3-5-й, реже – на 7-й день болезни.
При отсутствии бактериальных осложнений изменения в легких часто бывают атипичными, без отчетливых физикальных данных, и не сопровождаются одышкой. Но у большинства больных орнитозом детей после первой недели (реже – после 10-ти дней) процесс в легких прогрессирует, появляется одышка, усиливается кашель с мокротой, возможно поражение инфекцией плевры. Если появились такие изменения, это значит, что к болезни присоединилась бактериальная флора – стафилококк или грамотрицательная флора.
Также при орнитозе врачи отмечают снижение артериального давления, брадикардию, глухость сердечных тонов. У большинства больных наблюдается увеличение печени, в редких случаях – селезенки, есть вероятность жидкого стула. При тяжелых формах орнитоза встречаются явления менингизма, вегетативные расстройства, клиническая картина серозного менингита.
В периферической крови при неосложненном орнитозе отмечаются лейкопения, анэозинофилия с лимфоцитозом; СОЭ умеренно повышена.
С помощью рентгенологического исследования вычисляют воспалительные очаги в прикорневой зоне или центральной части легких, с одной или с двух сторон.
Диагностика Орнитоза у детей:
Орнитоз диагностируют по клинико-эпидемиологическим и лабораторным данным. Если ребенок тесно общался с птицами, которые заболели или умерли, и у него появляется атипичная пневмония с тенденцией к длительному торпидному течению, у него подозревают орнитоз.
В постановке диагноза важны лабораторные исследования. На данный момент чаще всего используют такие методы как ПЦР и ИФА.
Лечение Орнитоза у детей:
Врачи прописывают при орнитозе у детей прием антибиотиков. В большинстве случаев прописывают эритромицин, левомицетин, азитромицин курсом от 5 до 10 дней в дозе, соответствующей возрасту больного. Если есть бактериальные осложнения, применяют цефалоспорины и аминогликозиды.
Тяжелые случаи орнитоза лечатся кортикостероидными гормонами, которые применяются от 5 до 7 дней. Также рекомендовано стимулирующее и симптоматическое лечение.
Прогноз благоприятный. Летальный исход случается крайне редко и исключен при своевременной диагностике и правильном лечении.
Профилактика Орнитоза у детей:
Профилактические меры начинаются с выявления данного заболевания у птиц. Самое большое внимание следует обратить на птиц, которых разводят в домашнем хозяйстве, и на декоративных птиц. В птицеводческих хозяйствах имеют значение карантинные мероприятия, если там есть вспышки орнитоза. За импортируемой птицей должен быть строгий ветеринарный надзор.
У детей воспитывают санитарно-гигиенические навыки, необходимые при уходе за декоративными птицами, к примеру, за попугаями. Больной орнитозом ребенок должен быть полностью изолирован, пока врачи не зафиксируют полное выздоровление. Мокроту и выделения больного дезинфицируют 5% раствором лизола или хлорамина в течение 3 часов или кипятят в 2% растворе натрия гидрокарбоната в течение 30 минут. Специфическая профилактика не разработана.
К каким докторам следует обращаться если у Вас Орнитоз у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Орнитоза у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Читайте также:

