Аутоиммунный гепатит что это такое и можно ли вылечить
Обновлено: 12.05.2024
Аутоиммунный гепатит (АИГ) – хроническое заболевание печени неизвестной этиологии, характеризующееся перипортальным или более обширным воспалением, и протекающее со значительной гипергаммаглобулинемией и появлением в сыворотке широкого спектра аутоантител. Современные представления о патогенезе АИГ предусматривают взаимодействие факторов окружающей среды, нарушения механизмов иммунной толерантности и генетической предрасположенности. Это взаимодействие индуцирует Т-клеточные иммунные реакции против антигенов гепатоцитов, что ведет к развитию прогрессирующих некровоспалительных и фибротических изменений в печени.
Классификация
На основании профиля серологических маркеров различают 2 типа АИГ. Выделение 3-го типа АИГ большинством специалистов не поддерживается, так как его серологический маркер (анти-SLA) встречается как при АИГ 1-го типа, так и при АИГ 2-го типа.
При АИГ 1-го типа встречаются АNА и SMA или оба вида аутоантител; 80% всех случаев АИГ относятся к 1-му типу. 70% пациентов – женщины, пик заболеваемости приходится на возраст от 16 до 30 лет. 50% пациентов старше 30 лет, 23% старше 60 лет. Часто (15-34% случаев) встречаются ассоциации с другими аутоиммунными заболеваниями, такими как аутоиммунный тиреодит, ревматоидный артрит, целиакия, язвенный колит и другие. На момент установления диагноза цирротическая стадия болезни констатируется у 24%.
АИГ 2-го типа характеризуется положительными анти-LKM-1 и/или анти-LC1 и/или анти-LC3 аутоантителами. Подавляющее большинство (80-96%) больных АИГ 2-го типа – дети. Данный тип характеризуется высокой частотой сопутствующих иммуноопосредованных заболеваний, нередко острым дебютом и быстрым прогрессированием до стадии цирроза.
Диагностика
Скрининговое обследование на АИГ не проводится ввиду относительной редкости заболевания и отсутствия надежных скрининговых маркеров. Вместе с тем АИГ следует включать в круг дифференциального диагноза в случаях любого гепатита неуточненной этиологии, а также известной этиологии при атипичном течении, принимая во внимание возможность развития перекрестных синдромов. Следует учитывать, что женщины болеют чаще мужчин (3-4 : 1).
Диагностические критерии АИГ и система оценки были разработаны Международной группой по изучению АИГ (IAIGH) в 1993 и пересмотрены в 1999 (таблица 1).
Таблица 1. Диагностические критерии АИГ (IAIGH, 1999)
Перипортальный гепатит с умеренной и выраженной активностью с лобулярным гепатитом или без него, либо с наличием центропортальных мостовидных некрозов, но без поражения желчных протоков, четко определяемых гранулем или других заметных изменений, предполагающих другую этиологию
Повышение активностисывороточных аминотрансфераз сыворотки, особенно (но не исключительно) при незначительном повышении ЩФ. Нормальное содержание в сыворотке
Серопозитивность по ANA, SMA или анти-LKM-1 в титре более 1:80. Низкие титры (особенно по анти-LKM-1) могут быть у детей. Серонегативность по AMA
Потребление алкоголя менее 50 г/сут, нет сведений о недавнем применении гепатотоксических лекарств. Могут быть включены пациенты, которые употребляли большее количество алкоголя и потенциально
гепатотоксические препараты, если доказано повреждение печени после отказа от алкоголя и отмены лекарств
Пересмотренная международная система оценки была создана специально для проведения клинических исследований, чтобы их можно было сравнивать между собой (таблица 2); также она может быть применима в диагностически неясных случаях, когда описательных критериев, приведенных в таблице 1, недостаточно (Уровень В).
Таблица 2. Международная система оценки для диагностики АИГ (IAIGH, 1999)
Таблица 3. Упрощенные диагностические критерии АИГ
Определенный АИГ ≥7 баллов
Вероятный АИГ ≥6 баллов
Для установления диагноза АИГ необходимо наличие определенных клинических и лабораторных признаков, а также исключение других причин, которые могут вызывать развитие хронического гепатита или цирроза печени. Необходимо уточнить количество потребляемого алкоголя и применение гепатотоксичных препаратов. При оценке лабораторных показателей следует обратить внимание на изменения в показателях АЛТ, АСТ, ЩФ, уровня альбумина, γ-глобулинов, IgG и билирубина. АИГ может протекать бессимптомно в 34-45% случае. Как правило, эти пациенты – мужчины, уровень АЛТ у них значительно ниже в момент дебюта заболевания, чем у пациентов с клиническими проявлениями. Гистологические изменения, включая частоту перехода в цирроз, одинаковы как у бессимптомных больных, так и у пациентов с клиническими проявлениями. Учитывая тот факт, что у 70% бессимптомных пациентов в дебюте по мере прогрессирования болезни развиваются клинические проявления, эта группа должна находиться под тщательным наблюдением.
Рекомендуется проведение биопсии печения в дебюте болезни всем больным как для постановки диагноза, так и для принятия решения о проведения терапии. В случае острого дебюта отсутствие гистологических данных не должно быть препятствием для начала терапии. Основным гистологическим признаком АИГ является межуточный (перипортальный, interface) гепатит, к типичным признакам также относят лимфоплазмацитарную инфильтрацию. Необходимо отметить, что специфических гистологических признаков АИГ не существует, и отсутствие плазмацитарной инфильтрации не исключает диагноз. В инфильтрате могут присутствовать эозинофилы; наблюдаются ступенчатые, мостовидные, мультилобулярные некрозы. Портальные повреждения обычно не затрагивают желчные протоки, гранулемы встречаются редко. Иногда встречаются центролобулярные (в 3-й зоне ацинуса) повреждения. При всех формах заболевания присутствует выраженный в той или иной степени фиброз.
Антинуклеарные аутоантитела (АNА), антигладкомышечные аутоантитела (SMA), антитела к микросомам печени и почек 1 типа (анти-LKM-1) и антитела к печеночно-цитозолному антигену (анти-LC1) являются основными серологическими маркерами диагностики АИГ. У 96% взрослых пациентов с АИГ определяются ANA, SMA или оба маркера, у 4% имеются анти-LKM-1 или анти-LC1. Обычно при наличии анти-LKM-1 аутоантител ANA и SMA отрицательные.
Аутоантитела неспецифичны для АИГ, и их образование зависит от особенностей течения болезни. Низкий титр аутоантител не исключает диагноз АИГ, также как только их высокий титр при отсутствии других признаков не подтверждает этот диагноз. У серонегативных пациентов выработка аутоантител может манифестировать позднее, по мере прогрессирования заболевания. У взрослых титр аутоантител слабо коррелирует с активностью, характером течения болезни и ответом на проводимую терапию.
Лечение
Три РКИ продемонстрировали, что у пациентов с активностью АСТ выше нормы в 10 раз или у пациентов с повышением АСТ более чем в 5 раз в сочетании с повышением уровня γ-глобулинов в 2 раза в отсутствие адекватного лечения смертность достигает 60% в течение 6 мес. Наличие в дебюте гистологических признаков в виде мостовидных некрозов или мультилобулярных некрозов приводит к прогрессированию в цирроз у 82% нелеченых пациентов и ассоцированы с 45%-ной смертностью в течение 5 лет. Данные лабораторные и гистологические признаки активности болезни в дебюте служат абсолютным показанием для лечения глюкокортикостероидами (ГКС). Системные проявления АИГ, такие как выраженная слабость и артралгия, также являются абсолютным показанием к лечению, вне зависимости от других показателей (Уровень А).
Иммуносупрессивная терапия эффективна только у больных с клиническими, лабораторными или гистологическими признаками активного воспаления в печени. У пациентов с неактивным циррозом эффект от терапии сомнителен (Уровень С). При этом у них имеется повышенный риск развития побочных эффектов: гипоальбуминемия и портосистемное шунтирование крови могут повлиять на связывание преднизолона с белками крови и распределение свободного преднизолона. У пациентов с декомпенсированным сахарным диабетом, остеопенией, психическими расстройствами или выраженным остеопорозом надо тщательно обосновать необходимость назначения ГКС. Азатиоприн не следует назначать больным с выраженной цитопенией (лейкоциты ниже 2,5×109/л, тромбоциты ниже 50×109/л) или с известной непереносимостью препарата (таблица 4).
Таблица 4. Показания к проведению иммуносупрессивной терапии
Бессимптомное течение с нормальными или субнормальными показателями сывороточной АСТ и уровня γ-глобулинов
Компрессионные переломы, психоз, декомпенсированный диабет, неконтролируемая артериальная гипертензия, непереносимость азатиоприна
Остеопения, эмоциональная лабильность, гипертензия, диабет или цитопения (лейкоциты ≤ 2,5×109/л, тромбоциты ≤ 50×109/л)
Препаратами выбора служат преднизолон или метилпреднизолон; применение последнего может быть сопряжено с меньшими побочными эффектами ввиду практически отсутствующей минералокортикоидной активности. С целью повышения эффективности иммуносупрессии и уменьшения дозы и, соответственно, побочного действия кортикостероидов к терапии нередко добавляется азатиоприн, представляющий собой производное 6-меркаптопурина и обладающий антипролиферативной активностью (таблица 5). В случае недостаточной эффективности стандартных схем иммуносупрессии возможно повышение дозы азатиоприна до 150 мг в сутки, что не сопровождается существенным увеличением частоты побочных эффектов.
Таблица 5. Схемы лечения аутоиммунного гепатита
Обе схемы лечения продемонстрировали одинаковую эффективность: 5- и 10-летняя выживаемость больных на фоне адекватной иммуносупрессии составляет 94% и 90% соответственно (Уровень В). Однако полное исчезновение биохимических, серологических и гистологических признаков заболевания, позволяющее ставить вопрос об отмене препаратов, наблюдается лишь у 31%. Морфологическая ремиссия АИГ запаздывает на 3-6 мес по отношению к биохимической, поэтому перед отменой иммуносупрессоров обязательно выполнение биопсии печени для констатации исчезновения гистологических признаков активности АИГ.
Результаты стандартной иммуносупрессии могут быть представлены 4 вариантами: ремиссией, рецидивом, резистентностью и стабилизацией.
Ремиссия представляет собой полную нормализацию всех параметров, отражающих активность гепатита, включая гистологические. В связи с невозможностью с патогенетической позиции достижения полного выздоровления от АИГ, данный исход является оптимальным вне зависимости от режима терапии и ассоциирован с наилучшим отдаленным прогнозом. Через 24 мес лечения ремиссия констатируется у 65-75% больных.
Рецидив констатируется по повышению активности аминотрансфераз, с клинической симптоматикой либо без нее, во время лечения, в период снижения доз иммуносупрессоров или на фоне полной отмены препаратов. По обобщенным литературным, а также нашим собственным данным, рецидив наблюдается у 50% пациентов в течение 6 мес после прекращения терапии и у 80% через 3 года. Он ассоциирован с формированием цирроза у 38% больных и развитием печеночной недостаточности у 14%. Рецидив нередко требует возвращения к инициирующим дозам преднизолона и азатиоприна, либо, по крайней мере, их повышения по сравнению с исходными.
Резистентность характеризуется прогрессированием клинических, биохимических и гистологических проявлений болезни на фоне адекватной иммуносупрессивной терапии. Данный вариант наблюдается у 10% больных и требует тщательной ревизии первоначального диагноза, предусматривающей исключение других причин острого или хронического гепатита. Если диагноз АИГ подтверждается, такой пациент рассматривается в качестве кандидата на альтернативные методы терапии, либо, в случае неуклонного прогрессирования, на трансплантацию печени.
Альтернативная терапия
Будесонид. Синтетический ГКС, характеризующийся активным печеночным метаболизмом, высокой аффинностью к глюкокортикоидным рецепторам и низкой частотой системных побочных эффектов. При пероральном приеме препарат на 90% задерживается печенью, где в высоких концентрациях воздействует на патогенные лимфоциты. Исследования продемонстрировали неоднозначные результаты относительно частоты достижения ремиссии АИГ. Формирование портосистемных шунтов увеличивает системную концентрацию препарата. По-видимому, основное преимущество будесонида перед преднизолоном заключается в возможности длительной поддерживающей терапии у больных на доцирротической стадии с рано проявляющимся побочным действием системных стероидов (Уровень С).
Микофенолат мофетила. Конкурентный ингибитор инозин-монофосфат-дегидрогеназы, необходимой для синтеза пуриновых нуклеотидов. Действие микофенолата ограничено активированными Т- и В-лимфоцитами, что обусловливает ограничение нежелательной системной иммуносупрессии. Ретроспективный анализ 37 пациентов, не ответивших или не переносивших лечение азатиоприном, установил, что ответ на микофенолат наблюдался лишь у половины, а в случае отсутствия эффекта от азатиоприна терапия микофенолатом не привела к желаемому результату в 75% случаев. Дозировка – 2 г/сут (Уровень С).
Циклоспорин А. Липофильный циклический 11-аминокислотный пептид, продуцируемый Tolipocladium inflatum. Механизм его действия определяется влиянием на Са2+-зависимую передачу внутриклеточного сигнала и следующим за этим подавлением Т-клеточного звена иммунного ответа посредством репрессии гена, кодирующего интерлейкин-2. В ряде исследований продемонстрирована индукция стойкой ремиссии АИГ на фоне лечения циклоспорином как у детей, так и взрослых. Дозировка – 2,5-5 мг/кг/сут. Широкое применение циклоспорина в качестве препарата первой линии ограничено серьезными нежелательными явлениями, такими как артериальная гипертензия, нефропатия, гиперлипидемия, инфекционные осложнения и др (Уровень С).
Такролимус. Макролидное лактоновое соединение, имеющее аналогичный циклоспорину механизм действия, но более выраженный и опосредованный связыванием с другим иммунофиллином. Пилотные исследования продемонстрировали возможность достижения биохимической ремиссии на фоне длительного применения такролимуса, в том числе у стероидорезистентных больных АИГ. Дозировка – 0,05-0,1 мг/кг/сут Из нежелательных явлений чаще всего отмечается умеренное повышение креатитнина и азота мочевины (Уровень С).
Циклофосфамид. Назначается вместе с преднизолоном в дозе 1–1,5 мг/кг/сут, как правило, у пациентов с непереносимостью азатиоприна. У некоторых больных возможен альтернирующий прием (50 мг через день). Длительное лечение нежелательно ввиду риска гематологических побочных эффектов (Уровень С).
Другие альтернативные стратегии лечения АИГ включают назначение метотрексата, 6-тиогуанина, инфликсимаба (анти-TNFα) и ритуксимаба (анти-CD20), однако клинических данных на сегодняшний день недостаточно для оценки профиля эффективности и безопасности.
Возможность отмены иммуносупрессоров рассматривается у пациентов не ранее чем через 6 мес после достижения полной клинической, биохимической и иммунологической ремиссии. Перед отменой целесообразно выполнение биопсии печени для констатации отсутствия некровоспалительных изменений. Учитывая высокую частоту рецидива заболевания, обязательно динамическое наблюдение за пациентом с исследованием биохимических показателей (АЛТ, АСТ) 1 раз в 3 мес, иммунологических (γ-глобулинов, IgG) – 1 раз в 6 мес.
Приблизительно у 10% больных АИГ трансплантация печени является единственным способом ликвидации непосредственной угрозы жизни. Обычно основанием для включения в лист ожидания служит появление признаков декомпенсации цирроза или кровотечение из варикозномрасширенных вен пищевода. Однако явная резистентность к проводимой терапии и неуклонное прогрессирование заболевания позволяют рассматривать в качестве кандидатов на пересадку печени больных на доцирротической стадии. В этих случаях показания определяются как множественными рецидивами на фоне применения стандартных и альтернативных схем медикаментозной иммуносупрессии, так и выраженными побочными эффектами стероидной и цитостатической терапии: остеопорозом, артериальной гипертензией, изъязвлениями пищеварительного тракта, диабетом, лейкопенией. В качестве признаков угрожающей печеночной недостаточности рассматриваются нарастающая гипербилирубинемия и мультилобулярные некрозы в биоптате.
Прогноз трансплантации благоприятный: 5-летняя выживаемость превышает 90%. Вместе с тем следует учитывать возможность рецидива, частота которого составляет в среднем 10-35%. Риск рецидива выше у HLA DR3-позитивных больных, при наличии анти-LKM-1, дискордантности донора и реципиента по HLA, ранней отмене кортикостероидов, применении такролимуса в посттрансплантационном периоде. Он также возрастает по мере увеличения срока после трансплантации. С другой стороны, фульминантная печеночная недостаточность в дебюте болезни снижает вероятность ее повторной манифестации. Рецидив АИГ сопряжен с существенным риском гибели трансплантата. В то же время посттрансплантационная иммуносупрессия, в первую очередь ГКС, не только предотвращают отторжение, но и позволяют купировать рецидив.
Прогноз
Данные по естественному течению заболевания без лечения получены преимущественно из исследований, опубликованных до широкого применения иммуносупрессоров при лечении АИГ и до открытия вируса гепатита С. Из этих исследований следовало, что до 40% пациентов с тяжелым течением заболевания без лечения умирали в течение 6 мес от момента установления диагноза. У выживших с высокой частотой развивался цирроз с прогрессированием печеночной недостаточности и портальной гипертензии.
Нелеченый АИГ имеет плохой прогноз: 5-летняя выживаемость составляет 50%, 10-летняя – 10%. В среднем у 30% взрослых пациентов на момент установления диагноза имеются гистологические признаки цирроза. Цирроз формируется через 5 лет только у 17% больных с перипортальным гепатитом по данным первой биопсии, но при наличии мостовидных или мультилобулярных некрозов такой исход вероятен у 82%. Цирротическая трансформация в случае адекватного лечения, по-видимому, не снижает 10-летнюю выживаемость, что определяет обоснованность агрессивной терапевтической тактики у этих пациентов (Уровень С). Применение современных схем иммуносупрессии позволяет эффективно контролировать течение заболевания. Так, по данным 1990-х гг., 20-летняя выживаемость больных АИГ на фоне терапии превышает 80%.
Информация
Источники и литература
Информация
Аутоиммунный гепатит – это прогрессирующее хроническое воспаление печени, протекающее с признаками перипортального или более обширного поражения и наличием аутоантител к печеночным клеткам. Клинические проявления включают астеновегетативные расстройства, желтуху, боли в правом подреберье, кожные сыпи, гепатомегалию и спленомегалию, аменорею у женщин, гинекомастию – у мужчин. Диагностика основывается на серологическом выявлении антинуклеарных антител (ANA), тканевых антител к гладкой мускулатуре (SMA), антител к микросомам печени и почек и др., гипергаммаглобулинемии, увеличения титра IgG, а также данных биопсии печени. Основу лечения составляет иммуносупрессивная терапия глюкокортикостероидами.
МКБ-10
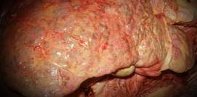
Общие сведения
В структуре хронических гепатитов в современной гастроэнтерологии на долю аутоиммунного поражения печени приходится 10-20% случаев у взрослых и 2% - у детей. Женщины заболевают аутоиммунным гепатитом в 8 раз чаще, чем мужчины. Первый возрастной пик заболеваемости приходится на возраст до 30 лет, второй – на период постменопаузы. Течение аутоиммунного гепатита носит быстропрогрессирующий характер, при котором довольно рано развивается цирроз печени, портальная гипертензия и печеночная недостаточность, ведущая к гибели пациентов.

Причины
Вопросы этиологии аутоиммунного гепатита изучены недостаточно. Считается, что в основе развития аутоиммунного гепатита лежит сцепленность с определенными антигенами главного комплекса гистосовместимости (HLA человека) - аллелями DR3 или DR4, выявляющаяся у 80-85% пациентов. Предположительными триггерными факторами, запускающими аутоиммунные реакции у генетически предрасположенных индивидуумов, могут выступать вирусы Эпштейна–Барр, гепатитов (А, В, С), кори, герпеса (HSV-1 и HHV-6), а также некоторые лекарственные препараты (например, интерферон). Более чем у трети пациентов с аутоиммунным гепатитом выявляются и другие аутоиммунные синдромы – тиреоидит, болезнь Грейвса, синовит, язвенный колит, болезнь Шегрена и др.
Патогенез
Основу патогенеза аутоиммунного гепатита составляет дефицит иммунорегуляции: снижение субпопуляции Т-супрессорных лимфоцитов, что приводит к неуправляемому синтезу В-клетками IgG и разрушению мембран клеток печени – гепатоцитов, появлению характерных сывороточных антител (ANA, SMA, анти-LKM-l).
Классификация
В зависимости от образующихся антител различают аутоиммунный гепатит I (анти-ANA, анти-SMA позитивный), II (анти-LKM-l позитивный) и III (анти-SLA позитивный) типов. Каждый из выделяемых типов заболевания характеризуется своеобразным серологическим профилем, особенностями течения, откликом на иммуносупрессивную терапию и прогнозом.
- I тип. Протекает с образованием и циркуляцией в крови антинуклеарных антител (ANA) – у 70-80% пациентов; антигладкомышечных антител (SMA) у 50-70% больных; антител к цитоплазме нейтрофилов (pANCA). Аутоиммунный гепатит I типа чаще развивается в возрасте от 10 до 20 лет и после 50 лет. Характеризуется хорошим откликом на иммуносупрессивную терапию, возможностью достижения стойкой ремиссии в 20% случаев даже после отмены кортикостероидов. При отсутствии лечения в течение 3 лет формируется цирроз печени.
- II тип. В крови у 100% пациентов присутствуют антитела к микросомам печени и почек 1-го типа (анти-LKM-l). Данная форма заболевания развивается в 10-15% случаях аутоиммунного гепатита, преимущественно в детском возрасте и характеризуется высокой биохимической активностью. Аутоиммунный гепатит II типа более резистентен к иммуносупрессии; при отмене препаратов часто наступает рецидив; цирроз печени развивается в 2 раза чаще, чем при аутоиммунном гепатите I типа.
- III тип. Образуются антитела к растворимому печеночному и печеночио-панкреатическому антигену (анти-SLA и анти-LP). Довольно часто при этом типе выявляются ASMA, ревматоидный фактор, антимитохондриальные антитела (АМА), антитела к антигенам печеночной мембраны (антиLMA).
К вариантам атипичного аутоиммунного гепатита относят перекрестные синдромы, включающие также признаки первичного билиарного цирроза, первичного склерозирующего холангита, хронического вирусного гепатита.
Симптомы аутоиммунного гепатита
В большинстве случаев патология манифестирует внезапно и в клинических проявлениях не отличается от острого гепатита. Вначале протекает с выраженной слабостью, отсутствием аппетита, интенсивной желтухой, появлением темной мочи. Затем в течение нескольких месяцев разворачивается клиника аутоиммунного гепатита. Реже начало заболевания постепенное; в этом случае преобладают астеновегетативные расстройства, недомогание, тяжесть и боли в правом подреберье, незначительная желтуха. У части пациентов аутоиммунный гепатит начинается с лихорадки и внепеченочных проявлений.
Период развернутых симптомов аутоиммунного гепатита включает выраженную слабость, чувство тяжести и боли в правом подреберье, тошноту, кожный зуд, лимфаденопатию. Для аутоиммунного гепатита характерны непостоянная, усиливающаяся в периоды обострений желтуха, увеличение печени (гепатомегалия) и селезенки (спленомегалия). У трети женщин при аутоиммунном гепатите развивается аменорея, гирсутизм; у мальчиков может наблюдаться гинекомастия. Типичны кожные реакции: капиллярит, пальмарная и волчаночноподобная эритема, пурпура, акне, телеангиэктазии на коже лица, шеи и рук. В периоды обострений аутоиммунного гепатита могу наблюдаться явления преходящего асцита.
К системным проявлениям аутоиммунного гепатита относится рецидивирующий мигрирующий полиартрит, затрагивающий крупные суставы, но не приводящий к их деформации. Достаточно часто аутоиммунный гепатит протекает в сочетании с язвенным колитом, миокардитом, плевритом, перикардитом, гломерулонефритом, тиреоидитом, витилиго, инсулинозависимым сахарным диабетом, иридоциклитом, синдромом Шегрена, синдромом Кушинга, фиброзирующим альвеолитом, гемолитической анемией.
Диагностика
Аутоиммунный гепатит диагностируется в ходе консультации гепатолога или гастроэнтеролога. Критериями патологии служат серологические, биохимические и гистологические маркеры. Согласно международным критериям, об аутоиммунном гепатите можно говорить в случае, если:
- в анамнезе отсутствуют гемотрансфузии, прием гепатотоксичных препаратов, злоупотребление алкоголем;
- в крови не обнаруживаются маркеры активной вирусной инфекции (гепатитов А, В, С и др.);
- уровень γ-глобулинов и IgG превышает нормальные показатели в 1,5 и более раза;
- значительно повышена активность АсТ, АлТ;
- титры антител (SMA, ANA и LKM-1) для взрослых выше 1:80; для детей выше 1: 20.
Биопсия печени с морфологическим исследованием образца тканей позволяет выявить картину хронического гепатита с признаками выраженной активности. Гистологическими признаками аутоиммунного гепатита служат мостовидные или ступенчатые некрозы паренхимы, лимфоидная инфильтрация с обилием плазматических клеток. Инструментальные исследования (УЗИ печени, МРТ печени и др.) при аутоиммунном гепатите не имеют самостоятельного диагностического значения.
Лечение аутоиммунного гепатита
Патогенетическая терапия заболевания заключается в проведении иммуносупрессивной терапии глюкокортикостероидами. Такой подход позволяет снизить активность патологических процессов в печени: повысить активность Т-супрессоров, уменьшить интенсивность аутоиммунных реакций, разрушающих гепатоциты.
Обычно иммуносупрессивная терапия при аутоиммунном гепатите проводится преднизолоном или метилпреднизолоном в начальной суточной дозе 60 мг (1-ю неделю), 40 мг (2-ю неделю), 30 мг (3-4-ю недели) со снижением до 20 мг в качестве поддерживающей дозы. Уменьшение суточной дозировки проводят медленно, учитывая активность клинического течения и уровень сывороточных маркеров. Поддерживающую дозу пациент должен принимать до полной нормализации клинико-лабораторных и гистологических показателей. Лечение аутоиммунного гепатита может продолжаться от 6 месяцев до 2-х лет, а иногда и на протяжении всей жизни.
При неэффективности монотерапии возможно введение в схему лечения аутоиммунного гепатита азатиоприна, хлорохина, циклоспорина. В случае неэффективности иммуносупрессивного лечения аутоиммунного гепатита в течение 4-х лет, множественных рецидивах, побочных эффектах терапии ставится вопрос и трансплантации печени.
Прогноз и профилактика
При отсутствии лечения аутоиммунного гепатита заболевание неуклонно прогрессирует; спонтанные ремиссии не наступают. Исходом аутоиммунного гепатита служит цирроз печени и печеночная недостаточность; 5-летняя выживаемость не превышает 50%. С помощью своевременной и четко проводимой терапии удается достичь ремиссии у большинства пациентов; при этом выживаемость в течение 20 лет составляет более 80%. Трансплантация печени дает результаты, сопоставимые с лекарственно достигнутой ремиссией, 5-летний прогноз благоприятен у 90% пациентов.
При аутоиммунном гепатите возможна лишь вторичная профилактика, включающая регулярное наблюдение гастроэнтеролога (гепатолога), контроль активности печеночных ферментов, содержания γ-глобулинов, аутоантител для своевременного усиления или возобновления терапии. Пациентам с аутоиммунным гепатитом рекомендуется щадящий режим с ограничением эмоциональных и физических нагрузок, соблюдение диеты, отвод от профилактической вакцинации, ограничение приема лекарственных препаратов.
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменени
 |
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменения, приводящие к фиброзу и циррозу печени (ЦП). Генетически детерминированная предрасположенность к этому заболеванию выявлена во многих исследованиях. Доказано, что большая часть больных АГ имеют фенотип по антигенам главного комплекса гистосовместимости HLA-B8, HLA-DR4, DR3 и DR52a. Пусковой агент пока неизвестен, однако есть некоторые данные о роли вирусов гепатита [31, 26], кори [27], Эпштейн-Барр вируса [32], а также интерферона (ИФН) [14] как инициаторов начала АГ.
| Аутоиммунный гепатит (АГ) — хроническое воспалительное заболевание печени невыясненой этиологии, характеризующееся определенными лабораторными, клиническими и гистологическими признаками. Болеют им в основном женщины молодого возраста |
АГ — это прогрессирующее воспаление печени, характеризующееся наличием некрозов в перипортальной, септальной зонах (ступенчатые некрозы) или, более широко, лобулярным гепатитом (ЛГ), гипергаммаглобулинемией и аутоантителами в сыворотке крови [7]. Портальные тракты печени на биоптатах находят расширенными с накоплением в них обширных инфильтратов, имеющих разный клеточный состав: лимфоциты, макрофаги, плазматические клетки. ЛГ — дольковый гепатит, когда некрозы выявляются во второй и третьей зонах ацинусов, а также обнаруживается внутридольковая лимфоидноклеточная инфильтрация, которая выражена значительно больше, чем инфильтрация портальных трактов. ЛГ является частью гистологической картины АГ, если он выявляется одновременно с перипортальным гепатитом. По гистологической картине на АГ может указывать, кроме вышеперечисленного, наличие многоядерных гепатоцитов [2].
Наконец, картина фиброза может присутствовать в той или иной степени даже при умеренной степени активности АГ, а в запущенных случаях, особенно при отсутствии эффективной терапии, формируются мостовидные некрозы и, в конце концов, ЦП.
Хотя гистологическая картина при АГ очень характерна, все-таки она неспецифична. Отличительной чертой АГ является обнаружение в биоптатах преимущественно плазматических клеток, так как выраженная инфильтрация в портальной, перипортальной зоне, вовлечение в процесс долек печени — в равной мере присущи и хроническому вирусному гепатиту (ХВГ).
Одной из основных клинических характеристик АГ является обнаружение аутоантител к клеточным и субклеточным структурам клеток разных органов [22]. Типичным маркером АГ являются антитела к ядрам клеток — ANA. Из других маркеров выявляются антитела к клеткам гладкой мускулатуры (SMA), антитела к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек (LKM), антитела к растворимому печеночному антигену (SLA), антитела к антигенам (цитокератины 8, 18) мембран гепатоцитов — LMA.
Клинические проявления АГ очень разнообразны [1, 3, 4]. С одной стороны, встречаются бессимптомные формы, когда случайно выявляется повышение АЛТ, АСТ, а с другой — острое начало болезни с тяжелым течением вплоть до развития фульминантного гепатита (ФГ).
Нередко заболевание начинается незаметно с астеновегетативных проявлений, болей в области правого предреберья, незначительной желтухи. Однако у большинства больных АГ начало болезни острое, как при остром вирусном гепатите (ОВГ), и при осмотре пациента врач впервые выявляет признаки хронического гепатита (ХГ) — телеангиоэктазии, пальмарную эритему, увеличение печени и селезенки, а также изменения в анализах крови — гипергаммаглобулинемию, увеличение IgG, снижение содержания общего белка, резкое увеличение СОЭ. Лейкопения и тромбоцитопения наблюдаются у больных на поздних стадиях болезни или при развившихся гиперспленизме и синдроме портальной гипертензии.
Когда АГ впервые проявляется желтухой, как при ОВГ, приходится дифференцировать его от гепатитов А, В, Е и особенно С, при котором антитела в сыворотке крови могут появляться через достаточно продолжительное время после начала болезни. Желтуха у пациентов с АГ может быть разной степени выраженности, часто появляется на поздних стадиях заболевания, бывает непостоянной и усиливается в период обострений. В общем же у большинства больных чаще всего изменяются аминотрансферазы, нежели щелочная фосфотаза (ЩФ) или билирубин.
| Аутоиммунный гепатит был выделен из группы болезней печени и впервые описан как отдельная нозология в начале 50-х годов [33]. В научной литературе существовал под разными названиями. Термин люпоидный гепатит, который часто использовался в нашей стране, ввел в 1956 году Дж. Маккей с соавторами в журнале Lancet, так как при этом заболевании нередко в сыворотке крови больных выявлялись волчаночные клетки. Потом, в последующие годы, люпоидный, или классический, АГ стали называть аутоиммунным активным хроническим гепатитом, но в 1993 году Международная группа по изучению болезней печени предложила термин АГ, а также критерии установления его диагноза [17] |
Для АГ характерно поражение кожи в виде геморрагической сыпи, оставляющей после себя пигментацию. Из других симптомов встречаются волчаночная и узловатая эритемы, очаговая склеродермия, пальмарная эритема и телеангиоэктазии. У всех больных выявляются изменения в эндокринной системе — аменорея, угри, гирсутизм, стрии. Диагностическое значение отдельных симптомов болезни при АГ неодинаково. К наиболее значимым относятся длительная лихорадка и арталгии. В большинстве случаев АГ они присутствуют одновременно, являясь наиболее частыми и постоянно встречающимися жалобами больных [4].
Один из вариантов начала АГ — появление лихорадки с внепеченочными проявлениями, из которых следует назвать аутоиммунный тиреоидит, язвенный колит, гипертиреоидизм, гемолитическая анемия, идеопатическая тромбоцитопения, сахарный диабет, целиакия, полимиозит, фиброзирующий альвеолит, гломерулонефрит и т. д. Желтуха при этом варианте появляется позже [20].
Часто АГ сопровождается бесплодием, однако при возникновении беременности и последующих родах на фоне компенсированного процесса это не влияет на течение АГ и судьбу ребенка даже при постоянном приеме преднизолона (ПР) [30]. Беременность на стадии сформировавшегося ЦП и синдрома портальной гипертензии, которые выявляются у трети больных на момент выявления АГ, нежелательна [3].
В отличие от ХВГ течение АГ у больных непрерывно прогрессирующее, без самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических процессов не происходит. Прогноз течения АГ хуже у пациентов с острым началом болезни по типу ОВГ, с наличием признаков холестаза, асцитом, повторными эпизодами острой печеночной энцефалопатии (ОПЭ). Как правило, больные, пережившие критический период, имеют лучший прогноз.
Диагноз АГ выставляется на основании соответствия лабораторных и гистологических данных, отсутствия маркеров ВГ, исключения злоупотребления алкоголем и контактов с препаратами крови, гипотоксическими веществами, повышения гамма-глобулинов не менее чем в 1,5 раза выше нормы. Повреждение желчных протоков, отложение меди, гемосидероз, при которых также могут выявляться ЛГ и ступенчатые некрозы, предполагают другую причину ХГ и исключают диагноз АГ. ANA, SMA и LRM-1 должны быть в титрах не менее 1:80 у взрослых и 1:20 у детей (рекомендации Международной группы, 1993).
Дифференциальный диагноз между АГ и другими аутоиммунными заболеваниями, в основном первичным билиарным циррозом (ПБЦ), первичным склерозирующим холангитом (ПСХ), ХВГ основывается на клинических, гистологических и иммунологических параметрах. Однако нередко выявляется так называемый overlap-синдром, когда одновременно у пациентов выявляются признаки АГ и вышеперечисленных хронических заболеваний печени. Далее они будут описываться как варианты АГ [7, 13]. Предполагаемый диагноз АГ в данном случае подразумевает сходство с клиникой АГ (жалобы на слабость, арталгии, миалгии), а биохимический анализ крови отражает преимущественно изменения холестатического порядка, имеет место кожный зуд разной степени выраженности. Пациенты с такими вариантами АГ могут быть обоего пола, любого возраста, но все же чаще это женщины в возрасте до 40 лет и моложе. На гистологии находят перипортальный гепатит с или без ЛГ, часто с поражением желчных протоков, жировой дистрофией гепатоцитов и лимфоидной инфильтацией портальных трактов в виде гранулем [7, 10].
Деление АГ на подтипы практического значения не имеет, однако следует иметь в виду, что подтип 2 АГ может быть связан с гепатитом С либо HCV может индуцировать появление АГ у генетически предрасположенных лиц. Нет данных о различиях гистологической картины при отдельных подтипах АГ
Большинство больных с ПБЦ можно точно отделить от пациентов с АГ с помощью характерных лабораторных и иммунологических данных. Однако при этом варианте наряду с характерными параметрами АГ нередко выявляются гистологические признаки холангита и АМА (антитела к антигенам внутренней поверхности мембраны митохондрий), что очень характерно для ПБЦ. Наиболее важным для подтверждения диагноза ПБЦ является обнаружение АМА подтипа М2 [6]. АМА выявляются у 20-27% больных АГ в разных титрах [19]. Это может отражать диагностические ошибки в определении иммуносерологических маркеров, другие заболевания или одну из стадий ПБЦ. Если у больного повышена щелочная фосфатаза (ЩФ), IgM сыворотки крови и обнаружена АМА — вероятен диагноз ПБЦ. Трех-шестимесячный курс лечения стероидами помогает расшифровать преобладающую патологию — при реакции на лечение можно говорить о превалировании АГ.
Установлено, что у 16% больных АГ выявляется язвенный колит (ЯК), наличие которого характерно для пациентов с ПСХ (от 40 до 60% больных). К тому же при таком сочетании — АГ и признаки ПСХ (наличие ЯК, поражение желчных протоков, слабый ответ на стероиды) — также обнаруживают фенотип HLA-B8, HLADR3, HLA DR4. Поэтому наличие кожного зуда у больных АГ и повышение ЩФ более чем в четыре раза против нормы указывают на необходимость проведения холангиографии (ХГР) и вероятность развития варианта АГ и ПСХ. Поражения желчных протоков несовместимы с диагнозом АГ. Они редки, но когда появляются у больных АГ с сопутствующей патологией кишечника или атипичным повышением ЩФ, можно допустить этот вариант АГ. Окончательный диагноз зависит от результатов ХГР. ХГР выявляет признаки склерозирующего холагнита у 42% больных АГ и ЯК. Но иногда ХГР бывает в норме у 14% больных ПСХ при гистологически подтвержденном диагнозе. Об этом необходимо помнить [24].
АГ считается заболеванием невирусной этиологии, но у 4% больных АГ выявляются антиHCV и еще у 4% — маркеры вируса гепатита В. Больные АГ, имеющие атипичное течение болезни либо плохо отвечающие на терапию стероидами, нередко имеют в сыворотке крови HCV RNA. Любопытно, что 11% больных ХВГ имеют SMA и 28% — ANA. У 62% выявляются аутоантитела к щитовидной железе и ревматоидный фактор. Большая часть этих больных имеют низкие титры SMA и ANA (1:80 и ниже), а пациенты с точным диагнозом АГ — SMA в титрах 1:160 и ANA 1:320. Поэтому больные АГ и с выявляемыми SMA или ANA в титрах ниже 1:320 могут быть отнесены к группе с превалированием вирусного заболевания [11].
Тем не менее пациенты с АГ имеют более выраженную инфильтрацию портальных трактов плазматическими клетками, более выраженные воспалительные изменения в дольках и больше ступенчатых и перисептальных некрозов по сравнению с пациентами ХВГ, особенно ХГС. У больных ХВГ/ХГС наоборот — в портальных трактах преобладает лимфоидноклеточная инфильтрация, чаще выявляется стеатоз и повреждения желчных протоков, особенно при ХГС.
У 13% взрослых больных с признаками АГ не обнаруживаются аутоантитела, а все остальные признаки — иммунологические, биохимические и гистологические, а также возраст и пол соответствуют критериям постановки диагноза АГ. Что важно, эти больные также хорошо реагируют на лечение стероидами [8, 9]. Отмечено, что с течением времени при динамическом наблюдении у некоторых из них появляются соответствующие аутоантитела, характерные для АГ.
Несмотря на разнообразие клинической картины, при АГ основой лечения является назначение преднизолона (ПР). Ответ на данную терапию — один из критериев постановки диагноза АГ. Целесообразность назначения ПР при АГ доказана в многочисленных исследованиях и обусловлена редкими самопроизвольными ремиссиями в течении болезни, высокой смертностью и ухудшением качества жизни [12, 18, 23, 28, 29]. При назначении ПР смертность удается снизить в течение пяти лет с 50 до 20%, а частоту индуцированных ремиссий довести до 80%. У большинства больных ремиссии появляются в течение первых двух лет терапии и почти у всех в последующие четыре года лечения.
Лечение ПР следует назначать всем больным АГ высокой степени активности с фиброзом и циррозом или без. У больных с умеренной степенью активности болезни назначение ПР часто определяется наличием жалоб и симптомов болезни. Больные без симптомов и с умеренной степенью активности процесса по гистологической картине не нуждаются в лечении, но должны тщательно и регулярно наблюдаться для своевременного выявления признаков прогрессирования болезни.
Как правило, начальная доза ПР составляет 20-30 мг/сутки с последующим постепенным снижением ее до поддерживающей — обычно 10 мг/сутки. Из всех схем лечения предпочтителен ежедневный прием однократно утром. Осложнения терапии наблюдаются при дозе более 10 мг/сутки. Нет точных рекомендаций по отмене или снижению дозы иммуносупрессоров, некоторые больные могут долго оставаться в ремиссии после отмены ПР.
Однако было установлено, что у большей части больных в дальнейшем, даже спустя несколько лет после ремиссии, появляются признаки обострения и часто требуется большая доза для ее достижения [15].
Комбинация ПР с азатиоприном (АЗА) может уменьшить побочные эффекты (при этом требуется небольшая доза ПР). Лучше давать 10 мг/сутки ПР с 50 мг/сутки АЗА, чем один ПР, но в большей дозе. Сам АЗА не способен индуцировать ремиссию, но его добавление к ПР поддерживает ее даже в дозе 1 мг/кг/сутки. При неэффективности лечения АЗА назначали 6-меркаптопурин с хорошим эффектом [25]. У 20% больных АГ не удается достигнуть ремиссии — чаще всего у пациентов с признаками ЦП, лиц молодого возраста, при длительном анамнезе болезни до начала терапии ПР и у больных с фенотипом HLA-B8, DR3 [28]. Побочные эффекты при назначении иммунодепрессантов редкие, это в основном диспепсический синдром, сыпи, кушингоидизм, нарушение роста и развития у детей, сахарный диабет и остеопороз у женщин в менопаузе. АЗА может индуцировать миелосупрессию, возникновение катаракты, обладает онкогенным и, возможно, тератогенным эффектами.
Лечение вариантов АГ представляет определенные трудности. Основа терапии, препарат выбора для начала лечения — и здесь ПР. При сочетании АГ и ПБЦ назначают ПР в дозе 20 мг/сутки от трех до шести месяцев, а при отсутствии эффекта — урсодезоксихолевую кислоту (УДХК) или ее коммерческие препараты (урсофальк, урсосан, урсодиол и др.) по 13-15 мг/сутки от трех до шести месяцев.
Тактика лечения больных с вариантом АГ и ПСХ та же, что и при АГ и ПБЦ. Больные АГ и ЯК отвечают на терапию ПР хуже, чем больные с одним АГ (не столь часты ремиссии, чаще и быстрее выявляют прогрессирование к ЦП). Эти пациенты, возможно, должны лечиться УДХК большими дозами (до 15-20 мг/кг/сутки), если признаки холестаза выражены.
При сочетании АГ и ХВГ назначают ПР 20 мг/сутки или 10 мг/сутки ПР и 50 мг/сутки АЗА на три–шесть месяцев, если превалируют признаки АГ. Рекомбинантный ИФН в дозе 3 млн. МЕ/сутки три раза в неделю до 6 месяцев назначают при выявлении признаков ХВГ и маркеров репликации вируса либо неэффективности стероидной терапии [21, 5]. Лечение таких больных представляет собой сложную задачу, так как ПР усиливает вирусную репликацию, а ИФН может усилить иммуноопосредованный печеночно-клеточный некроз, перевести ХВГ в АГ, который до этого мог быть в латентном состоянии, обострить течение болезни с развитием внепеченочных аутоиммунных проявлений, индуцировать выброс антител с неясным клиническим значением. Поэтому лечение состоит в правильном определении преобладания тех или иных клинических синдромов или признаков. В любом случае обострение болезни печени или внезапное появление признаков аутоиммунного заболевания у пациентов с признаками АГ, но с преобладанием вирусного поражения указывает на необходимость прерывания лечения ИФН.
Тактика лечения больных криптогенным ХГ состоит в назначении ПР 10-20 мг/сутки вместе с 50 мг/сутки АЗА до появления ремиссии или максимального эффекта.
Литература
Будесонид является глюкокортикостероидом 2-го поколения с высоким сродством к глюкокортикоидным рецепторам и минимальным системным действием. Он рассматривается как перспективный агент в терапии аутоиммунного гепатита, в особенности у пациентов с побочным
Budisonide is a 2nd generation glucocorticosteroid with high affinity to glucocorticoid receptors and minimum systemic effect. It is considered as a promising agent in therapy of autoimmune hepatitis, in particular, in patients with side effects for prednisolone.
Эффективное лечение аутоиммунного гепатита (АИГ), основанное на комбинации преднизолона с азатиоприном, было разработано почти полвека назад [1] и привело к существенному увеличению продолжительности жизни больных, которая в настоящее время сравнялась с популяционной [2].
В то же время не утихают дискуссии по поводу применения других, альтернативных схем терапии. Это обусловлено тем, что терапия АИГ является продолжительной: согласно недавним рекомендациям Европейской ассоциации по изучению печени (European Association for the Study of the Liver, EASL) она назначается на 3 года или по меньшей мере на 2 года после полной нормализации лабораторных показателей [3]. Кроме того, лечение часто является пожизненным, поскольку в достаточно небольшом проценте случаев удается достичь безмедикаментозного сохранения ремиссии. В то же время существующие режимы терапии, включающие преднизолон, приводят к большому количеству побочных эффектов, обусловленных его системным действием [3].
К сожалению, вероятно в связи с хорошей эффективностью существующей терапии, фактически не проводилось рандомизированных клинических исследований (РКИ) по применению альтернативных иммуносупрессоров при АИГ. Их действие подтверждается преимущественно описанием серий случаев и открытыми исследованиями. Исключение составляет будесонид, по применению которого существуют не только наблюдательные данные, но и результаты мультицентрового РКИ [4]. Будесонид является глюкокортикостероидом (ГКС) 2-го поколения, сродство которого к глюкокортикоидным рецепторам в 15–20 раз выше, чем у преднизолона. Кроме того, при пероральном приеме 90% его метаболизируются в печени при ее первом прохождении [4].
В проведенном M. P. Manns c соавт. в 2010 г. многоцентровом проспективном двойном слепом активно контролируемом РКИ назначение будесонида (в дозе 9 мг/сут) в комбинации с азатиоприном достоверно чаще (в 60,0% против 38,8% случаев) позволяло достичь биохимической ремиссии АИГ через 6 месяцев лечения, чем стандартная терапия преднизолоном (40 мг с последующим снижением до 10 мг) и азатиоприном. При этом системные побочные эффекты отсутствовали у 72,0% пациентов (в сравнении с 46,6% получавших преднизолон). В дальнейшем все пациенты принимали будесонид в открытом режиме. Среди пациентов, которые первоначально получали преднизолон, стероидные побочные эффекты снизились с 44,8% до 26,4% [5]. Недостатками работы M. P. Manns c соавт. является отсутствие гистологической верификации ремиссии и оценки отдаленных результатов. Но на основании полученных данных авторы сделали вывод о большей эффективности будесонида по сравнению с преднизолоном при АИГ. Этот тезис подвергался определенной критике с точки зрения эквивалентности сравниваемых доз. Существуют противоположные данные, что у части больных будесонид является менее эффективным в достижении ремиссии по сравнению с преднизолоном [6], это может быть обусловлено отсутствием возможности наращивания дозы и мальабсорбцией перорального препарата.
Однако исследование M. P. Manns c соавт. однозначно доказало следующее:
а) будесонид может использоваться при индукции ремиссии АИГ;
б) будесонид реже приводит к системным побочным эффектам, чем преднизолон;
в) пациенты, достигшие ремиссии путем назначения преднизолона, для снижения побочных эффектов ГКС могут быть переведены на терапию будесонидом с сохранением ремиссии.
Эти результаты способствовали более частому назначению будесонида при АИГ в ряде стран. Так, по данным израильского эпидемиологического исследования [7] будесонид (в качестве монотерапии или в комбинации с азатиоприном) получают 16% пациентов с установленным диагнозом АИГ. Показано, что будесонид может безопасно и эффективно применяться для индукции и поддержания ремиссии не только у взрослых, но и у детей [6].
Ограничением к применению будесонида при АИГ является стадия цирроза печени, так как в этом случае наличие портокавальных шунтов увеличивает системную концентрацию препарата, и, кроме того, растет риск тромбозов, в особенности в зоне портального кровотока [8–10].
Широкому применению будесонида при лечении АИГ препятствует ограниченное количество данных по долговременному применению препарата (возможность продолжительного поддержания ремиссии) и оптимальному варианту снижения дозы. Однако в последние годы ряд гепатологических ассоциаций выпустили рекомендации по лечению АИГ, включающие применение схем с будесонидом.
Отдельную проблему составляет лечение так называемых перекрестных (или вариантных) синдромов, наиболее распространенным из которых является комбинация АИГ и первичного билиарного цирроза (АИГ/ПБЦ).
Следует отметить, что согласно мнению части экспертов Европейской ассоциации по изучению печени [14] неконтролируемое течение ПБЦ само по себе является показанием для назначения будесонида. Этот тезис повторен в отечественных рекомендациях по лечению холестатических заболеваний, согласно которым у пациентов на доцирротических стадиях заболевания с субоптимальным биохимическим ответом на терапию урсодезоксихолевой кислотой (УДХК) предлагается использовать комбинацию ее с будесонидом (6–9 мг/день) [15]. Положительный эффект будесонида на течение ПБЦ при назначении на I-II cтадиях заболевания был показан в ряде проспективных исследований, в том числе в 3-летнем открытом РКИ H. Rautiainen с соавт. (2005) и 2-летнем двойном слепом РКИ M. Leuschner с соавт. (1999), где его назначение в сочетании с УДХК приводило к улучшению гистологической картины [16–17].
При лечении перекрестного синдрома АИГ/ПБЦ ведущие ассоциации и рабочие группы [3, 14] предлагают применять комбинацию УДХК и ГКС. Ранее обсуждалось назначение в этих случаях монотерапии УДХК, с последующим присоединением ГКС при неэффективности монотерапии [18]. Недавние рекомендации Европейской ассоциации по изучению печени подчеркивают обязательность иммуносупрессивной терапии, а при преобладании признаков АИГ рекомендуют начинать с иммуносупрессоров с последующим добавлением УДХК [3]. Проблема выработки однозначных рекомендаций по лечению АИГ/ПБЦ также связана с отсутствием клинических исследований с хорошим дизайном. В то же время применение преднизолона при ПБЦ приводит к резкому снижению минеральной плотности костной ткани, а также повышает риск развития других неблагоприятных явлений [19]. В этой ситуации предпочтительным может являться назначение будесонида.
Позволим представить собственный опыт применения будесонида при АИГ.
Материалы и методы исследования
Ответ на терапию при АИГ оценивался как ремиссия, или неэффективное лечение, или неполный ответ [13]. Дополнительно выделялись полная (нормализация аланиновой (АЛТ) и аспаргиновой (АСТ) аминотрансфераз, а также IgG) и неполная ремиссия (снижение АСТ и АЛТ до уровня, менее чем в 2 раза превышающего верхний предел референтных значений, либо нормализация АЛТ и АСТ без полной нормализации IgG) [25]. Ответ на терапию при АИГ/ПБЦ рассматривался согласно критериям ответа на АИГ, а также парижским и барселонским критериям ответа на УДХК [26, 27].
Результаты и обсуждение
Ретроспективный анализ выявил следующие показания к назначению будесонида:
В 17 случаях будесонид назначался для индукции ремиссии АИГ у первичных пациентов либо у пациентов, имевших рецидив заболевания на фоне отмены терапии или снижения доз ГКС. У 7 пациентов будесонид использовался для поддержания ремиссии после стандартного индукционного курса преднизолона (с достижением критериев полной либо неполной лабораторной ремиссии).
При АИГ в 5 случаях использовалась монотерапия будесонидом в дозе 9 мг (у этих пациентов имелись противопоказания к назначению азатиоприна — цитопения), а в 6 случаях назначалась комбинация будесонида 9 мг/сут и азатиоприна 50–100 мг/сут. При АИГ/ПБЦ в 9 случаях использовалось сочетание будесонида 9 мг/сут с УДХК (13–15 мг/кг/сут), а 4-м пациентам также назначался азатиоприн 50 мг/сут. Средняя продолжительность терапии на момент проведения анализа составила 20,3 ± 11,1 месяца (максимальная продолжительность — 36 месяцев). Результаты лечения представлены в табл.
У 15 пациентов (88,2% случаев) терапия будесонидом (в сочетании с азатиоприном и без него) позволила обеспечить ремиссию АИГ в течение первого года лечения. При этом достижение ремиссии наблюдалось в среднем через 8,3 ± 3,4 месяца от начала терапии. Побочных эффектов от приема будесонида в данной группе не отмечалось. В дальнейшем этим пациентам была продолжена поддерживающая терапия будесонидом с устойчивым сохранением ремиссии. У 10 пациентов при этом через год от начала лечения доза будесонида была снижена до 6 мг/сут.
Отсутствие клинико-лабораторного улучшения отмечалось у одного пациента с АИГ и одного с АИГ/ПБЦ. Была произведена замена будесонида на преднизолон в стандартной дозе, что также не привело к улучшению лабораторных показателей. У пациентки с АИГ/ПБЦ неполная лабораторная ремиссия позже была достигнута назначением метотрексата.
В результате у 4 пациентов весь период наблюдения сохранялась полная/неполная ремиссия, в том числе при дальнейшем снижении суточной дозы будесонида до 6 мг, а уровень лабораторных показателей соответствовал ранее наблюдавшемуся на терапии преднизолоном. У 3 пациентов ремиссия сохранялась при приеме будесонида в дозе 9 мг/сут, а рецидив АИГ возник после снижения до 3 мг/сут (1 пациент) и 6 мг/сут (2 пациента). Срок возникновения рецидива после изменения дозы составлял от 4 до 13 месяцев.
В настоящее время целью лечения АИГ является достижение ремиссии и последующее ее сохранение на минимальной поддерживающей дозе иммуносупрессоров [3]. Наши данные показывают высокую эффективность будесонида в индукции и поддержании ремиссии при АИГ и его вариантной форме и совпадают с результатами других авторов [4, 28–30]. При этом частота достижения ремиссии при ее индукции будесонидом соответствовала данным, приводимым для системных ГКС [3] при минимуме побочных эффектов. В случаях неэффективности будесонида в дальнейшем при лечении преднизолоном также наблюдалась гормонорезистентность.
При терапии АИГ/ПБЦ комбинацией УДХК с будесонидом (+/- азатиоприн) у всех пациентов наблюдалось улучшение лабораторного профиля, а ремиссия АИГ была достигнута в 77,8% случаев.
Будесонид был эффективен и при поддержании ремиссии, индуцированной ранее преднизолоном. Важно, что отдельные больные в нашем исследовании получали терапию будесонидом в течение 3 лет с сохранением его эффективности, что свидетельствует о возможности его длительного применения. В то же время при снижении поддерживающей дозы у 3 пациентов наблюдался рецидив заболевания. Именно вопросы снижения дозы при терапии будесонидом являются наименее разработанными и, несомненно, требуют проведения клинических исследований для выработки оптимальной тактики.
По нашему мнению, будесонид следует активно использовать в лечении АИГ и его вариантных форм у нецирротических больных без выраженных системных проявлений заболевания, особенно в группах риска развития стероидных осложнений.
Выводы
Будесонид является эффективным препаратом для индукции и поддержания ремиссии при АИГ, а также он может быть успешно использован в терапии АИГ/ПБЦ.
Литература
К. Л. Райхельсон* , 1 , доктор медицинских наук, профессор
М. К. Прашнова*
Н. В. Марченко*, кандидат медицинских наук
С. Н. Мехтиев**, доктор медицинских наук, профессор
Е. Н. Зиновьева***, кандидат медицинских наук
Читайте также:

