Аутоиммунный тиреоидит при аутоиммунном гепатите
Обновлено: 19.04.2024
Что такое аутоиммунный тиреоидит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сивова А. А., эндокринолога со стажем в 13 лет.
Над статьей доктора Сивова А. А. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Хронический аутоиммунный (лимфоматозный) тиреоидит (ХАИТ) — хроническое заболевание щитовидной железы аутоиммунного происхождения, было описано Х. Хасимото в 1912 г. Заболевание чаще наблюдается у женщин и наиболее часто диагностируется среди известных патологий щитовидной железы. Аутоиммунный тиреоидит выявляется у одной из 10-30 взрослых женщин. [1]
Рассматриваемое заболевание аутоиммунной природы, и для него обязательно присутствие антител. Впервые опубликовали данные об обнаружении антител к ткани щитовидной железы в сыворотке у пациентов с аутоиммунным тиреоидитом в 1956 году. Впоследствии выяснилось, что аутоиммунный тиреоидит подразумевает наличие антител к тиреоглобулину, второму коллоидному антигену и тиреопероксидазе (микросомальному антигену).
Провоцирующие факторы
Сегодня принято считать, что апоптоз, то есть программируемая гибель фолликулярных клеток щитовидной железы — одна из главных причин аутоиммунного тиреоидита и других патологий щитовидной железы. [2] Предполагается, что запуску апоптоза способствуют вирусы и генетические нарушения.
Чем опасен тиреоидит во время беременности
Аутоиммунный тиреоидит у женщины никак не отражается на возможности забеременеть и родить здорового ребёнка при условии, что у пациентки нормальный уровень гормонов — тиреотропный гормон (ТТГ) до 2,5 мЕд/л, в том числе в первом триместре беременности.
При гормональном нарушении возможны следующие осложнения:
-
;
- выкидыш;
- преждевременные роды;
- проблемы со сном;
- поздний токсикоз; ;
- кровотечения после родов;
- гипоксия плода;
- неонатальный тиреотоксикоз.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
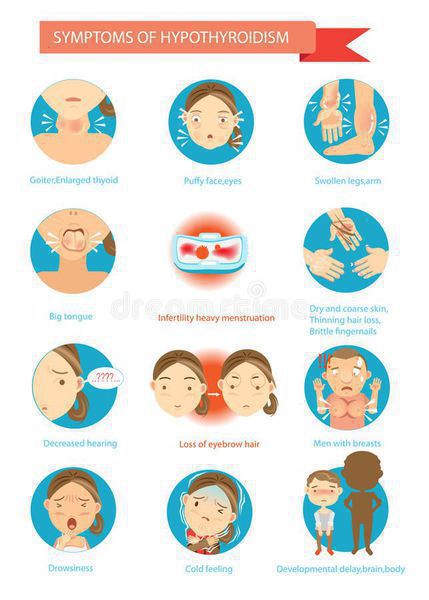
Симптомы аутоиммунного тиреоидита
Изначально, на протяжении некоторого времени, больные не высказывают никаких жалоб. Постепенно с течением времени регистрируют медленное развитие клинической картины снижения функции щитовидной железы, вместе с тем в части ситуаций будет отмечаться прогрессирующее уменьшение размеров железы или же наоборот ее увеличение. [3]
Клинические проявления при хроническом аутоиммунном тиреоидите начинают появляться с нарушением функции щитовидной железы, но в части ситуаций симптомов может и не быть. Все симптомы аутоиммунного тиреоидита щитовидной железы неспецифические, т. е. могут быть при многообразных заболеваниях. Но несмотря на это, все же обозначим клинические проявления, имея которые следует обратиться к эндокринологу для обследования.

Патогенез аутоиммунного тиреоидита
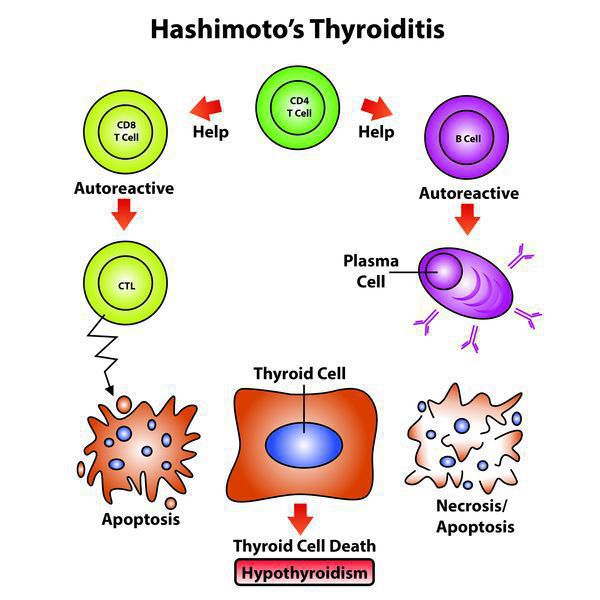
Эндогенный (внутренний) критерий наследования аутоиммунных заболеваний взаимосвязан с клонами Т-лимфоцитов.
- Чтобы произошло развитие хронического заболевания с учетом имеющейся наследственной предрасположенности, нужно влияние экзогенных факторов (вирусных и любых других инфекций, фармпрепаратов), которые способствуют активации Т-лимфоцитов, те впоследствии активируют В-лимфоциты, запуская цепную реакцию.
- Далее Т-клетки, кооперируясь с антитиреоидными антителами, воздействуют на эпителиальные клетки фолликулов, содействуя их деструкции, вследствие чего снижается численность правильно функционирующих структурных единиц щитовидной железы. [1][4]
Количество антитиреоидных антител при этом заболевании непосредственно отражает выраженность аутоиммунного процесса и иногда имеет склонность уменьшаться по мере увеличения продолжительности заболевания. Только присутствия антитиреоидных антител недостаточно, чтобы травмировать структурные элементы щитовидной железы.
Для реализации токсических свойств имеющимся антителам необходимо вступить во взаимодействие с Т-лимфоцитами, которые чувствительны к антигенам щитовидной железы при ХАИТ, чего не бывает при наличии обычного зоба или если патология щитовидной железы не выявлена.
В норме все клетки имеют иммунологическую нечувствительность к другим клеткам собственного организма, которая приобретается во время внутриутробного развития (еще до рождения), во время взаимодействия зрелых лимфоцитов со своими антигенами. Любые нарушения в данном взаимодействии и синтез особых клонов Т-лимфоцитов, которые вступают во взаимодействие со своими же антигенами, и могут стать той причиной, которая приводит к нарушению иммунологической нечувствительности и впоследствии привести к формированию любых аутоиммунных патологий, включая и ХАИТ.
Классификация и стадии развития аутоиммунного тиреоидита
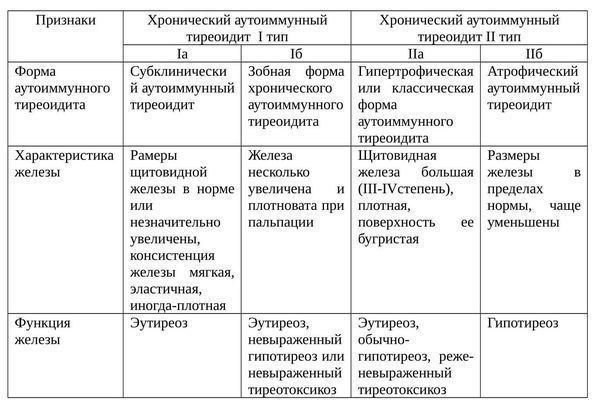
Формы ХАИТ с учетом объема железы и данных клиники:
- Гипертрофическая (тиреоидит Хасимото). Наиболее распространена. Щитовидная железа отличается плотностью, увеличена до II или III степени. Функция железы чаще не изменена, однако в большинстве ситуаций регистрируют тиреотоксикоз или гипотиреоз. Встречается у 15-20% больных.
- Атрофическая. Щитовидная железа в норме или незначительно увеличена, а на момент осмотра может быть даже уменьшена. Функционально — гипотиреоз. Встречается у 80-85% пациентов.
Еще одна классификация аутоиммунного тиреоидита щитовидной железы: [2]
Фазы ХАИТ с учетом клинической картины заболевания:
- Эутиреоидная. Бессимптомное продолжительное (иногда пожизненное) течение, без изменений в функции щитовидной железы.
- Субклиническая. Если заболевание прогрессирует, то поскольку происходит деструкция клеток щитовидной железы и уменьшается уровень тиреоидных гормонов, повышается синтез тиреотропного гормона (ТТГ), который в свою очередь чрезмерно стимулирует щитовидную железу, благодаря чему организм поддерживает на нормальном уровне секрецию Т4.
- Фаза тиреотоксикоза. Поскольку заболевание продолжает развиваться, в кровь высвобождаются имеющиеся тиреоидные гормоны и формируется тиреотоксикоз. Не считая этого, в кровь попадают разрушенные части внутренних структур фолликулярных клеток, в результате образуются антитела к клеткам щитовидной железы. Когда при прогрессирующей деструкции щитовидной железы концентрация гормонопродуцирующих клеток снижается ниже допустимого предела, концентрация в крови Т4 стремительно уменьшается, развивается стадия явного гипотиреоза.
- Фаза гипотиреоза. Продолжается приблизительно в течение года, чаще всего после этого происходит восстановление функции щитовидной железы. Иногда гипотиреоидная фаза продолжается всю жизнь.
ХАИТ преимущественно протекает только с одной фазой заболевания. [5]
Осложнения аутоиммунного тиреоидита
ХАИТ — условно безопасное заболевание, не приводящее к осложнениям только при условии сохранения необходимой концентрации гормонов в крови, т. е. эутиреоидного состояния. И, соответственно, тогда никаких осложнений не развивается. Но при наступлении гипотиреоза могут наблюдаться осложнения. При отсутствии лечения гипотиреоза могут возникать осложнения: нарушение репродуктивной функции, выраженное снижение памяти, вплоть до слабоумия, анемия, но самое грозное и тяжелое осложнение гипотиреоза — гипотиреоидная или мексидематозная кома — возникает при резкой недостаточности гормонов щитовидной железы. [5] [6]
Диагностика аутоиммунного тиреоидита
Диагностика ХАИТ состоит из нескольких пунктов. Для определения данного заболевания у больного необходим минимум один большой критерий, если таких критериев не обнаружено, то диагноз лишь вероятен. [1]
Большие диагностические критерии:
- первичный гипотиреоз (причем возможен как манифестный, так и устойчивый субклинический);
- присутствие антител к ткани щитовидной железы;
- ультразвуковые критерии аутоиммунной патологии.
Пальпация щитовидной железы
Какие анализы нужны, чтобы определить АИТ
Для установления аутоиммунного тиреоидита необходимо сдать кровь на тиреотропный гормон ( ТТГ), тироксин свободный (Т4 свободный) и антитела к тиреопероксидазе (ТПО). Если антитела к ТПО повышены, но ТТГ в пределах нормы, то диагноз АИТ носит вероятный характер.
Нужно заметить, что при обнаружении у больного гипотиреоза манифестного или стабильного субклинического, диагностирование аутоиммунного тиреоидита важно для установления причины уменьшения функции железы, но несмотря на это постановка диагноза никак не меняет терапевтических методов. Лечение заключается в употреблении заместительной гормональной терапии препаратами тиреоидных гормонов.
Использование пункционной биопсии щитовидной железы не показано для установления хронического аутоиммунного тиреоидита. Ее необходимо проводить, только если имеются узлы щитовидной железы, более 1 см в диаметре.
Важно отметить, что нет надобности контролировать в течение болезни количество имеющихся антител к щитовидной железе, потому что данная процедура не имеет диагностической роли для анализа прогрессирования аутоиммунного тиреоидита. [7]
Лечение аутоиммунного тиреоидита
Терапия аутоиммунного тиреоидита щитовидной железы неспецифическая. При формировании фазы тиреотоксикоза достаточно применения симптоматической терапии. При формировании гипотиреоза главным вариантом медикаментозной терапии является назначение тиреоидных гормонов. Сейчас в аптечной сети РФ возможно приобрести только таблетки Левотироксина натрия (L-тироксин и Эутирокс). Применение таблетированных препаратов тиреоидных гормонов нивелирует клинику гипотиреоза и при гипертрофической форме аутоиммунного тиреоидита вызывает уменьшение объема щитовидной железы до допустимых значений.
В случае обнаружения у пациента манифестного гипотиреоза (повышение уровня тиреотропного гормона и снижение концентрации Т4 свободного) необходимо использование в лечении левотироксина натрия в средней дозе 1,6 – 1,8 мкг/кг массы тела пациента. Показателем правильности назначенного лечения будет являться уверенное удержание в пределах референсных значений тиреотропного гормона в крови больного.
Когда у больного диагностирован субклинический гипотиреоз (увеличена концентрация ТТГ в совокупности с неизмененной концентрацией Т4 свободного), необходимо:
- Спустя 3–6 месяцев вторично провести гормональное обследование для доказательства наличия изменения функции щитовидной железы;
- Когда в течение беременности у пациентки обнаружено увеличение уровня тиреотропного гормона, даже при сохраненной концентрации Т4 свободного, назначить левотироксин натрия в полной расчетной заместительной дозе сразу же;
- Лечение левотироксином натрия нужно при постоянном субклиническом гипотиреозе (увеличение концентрации тиреотропного гормона в крови свыше 10 мЕд/л, и еще в ситуациях не менее двукратного определения концентрации тиреотропного гормона между 5 – 10 мЕд/л), но если этим больным более 55 лет и у них имеются сердечно-сосудистые патологии, лечение левотироксином натрия назначается только при отличной переносимости лекарства и при отсутствии сведений о декомпенсации данных болезней на фоне приема тироксина;
- Показатель достаточности лечения субклинического гипотиреоза представляет собой стабильное удержание уровня ТТГ в пределах референсных значений в крови.
Если у женщин перед планированием беременности, выявлены антитела к ткани щитовидной железы и/или ультразвуковые признаки аутоиммунного тиреоидита, нужно определить гормональную функцию щитовидной железы (концентрацию тиреотропного гормона и концентрацию Т4 свободного) и обязательно определять уровень гормонов в каждом триместре беременности. [8]
Если поставлен диагноз аутоиммунный тиреоидит, но не выявляются изменения в работе щитовидной железы, применение препаратов левотироксина натрия не показано. [9] Оно возможно иногда в исключительных ситуациях внушительного увеличения объема щитовидной железы, спровоцированного аутоиммунным тиреоидитом, при этом решение принимается по каждому пациенту индивидуально. [10]
Физиологическое количество калия йодита (приблизительно 200 мкг/сутки) не могут спровоцировать формирование гипотиреоза и не осуществляют негативного воздействия на функцию щитовидной железы при ранее развившемся гипотиреозе, вызванном аутоиммунным тиреоидитом.
Питание при аутоиммунном тиреоидите
Продуктов, которые влияют на течение аутоиммунного тиреоидита, не существует. Глютен или лактоза не имеют отношения к гипотиреозу на фоне АИТ. Поэтому рекомендации по питанию для людей с аутоиммунным тиреоидитом такие же, как и для всех остальных: разнообразное сбалансированное питание с достаточным употреблением воды.
Существуют ли народные способы лечения
Аутоиммунный тиреоидит лечат только медицинскими препаратами, которые назначает эндокринолог. Отсутствие адекватной терапии может грозить опасными осложнениями: нарушением репродуктивной функции, выраженным снижением памяти (вплоть до слабоумия), анемией и комой, которая возникает при резкой недостаточности гормонов щитовидной железы.
Прогноз. Профилактика
Хронический аутоиммунный тиреоидит прогрессирует обычно крайне медленно, с развитием гипотиреоидного состояния спустя несколько лет. В отдельных ситуациях состояние и трудоспособность сохраняются в течение 15-18 лет, даже с учетом непродолжительных обострений. В фазе обострения тиреоидита регистрируются симптомы невыраженного либо гипотиреоза, либо тиреотоксикоза.
Сегодня методов профилактики хронического аутоиммунного тиреоидита не найдено.

АИТ может развиться на фоне противовирусного лечения гепатитов препаратами интерферона. Картина такого АИТ очень яркая, сначала развивается болевая форма, имитируя подострый тиреоидит, с преходящим тиреотоксикозом, (крайне редко развивается не АИТ, а явный ДТЗ), потом функция железы спонтанно восстанавливается, при выраженном тиреотоксикозе может потребоваться коррекция тиреостатиками, а при болевой форме препаратами НПВС.
В последние годы, судя по научным публикациям, исследование влияния вирусов в развитии АИТ активизировалось. К настоящему времени вирусологами изучено более 500 вирусов, способных вызвать различные заболевания у людей. В рамках АИТ - это роль герпес-вирусов (в том числе вируса Эпштейна-Барр, ЦМВ и др.). В связи с этим предпринимаются попытки лечения АИТ иммуномодулирующими препаратами (Т-активин, Тималин и другими).
Кроме того, известно, что АИТ входит в состав АПГС (аутоиммунного полигландулярного синдрома), поэтому важно не пропустить другие составляющие АПГС, особенно ХНН (надпочечниковую недостаточность).
Так же, иногда чётко можно проследить начало АИТ при смене места жительства из йод- дефицитного региона в регион с относительно достаточным содержанием йода, из-за реакции организма на созданный переизбыток йода. Возможно, что и другие особенности (микроэлементы, продукты горения и др.) нового региона, содержащиеся в воде или воздухе провоцируют АИТ, чаще в состоянии гипотиреоза.
Приём препаратов с большим содержанием йода (Кордарон, Амиодарон) тоже провоцирует такую форму тиреоидита, как кордарон (амиодарон) – ассоциированная тиропатия. Это отдельная форма тиреоидита (йод-индуцированная).
Облучение тоже является провокатором АИТ (например, у меня есть клинические наблюдения возникновения АИТ с гипотиреозом после лучевой терапии по поводу рака молочной железы).
Провокаторами развития АИТ являются и другие аутоиммунные заболевания – бронхиальная астма, атопический дерматит, суставные заболевания (ревматоидный артрит, СКВ и др.).
Есть ещё такой вид антител, как антитела к рТТГ (рецептору ТТГ), которые всегда считались маркёром ДТЗ, но есть случаи повышения их при АИТ, даже с гипотиреозом. Поэтому вопрос о лабораторных маркёрах АИТ остаётся спорным.
Учитывая всю приведённую выше информацию, можно сделать вывод - лечение АИТ непростое занятие. 8) Гипотиреоз при АИТ, на фоне лечения L-тироксином, тоже может иметь свои особенности. Вроде, кажется - доза подобрана. Но, бывает так, что щитовидная железа спонтанно восстанавливает свою функцию и в течение года подобранная доза становится большой, возникает передозировка (медикаментозный гипертиреоз).
Особенно сложно бывает лечить беременных, так как с дозой необходимо определиться быстрее и точнее, пока закладываются ткани и органы плода (первые 3 месяца). И тут метод постепенного титрования дозы (то есть наращивания дозы маленькими порциями под контролем самочувствия и гормонов крови, занимающее иногда несколько месяцев) не подойдёт, надо выбрать максимально допустимые дозы одномоментно, компенсация гормонального фона должна наступить быстро. В данном случает лучше превышение, чем недостаточное дозирование! Для ведения беременных и назначения L-тироксина в России есть официальные рекомендации, нет никакой "отсебятины", в рекомендациях чётко прописаны этапы диагностики и лечения тиреоидной функции при беременности.
Из особенностей лечения АИТ нужно ещё заметить, что люди по разному реагируют на дефицит тиреоидных гормонов и на разные уровни ТТГ. Симптом-комплекс гипотиреоза проявляется у всех индивидуально, на чём основывается иногда назначение гормонозаместительной терапии. Поэтому важно до и на фоне лечения L-тироксином подробнее описывать возникшие симптомы (это замечание для врачей ).
Кроме того, чувствительность к разным дозам L-тироксина у всех разная, вероятно, зависит от количества рецепторов к L-тироксину на мембранах клеток, наличия антител к ним (рецепторам) и других малоизученных факторов. Поэтому так специфичен подбор дозы.
Не только АИТ с гипотиреозом, но и АИТ, гипертрофическая (с увеличением объёма щитовидной железы), псевдоузловая форма с эутиреозом подлежит лечению L-тироксином. При условии, что ТТГ не ниже 0.5 мМЕ\мл, иначе велик риск передозировки L-тироксина.
Гипотиреоз с ТТГ до 7.5 ММЕ\мл, без клинических проявлений, можно не лечить, а только наблюдать (если только это не планирование беременности).
Более подробно останавливаться на лечении не буду, потому что вопрос о лечении, дозах, длительности выясняется после ретроспективной оценки истории заболевания в каждом конкретном случае.

Эта заметка скорее попытка для врачей описать варианты течения такого остающегося до сих пор загадочным заболеванием как АИТ. Это не руководство к действию для пациентов.
Сколько я не пыталась найти, ни в одном учебнике или монографии нет полного, подробного описания вариантов течения АИТ. Поэтому не все ещё понятно и раскрыто в этом процессе. Нет единой, общепринятой классификации АИТ. Патогенетическая терапия не разработана, а симптоматическая не имеет доказательной базы.
Проведу анализ вариантов течения АИТ, на основе наиболее известных классификаций и клинических наблюдений.
Это - наличие зоба (увеличения щитовидной железы) + гипотиреоз + носительство антител к ТПО и/или а/тел к ТГ, превышающее в 2 раза норму + УЗИ картина АИТ.
УЗИ картина АИТ предполагает:
- Увеличение размеров железы, передне-заднего размера, ширины доли;
- при атрофическом варианте, размеры могут уменьшаться или оставаться в пределах нормы;
- снижение эхогенности ткани;
- диффузная неоднородность ткани от мелко- до крупно-зернистой, иногда сливного характера;
- появление включений повышенной эхогенности;
- диффузная гиперваскуляризация при ЦДК или гиповаскуляризация гипоэхогенных очагов!
Косвенным признаком АИТ является увеличение лимфатических узлов у нижних полюсов обеих долей щитовидной железы.
2. По классификации национального руководства по эндокринологии под редакцией Дедова И.И.
Наиболее часто встречающиеся формы тиреоидита:
Сроки наступления/чередования фаз тоже могут быть разными. Например, начало послеродового тиреоидита может быть через полгода или даже через год после родов. а не через 3 месяца.
3. Более редкие формы АИТ:
- АИТ 1 типа с эутиреозом (нормальным гормональным фоном).
1 А - с зобом
1 В - без зоба - АИТ 2 типа с гипотиреозом.
2 А – с зобом (Хашимото)
2 В – атрофический
2 С - с Хаши - токсикозом, то есть начинается всё с тиреотоксикоза и затем исход в гипотиреоз (или исход в эутиреоз).
Вот на последнем варианте хочу остановиться ещё подробнее. Есть варианты течения АИТ 2 типа 2 С, когда фазы тиреотоксикоз/эутиреоз или тиреотоксикоз гипотиреоз - чередуются между собой, несколько раз в течение жизни. Периодичность их чередования предсказать сложно), длительность каждой фазы по нескольку месяцев, я видела чередование до 5 раз! Естественно, что это редкий вариант течения АИТ. Суть в том - это не надо лечить! (если только речь не идёт о планировании беременности!), этот процесс саморазрешающийся! Что провоцирует такое течение АИТ пока остаётся не ясным.
Есть ещё УЗ- классификация АИТ по В.П. Харченко (1999 года) при которой АИТ бывает 4-х УЗИ – типов:
- диффузная форма,
- очаговая форма,
- диффузно-очаговая форма,
- сочетанная с узловыми образованиями разной эхогенности и структуры.
Реже встречается, гипотиреоз после таких операций транзиторный (преходящий), с последующим восстановлением в эутиреоз функции оставшейся доли без гормонозаместительной терапии (ГЗТ).
Не исключено сочетание АИТ с раком щитовидной железы, поэтому проведение пункции узлов (ТАБ = аспирационной тонкоигольной биопсии), так же необходимо при узлах более 1 см, как и при коллоидном зобе.
Причины появления АИТ до сих пор до конца не ясны, есть предположения о наследственной предрасположенности, особенно по женской линии, вирусной теории, теории переизбытка йода в окружающей среде, сочетании с другими иммунными заболеваниями, проблемами с экологией и т.д.

Эндокринология – наука ультрасовременная!! Она появилась только в 20 веке. Подходы в диагностике и лечении многих эндокринных заболеваний постоянно меняются по мере появления новых исследований о причинах, вызвавших ту или иную патологию, человек продолжает изучать гормонально-эндокринные, и не только, тайны своего организма ;)
В ближайших темах блога я представлю:
- новый подход в лечении АИТ
- новый взгляд на лечение ожирения и обновлённое меню
- новый взгляд на проблему лечения сахарного диабета 2 типа и прогрессирования осложнений. В основе теории лежит деление сахарного диабета 2 типа на подруппы по наличию аутоиммунной реакции на инсулин, что позволит спрогнозировать различные варианты течения сахарного диабета 2 типа и появление осложнений.
Но сегодня рассказ про такой загадочный аутоиммунный тиреоидит . В настоящее время в целом отмечается рост аутоиммунных заболеваний. Но именно аутоиммунные заболевания щитовидной железы стоят особняком от других иммунных патологий. Из всей тиреоидной патологии на долю АИТ приходится 20-50% случаев. Чаще болеют женщины старше 60 лет, особенно жители мегаполисов.
В клинической картине АИТ можно выделить жалобы, проебладающие в зависимости от возраста. С ними люди, как правило, и обращаются на приём к врачу:
Для молодых с АИТ характерны жалобы на выпадение волос, прибавку веса, запоры (констипация), ломкость ногтей, сухость кожи.
В среднем возрасте – преобладают жалобы на симптомы артроза и остеохондроза, депрессии, артериальной гипертонии.
за 50 лет из жалоб преобладают неврологические и сердечно-сосудистые.
АИТ (аутоимунный тиреоидит) – это иммуно-воспалительный процесс замедленного типа, выражающийся аутоагрессией иммунных клеток к собственным клеткам щитовидной железы в виде деструктивного процесса и инфильтрации ткани железы клетками воспаления: нейтрофилами, макрофагами и др. с выработкой антител к тироглобулину и микросомальным белковым структурам щитовидной железы.
Сами антитела не способны разрушать клетки и фолликулы щитовидной железы. Воспаление – деструкцию (разрушение ткани) вызывают именно иммунные клетки.
Теорий о причинах появления АИТ множество. Вот основные из них:
Но, относительно недавно, появилась новая теория развития АИТ.
НОУ-ХАУ теории 2014 г (профессора, д.м.н. Рустамбековой С.А.) состоит в том, что в одну из причин развития АИТ- положена теория дисполимикр(макро)элементоза.
Дисполимикр(макро)элементоз – это нарушение гомеостатического равновесия макро-микроэлементного обеспечения организма, что также провоцирует и инициирует иммунное воспаление, оксидативный стресс и другие, повреждающие ткань щитовидной железы, патологические процессы.
Эта теория подтверждается ещё и тем, что клинические проявления (симптомы) аутоиммунного тиреоидита не характерны для истинного воспаления, встречающегося при попадании в железу инфекции.
Теория дисмикроэлемнотозов сейчас популярна и в акушерстве
(гипомагниемия, гипокальцимия), в кардиологии уже давно, при аритмии, нарушениях ритма.
Объясняю: наш организм для нормального функционирования имеет определённый набор микро(макро) элементов: макроэлементы -это калий, кальций, магний и др. Микроэлементы: селен, цинк, йод, железо и т.д.
Если вспомнить школьно-студенческие знания, то эти микро(макро)элементы есть во всех клетках организма – они участвуют во всех обменных процессах и в составе многих ферментов организма, в том числе участвующих в образовании гормонов щитовидной железы и иммунных клетках.
Избыток или нехватка некоторых микро(макро)элементов – смертельно опасны, например, гиперкалиемия (избыток калия, вследствие почечной недостаточности – вызывает жизнеугрожаемые аритмии). Другие микро(макро)элементозы не так опасны, но нарушают работу многих органов, в нашем случае – щитовидной железы.
В результате многолетних исследований, учёные Москвы пришли к выводу, что щитовидной железе для работы необходимы не только так популяризированный йод, но и селен, цинк магний, и другие, не менее важные микроэлементы.
И очень мешают работе щитовидной железе выбрасываемые в атмосферу в результате работы промышленных предприятий, транспорта, и по другим причинам: кадмий и свинец!
Экологическая обстановка в городе или регионе, где проживает человек, как оказалось, напрямую влияет на развитие АИТ, вследствие переизбытка токсичных элементов: свинца, кадмия, алюминия, ртути и др. в воздухе, воде, почве.
Вот почему сейчас АИТ называют экологически зависимым заболеванием.
Кадмий, например, является прямым антагонистом полезных селена и цинка.
Поэтому, для построения правильной тактики лечения при АИТ, необходимо сдать микро(макро)элементный состав крови или волос, куда обязательно должны войти: йод, кальций, железо, фосфор, калий, магний, селен, цинк, медь, марганец, кадмий, свинец и ртуть. На основе этого анализа решается, как надо правильно откорректировать имеющиеся изменения. Это и есть индивидуализированный подход к лечению пациента.
Если при этом есть нарушении функции железы: гипо- или гипертиреоз – они подлежат корректировке принятыми для этого по стандарту лекарствами – Тирозол (Мерказолил) или Л-тироксин (Эутирокс).
В монографическом исследовании дисмикроэлементозов проф. Рустамбековой С.А. показано на клинических примерах, что корректировка макро(микро)элементной дисфункции организма приводит:
- к уменьшению титра антител к ТПО и ТГ
- уменьшению воспалительного процесса
- исчезновению узлов, а вернее сказать, псевдоузлов на фоне АИТ
- более быстрой нормализации уровня ТТГ и Т4 свободного
- исчезновению симптомов, характерных для гипотиреоза, что не всегда компенсируется даже приёмом Л-тироксина
- более быстрому уменьшению одутловатости – отёчности лица, сухости кожи, слабости и других симптомов.
Но для достаточной эффективности курс лечения микро-макроэлементами не должен быть меньше 3 месяцев.
Наиболее эффективными препаратами являются:
- препараты селена (дозы первые месяцы лечения не менее 200мкг), - - препараты магния (можно без В6, при аллергии на витамины гр В) , - препараты цинка,
- препараты йода !очень строго по потребности! и др.
И этот подход оправдывает себя, а в некоторых случаях, я думаю, сможет помочь длительной ремиссии АИТ (без лечения гормонами) или излечению в его начальных стадиях заболевания.
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменени
 |
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменения, приводящие к фиброзу и циррозу печени (ЦП). Генетически детерминированная предрасположенность к этому заболеванию выявлена во многих исследованиях. Доказано, что большая часть больных АГ имеют фенотип по антигенам главного комплекса гистосовместимости HLA-B8, HLA-DR4, DR3 и DR52a. Пусковой агент пока неизвестен, однако есть некоторые данные о роли вирусов гепатита [31, 26], кори [27], Эпштейн-Барр вируса [32], а также интерферона (ИФН) [14] как инициаторов начала АГ.
| Аутоиммунный гепатит (АГ) — хроническое воспалительное заболевание печени невыясненой этиологии, характеризующееся определенными лабораторными, клиническими и гистологическими признаками. Болеют им в основном женщины молодого возраста |
АГ — это прогрессирующее воспаление печени, характеризующееся наличием некрозов в перипортальной, септальной зонах (ступенчатые некрозы) или, более широко, лобулярным гепатитом (ЛГ), гипергаммаглобулинемией и аутоантителами в сыворотке крови [7]. Портальные тракты печени на биоптатах находят расширенными с накоплением в них обширных инфильтратов, имеющих разный клеточный состав: лимфоциты, макрофаги, плазматические клетки. ЛГ — дольковый гепатит, когда некрозы выявляются во второй и третьей зонах ацинусов, а также обнаруживается внутридольковая лимфоидноклеточная инфильтрация, которая выражена значительно больше, чем инфильтрация портальных трактов. ЛГ является частью гистологической картины АГ, если он выявляется одновременно с перипортальным гепатитом. По гистологической картине на АГ может указывать, кроме вышеперечисленного, наличие многоядерных гепатоцитов [2].
Наконец, картина фиброза может присутствовать в той или иной степени даже при умеренной степени активности АГ, а в запущенных случаях, особенно при отсутствии эффективной терапии, формируются мостовидные некрозы и, в конце концов, ЦП.
Хотя гистологическая картина при АГ очень характерна, все-таки она неспецифична. Отличительной чертой АГ является обнаружение в биоптатах преимущественно плазматических клеток, так как выраженная инфильтрация в портальной, перипортальной зоне, вовлечение в процесс долек печени — в равной мере присущи и хроническому вирусному гепатиту (ХВГ).
Одной из основных клинических характеристик АГ является обнаружение аутоантител к клеточным и субклеточным структурам клеток разных органов [22]. Типичным маркером АГ являются антитела к ядрам клеток — ANA. Из других маркеров выявляются антитела к клеткам гладкой мускулатуры (SMA), антитела к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек (LKM), антитела к растворимому печеночному антигену (SLA), антитела к антигенам (цитокератины 8, 18) мембран гепатоцитов — LMA.
Клинические проявления АГ очень разнообразны [1, 3, 4]. С одной стороны, встречаются бессимптомные формы, когда случайно выявляется повышение АЛТ, АСТ, а с другой — острое начало болезни с тяжелым течением вплоть до развития фульминантного гепатита (ФГ).
Нередко заболевание начинается незаметно с астеновегетативных проявлений, болей в области правого предреберья, незначительной желтухи. Однако у большинства больных АГ начало болезни острое, как при остром вирусном гепатите (ОВГ), и при осмотре пациента врач впервые выявляет признаки хронического гепатита (ХГ) — телеангиоэктазии, пальмарную эритему, увеличение печени и селезенки, а также изменения в анализах крови — гипергаммаглобулинемию, увеличение IgG, снижение содержания общего белка, резкое увеличение СОЭ. Лейкопения и тромбоцитопения наблюдаются у больных на поздних стадиях болезни или при развившихся гиперспленизме и синдроме портальной гипертензии.
Когда АГ впервые проявляется желтухой, как при ОВГ, приходится дифференцировать его от гепатитов А, В, Е и особенно С, при котором антитела в сыворотке крови могут появляться через достаточно продолжительное время после начала болезни. Желтуха у пациентов с АГ может быть разной степени выраженности, часто появляется на поздних стадиях заболевания, бывает непостоянной и усиливается в период обострений. В общем же у большинства больных чаще всего изменяются аминотрансферазы, нежели щелочная фосфотаза (ЩФ) или билирубин.
| Аутоиммунный гепатит был выделен из группы болезней печени и впервые описан как отдельная нозология в начале 50-х годов [33]. В научной литературе существовал под разными названиями. Термин люпоидный гепатит, который часто использовался в нашей стране, ввел в 1956 году Дж. Маккей с соавторами в журнале Lancet, так как при этом заболевании нередко в сыворотке крови больных выявлялись волчаночные клетки. Потом, в последующие годы, люпоидный, или классический, АГ стали называть аутоиммунным активным хроническим гепатитом, но в 1993 году Международная группа по изучению болезней печени предложила термин АГ, а также критерии установления его диагноза [17] |
Для АГ характерно поражение кожи в виде геморрагической сыпи, оставляющей после себя пигментацию. Из других симптомов встречаются волчаночная и узловатая эритемы, очаговая склеродермия, пальмарная эритема и телеангиоэктазии. У всех больных выявляются изменения в эндокринной системе — аменорея, угри, гирсутизм, стрии. Диагностическое значение отдельных симптомов болезни при АГ неодинаково. К наиболее значимым относятся длительная лихорадка и арталгии. В большинстве случаев АГ они присутствуют одновременно, являясь наиболее частыми и постоянно встречающимися жалобами больных [4].
Один из вариантов начала АГ — появление лихорадки с внепеченочными проявлениями, из которых следует назвать аутоиммунный тиреоидит, язвенный колит, гипертиреоидизм, гемолитическая анемия, идеопатическая тромбоцитопения, сахарный диабет, целиакия, полимиозит, фиброзирующий альвеолит, гломерулонефрит и т. д. Желтуха при этом варианте появляется позже [20].
Часто АГ сопровождается бесплодием, однако при возникновении беременности и последующих родах на фоне компенсированного процесса это не влияет на течение АГ и судьбу ребенка даже при постоянном приеме преднизолона (ПР) [30]. Беременность на стадии сформировавшегося ЦП и синдрома портальной гипертензии, которые выявляются у трети больных на момент выявления АГ, нежелательна [3].
В отличие от ХВГ течение АГ у больных непрерывно прогрессирующее, без самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических процессов не происходит. Прогноз течения АГ хуже у пациентов с острым началом болезни по типу ОВГ, с наличием признаков холестаза, асцитом, повторными эпизодами острой печеночной энцефалопатии (ОПЭ). Как правило, больные, пережившие критический период, имеют лучший прогноз.
Диагноз АГ выставляется на основании соответствия лабораторных и гистологических данных, отсутствия маркеров ВГ, исключения злоупотребления алкоголем и контактов с препаратами крови, гипотоксическими веществами, повышения гамма-глобулинов не менее чем в 1,5 раза выше нормы. Повреждение желчных протоков, отложение меди, гемосидероз, при которых также могут выявляться ЛГ и ступенчатые некрозы, предполагают другую причину ХГ и исключают диагноз АГ. ANA, SMA и LRM-1 должны быть в титрах не менее 1:80 у взрослых и 1:20 у детей (рекомендации Международной группы, 1993).
Дифференциальный диагноз между АГ и другими аутоиммунными заболеваниями, в основном первичным билиарным циррозом (ПБЦ), первичным склерозирующим холангитом (ПСХ), ХВГ основывается на клинических, гистологических и иммунологических параметрах. Однако нередко выявляется так называемый overlap-синдром, когда одновременно у пациентов выявляются признаки АГ и вышеперечисленных хронических заболеваний печени. Далее они будут описываться как варианты АГ [7, 13]. Предполагаемый диагноз АГ в данном случае подразумевает сходство с клиникой АГ (жалобы на слабость, арталгии, миалгии), а биохимический анализ крови отражает преимущественно изменения холестатического порядка, имеет место кожный зуд разной степени выраженности. Пациенты с такими вариантами АГ могут быть обоего пола, любого возраста, но все же чаще это женщины в возрасте до 40 лет и моложе. На гистологии находят перипортальный гепатит с или без ЛГ, часто с поражением желчных протоков, жировой дистрофией гепатоцитов и лимфоидной инфильтацией портальных трактов в виде гранулем [7, 10].
Деление АГ на подтипы практического значения не имеет, однако следует иметь в виду, что подтип 2 АГ может быть связан с гепатитом С либо HCV может индуцировать появление АГ у генетически предрасположенных лиц. Нет данных о различиях гистологической картины при отдельных подтипах АГ
Большинство больных с ПБЦ можно точно отделить от пациентов с АГ с помощью характерных лабораторных и иммунологических данных. Однако при этом варианте наряду с характерными параметрами АГ нередко выявляются гистологические признаки холангита и АМА (антитела к антигенам внутренней поверхности мембраны митохондрий), что очень характерно для ПБЦ. Наиболее важным для подтверждения диагноза ПБЦ является обнаружение АМА подтипа М2 [6]. АМА выявляются у 20-27% больных АГ в разных титрах [19]. Это может отражать диагностические ошибки в определении иммуносерологических маркеров, другие заболевания или одну из стадий ПБЦ. Если у больного повышена щелочная фосфатаза (ЩФ), IgM сыворотки крови и обнаружена АМА — вероятен диагноз ПБЦ. Трех-шестимесячный курс лечения стероидами помогает расшифровать преобладающую патологию — при реакции на лечение можно говорить о превалировании АГ.
Установлено, что у 16% больных АГ выявляется язвенный колит (ЯК), наличие которого характерно для пациентов с ПСХ (от 40 до 60% больных). К тому же при таком сочетании — АГ и признаки ПСХ (наличие ЯК, поражение желчных протоков, слабый ответ на стероиды) — также обнаруживают фенотип HLA-B8, HLADR3, HLA DR4. Поэтому наличие кожного зуда у больных АГ и повышение ЩФ более чем в четыре раза против нормы указывают на необходимость проведения холангиографии (ХГР) и вероятность развития варианта АГ и ПСХ. Поражения желчных протоков несовместимы с диагнозом АГ. Они редки, но когда появляются у больных АГ с сопутствующей патологией кишечника или атипичным повышением ЩФ, можно допустить этот вариант АГ. Окончательный диагноз зависит от результатов ХГР. ХГР выявляет признаки склерозирующего холагнита у 42% больных АГ и ЯК. Но иногда ХГР бывает в норме у 14% больных ПСХ при гистологически подтвержденном диагнозе. Об этом необходимо помнить [24].
АГ считается заболеванием невирусной этиологии, но у 4% больных АГ выявляются антиHCV и еще у 4% — маркеры вируса гепатита В. Больные АГ, имеющие атипичное течение болезни либо плохо отвечающие на терапию стероидами, нередко имеют в сыворотке крови HCV RNA. Любопытно, что 11% больных ХВГ имеют SMA и 28% — ANA. У 62% выявляются аутоантитела к щитовидной железе и ревматоидный фактор. Большая часть этих больных имеют низкие титры SMA и ANA (1:80 и ниже), а пациенты с точным диагнозом АГ — SMA в титрах 1:160 и ANA 1:320. Поэтому больные АГ и с выявляемыми SMA или ANA в титрах ниже 1:320 могут быть отнесены к группе с превалированием вирусного заболевания [11].
Тем не менее пациенты с АГ имеют более выраженную инфильтрацию портальных трактов плазматическими клетками, более выраженные воспалительные изменения в дольках и больше ступенчатых и перисептальных некрозов по сравнению с пациентами ХВГ, особенно ХГС. У больных ХВГ/ХГС наоборот — в портальных трактах преобладает лимфоидноклеточная инфильтрация, чаще выявляется стеатоз и повреждения желчных протоков, особенно при ХГС.
У 13% взрослых больных с признаками АГ не обнаруживаются аутоантитела, а все остальные признаки — иммунологические, биохимические и гистологические, а также возраст и пол соответствуют критериям постановки диагноза АГ. Что важно, эти больные также хорошо реагируют на лечение стероидами [8, 9]. Отмечено, что с течением времени при динамическом наблюдении у некоторых из них появляются соответствующие аутоантитела, характерные для АГ.
Несмотря на разнообразие клинической картины, при АГ основой лечения является назначение преднизолона (ПР). Ответ на данную терапию — один из критериев постановки диагноза АГ. Целесообразность назначения ПР при АГ доказана в многочисленных исследованиях и обусловлена редкими самопроизвольными ремиссиями в течении болезни, высокой смертностью и ухудшением качества жизни [12, 18, 23, 28, 29]. При назначении ПР смертность удается снизить в течение пяти лет с 50 до 20%, а частоту индуцированных ремиссий довести до 80%. У большинства больных ремиссии появляются в течение первых двух лет терапии и почти у всех в последующие четыре года лечения.
Лечение ПР следует назначать всем больным АГ высокой степени активности с фиброзом и циррозом или без. У больных с умеренной степенью активности болезни назначение ПР часто определяется наличием жалоб и симптомов болезни. Больные без симптомов и с умеренной степенью активности процесса по гистологической картине не нуждаются в лечении, но должны тщательно и регулярно наблюдаться для своевременного выявления признаков прогрессирования болезни.
Как правило, начальная доза ПР составляет 20-30 мг/сутки с последующим постепенным снижением ее до поддерживающей — обычно 10 мг/сутки. Из всех схем лечения предпочтителен ежедневный прием однократно утром. Осложнения терапии наблюдаются при дозе более 10 мг/сутки. Нет точных рекомендаций по отмене или снижению дозы иммуносупрессоров, некоторые больные могут долго оставаться в ремиссии после отмены ПР.
Однако было установлено, что у большей части больных в дальнейшем, даже спустя несколько лет после ремиссии, появляются признаки обострения и часто требуется большая доза для ее достижения [15].
Комбинация ПР с азатиоприном (АЗА) может уменьшить побочные эффекты (при этом требуется небольшая доза ПР). Лучше давать 10 мг/сутки ПР с 50 мг/сутки АЗА, чем один ПР, но в большей дозе. Сам АЗА не способен индуцировать ремиссию, но его добавление к ПР поддерживает ее даже в дозе 1 мг/кг/сутки. При неэффективности лечения АЗА назначали 6-меркаптопурин с хорошим эффектом [25]. У 20% больных АГ не удается достигнуть ремиссии — чаще всего у пациентов с признаками ЦП, лиц молодого возраста, при длительном анамнезе болезни до начала терапии ПР и у больных с фенотипом HLA-B8, DR3 [28]. Побочные эффекты при назначении иммунодепрессантов редкие, это в основном диспепсический синдром, сыпи, кушингоидизм, нарушение роста и развития у детей, сахарный диабет и остеопороз у женщин в менопаузе. АЗА может индуцировать миелосупрессию, возникновение катаракты, обладает онкогенным и, возможно, тератогенным эффектами.
Лечение вариантов АГ представляет определенные трудности. Основа терапии, препарат выбора для начала лечения — и здесь ПР. При сочетании АГ и ПБЦ назначают ПР в дозе 20 мг/сутки от трех до шести месяцев, а при отсутствии эффекта — урсодезоксихолевую кислоту (УДХК) или ее коммерческие препараты (урсофальк, урсосан, урсодиол и др.) по 13-15 мг/сутки от трех до шести месяцев.
Тактика лечения больных с вариантом АГ и ПСХ та же, что и при АГ и ПБЦ. Больные АГ и ЯК отвечают на терапию ПР хуже, чем больные с одним АГ (не столь часты ремиссии, чаще и быстрее выявляют прогрессирование к ЦП). Эти пациенты, возможно, должны лечиться УДХК большими дозами (до 15-20 мг/кг/сутки), если признаки холестаза выражены.
При сочетании АГ и ХВГ назначают ПР 20 мг/сутки или 10 мг/сутки ПР и 50 мг/сутки АЗА на три–шесть месяцев, если превалируют признаки АГ. Рекомбинантный ИФН в дозе 3 млн. МЕ/сутки три раза в неделю до 6 месяцев назначают при выявлении признаков ХВГ и маркеров репликации вируса либо неэффективности стероидной терапии [21, 5]. Лечение таких больных представляет собой сложную задачу, так как ПР усиливает вирусную репликацию, а ИФН может усилить иммуноопосредованный печеночно-клеточный некроз, перевести ХВГ в АГ, который до этого мог быть в латентном состоянии, обострить течение болезни с развитием внепеченочных аутоиммунных проявлений, индуцировать выброс антител с неясным клиническим значением. Поэтому лечение состоит в правильном определении преобладания тех или иных клинических синдромов или признаков. В любом случае обострение болезни печени или внезапное появление признаков аутоиммунного заболевания у пациентов с признаками АГ, но с преобладанием вирусного поражения указывает на необходимость прерывания лечения ИФН.
Тактика лечения больных криптогенным ХГ состоит в назначении ПР 10-20 мг/сутки вместе с 50 мг/сутки АЗА до появления ремиссии или максимального эффекта.
Литература
Читайте также:

