Белки core при гепатите с
Обновлено: 17.04.2024
Гепатит В – острое или хроническое заболевание печени, вызываемое вирусом гепатита В (HBV), протекающее в различных клинических вариантах: от бессимптомных форм до злокачественных (цирроз печени, гепатоцеллюлярная карцинома). На долю ГВ приходится около 15% всех регистрируемых в РФ острых гепатитов и не менее 50% хронических.
Схематично строение вирусной частицы гепатита В можно изобразить так:
Рис.1. Структура вируса гепатита В.
Вирусные частицы гепатита В размером 42 - 45 нм (частицы Дейна) имеют достаточно сложное строение и включают ДНК, ДНК - полимеразу и антигены: поверхностный (HBs Ag ), сердцевинный - ядерный или коровский (HBc Ag или cor Ag), антиген инфекционности (HBe Ag, выявляемый в крови при активной репликации HBV-инфекции.
Белок внешней оболочки ВГВ является его поверхностным антигеном – HBsAg. HBsAg – это основной маркёр ГВ. При остром гепатите HBsAg может быть выявлен в крови обследуемых уже в инкубационный период в первые 4–6 недель от начала клинического периода. Присутствие HBsAg более 6 мес рассматривается как фактор перехода болезни в хроническую стадию.
Следует отметить, что только часть HBsAg, образующегося при размножении вируса, используется для построения новых вирусных частиц, основное же его количество поступает в кровь инфицированных лиц, где и определяется HBsAg- антиген.
HBc антиген - сердцевинный антиген, выявляемый только в ядрах клеток печени - гепатоцитов, но отсутствующий в крови. Большое диагностическое значение имеет определение в крови антител к нему класса М - антиHBc-IgM. Эти антитела при остром гепатите выявляются раньше, чем антитела к другим вирусным антигенам. АнтиHBc -IgM выявляют у 100% больных острым гепатитом В. Анти HBc суммарные (М+G ) антитела могут быть единственным маркером вируса гепатита В в фазу “окна”, когда в крови не удается выявить ни HBs- антиген, ни антитела к нему. Именно поэтому их определяют на станциях переливания крови при тестировании донорской крови и плазмы.
HBeAg представляет собой измененный HBсоrеAg. HBcoreAg и HBeAg обладают структурным родством и имеют общие эпитопы - центры связывания.
Это четвертый маркер активной репликации вируса наряду с ДНК, HBs Ag и антиHBc –IgM.
HBe Ag - антиген инфекционности, циркулирует только при наличии HBs антигена. Длительность циркуляции HBe антигена - важный прогностический признак. Его выявление через два месяца с начала заболевания - признак вероятного развития хронического гепатита. В большинстве случаев происходит смена (сероконверсия) HBe Ag на антиHBe - антитела, что является маркером завершенной репликации вируса гепатита В и прогностически благоприятным признаком. На ранней стадии сероконверсии оба эти маркёра могут обнаруживаться одновременно.
Исчезновение HBeAg и быстрое нарастание титра анти-HBе у больного практически исключает угрозу хронизации ГВ. Отсутствие такой динамики и выявление монотонно низких концентраций анти-НВе, наоборот, может свидетельствовать о развитии хронического ГВ с невысокой активностью (HBeAg-негативный хронический ГВ).
анти-HBs определяют для оценки течения инфекционного процесса и благоприятности его исхода. Факт появления анти-HBs рассматривается как надежный критерий развития постинфекционного иммунитета, т.е. выздоровления после гепатита В. Хотя при хроническом гепатите В HBsAg и анти-HBs могут иногда обнаруживаются одновременно.
Анти-HBs могут сохраняться пожизненно. Анти-HBs обладают протективными (защитными) свойствами. Этот факт лежит в основе вакцинопрофилактики. В настоящее время в качестве вакцины против ГВ, в основном, применяют препараты рекомбинантного HBsAg. Эффективность иммунизации оценивают по концентрации антител к HBsAg у вакцинированных лиц. Согласно данным ВОЗ, общепринятым критерием успешной вакцинации считается концентрация антител, превышающая 10 мМЕ/мл.
Важное диагностическое значение для определения прогноза и тактики лечения больных гепатитом В имеет выделение двух качественно различных фаз развития HBV - репликативной и интегративной.
При репликативной фазе (т.е. массовом размножении вируса) наблюдается репликация ДНК HBV и всех белков, а соответственно, и антигены копируются в большом количестве. Характерно выявление ДНК HBV, HBe Ag и (или) анти - HBc - IgM, HBs Ag
При интегративной фазе развития (т.е. когда вирусные частицы не подвергаются дальнейшей репликации) геном HBV встраивается в геном гепатоцита. Основную роль играет фрагмент, несущий ген, кодирующий HBs антиген Поэтому при этой фазе идет преимущественное образование HBs Ag и антител к коровскому белку и анти- HBe Ag.
Гепатит C (HCV, ВГС) – вирусная инфекция, поражающая печень. В большинстве случаев заболевание протекает без видимых признаков – в острой форме, признаками которой является пожелтение кожных покровов и слизистых оболочек, изменение цвета кала и мочи, оно проявляется лишь в 15% случаев. Чаще, чем другие типы гепатитов, HCV принимает хроническую форму, которая при отсутствии лечения приводит к циррозу или первичному раку печени (гепатоцеллюлярной карциноме). Наиболее вероятный путь инфицирования – вливание зараженной крови и ее компонентов, пересадка зараженных органов, использование для пирсинга или татуировок нестерильных игл. Заражение возможно при проведении диагностических (например, гастроскопии) или терапевтических (например, санация полости рта) манипуляций. Реже инфицирование происходит половым путем, а также внутриутробно. Заболевание вызывается РНК-содержащим вирусом семейства Flaviviridae. Длительность инкубационного периода зависит от особенностей организма и может составлять 2-26 недель.
Первичная диагностика ВГС заключается в проведении теста на выявление суммарных специфических иммуноглобулинов (IgM+IgG) к антигенам вируса гепатита С. В случае обнаружения антител или получения сомнительного результата первичного исследования проводится данный тест, позволяющий определить присутствие в крови антител к структурным (core) и неструктурным (NS3-5) белкам агента инфекции.
Иммуногенность структурных и неструктурных белков HCV имеет разную степень активности. Наблюдение динамики их появления и изменение титра позволяет сделать вывод о длительности заболевания, составить прогноз его развития. Например:
Anti-HCV core IgG (антитела G к ядерным белкам вируса) начинают вырабатываться через 11-12 недель после заражения вирусом, достигая максимальной концентрации к 5-6 месяцу болезни. Такой уровень держится в течение всего заболевания, а также в период реконвалесценции (процесса восстановления нормальной работы организма после перенесенного заболевания). Для более раннего выявления инфекции исследуется наличие суммарных антител к core, которые появляются раньше. При переходе гепатита С в хроническую форму, антитела IgG циркулируют в крови до конца жизни. При выздоровлении их титр постепенно снижается, опускаясь через несколько лет до неопределяемого уровня.
Anti-NS3-5. Присутствие иммуноглобулинов NS3 характерно для самых ранних этапов сероконверсии (выработки организмом антител). На острой стадии заболевания титр anti-NS3 очень высок, что может служить отдельным индикатором вирусной инфекции ВГС. Значительная концентрация этих антител свидетельствует о высокой вирусной нагрузке, а их длительная циркуляция в кровотоке – о возможном переходе болезни в хроническую форму. Появление anti -NS4 и anti-NS5 является показателем более позднего периода болезни. Высокие титры anti -NS4 при хроническом гепатите C могут говорить о длительности процесса. По их уровню, по некоторым данным, также можно сделать вывод о степени поражения печени. Высокий титр anti-NS5 достаточно часто является индикатором присутствия РНК вируса. Их наличие в острый период заболевания расценивается как показатель возможного перехода болезни в хроническую стадию. Если при динамическом исследовании обнаружено снижение титров anti -NS4 и anti-NS5, то можно предположить о приближении клинико-биохимической ремиссии. Снижение титров anti-NS5 может быть показателем действенности проводимого лечения, а устойчиво-высокий уровень наблюдается у пациентов, не реагирующих на терапию. После выздоровления характерно постепенное снижение титров anti -NS4 и anti-NS5.
Исследование антител к структурным и неструктурным белкам вируса гепатита C может также применяться в качестве подтверждающего теста при получении положительных или сомнительных результатов по суммарным антителам к HCV.
Кровь желательно сдавать в утренние часы, натощак. Можно пить негазированную воду. Необходимо воздержаться от употребления чая, кофе, соков.
Общие рекомендации для подготовки к обследованию:
- накануне забора крови противопоказаны физические нагрузки;
- крайне желательно избегать стрессовых ситуаций;
- за сутки до обследования запрещено употребление алкоголя;
- в течение часа перед взятием крови не курить;
- перед тестированием ограничить количество принимаемой пищи;
- необходимо согласовывать с врачом необходимость применения лекарственных средств, могущие исказить результаты обследования, а также возможность их временной отмены;
- непосредственно перед сдачей крови нужно 10-15 минут спокойно посидеть.
Кровь не рекомендуется сдавать после инструментального, ректального, мануального, ультразвукового, рентгеновского исследований, кольпоскопии, гастроскопии, флюорографии, биопсии, массажа, физиопроцедур, а также прочих диагностических и (или) лечебных манипуляций.
Тест качественный. Результат описывается коэффициентом позитивности (КП), рассчитываемым по формуле:
КП = оптическая плотность конкретной пробы/пороговое значение
Данный показатель отражает, насколько позитивен конкретный тест, что позволяет врачам более точно истолковывать полученные результаты. Универсальность коэффициента позитивности дает возможность применять его при проведении всех иммуноферментных исследований. Концентрация антител и коэффициент позитивности между собой никак не связаны, поэтому показатель не используется для наблюдения динамики развития заболевания, так же как и действенности проводимого лечения.
Нормой является КП < 1.
Положительный ответ может быть получен:
- при инфицировании гепатитом C;
- в период восстановления функций организма после болезни (реконвалесценции).
Отрицательный ответ может свидетельствовать:
- об отсутствии гепатита C;
- о начальной стадии заболевания (инкубационном периоде);
- о серонегативном варианте течения болезни (т. е. протекающей без выработки организмом специфических антител к агенту инфекции).
В ряде случаев существует вероятность получения некорректных результатов, а именно:
Ф.И.О.: Петров Иван Иванович Пол: м Год рождения: хх.хх.хххх
Белки и антигены вируса гепатита С. Диагностика ВГС
Сегодня известно минимум 10 структурных и неструктурных белков, кодируемых геномом HCV. К структурным белкам относят core, envelop 1 и envelop 2. Белок core является белком нуклеокапсида, тогда как envelop 1 и envelop 2 — гликопротеины внешней оболочки вируса. В структурной зоне кодируется также белок р7, функция которого не ясна, однако аналогия с другими представителями семейства Flaviviridae позволяет предположить, что его функция связана с высвобождением вириона из инфицированной клетки.
Этот белок отщепляется клеточной пептидазой от envelop 2, но не во всех случаях, что обусловливает существование envelop 2 в виде двух форм более и менее протяженной.
Неструктурная область генома HCV кодирует 6 белков — NS2, NS3, NS4A, NS4B, NS5A и NS5B. Белок NS2 является вирусной металлозависимой протеиназой. Белок NS4A действует как эффектор или кофактор для NSЗ-протеолитической активности в NS4A/NS4B, NS4B/NS5A, NS5A/NS5B сайтах нарезания полипротеина вируса.
В настоящее время фрагменты структурных и неструктурных белков, полученных генноинженерным путем (рекомбинантные белки) или с помощью химического синтеза, используют в качестве антигенов при конструировании иммуноферментных тест-систем. Первое поколение иммуноферментных тест-систем появилось на рынке в 1989 году и было основано на прямом ИФА. В качестве иммуносорбента были использованы фрагменты двух белков, NS3 и NS4, обозначаемых как 5-1-1 и С100-3.
Одновременно были разработаны и подтверждающие тесты на основе иммуноблота с рекомбинантными белками (RIBA). Чувствительность этих тест-систем первого поколения составляла только 64% для ИФА и 55% для иммуноблота. Тест-системы второго поколения появились на рынке в 1991 году. В качестве антигенов, сорбированных на твердой фазе, в этих тест-системах использовали капсидные белки (фрагмент с22-3) и антигены неструктурных регионов NS3 (фрагменты с200 и сЗЗс) и NS4, что позволило повысить чувствительность и специфичность исследований. Поскольку гуморальный иммунный ответ на капсидные антигены (структурные белки) нагинается быстрее, гем на неструктурные белки, период от инфицирования до выявляемой сероконверсии удалось уменьшить до двух месяцев.
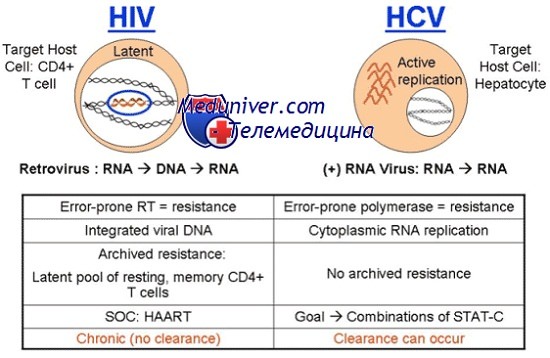
Подтверждающие тест-системы на основе иммуноблота позволяли идентифицировать участвующие в реакции антигены. Результаты, полученные при помощи этих тест-систем, интерпретировали как положительные лишь при реакции антител, находящихся в исследуемом субстрате, по крайней мере, с двумя антигенами, тогда как при наличии реакции лишь с одним из антигенов результат считали неопределенным. Было установлено, что специфичность второго поколения тест-систем зависела от источника антигенов. В 1993 году на рынке появилось третье поколение тест-систем. В дополнение к вышеупомянутым антигенам в этих тест-системах используются также антигены, аминокислотная последовательность которых соответствует иммунодоминантным участкам NS5 белков.
В тест-системах первого, второго и третьего поколений в качестве антигенов использовались или рекомбинантные, или синтетические пептиды. В настоящее время можно выделить также тест-системы четвертого поколения, в которых в качестве иммуносорбента используют сочетания рекомбинантных и синтетических пептидов.
Опыт применения тест-систем различных поколений в мире очень большой. Было установлено, что если с помощью тест-систем первого или второго поколения у больных с острым вирусным гепатитом С антитела выявляли на 10-16, а в ряде случаев и 25-30 неделе от начала заболевания, то диагностикумы третьего поколения позволяли сократить этот срок до 2-3 недель. Согласно обобщенным данным чувствительность тест-систем первого, второго и третьего поколений составляет соответственно 70-80%, 92-95% и 97%.
В то же время, по данным С. Colin, 2001, чувствительность тест-систем третьего поколения составила 98,9% у пациентов с хроническими заболеваниями печени и 97,2% на специальных контрольных панелях сывороток. Достижение высокой чувствительности иммуноферментных тест-систем 3 и 4 поколения сопряжено с некоторыми проблемами в обеспечении специфичности исследований, что в ряде случаев может приводить к появлению ложноположительных результатов. В литературе имеются данные о возможных погрешностях в специфичности ELISA 3 тест-систем. Они являются общими для всех ELISA тест-систем, включая тест-системы для диагностики СПИДа.
Ложнопозитивные результаты могут быть следствием повышенного содержания в образцах гамма-глобулинов (сыворотки пациентов африканской расы, миеломная болезнь, ревматоидные факторы), заболеваний печени (цирроз, рак), аутоиммунных заболеваний (коллагенозы, аутоиммунные гепатиты), других вирусных инфекций (ВИЧ, гепатит В) и длительного хранения сывороток в меняющихся температурных условиях. Проведение какой-либо иммунизации также может сопровождаться повышением частоты ложнопозитивных реакций. Рекомендуемые в настоящее время меры по устранению этой проблемы следующие: а) повторная постановка образца в этой же ИФТС; б) повторная детекция anti-HCV в другой ИФТС; в) использование подтверждающих тестов на основе ИФА и иммуноблота.
Однако использование предлагаемых способов подтверждения результатов зачастую приводят к расхождениям в их итоговой трактовке, что показано исследованиями российских и зарубежных исследователей.
В настоящее время производители ИФТС для детекции anti-HCV достигают высокой чувствительности или за счет более полного выявления антител к NS3 или антител к антигенам core. Сравнительные исследования, выполненные на различных группах риска и специальных контрольных панелях показали, что тест-системы, лучше выявлявшие антитела к NS3, оказались несколько более чувствительными, чем тест-системы, лучше выявлявшие антитела к антигенам core. Их чувствительность составляла, соответственно 99,9% и 98,6%.
Подтверждение или исключение гепатита D и гепатита С у детей
Серологигеский профиль дельта (D) гепатита определяется обязательным присутствием вируса гепатита В и формой D — инфекции: острой с одновременным заражением вирусом гепатита В (коинфекция) или острой инфекции вируса гепатита D у больного хроническим гепатитом В — суперинфекция.
При коинфекции дельта-антиген (HDAg) и RNA HDV могут обнаруживаться с первой недели желтушного периода в течение 1-2 недель. Антитела класса IgM появляются в остром периоде и могут сохраняться в течение 3 месяцев. В реконвалесцентном периоде обнаруживаются anti-HDV IgG в невысоких титрах, с последующей элиминацией в течение года.
При суперинфекции в остром периоде обнаруживаются anti-HDV IgM. В отличие от коинфекции одновременно обнаруживаются и anti-HDV IgG в высоких титрах, которые сохраняются в периоде реконвалесценции и в случае исхода в хронический гепатит — в последующие годы.
Этиологигеская диагностика острого и хронигеского вирусного гепатита С основана на обнаружении в сыворотке крови больного специфических маркеров вируса гепатита С: антител — anti-HCV IgM и anti-HCV IgG, а также маркера репликации — вирусной рибонуклеиновой кислоты RNA HCV.
Сложности лабораторной диагностики гепатита С вызваны беспрецедентной гетерогенностью вируса, обусловленной чрезвычайно быстрой изменчивостью его антигенной структуры, слабой иммуногенностью, преимущественно низкой концентрацией. В отличие от диагностической значимости обнаружения специфических иммуноглобулинов класса IgM при вирусном гепатите А и остром гепатите В anti-HCV класса IgM не могут служить маркером острого гепатита С, так как выявляются у большинства больных как острым в 50-93%, так и хроническим гепатитом С в 50-70% случаев.
Скрининговым маркером HCV являются антитела к вирусу —anti-HCV IgG. Антигены вируса HCV представлены структурным белком —core и неструктурными белками — NS. У 70-90 % больных острым гепатитом С вна-гале появляются антитела к структурному белку core при отсутствии антител к неструктурным белкам, и только в дальнейшем нарастают титры антител к белкам NS. Николаевой Л. И. приведены данные динамики специфических антител у больных острым с гепатитом С и с нормальной функцией иммунной системы.
Для первых четырех месяцев было характерно увеличение титров anti-HCV IgG против core и NS белков, которые оставались стабильными в течение 12-24 месяцев наблюдений до 1:800 — 1:20000. Титры anti-HCV IgM у больных острым и хроническим гепатитом имели близкие значения. В сыворотках пациентов, благополучно перенесших вирусный гепатит С в прошлом, были выявлены только anti-HCV IgG против core-белка HCV в титрах 1:40 — 1:100.
всем мире. В настоящее время абсолютно очевидны серьезные проблемы, связанные с данной инфекцией: высокая частота формирования хронических форм, бессимптомное течение, манифестация заболевания на поздних стадиях (цирроз печени), четкая ассоциация с развитием гепатоцеллюлярной карциномы. Ассамблея ВОЗ в 2016 г определила глобальную стратегию по борьбе с вирусными гепатитами, предполагающую элиминацию этих инфекций к 2030 г. Важнейшими целями этой программы, принятой 194 странами мира, являются сокращение числа новых случаев заражения вирусными гепатитами на 90% и числа случаев смерти от него на 65% по сравнению с уровнем 2016 г.
Актуальность проблемы объяснима еще и фактом выявления значительной частоты коинфекции ВГС и вирусом гепатита В (ВГВ). Маркеры вируса гепатита В (ВГВ) обнаруживаются у пациентов с ХГС в 22% случаев, что определяет важность вакцинации больных ХГС без коинфекции ВГВ против вирусного гепатита В. Установлена низкая частота перинатальной передачи ВГС от матерей с ХГС детям (3,5%), в то время как у женщин с сочетанием ХГС и ВИЧ-инфекции перинатальная передача ВГС составяет 14–16%.
Группы риска по заражению ВГС: медицинские работники; лица, использующие инъекционные наркотики; пациенты с ВИЧ; лица, которым были сделаны татуировки с помощью нестерильных инструментов; пациенты, получающие переливание крови или ее компонентов до 1992 г., пациенты отделений гемодиализа, дети, рождённые от матерей с ВГС.
Большинство пациентов с ОГС не демонстрируют каких-либо симптомов заболевания, у некоторых из них наступает спонтанная элиминация вируса, с которой ассоциируются следующие факторы: женский пол, молодой возраст, течение заболевания с клинической симптоматикой, клиренс РНК ВГС в течение 4 недель от начала клинической манифестации заболевания, генотип интерлейкина 28В (ИЛ 28В) СС. Однако ни один из этих параметров не может лечь в основу предсказания характера течения заболевания у каждого конкретного пациента.
Хронический гепатит С - хроническое заболевание печени, продолжающееся более 6 месяцев, в основе которого лежат инфицирование и поражение печени ВГС и манифестирующее морфологически некротическими, воспалительными и фибротическими изменениями печеночной ткани различной степени тяжести.
Диапазон исходов инфекции, вызванной ВГС, широк и колеблется от минимального до тяжелого поражения печени, включая развитие ЦП и ГЦК. Через 20– 30 лет после инфицирования ВГС вероятность развития ЦП колеблется от 4 до 45%. Прогрессирование фиброза печени имеет нелинейный характер и длится, как правило, в течение 20–40 лет от момента инфицирования. У части больных этот процесс происходит чрезвычайно медленно.
Выделен ряд факторов, которые могут оказывать отрицательное влияние на естественное течение гепатита С: возраст старше 40 лет к моменту инфицирования, мужской пол, раса (неевропейская), злоупотребление алкоголем, ожирение, нарушение обмена железа, метаболический синдром и др.
Верификация диагноза гепатита С основывается на обнаружении специфических маркеров гепатита С – определение суммарных антител к гепатиту С и маркерного спектра, состоящего из антител к структурным и неструктурным белкам вируса класса М и G.
Структурные белки (core- белок - ядерный, белки оболочки -Е1 и Е2, необходимы для формирования вирусного капсида. Основным структурным белком вируса гепатита С является core-протеин, который обладает РНК-связывающей активностью и образует нуклеокаспид вируса. Именно с этим структурным белком связывают прямое цитопатическое действие вируса С на печеночную клетку. Одновременно с этим показано, что данный белок обладает онкогенным эффектом. В эксперименте было установлено, что core-протеин вируса гепатита С подавляет процесс апоптоза и тем самым способствует развитию опухолевого процесса. Однако до настоящего времени все еще не выяснено, коррелирует ли наличие core-протеина с уровнем РНК и различных генотипов вируса.
Антитела класса М к core-антигену начинают выявляться в крови, начиная с 2 недели от начала заболевания, могут циркулировать как при остром, так и хроническом течении заболевания. Обнаружение антител класса М у новорожденного ребенка от матери, инфицированной гепатитом С, означает внутриутробное инфицирование плода. Антитела класса G начинают синтезироваться через 3-4 недели от начала заболевания, их циркуляция достаточно длительная.
Неструктурные белки (p7, NS2, NS3, NS4A, NS4B, NS5A и NS5B) выполняют различные регуляторные функции. Неструктурный белок NS2 является цинк-зависимой протеиназой, а NS3 - серин-протеиназой, участвующей в сборке вириона. Функция NS4 недостаточно известна, хотя предполагается, что этот белок участвует в качестве Ко-фактора для NS3 серин-протеазы [3]. Достаточно хорошо выяснена функция белка NS5. Изучено, что данный белок является РНК- зависимой РНК-полимеразой - ферментом, который крайне необходим для синтеза вирусной РНК, т.е. репликации вируса С. Установлено, что NS5A подавляет активность интерферона. G. Reyes (2002) показал, что NS5A ингибирует процесс апоптоза и тем самым становится фактором канцерогенеза.
При положительном результате на суммарные антитела в вирусу гепатита С (анти-HCV) обязательно необходимо проводить подтверждающее исследование, используя тест на выявление маркеров гепатита и определение РНК вируса с помощью полимеразной цепной реакции в реальном времени.
- диагностика гепатита С;
- подтверждение положительных и сомнительных результатов скрининговых исследований.
Положительный результат: инфицированность вирусом гепатита С (необходимо дополнительно выявлять HCV РНК и подтверждать наличие антител определение подтверждающего теста с определением антител к структурным и неструктурным антигенам).
Если в подтверждающем тесте выявлены антитела только к одному из неструктурных антигенов вируса, результат считается неопределенным. Такие пациенты должны быть обследованы на наличие РНК вируса гепатита С, а через 2-3 недели от момента первого забора крови повторно исследовать кровь на наличие антител к гепатиту С.
Несмотря на высокую точность ИФА, на результаты диагностики могут повлиять: тяжелые иммунодефицитные состояния; беременность; рассеянный склероз; обострения респираторных заболеваний; вакцинация; аутоиммунные системные заболевания соединительной ткани; гематологические недоброкачественные опухоли; систематическое проведение гемодиализа.
Читайте также:

