Бубонная чума забытое прошлое
Обновлено: 18.04.2024
Страшные заболевания прошлого, практически стёртые с лица земли современной медициной (или нет?).
Реально ли уничтожить болезнь? В теории это возможно – если на всей планете достаточно долго не фиксируют ни одного случая, болезнь считается искоренённой.
В первую очередь это касается инфекционных болезней. Такие болезни приходят извне, их вызывает попадание в организм вирусов, бактерий, паразитов. Опасность инфекций в том, что они заразны, а слабость – в том, что они не возникают из ниоткуда. Всегда есть источник (носитель микроорганизмов–возбудителей), есть переносчики и восприимчивые организмы – незащищённые иммунитетом жертвы. Если уничтожить все источники и/или привить всем иммунитет, болезнь исчезнет.
Проблема в том, что на практике это почти невозможно – найти все очаги на планете, или привить всё человечество, включая беднейшие страны. Поэтому на данный момент остаётся лишь одна страшная человеческая болезнь, которую удалось стереть с лица земли – натуральная оспа.
А как обстоят дела с другими известными болезнями? Об этом и пойдёт речь ниже.
Дисклеймер: материал содержит иллюстрации (скрытые), которые могут показаться неприятными
Первый кандидат из нашей подборки на то, чтобы кануть в небытие вслед за оспой. Полиомиелит – инфекционное заболевание, вызываемое полиовирусом. В 99 случаях из 100 полиовирус ведёт себя как типичный энтеровирус – лихорадка, ломота в мышцах, расстройство стула, тошнота, рвота. А ещё боль в горле, кашель, насморк, увеличение лимфоузлов, сыпь. Всё это богатство проходит само собой через какое-то время, специфического лечения нет.
Опасность полиовируса в том, что в 1 случае из 100 он проберётся в спинной мозг и начнёт уничтожать серое вещество. В зависимости от того, какие именно клетки ему подвернутся, могут нарушиться самые разные функции организма. Чаще всего встречаются парезы (ослабление) и параличи (полное расслабление). Подвержены полиомиелиту в основном дети до 5 лет, поэтому его ещё называют детским параличом.
В тяжёлых случаях вирус может добраться до дыхательных центров, и в таком случае шансов очень мало. Несмотря на то, что шанс заболеть паралитической формой полиомиелита не более 1%, эта болезнь всё равно вызывала волны детских смертей и считалась национальным бедствием.
Всё дело в том, что полиомиелит невероятно опасен в эпидемиологическом плане. В большинстве случаев он протекает бессимптомно или в форме обычной кишечной инфекции. При этом носитель остаётся чрезвычайно заразным целую неделю, а его испражнения – ещё месяц. Представьте – гигантское количество ничего не подозревающих переносчиков, которые будут заражать всех вокруг по неделе и больше. Из-за этого даже 1% – это десятки тысяч парализованных и умерших детей. И никакого лечения. Как у простуды – просто ждать, пока пройдёт сам.
К сожалению, у полиомиелита есть талант, которого не было у оспы – поэтому он всё ещё не уничтожен. Это талант к мутациям, которому позавидует любой вирус Resident Evil.
Есть два типа вакцин – c убитым (инактивированным) и ослабленным вирусом. Инактивированная вакцина намного сложнее и дороже в производстве. Живая вакцина гораздо дешевле и идеальна для массовых кампаний в бедных странах – это просто капли в рот, вакцинация занимает пару секунд. При этом она тоже очень эффективная – именно благодаря ей удалось освободить от полиомиелита даже страны с низкой санитарией.
С вакциной вводится ослабленный вирус, в ответ вырабатываются антитела, человек получает иммунитет, остатки вируса выводятся из организма. И вроде бы всё в порядке, так и должно быть. Но иногда этот вакцинный мусор попадает в удачное грязное место и умудряется дотянуть до контакта с непривитым человеком. И начинает путешествовать по другим непривитым. И если это продолжается достаточно долго, в какой-то момент он может мутировать в паралитическую форму. Отработанный материал вакцины переродится в живой и опасный полиомиелит.
К счастью, такое случается редко – чаще всего контакт с отходами наоборот приводит к пассивной иммунизации. Тем не менее, случаи полио вакцинного происхождения периодически всё-таки случаются в странах, у которых даже близко нет денег на инактивированные вакцины – Сомали, Конго, Нигер, Нигерия.
Единственный путь к полному искоренению полиомиелита – вакцинация всего населения Земли инактивированной вакциной. Над этим работает ООН. Конечно, пандемия COVID-19 наверняка замедлила программу, но рано или поздно полиовирус будет уничтожен.
Человек заражается бешенством через укус больного животного. Жуткая возможность заразиться от укуса озверевшего человека теоретически есть, но на деле крайне мала.
Часто нулевому пациенту зоонозного заболевания нужно совершить сомнительные действия с заражённым животным (например съесть), чтобы у болезни появился шанс перейти видовой барьер. Опасность же бешенства в том, что от него никто не защищён – агрессивная больная собака может покусать кого угодно, летучая мышь тем более.
Бешеная собака выглядит скорее невероятно больной, чем невероятно злобной (но они агрессивны, пусть и не по своей воле)
Огромную опасность представляют так называемые естественные резервуары – животные, для которых вирус неопасен, но которые могут быть переносчиками. Например, бешеная собака опасна около недели, пока жива, а в летучей мыши бешенство может жить сколько вздумается.
Бешенство до сих пор нельзя вылечить, если появились симптомы, человек гарантированно умирает. Болезнь вызывает воспаление головного мозга, из-за которого отказывают лёгкие. Но пока нет симптомов, спастись можно – для этого используют вакцину и иммунную сыворотку. Сыворотка представляет собой огромную дозу иммуноглобулинов, ориентированных именно на бешенство. Самое главное – экстренное обеззараживание раны.
В 2005 году появился экспериментальный курс лечения – Милуокский протокол. Девушку с симптомами пытались вылечить, погрузив в глубокую искусственную кому и накачав противовирусными. План был такой, что если отключить большую часть функций мозга, организм сможет побороть инфекцию самостоятельно. И это сработало – через неделю она вышла из комы без признаков болезни. Но в дальнейшем метод показал себя не очень – выживала в лучшем случае пятая часть пациентов. И каждому до появления симптомов успевали вкатить вакцину, поэтому сложно сказать, что именно помогло.
Полностью уничтожить бешенство на планете фактически невозможно – для этого нужно отловить и привить всех диких животных – потенциальных переносчиков. А также уничтожить всех тех, кто является долгоживущим резервуаром инфекции.
Зато можно свести к минимуму случаи заражения людей. Для этого вакцинируют всех животных, которые контактируют с человеком – домашних питомцев, сельскохозяйственных и тех, кого употребляют в пищу. Критически важно, чтобы каждый укушенный незнакомым животным быстро обращался в больницу. Это особенно актуально в Америке, где существует опасность получить бешенство от летучих мышей.
Так что победить бешенство помогают близость к цивилизации и деньги. В развитых странах годами и даже десятилетиями не случается ни одного заражения. Но если вокруг вас на несколько дней пути нет ни одной больницы, вы умрёте.


Исследование древней ДНК показало, что 3800 лет назад жители нынешней Самарской области уже болели бубонной чумой. Раньше предполагалось, что ген, позволяющий чуме переходить в бубонную форму, появился только в конце 1-го тысячелетия до нашей эры. Теперь эта дата отодвинута как минимум на тысячу лет назад. Бубонная чума переносится блохами, а это требует особых адаптаций, которые появились у чумного микроба эволюционно недавно — теперь время их появления уточнено. Кроме того, полученные данные позволяют поставить интересную проблему связи распространения штаммов чумы с миграциями народов бронзового века (в частности, индоевропейцев, относившихся к ямной и срубной культурам).
Конечно, бацилла устроена гораздо проще человека (это придется признать при любом разумном понимании простоты и сложности). Но вот если считать критерием прогресса эволюционный успех, ситуация сразу утратит однозначность. Чумная бацилла — эволюционно молодой вид, на протяжении всей своей короткой истории последовательно распространявшийся по земному шару (чтобы оценить это, достаточно взглянуть на современную карту природных очагов). Он многочислен, и в обозримом будущем ему не грозит гибель, несмотря на все человеческие усилия — задачу полного уничтожения чумы современная медицина даже не берется ставить. А из истории мы все отлично знаем, что чумная бацилла тысячелетиями использовала популяции человека как источник питания, временами нанося им страшный урон. Сейчас это пресечено благодаря антибиотикам и продуманным глобальным эпидемиологическим мерам. Но сама по себе чумная бацилла продолжает процветать — у нее ведь есть и другие хозяева.
Более того, судьбы чумной бациллы и человечества связаны гораздо более причудливо, чем может показаться на первый взгляд. В последние годы, благодаря методам современной биологии, этот клубок взаимоотношений удается понемногу распутать.
Естественная история чумы
Происхождение чумной бациллы от псевдотуберкулезной палочки — событие, случившееся едва ли больше 20 000 лет назад (M. Achtman et al., 1999. Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis). Это означает, что чумная бацилла в несколько раз моложе нашего собственного биологического вида — человека разумного. Хорошо известно, что 20 000 лет назад анатомически современные люди уже успели заселить не только Старый Свет, но и Австралию. И только после этого внезапно произошла трансформация, превратившая относительно безобидную псевдотуберкулезную палочку в страшного возбудителя чумы.
Биологи знают, что переход к паразитизму, как правило, сопровождается неким упрощением организма. Так обстоит дело и у животных, и у растений, и у бактерий. Превращаясь в чумную бациллу, псевдотуберкулезная палочка потеряла примерно 10% генома, в том числе гены, обеспечивающие многие биохимические процессы и сборку жгутиков (A. McNally et al., 2016. 'Add, stir and reduce': Yersinia spp. as model bacteria for pathogen evolution). Последнее понятно: в отличие от многих других микроорганизмов, чумной бацилле подвижность не нужна. А отказавшись вместе с генами от способности самостоятельно синтезировать ряд полезных веществ, бацилла утратила экологическую гибкость — теперь ей просто-напросто ничего не осталось, кроме как осваивать роль глубоко специализированного паразита, умеющего получать эти вещества в готовом виде от хозяина. Неудивительно, что результат оказался впечатляющим.
Став на этот путь, чумная бацилла приобрела несколько генетических особенностей, которых нет у псевдотуберкулезной палочки и ни у каких других представителей рода Yersinia. У нее появились две новые плазмиды, кодирующие особые белки — факторы вирулентности. Про один из этих факторов известно, что он, воздействуя на синтез и разрушение определенных структурных белков хозяина, облегчает проникновение чумной бациллы в легкие (D. L. Zimmler et al., 2015. Early emergence of Yersinia pestis as a severe respiratory pathogen). Именно так возникает крайне опасная форма чумы — легочная.
Не будем забывать, что чума поражает отнюдь не только человека. Судя по всему, чумная бацилла потенциально способна использовать как питательную среду практически любое млекопитающее. Во всяком случае, среди ее зафиксированных жертв — не только грызуны и зайцеобразные (о которых это широко известно), но и хищники, парнокопытные, насекомоядные, даманы, сумчатые (K. L. Gage, M. Y. Kosoy, 2005. Natural history of plague: perspectives from more than a century of research). Именно поэтому чума — когда ей дают возможность распространиться по миру — легко образует новые природные очаги, находя себе хозяев из числа разнообразных зверей, никогда раньше чумой не болевших. Таких недавно возникших природных очагов чумы предостаточно, например, в Северной и Южной Америках, куда чума проникла только на рубеже XIX и XX веков, в эпоху так называемой третьей пандемии.
Но когда же люди начали болеть чумой?
Свидетельства чумных могил
Более того, исследование ДНК древних штаммов Yersinia pestis принесло сюрприз. Оказалось, что у большинства из них нет гена, кодирующего белок Ymt — тот самый, который нужен для успешного размножения бациллы внутри блохи и для образования чумного блока. Это ген был приобретен чумной бациллой в результате широко распространенного у бактерий горизонтального переноса генов, и произошло это, по-видимому, относительно недавно. Обнаружить его удалось только в самом молодом образце — в ДНК бациллы, заключенной в скелете человека, который жил в Армении в X веке до нашей эры. В более ранних находках, относящихся ко 2-му и 3-му тысячелетиям до нашей эры, никаких следов белка Ymt (вернее, кодирующего его гена) нет. Скорее всего, это означает, что древняя чума не могла переноситься блохами — во всяком случае, таким специализированным способом, как современная бубонная чума, которая обязана своим существованием механизму распространения через чумной блок. Древняя чума не была бубонной, а была только легочной; это подтверждается тем, что фактор вирулентности, нужный для развития легочной чумы, у всех древних штаммов оказался на месте.
Это — не единственное отличие древней Yersinia pestis от современной. Известно, что для по-настоящему успешного размножения чумной бациллы в теле блохи ей надо было не только приобрести ген, кодирующий белок Ymt, но еще и отключить три ранее существовавших гена, действующих на мембранные белки (Y. C. Sun et al., 2014. Retracing the evolutionary path that led to flea-borne transmission of Yersinia pestis). После прекращения работы этих генов бациллы начинают слипаться друг с другом, образуя разрастающиеся пленки, что, собственно, им в новых условиях и требуется. Именно в результате этих изменений образуется чумной блок. Так вот, показано, что у штамма чумной бациллы, жившего в 3-м тысячелетии до нашей эры на Алтае, два из трех упомянутых генов еще работали. Значит, создавать чумной блок этот штамм не мог.
Но и это еще не все. Мы уже упоминали, что чумная бацилла отличается от своего предка — псевдотуберкулезной палочки — полным отсутствием жгутиков. Дело в том, что белки бактериальных жгутиков провоцируют защитные клетки организма млекопитающих на иммунный ответ (F. Hayashi et al., 2001. The innate immune response to bacterial flagellin is mediated by Toll-like receptor). Поэтому такому глубоко специализированному паразиту, как чумная бацилла, жгутики не только не нужны, но и мешают. Известно, что и псевдотуберкулезная палочка при попадании в организм млекопитающего отключает экспрессию гена, кодирующего главный белок жгутиков (флагеллин). Ну, а у чумной бациллы этот ген вообще выведен из строя благодаря мутации сдвига рамки считывания, которая в данном случае оказалась полезной.
Уточнение: это относится к современной чумной бацилле. А вот у чумных бацилл, живших в 3-м тысячелетии до нашей эры, мутации сдвига рамки в гене флагеллина еще не было и жгутиковая система, хотя и будучи уже бесполезной, сохраняла (по-видимому) частичную работоспособность. Это — эволюционно архаичный признак.
Итак, люди болели чумой давно, но все же не всегда. И возбудитель болезни на протяжении человеческой истории менялся. В эпоху расцвета древнего Шумера чума была в основном легочной. Эта форма чумы стремительно передается от человека к человеку и за считанные сутки убивает всех заболевших (первые вылеченные появились только после изобретения антибиотиков). Но как раз эта чрезвычайная смертоносность не дает чуме непрерывно циркулировать в человеческих популяциях. Микроб, который мгновенно убивает всех попавших в зону заражения, лишает себя питательной среды, и вспышка инфекции затухает.
Ради вящей точности отметим, что некоторые американцы, пострадавшие от чумы, получили ее не напрямую от грызунов, а от домашних кошек, которые тоже болеют чумой, подхватывая ее от диких животных. А один биолог в штате Аризона вообще заразился чумой от дикой пумы (см. Epidemiology of plague). Здесь напоминает о себе важное преимущество чумной бациллы: ее крайняя неспецифичность, позволяющая легко менять хозяев. А механизм чумного блока — это уловка, помогающая ей буквально перепрыгивать с одного хозяина на другого.
Лошадь, колесо, язык. и чума
Совсем недавно, в июне 2018 года, в журнале Nature Communications вышла еще одна статья, подписанная большой группой германских, российских, китайских и швейцарских исследователей и тоже посвященная древним штаммам возбудителя чумы. Авторам удалось обнаружить ДНК чумной бациллы в зубах нескольких древних людей из курганных захоронений в Самарской области, возраст которых — примерно 3800 лет, или 1800 лет до нашей эры.


Рис. 2. Расположение курганного могильника Михайловский II в Самарской области (а) и найденные там скелеты, послужившие объектом исследования (b). Иллюстрации из обсуждаемой статьи в Nature Communications
Чума — важнейший, хотя и очень мрачный, эволюционный спутник человека. Эволюция чумного микроба и история человечества сложным образом переплелись, породив многогранный комплекс явлений, в которых современная наука, по сути, только начинает разбираться. Чума влияла на человека (например, через социальные последствия великих пандемий), но и человек влиял на чуму: с одной стороны, он научился ее лечить, с другой же, невольно помог ей распространиться на новую часть света — Америку (см. Б. Жуков, 2008. Царица грозная чума). Человек и чума — хороший пример комплексной проблемы, для раскрытия всех сторон которой могут пригодиться методы самых разных наук: молекулярной филогенетики, микробиологии, патофизиологии, зоологии, археологии и даже лингвистики. Особенно это касается древних событий, изучать которые трудно, но все же возможно. Успехи, достигнутые в этой области за последние годы (2015–2018), показывают, что тема эта — многообещающая.
См. также:
Надежда Маркина. Из Азии в Европу и обратно: степной коридор для чумы // Троицкий вариант. 2018.
К 120-летию открытия А. Йерсеном и Ш. Китазато микроба чумы Yersinia pestis
Об авторе
Виктор Васильевич Сунцов — доктор биологических наук, ведущий научный сотрудник Института проблем экологии и эволюции им. А. Н. Северцова РАН. Занимается изучением происхождения и эволюции возбудителей природноочаговых инфекций, в частности чумы.
Диаграмма публикаций по проблеме чумы, фиксирующая скачок их числа с 2003 г.
Немного истории
Карта распространения чумы в Европе. Пандемия, начавшаяся в центральных районах Азии, достигла берегов Черного моря в 1347 г.
Когда появился микроб чумы?
Доказанное в 1980 г. молекулярными методами непосредственное родство псевдотуберкулезного (Y. pseudotuberculosis) и чумного (Y. pestis) микробов привело к выводу об их недавней дивергенции, правда, без указания времени и места, когда именно и где это случилось [5]. Высокое сходство их геномов позволяло некоторым авторам даже объединить их в один вид в качестве отдельных подвидов, хотя вызывают они совершенно разные болезни. И псевдотуберкулезного, и чумного микробов относят к семейству Enterobacteriaceae — возбудителям кишечных инфекций, но последний, будучи паразитом крови, не имеет к ним никакого отношения. У него иная адаптивная среда, и в принципе его нужно отнести к другому семейству [3].
Микрофотография чумной палочки. Увел. ×200. Фото с сайта cdc.gov
Идея недавнего отделения чумного микроба от псевдотуберкулезного была неожиданной, но отнюдь не новой. В 1950–1970-х годах такие мысли высказывали В. Н. Беклемишев, В. А. Бибикова, А. И. Дятлов, Л. Н. Классовский, В. С. Петров, Н. М. Хрусцелевская. Но тогда подобные интуитивные ощущения эволюционной молодости возбудителя чумы выглядели теоретически чуждыми, паранаучными и деструктивными, поэтому они не нашли поддержки у ортодоксов.
Головокружение от успехов
В современных исторических реконструкциях в биологии доминирует новая филогенетика (молекулярная филогенетика, генофилетика). Отчасти это лидерство оправдано широкими возможностями, которые предоставляют молекулярные структуры и компьютерные технологии филогенетических построений, позволяющие сравнивать и обрабатывать миллионы признаков, — таких, как последовательности нуклеотидов. Все составляющие новой филогенетики полезны, они необходимы для создания естественных филогенетических схем, но недостаточны, особенно в отношении прокариот. Молекулярная генетика — молодая наука, и закономерности молекулярной эволюции пока не вполне ясны. Филогении можно выстраивать только по гомологичным признакам, а их выявление, в том числе и на молекулярном уровне, представляет немалую проблему. Выводы на основе применения разных молекулярно-генетических методов далеко не однозначны, порой не согласуются между собой и с данными других наук: экологии, биогеографии, микробиологии и др. Такая обескураживающая разноголосица свойственна и заключениям в отношении микроба чумы.
Происхождение Yersinia pestis: взгляд натуралиста
Знание экологии монгольского сурка и его блох позволяет понять селективные (адаптационные) процессы, проходившие в микробных популяциях в природе, и причинно-следственные связи в эволюционных филумах. Появление возбудителя чумы в Центральной Азии предопределили два природных фактора: аридность горно-степных ландшафтов, постепенно увеличивающаяся с олигоцена-миоцена, и максимальное похолодание в сартанское время последнего оледенения. Проще говоря, индуктором видообразования микроба чумы был сухой и холодный климат Центральной Азии в конце ледниковой эпохи. Кроме того, в возникновении чумного микроба важную роль играет физиология, точнее поведение монгольского сурка, связанное с устройством зимовочной пробки, а также особенности сурочьей блохи O. silantiewi.
В Центральной Азии, в горно-степных поселениях сурка тарбагана влажность почвы очень низкая, всего 2–7% [3], а грунт в зимовочной норе зверька сухой и щебнистый. Изготовить из него земляную пробку внутри норы, в вертикальном лазе диаметром 15–20 см, все равно, что замазать сухим песком отверстие в потолке размером с футбольный мяч. Из-за дефицита почвенной влаги у монгольского сурка выработалось специфичное поведение. При залегании в спячку он устраивает зимовочную пробку из специально подготавливаемой смеси мелкозема, щебня и влажных каловых масс, которые летом собираются в отнорках (уборных). Для перетаскивания камней, обвалянных в фекалиях, сурки используют зубы, при этом частицы фекалий, а с ними и возбудитель псевдотуберкулеза, попадают в ротовую полость. Итак, во рту спящих тарбаганов — экскременты, а в них — кишечный паразит, микроб псевдотуберкулеза!
Монгольский сурок тарбаган и его зимовочная (постоянная) нора. Вверху: зимовочная пробка, состоящая из смеси мелкозема, щебня и цементирующих их экскрементов (1); гнездовая камера (2); отнорки-уборные, в которых в летние месяцы сурки накапливают строительную смесь (3). Внизу: слой мелкозема и щебня (а); и коренные породы (б), приведены температуры грунта и спящих сурков во время раскопки (февраль 1979 г.)
Сурки — типичные семейно-колониальные животные. Группировки из 2–22 разновозрастных и разнополых зверьков совместно зимуют в одной постоянной, или зимовочной, норе. У каждого зверька в течение зимней спячки более длительные периоды глубокого сна (торпора) чередуются с короткими периодами бодрствования (эутермии). В торпорной фазе температура тела снижается до 2–5°C, в эутермной может достигать нормальной, у активных сурков — около 37°С. За осенне-зимне-весеннее время сурки не вполне синхронно просыпаются до 15 раз, примерно дважды в месяц. Таким образом, каждый зверек в течение периода подземной жизни имеет два гомеостатических состояния, между которыми лежит промежуток физиологической гетеротермии. Отсюда следствие: блохи в холодное время года питаются на сурках, температура тела которых лежит в диапазоне 5–37°C. Обратим внимание на непрерывность температур!
В 1970-х годах в тувинском очаге чумы, расположенном в Центральной Азии, мы изучали зимнюю спячку тарбагана. В феврале-марте, во время максимального зимнего промерзания грунта (до глубины более 2 м), раскопали три зимовочных норы. Из них изъяли восемь глубоко спящих и девять проснувшихся активных зверьков, среди которых были молодые, полувзрослые и взрослые особи. Из их шерсти собрали 230 личинок O. silantiewi, 60 живых и 452 пустых коконов, а из ротовой полости торпидных зверьков — дополнительно 20 личинок. Пустые коконы (от 4 до 87) обнаружили также на 22 зверьках, отловленных в первые две недели после весеннего пробуждения.
Тувинский природный очаг чумы, Монгун-Тайгинский мезоочаг. Снеговое покрытие в зимне-весенние месяцы не превышает 30–40%, грунт промерзает на глубину более 2 м к началу января, а оттаивает в июле
Отметим распределение коконов на шерсти: большая часть прикреплена на голове, у основания хвоста и на наружной стороне задних ног. Все личинки, извлеченные из ротовой полости, оказались с кровью и увеличенными в размерах за счет развития жирового тела, что свидетельствовало о полноценности пищи и об их готовности к окукливанию. У спящих зверьков поврежденная личинками слизистая ротовой полости и язык обильно кровоточили, изо рта заметно выступала кровяная пена, а рот, зубы, лапы были обильно испачканы экскрементами (следами устройства зимовочной пробки осенью). Незарубцевавшиеся раны в ротовой полости мы наблюдали у всех сурков, отловленных после выхода из нор в конце марта и начале апреля, что говорит о массовости описываемого явления, его общепопуляционном характере.
Отсюда понятна причина концентрации пустых коконов на голове, хвосте и наружной стороне задних ног у спящих и недавно пробудившихся сурков тарбаганов. Зимой грунт промерзает глубже гнездовых камер, и личинки переходят из гнездовой выстилки на более теплые тела спящих зверьков. При этом некоторые личинки, произвольно перемещаясь в шерсти, попадают в ротовую полость сурка, где, питаясь на слизистой, травмируют ее. Перед окукливанием личинки покидают ротовую полость и прикрепляются к шерсти близ рта. Зная позу свернувшегося в шар спящего сурка, у которого нос уткнулся в анус, а задние ноги прижаты к щекам, легко предсказать места прикрепления коконов.
На основе новых эколого-географических, палеоклиматических и генетических данных можно сформулировать основные постулаты теории происхождения и мировой экспансии микроба чумы.
Происхождение, естественное распространение в Евразии и антропогенная мировая экспансия микроба Y. pestis во время первой (I), второй (II) и третьей (III) пандемий. 1 — южная граница зоны многолетнемерзлых грунтов; 2 — граница доминантного распространения в природе микроба Y. pseudotuberculosis O:1b; 3 — ареал сурка-тарбагана, район происхождения микроба чумы; 4 — первичные природные очаги; 5 — вторичные природные очаги; gly + (gly − ) — способность (неспособность) штаммов ферментировать глицерин
Предковая форма возбудителя чумы — микроб псевдотуберкулеза 1-го серотипа (Y. pseudotuberculosis O:1b), который доминирует в северо-центрально-азиатских и дальневосточных районах с суровым климатом.
Метаморфоза микроба псевдотуберкулеза в чумную бактерию произошла в конце позднего плейстоцена. За весь четвертичный период глубокое промерзание грунта (2 м и более) в Центральной Азии отмечено только в сартанское время позднего плейстоцена и в голоцене, т. е. не ранее 22 тыс. лет назад [10].
В ультраконтинентальном районе зимнего антициклона в Центральной Азии личинки блох, паразитирующие на монгольском сурке тарбагане, зимой переходят к факультативной гематофагии, что приводит к устойчивому контакту крови сурков с псевдотуберкулезным микробом [3].
Теперь уже можно легко представить, как сапрозоонозный кишечный псевдотуберкулезный микроб постепенно эволюционировал в облигатный паразит крови незимоспящих грызунов: экскременты тарбагана → спящий сурок → активный сурок → незимоспящий грызун.
Знание молекулярно-генетических, популяционных и биоценотических факторов, а также их многообразных связей позволяет выделить в эволюционной истории возбудителя чумы основные вехи.
IV. Во время третьей пандемии с корабельными крысами микроб уже другого подвида (orientalis) из Азии вновь проник в Африку и впервые на быстроходных морских судах добрался до Нового Света, где закрепился в виде вторичных природных очагов в популяциях земляных белок, луговых собачек, полевок, морских свинок.
В поисках согласия
Экологический сценарий происхождения, эволюции и мировой экспансии возбудителя чумы весьма заметно расходится с гипотезами, построенными на основе генетических данных. Где же истина? Какой из них достоин большего одобрения?
В пользу экологического сценария говорит следующее:
Такие аргументы делают этот экологический сценарий наиболее правдоподобным в сравнении с другими, позволяют принять его за исходную гипотезу и наполнять его генетическими признаками. Биологическое содержание сценария, понятное широкому кругу исследователей, дает существенные гносеологические преимущества перед слишком редуцированными историческими реконструкциями. К примеру, некоторые авторы из-за сходства отдельных генетических признаков у кавказского подвида Y. pestis caucasica и псевдотуберкулезного микроба считают Кавказ родиной чумы и выстраивают соответствующую филограмму [11, 12]. Но на Кавказе, в относительно теплом климатическом регионе, нет псевдотуберкулезного микроба 1-го серотипа или он встречается крайне редко! Истоки чумы следует искать в холодных, суровых краях — как в предложенном сценарии.
Несмотря на разительное несходство экологической и генетической филогений, между ними нет непреодолимой пропасти, более того, есть безусловные точки соприкосновения. Экологический сценарий для молекулярных и генетических признаков очерчивает диапазон генетической изменчивости микробной популяции, вступившей на путь видообразования, выделяет рамки экологической достоверности генетических фактов, привлекаемых для филогенетических выводов [3, 13].
Бубонная чума – это карантинная природно-очаговая инфекция. Основным клиническим симптомом является наличие чумного бубона. Для нозологии характерна высокая лихорадка, выраженная интоксикация, при иммуносупрессии возможно висцеральное поражение, генерализация инфекции. Диагностика построена на обнаружении возбудителя в биологических материалах (микроскопия, посев, ПЦР), серологические методы малоинформативны, практически не применяются. Лечение проводится в условиях обязательного карантина, включает в себя антимикробную этиотропную терапию, массивную дезинтоксикацию, симптоматические методы. Реже прибегают к хирургическим вмешательствам.
МКБ-10
Общие сведения

Причины
Возбудитель болезни – бактерия Yersinia pestis. Источником и резервуаром инфекции служат больные люди, грызуны, зайцы, лисы, верблюды, домашние кошки и другие животные. Переносчики – блохи, в пищеварительном тракте которых размножаются чумные палочки. Заразными насекомые становятся уже через 3-5 суток после попадания в них возбудителя и остаются таковыми в течение года. При укусе блоха срыгивает внутрь ранки содержимое желудка с большим количеством бактерий. Также описаны воздушно-капельный, фекально-оральный и контактно-бытовые пути инфицирования.
Основными факторами риска заражения бубонной чумой считаются проживание и несение воинской службы на эндемичных территориях, профессии, связанные с истреблением грызунов, работой в зернохранилищах, ветеринарной службе. Опасности подвергаются археологические экспедиции, вскрывающие места старинных захоронений, а также животноводы, медицинский персонал, пастухи, туристы, работники международных аэропортов, зоопарков. Бубонной чуме наиболее подвержены дети, лица, не достигшие 20-ти лет, и взрослые мужчины.
Патогенез
После проникновения в организм чумные бактерии размножаются в месте внедрения, образуя воспалительный уплотненный участок либо папулу, пустулу с геморрагическим содержимым. Распространение возбудителя происходит лимфогенно до регионарных лимфатических узлов, внутри которых бактерии размножаются. Особенностью Y. рestis является способность к подавлению фагоцитарной активности макрофагов, внутриклеточному размножению в них. При этом выделяется большое количество токсинов, продуктов распада тканей, возбудителей, что обусловливает интоксикационные симптомы.
Плотная фиброзная нодулярная оболочка препятствует попаданию в очаг воспаления полиморфно-ядерных лейкоцитов и специфических антител. Активная репликация возбудителя способствует расплавлению и увеличению лимфатической ткани регионарных узлов, вследствие чего возникают конгломераты. Длительная персистенция, массивный воспалительный процесс приводит к геморрагическому некрозу нодулярной ткани и выходу чумной палочки в системный кровоток с последующей генерализацией инфекции; в 10-20% случаев развиваются симптомы вторично-легочной чумы.
Симптомы бубонной чумы
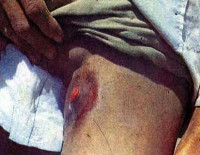
Инкубационный период составляет 2-6 суток, реже 1-12 суток, ведущими симптомами являются нарастающие локальные боли (обычно в паху), лихорадка до 39-40° C и более. Пациенты вынуждены сохранять крайне неудобные позы для уменьшения болевых ощущений. Характерны сильные ознобы, выраженная слабость, головные боли, расстройства сна, беспокойство, дискоординация движений, иногда бред, галлюцинации. Около половины заболевших бубонной чумой отмечают симптомы расстройств ЖКТ: абдоминальные боли, тошноту, рвоту, эпизоды диареи.
Спустя 1-3 дня без лечения преимущественно в паховой области, реже в зоне подмышек или шеи обнаруживается очень плотное, резко болезненное образование с гиперемированной, горячей, иногда лоснящейся над ним кожей. Конгломерат неподвижен, поскольку спаян с окружающей клетчаткой. Движения в конечности (чаще – нижней) ограничиваются. Через несколько дней образование размягчается, в нем появляются пульсирующие боли, может образовываться свищевое отверстие с изливающимся гнойным содержимым. После вскрытия бубона больные отмечают некоторое улучшение самочувствия, уменьшение выраженности симптомов.
Осложнения
К наиболее частым негативным последствиям бубонной чумы относят симптомы со стороны свертывающей системы крови (до 86% больных), что в 5-10% случаев приводит к возникновению сухой гангрены кожи, верхних и нижних конечностей. 5-50% пациентов имеют осложнения в виде единичных, множественных, либо массивных кровоизлияний. У больных бубонной чумой с нарушениями иммунитета, тяжелыми сопутствующими болезнями системного характера на 2-3 сутки заболевания возникает переход в генерализованную форму.
Диагностика
Стандарты диагностики бубонной чумы предусматривают консультацию инфекциониста, другие врачи привлекаются для осмотра и лечения по показаниям. Важным элементом диагностического поиска является сбор эпидемиологического анамнеза, строгое соблюдение правил осмотра, взятия, транспортировки и исследований биологических субстанций; работа с ними разрешена только в условиях лабораторий карантинных инфекций. Наиболее информативными инструментальными и лабораторными исследованиями при бубонной чуме считаются:
- Физикальные данные. Объективно определяются симптомы интоксикационного вовлечения ЦНС: больные возбуждены, беспокойны, речь невнятная. Пальпаторно бубон представляет собой резко болезненный малоподвижный конгломерат лимфоузлов с нечеткими контурами, гиперемированной горячей кожей над ним, флюктуацией либо свищами; около образования возникают чумные фликтены. Отмечается вынужденная поза пациента. Патологические изменения со стороны внутренних органов обычно отсутствуют.
- Лабораторные исследования. Общеклинический анализ крови характеризуется выраженным лейкоцитозом, сдвигом лейкоцитарной формулы влево, нейтрофилезом, нарастающей тромбоцитопенией, вторичной анемией, ускорением СОЭ. Изменения биохимических параметров транзиторны, чаще отмечается увеличение активности АЛТ, АСТ, общего билирубина, мочевины, креатинина, гипопротеинемия. В общем анализе мочи обнаруживается эритроцитурия.
- Выявление инфекционных агентов. Через 1-2 часа лаборатория должна предоставить результаты микроскопии свищевого отделяемого или пунктата бубона; разрешается применение ПЦР. Обязательным является посев биологических материалов на питательные среды. Серологические методики (ИФА, РПГА) можно оценить только со 2-ой недели инфекции, исследуя парные сыворотки с интервалом 14 дней для фиксации роста титра антител не менее чем четырехкратно.
- Инструментальные методики. Обязательно проведение рентгенографии грудной клетки для исключения рентгенологических симптомов чумной пневмонии; реже показаны КТ, МРТ. С целью дифференциального диагноза со злокачественными новообразованиями рекомендуется ультразвуковое исследование молочных желез, малого таза, органов брюшной полости, мягких тканей, забрюшинного пространства, лимфатических узлов; под контролем УЗИ возможна пункция бубона.
Дифференциальная диагностика осуществляется с туляремией (малоболезненный, не спаянный с кожей бубон). При туберкулезе рост лимфоузла постепенный, есть указания на иммунодефицит, симптомы туберкулеза в анамнезе. Укус крысы, пятнисто-уртикарная сыпь или оцарапывание кошкой, лимфангоит свидетельствуют в пользу содоку и болезни кошачьих царапин соответственно. Лимфогранулематоз манифестирует симптомами поражения легких, костей, ЖКТ. Хламидиозная инфекция иногда протекает с паховым односторонним лимфаденитом, спаиванием с окружающими тканями, формированием свищей.
Лечение бубонной чумы
Все пациенты с подозрением на заболевание либо с патогномоничными симптомами обязательно госпитализируются в боксированную палату инфекционного отделения для немедленного начала лечения. Постельный режим назначается до 4-5 дней нормализации температуры тела, передвижение ограничивается боксом. Диетические рекомендации неспецифичны, обусловлены необходимостью введения антибиотиков с широким спектром нежелательных токсических явлений, поэтому из рациона больного исключается тяжелая пища и алкоголь. Питьевой режим увеличивается с целью дезинтоксикации.
Консервативная терапия
Лечение больных с бубонной чумой направлено на снижение выраженности симптомов, профилактику заражения других людей. Пациентам обязательно назначаются антибактериальные средства, эффективные в отношении возбудителя и вводимые парентерально. К таковым относятся стрептомицин, тетрациклины, фторхинолоны, аминогликозиды, цефалоспорины, рифампицин. Требуется массивная внутривенная дезинтоксикация глюкозо-солевыми, сукцинат-содержащими растворами, назначение обезболивающих, противовоспалительных, жаропонижающих средств. Объем симптоматического лечения зависит от клинической необходимости.
Хирургическое лечение
Местное лечение бубонов вне их размягчения не проводится. С лечебно-диагностической целью может осуществляться тонкоигольная пункционная биопсия лимфатических узлов с одновременным опорожнением бубона. При наличии кожной язвы проводят её иссечение с целью гистологического исследования. Хирургическое вскрытие и дренирование бубонов рекомендовано при появлении симптома флюктуации конгломератов, одновременно внутрибубонно вводят антибиотики, активные в отношении Y. Pestis, стрептококков и стафилококков.
Экспериментальное лечение
В ходе современных исследований установлено, что макрофаги несут на себе рецептор к кортикостероидам, что способствует потенцированию действия собственной иммунной системы при симптомах бубонной чумы. В экспериментах с лечением мышей было доказано повышение макрофагальной способности инфильтрировать инфицированные ткани и поглощать апоптозные нейтрофилы под действием указанных гормональных препаратов. Также было отмечено усиление бактериального поглощения и улучшение выживаемости зараженных животных.
Прогноз и профилактика
Прогноз при отсутствии лечения серьезный, смертность достигает 7-26%. Наиболее неблагоприятными локализациями считаются подмышечные (15-20%) и шейные (5%) зоны из-за риска развития симптомов легочной формы болезни и отека воздухопроводящих путей. Общая продолжительность стационарного лечения для больных, страдающих бубонной чумой, должна составлять не менее 4-х недель, медицинское наблюдение после выписки – не менее 3-х месяцев. Срок изоляции контактных лиц – 7 дней.
Специфическая профилактика показана лицам, проживающим в эндемичных регионах, туристам, военным. Вакцинация осуществляется сухой живой вакциной. К неспецифическим мерам относится строгий санитарный контроль над системами водоснабжения и водоотведения, плановая дератизация в канализационных коллекторах, надзор за мигрантами, туристами, ввозимыми продуктами, животными. Важными мерами борьбы с распространением чумы являются ранняя изоляция и лечение больных, карантинизация контактных лиц, дезинфекция в очаге, улучшение санитарно-гигиенических условий жизни.
3. Adjunctive Corticosteroid Treatment Against Yersinia pestis Improves Bacterial Clearance, Immunopathology, and Survival in the Mouse Model of Bubonic Plague/ Yinon Levy, Yaron Vagima, Avital Tidhar// The Journal of Infectious Diseases – 2016 - V.214, №6.
Чума – это высококонтагиозная бактериальная инфекция с множественными путями передачи и эпидемическим распространением, протекающая с лихорадочно-интоксикационным синдромом, поражением лимфоузлов, легких и кожи. Клиническому течению различных форм чумы свойственна высокая лихорадка, тяжелая интоксикация, возбуждение, мучительная жажда, рвота, регионарный лимфаденит, геморрагическая сыпь, ДВС-синдром, а также свои специфические симптомы (некротические язвы, чумные бубоны, ИТШ, кровохарканье). Диагностика чумы осуществляется лабораторными методами (бакпосев, ИФА, РНГА, ПЦР). Лечение проводится в условиях строгой изоляции: показаны тетрациклиновые антибиотики, дезинтоксикация, патогенетическая и симптоматическая терапия.
МКБ-10
Общие сведения
Чума представляет собой острое инфекционное заболевание, передающееся преимущественно по трансмиссивному механизму, проявляющееся воспалением лимфоузлов, легких, других органов, имеющим серозно-геморрагический характер, либо протекающее в септической форме. Чума относится к группе особо опасных инфекций.

Причины чумы
Характеристика возбудителя
Yersinia pestis представляет собой неподвижную факультативно-анаэробную грамотрицательную палочковидную бактерию из рода энтеробактерий. Чумная палочка может длительно сохранять жизнеспособность в отделяемом больных людей, трупах (в бубонном гное иерсинии живут до 20-30 дней, в трупах людей и павших животных – до 60 дней), переносит замораживание. К факторам внешней среды (солнечные лучи, атмосферный кислород, нагревание, изменение кислотности среды, дезинфекция) эта бактерия довольно чувствительна.
Пути заражения
Резервуар и источник чумы – дикие грызуны (сурки, полевки, песчанки, пищухи). В различных природных очагах резервуаром могут служить разные виды грызунов, в городских условиях – преимущественно крысы. Резистентные к человеческой чуме собаки могут служить источником возбудителя для блох. В редких случаях (при легочной форме чумы, либо при непосредственном соприкосновении с бубонным гноем) источником инфекции может стать человек, блохи также могут получать возбудителя от больных септической формой чумы. Нередко заражение происходит непосредственно от чумных трупов.
Чума передается при помощи разнообразных механизмов, ведущее место среди которых занимает трансмиссивный. Переносчиками возбудителя чумы являются блохи и клещи некоторых видов. Блохи заражают животных, которые переносят возбудителя с миграцией, распространяя также блох. Люди заражаются при втирании в кожу при расчесах экскрементов блох. Насекомые сохраняют заразность около 7 недель (имеются данные о контагиозности блох на протяжении года).
Заражение чумой также может происходить контактным путем (через поврежденные кожные покровы при взаимодействии с мертвым животными, разделке туш, заготовке шкур и др.), алиментарно (при употреблении мяса больных животных в пищу).
Люди обладают абсолютной естественной восприимчивостью к инфекции, заболевание развивается при заражении любым путем и в любом возрасте. Постинфекционный иммунитет относительный, от повторного заражения не защищает, однако повторные случаи чумы обычно протекают в более легкой форме.
Классификация
Чума классифицируется по клиническим формам в зависимости от преимущественной симптоматики. Различают локальные, генерализованные и внешнедиссеминированные формы:
- Локальная чума подразделяется на кожную, бубонную и кожно-бубонную.
- Генерализованная чума бывает первично- и вторично-септической.
- Внешнедиссеминированная форма подразделяется на первично- и вторично- легочную, а также – кишечную.
Симптомы чумы
Инкубационный период чумы в среднем занимает около 3-6 суток (максимально до 9 дней). При массовых эпидемиях или в случае генерализованных форм инкубационный период может укорачиваться до одного – двух дней. Начало заболевания острое, характеризуется быстрым развитием лихорадки, сопровождающейся потрясающим ознобом, выраженным интоксикационным синдромом.
Больные могут жаловаться на боль в мышцах, суставах, крестцовой области. Появляется рвота (часто – с кровью), жажда (мучительная). С первых же часов больные пребывают в возбужденном состоянии, могут отмечаться расстройства восприятия (бред, галлюцинации). Нарушается координация, теряется внятность речи. Заметно реже возникают вялость и апатия, больные ослабевают вплоть до невозможности подняться с постели.
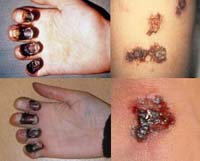
Кожная форма
Проявляется в виде карбункула в области внедрения возбудителя. Карбункул прогрессирует, проходя последовательно следующие стадии: сначала на гиперемированной, отечной коже образуется пустула (выражено болезненная, наполнена геморрагическим содержимым), которая после вскрытия оставляет язву с приподнятыми краями и желтоватым дном. Язва склонна увеличиваться. Вскоре в ее центра образуется некротический черный струп, быстро заполняющий все дно язвы. После отторжения струпа карбункул заживает, оставляя грубый рубец.
Бубонная форма
Является наиболее распространенной формой чумы. Бубонами называют специфически измененные лимфатические узлы. Таким образом, при этой форме инфекции преимущественным клиническим проявлением выступает регионарный в отношении области внедрения возбудителя гнойный лимфаденит. Бубоны, как правило, единичны, в некоторых случаях могут быть множественными. Первоначально в области лимфоузла отмечается болезненность, спустя 1-2 дня при пальпации обнаруживаются увеличенные болезненные лимфатические узлы, сначала плотные, при прогрессировании процесса размягчающиеся до тестообразной консистенции, сливаясь в единый спаянный с окружающими тканями конгломерат. Дальнейшее течение бубона может вести как к его самостоятельному рассасыванию, так и к формированию язвы, области склерозирования или некроза. Разгар заболевания продолжается с течение недели, затем наступает период реконвалесценции, и клиническая симптоматика постепенно стихает.
Кожно-бубонная форма
Характеризуется сочетанием кожных проявлений с лимфаденопатией. Локальные формы чумы могут прогрессировать во вторично-септическую и вторично-легочную форму. Клиническое течение этих форм не отличается от их первичных аналогов.
Первично-септическая форма
Развивается молниеносно, после укороченной инкубации (1-2 дня), характеризуется быстрым нарастанием тяжелой интоксикации, выраженным геморрагическим синдромом (многочисленными геморрагиями в кожных покровах, слизистых оболочках, конъюнктиве, кишечными и почечными кровотечениями), скорым развитием инфекционно-токсического шока. Септическая форма чумы без должной своевременной медицинской помощи заканчивается смертью.
Первично-лёгочная форма
Возникает в случае аэрогенного пути заражения, инкубационный период при этом также сокращается, может составлять несколько часов или продолжаться о двух дней. Начало острое, характерное для всех форм чумы – нарастающая интоксикация, лихорадка. Легочная симптоматика проявляется ко второму – третьему дню заболевания: отмечается сильный изнуряющий кашель, сначала с прозрачной стекловидной, позднее - с пенистой кровянистой мокротой, имеет место боль в груди, затруднение дыхания. Прогрессирующая интоксикация способствует развитию острой сердечно-сосудистой недостаточности. Исходом этого состояния может стать сопор и последующая кома.
Кишечная форма
Характеризуется интенсивными резкими болями в животе при тяжелой общей интоксикации и лихорадке, вскоре присоединяется частая рвота, диарея. Стул обильный, с примесями слизи и крови. Нередко – тенезмы (мучительные позывы к дефекации). Учитывая широкое распространение других кишечных инфекций, в настоящее время так и не решен вопрос: является ли кишечная чума самостоятельной формой заболевания, развившейся в результате попадания микроорганизмов в кишечник, или она связана с активизацией кишечной флоры.
Диагностика
Ввиду особой опасности инфекции и крайне высокой восприимчивости к микроорганизму, выделение возбудителя производится в условиях специально оборудованных лабораторий. Забор материала производят из бубонов, карбункулов, язв, мокроты и слизи из ротоглотки. Возможно выделение возбудителя из крови. Специфическую бактериологическую диагностику производят для подтверждения клинического диагноза, либо, при продолжительной интенсивной лихорадке у больных, в эпидемиологическом очаге.
Серологическая диагностика чумы может производиться с помощью РНГА, ИФА, РНАТ, РНАГ и РТПГА. Возможно выделение ДНК чумной палочки с помощью ПЦР. Неспецифические методы диагностики - анализ крови, мочи (отмечается картина острого бактериального поражения), при легочной форме - рентгенография легких (отмечаются признаки пневмонии).
Лечение чумы
Лечение производится в специализированных инфекционных отделениях стационара, в условиях строгой изоляции. Этиотропная терапия проводится антибактериальными средствами в соответствии с клинической формой заболевания. Продолжительность курса занимает 7-10 дней.
- Специфическая терапия. При кожной форме назначают ко-тримоксазол, при бубонной – внутривенно хлорамфеникол со стрептомицином. Можно также применять антибиотики тетрациклинового ряда. Тетрациклином или доксициклином дополняется комплекс хлорамфеникола со стрептомицином при чумной пневмонии и сепсисе.
- Неспецифическая терапия. Включает комплекс дезинтоксикационных мероприятий (внутривенная инфузия солевых р-ров, декстрана, альбумина, плазмы) в сочетании с форсированием диуреза, средства, способствующие улучшению микроциркуляции (пентоксифиллин). При необходимости назначаются сердечно-сосудистые, бронхолитические средства, жаропонижающие препараты.
Прогноз
В настоящее время в условиях современных стационаров при применении антибактериальных средств смертность от чумы довольно низка – не боле 5-10%. Ранняя медицинская помощь, предотвращение генерализации способствуют выздоровлению без выраженных последствий. В редких случаях развивается скоротечный чумной сепсис (молниеносная форма чумы), плохо поддающийся диагностированию и терапии, нередко заканчивающийся скорым летальным исходом.
Профилактика
В настоящее время в развитых странах инфекция практически отсутствует, поэтому основные профилактические мероприятия направлены на исключение завоза возбудителя из эпидемиологически опасных регионов и санацию природных очагов. Специфическая профилактика заключается в вакцинации живой чумной вакциной, производится населению в районах с неблагоприятной эпидемиологической обстановкой (распространенность чумы среди грызунов, случаи заражения домашних животных) и лицам, отправляющимся в регионы с повышенной опасностью заражения.
Выявления больного чумой является показанием к принятию срочных мер по его изолированию. При вынужденных контактах с больными используют средства индивидуальной профилактики – противочумные костюмы. Контактные лица наблюдаются в течение 6 дней, в случае контакта с больным легочной формой чумы производится профилактическая антибиотикотерапия. Выписка больных из стационара производится не ранее 4 недель после клинического выздоровления и отрицательных тестов на бактериовыделительство (при легочной форме – после 6 недель).
Читайте также:

