Человек как аналог вируса
Обновлено: 18.04.2024
Первичный иммунодефицит (ПИД) — это гетерогенная группа редких, преимущественно наследственных заболеваний, характеризующихся нарушением работы одного или нескольких компонентов иммунной системы.
Такие нарушения иммунитета приводят к повышенной уязвимости организма к различным патогенам, выражающейся в частых и рецидивирующих инфекционных заболеваниях, развитии хронических и системных болезней (аутоиммунных, онкологических).
Причины
В отличие от вторичных иммунодефицитов, возникающих в результате развития хронических заболеваний, иммуносупрессии, вызванной приемом лекарств, наличия ВИЧ-инфекции, естественного старения или недостаточности питания, большинство случаев первичного иммунодефицита ассоциированы с генетическими нарушениями. Дефектные гены передаются по наследству ребенку от одного или обоих родителей.
На данный момент известны более 350 первичных иммунодефицитов, почти все они ассоциированы с генетическими нарушениями. При этом до 70-90% людей, живущих с ПИД, не диагностированы, особенно в регионах с низкой доступностью лабораторного и генетического тестирования.
Первичные иммунодефициты классифицируют в зависимости от того, какая часть многокомпонентной иммунной системы поражена:
- дефицит гуморального иммунитета (B-клеток или B-лимфоцитов — типа лейкоцитов, вырабатывающих антитела, иммуноглобулины);
- дефицит клеточного иммунитета (T-клеток или T-лимфоцитов — типа лейкоцитов, помогающих идентифицировать и уничтожать чужеродные или аномальные клетки);
- комбинированный дефицит гуморального и клеточного иммунитета (B-лимфоцитов и T-лимфоцитов);
- дефекты фагоцитоза;
- дефицит белков комплемента (защитных белков, помогающих клеткам иммунной системы выявлять и уничтожать чужеродных агентов);
- аутовоспалительные заболевания (например, интерферонопатии 1 типа);
- иммунная дисрегуляция;
- фенокопии ПИД (не наследуемые, а приобретенные в процессе жизни) — ассоциированные с соматическими мутациями или появлением аутоантител.
Распространенность ПИД варьируется в зависимости от типа патологии. Более половины ПИД связаны с недостаточностью B-лимфоцитов. Примерно две трети пациентов — дети.
Симптомы
Клиническая картина первичных иммунодефицитов весьма разнородна и зависит от типа расстройства, она может включать не только иммунологические нарушения, но и желудочно-кишечные расстройства, гематологические и аутоиммунные заболевания, атопию, злокачественные новообразования. Кроме того, заболевания каждой группы ПИД имеют частично совпадающие симптомы и общие признаки типичных заболеваний.
Главной отличительной чертой ПИД являются частые, длительные, рецидивирующие инфекции, тяжело поддающиеся лечению, а также т. н. оппортунистические инфекции, которые для человека без иммунодефицита не опасны.
Симптомы первичного иммунодефицита могут включать:
- частые и рецидивирующие пневмонии, бронхиты, инфекции носовых пазух, дыхательных путей, уха, ротовой полости, кожные инфекции, менингит;
- задержку роста и развития;
- желудочно-кишечные расстройства (хроническая диарея, недостаточность питания, мальабсорбция, хронический лямблиоз, ВЗК, атрофический гастрит);
- аутоиммунные и аутовоспалительные заболевания (аутоиммунный тиреоидит, ревматоидный артрит, системная красная волчанка, дерматомиозит, диабет 1 типа);
- гематологические нарушения (аутоиммунная гемолитическая анемия, нейтропения, тромбоцитопения).
У некоторых пациентов с ПИД может наблюдаться целый комплекс связанных признаков заболевания. Например, для пациентов с хронической гранулематозной болезнью характерны рецидивирующие бактериальные или грибковые инфекции, а также хроническое воспаление ЖКТ и дыхательных путей. Для пациентов с синдромом Вискотта — Олдрича (Х-сцепленное рецессивное заболевание) характерны такие проявления, как экзема, рецидивирующие бактериальные инфекции и тромбоцитопения.
По сравнению с людьми со здоровой иммунной системой, у пациентов с ПИД выше риск злокачественных новообразований: лимфомы, лейкемии, опухолей пищеварительного тракта и вирус-индуцированного рака.
Диагностика
Первичные иммунодефициты достаточно сложно диагностировать и дифференцировать — в связи с неоднородным характером клинических проявлений и их схожестью с симптомами типичных болезней (синусита, бронхита, пневмонии, гастроэнтерита, менингита).
Иммунологические нарушения подтверждаются лабораторными исследованиями. Например, может проводиться оценка гуморального иммунитета и клеточного иммунитета, фагоцитарной функции, функции NK-клеток (естественных киллеров), системы комплемента. Необходимость в конкретных лабораторных исследованиях (оценке уровня сывороточных иммуноглобулинов, количественном измерении иммуноглобулинов, количественном измерении T-лимфоцитов, определении внутриклеточных цитокинов и белков, пролиферативной активности, клеточного цикла, цитотоксичности и др.) определяет иммунолог, в зависимости от клинической картины.
Генетическое тестирование (хромосомный анализ, флуоресцентная гибридизация in situ, полное секвенирование генома и экзома) играет важную роль для подтверждения диагноза, лечения и прогноза. Критерии выбора метода генетического тестирования основаны на стремлении к точной и быстрой постановке диагноза с минимальной финансовой нагрузкой для пациента.
Лечение первичного иммунодефицита
Лечение ПИД включает профилактику и контроль рецидивирующих инфекций, устранение основной причины иммунного нарушения, терапию заболеваний с ним связанных (аутоиммунных или онкологических).
Для профилактики и лечения частых и рецидивирующих инфекций назначается курс антибиотикотерапии (только инфекции, вызванные бактериями или грибками), прицельная (!) противовирусная терапия и симптоматическая терапия.
Для коррекции иммунитета могут назначаться иммуноглобулинотерапия (восполнение дефицита конкретных антител), интерферон-гамма терапия (синтетический аналог интерферонов, блокирующих репликацию вируса и стимулирующих клетки иммунной системы, используется для лечения хронической гранулематозной болезни, одной из форм ПИД), терапия факторами роста (при ПИД, вызванном недостатком лейкоцитов).
Защитный иммунитет пациентов с ПИД, более подверженных риску инфекции, обеспечивает регулярная и своевременная иммунизация, однако живые вакцины (от полиемиелита, кори, краснухи и паротита) для детей с первичными иммунодефицитами подходят не всегда.
Трансплантация костного мозга или трансплантация гемопоэтических стволовых клеток может рассматриваться как вариант лечения жизнеугрожающего ПИД, в частности тяжелого комбинированного иммунодефицита (или тяжелой комбинированной недостаточности — ТКИН). В последние годы достигнут значительный прогресс в лечении ТКИН (аденозиндезаминаза-ТКИН, X-сцепленный ТКИН, хроническая гранулематозная болезнь, синдром Вискотта — Олдрича) с помощью генной терапии. Переливание генно-скорректированных клеток показывает многообещающие результаты, однако пока метод применяют очень осторожно, поскольку такое лечение может приводить к неконтролируемому развитию у пациентов лейкемии.
Прогноз для пациентов с ПИД варьируется в зависимости от иммунных нарушений и тяжести течения заболевания. К сожалению, без трансплантации костного мозга или гемопоэтических стволовых клеток дети с тяжелой комбинированной недостаточностью умирают в течение первых 2 лет жизни. У детей, перенесших трансплантацию в возрасте до 3 месяцев, прогноз улучшается. У пациентов с менее тяжелыми формами ПИД, получивших адекватное лечение, показатели долгосрочной выживаемости и качества жизни намного выше.
Особенности и преимущества лечения первичного иммунодефицита в клинике Рассвет
Если у вашего ребенка или у вас наблюдаются частые или рецидивирующие инфекции с тяжелым течением, обязательно запишитесь на прием к педиатру или терапевту Рассвета. При подозрении на первичный (или вторичный) иммунодефицит эти специалисты направят вас к иммунологу.
Научно обоснованные и доказанно эффективные методы диагностики и лечения первичного иммунодефицита, которые используют иммунологи Рассвета, позволят вам сохранить хорошее качество жизни и здоровье надолго.
Наши врачи-иммунологи помогут исключить или выявить и устранить иммунодефицит, при необходимости вашим лечением займется мультидисциплинарная команда специалистов — терапевты, пульмонологи, ревматологи.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Вирус папилломы человека крайне распространен — с ним встречаются практически все люди. Описано более 120 его типов, 15 из них — онкогенные и могут вызвать рак. Остальные вызывают менее серьезные проявления: могут вырасти бородавки, кондиломы и папилломы. В зависимости от типа вирус поражает слизистые рта, гортани, половых органов, анус, кожу рук и подошв. Многим с детства знакомы шершавые бородавки на руках — их обычно вызывает как раз ВПЧ.

Но есть и опасности, например, если ВПЧ долгое время находится в женском организме, риск рака шейки матки повышается. По данным ВОЗ, два типа ВПЧ (16 и 18) вызывают до 70 % всех случаев рака шейки матки. Вирус папилломы человека выявляется при скрининге рака шейки матки.
В России и странах СНГ гинекологи назначают противовирусную терапию ВПЧ. Схемы лечения громоздкие и дорогостоящие: пациентке вручают список из нескольких препаратов.
по теме

Лечение
Многие российские гинекологи утверждают, что препараты с недоказанной эффективностью успешно лечат ВПЧ: анализ на вирус после одного или нескольких курсов становится отрицательным. Но такой результат — не заслуга лечения, он означает, что инфекция была транзиторной и устранилась бы сама, даже без ненужной лекарственной и денежной нагрузки.
Мировая практика
Центр по контролю заболеваний США пишет, что специфическая терапия ВПЧ не рекомендуется. ВОЗ в информационном бюллетене говорит только о необходимости лечения последствий, которые может вызвать ВПЧ: рака шейки матки, анальных или генитальных бородавок. У мужчин онкогенные типы ВПЧ способны провоцировать рак прямой кишки и полового члена.
В современном мире медикаментозной терапии не существует, но большое внимание уделяется вакцинации.
Вакцинация от ВПЧ
-
— защищает от ВПЧ 6, 11, 16, 18; — защищает от ВПЧ 16 и 18 типа.
Препараты очень дорогие (цена одной инъекции составляет около 6 000 — 10 000 рублей), поэтому массовую вакцинацию могут себе позволить только развитые страны.
В идеале должны быть вакцинированы все подростки в возрасте 11—12 лет независимо от пола (два раза в течение полугода) и взрослые до 26 лет (три раза после 14 лет в течение полугода). В российской инструкции к вакцинам рекомендуется трехкратная вакцинация в любом возрасте.
Отдельно стоит упомянуть, что Американский альянс иммунологов рекомендует прививаться от ВПЧ при ВИЧ. Об эффективности вакцинации ВИЧ-положительных девушек говорят ВОЗ, клинические исследования Канадского института исследований здоровья и другие публикации.
Когда нужно сдавать тест на ВПЧ?
Анализ на ВПЧ назначается женщинам после 30 лет при аномальных результатах цитологии или гистологии. Просто так проводить его бессмысленно и затратно. Результаты ПАП-теста вместе с анализом на ВПЧ помогают выбрать правильный интервал до повторного цитологического исследования или кольпоскопии.
Положительный анализ на ВПЧ не означает рак, он лишь позволяет сделать приблизительный прогноз; к тому же вирус — не единственный фактор риска рака шейки матки.
Тест на ВПЧ не должен использоваться массово — это дополнительный (и дорогостоящий) метод скрининга.
Итог:
Доказанной противовирусной терапии ВПЧ не существует, как и лекарств, укрепляющих иммунитет.
Лечат не ВПЧ, а его последствия: предраковые состояния и рак шейки матки, новообразования на коже и слизистых. Лечение не медикаментозное, а хирургическое: лазер, криодеструкция, операция.
И это неудивительно хотя бы потому, что вирусы — штука довольно непонятная. Неясно даже, считать их живыми или нет. С одной стороны, это просто хрупкий набор молекул, который не может существовать автономно, без живой клетки. Он не производит и не накапливает энергии, а также не поддерживает постоянства внутренней среды — ее попросту нет. Но когда вирус попадает в клетку, он проходит жизненный цикл, копирует себя и эволюционирует. Невидимое глазу нечто существует в огромном количестве, постоянно меняется, переходит от одних хозяев к другим и причиняет страдания разной степени тяжести всему человечеству.
Как устроены вирусы?
РНК-содержащие вирусы можно разделить на собственно РНК-вирусы и ретровирусы. Первые — это вирусы гриппа, бешенства, гепатита С, а также коронавирусы и вирус Эбола. Они содержат РНК и используют для размножения РНК-зависимую РНК-полимеразу, с ее помощью на исходной молекуле РНК сразу синтезируется новая. А к ретровирусам относится, например, ВИЧ. Он содержит РНК, но в ходе жизненного цикла она превращается в ДНК и встраивается в геном клетки-хозяина. После чего новая РНК синтезируется уже на основе молекулы ДНК — то есть так же, как у нас.
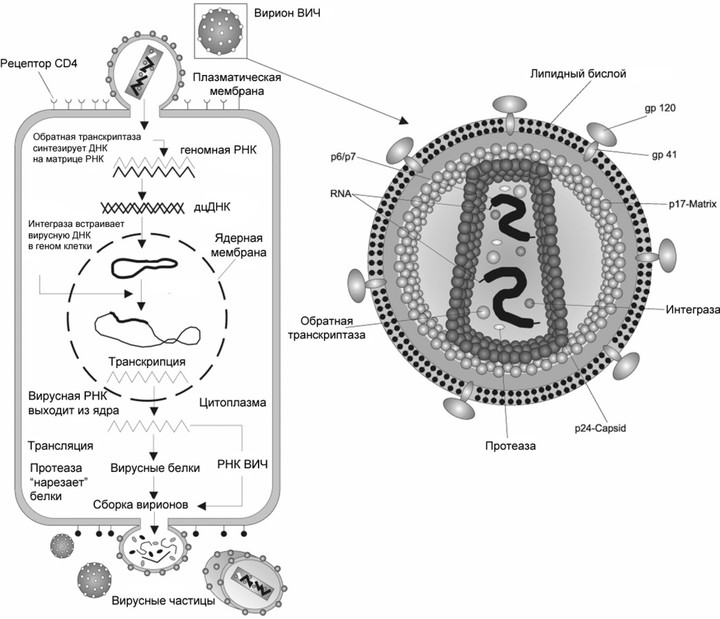
Жизненный цикл вируса, на примере вируса иммунодефицита
Как с ними бороться?
Еще одна стратегия — активная и пассивная иммунопрофилактика. Активная — это простая и всем знакомая вакцинация. Человеку вводят неактивную форму вируса или его кусочек, в организме срабатывает иммунный ответ и синтезируются антитела, которые защитят человека в будущем, если он когда-нибудь встретится с настоящим живым вирусом. Но вакцину не всегда можно создать, да и уже существующие порой не работают на все сто. Так, вакцина от гриппа защищает только от нескольких — самых распространенных в текущем сезоне — штаммов (видов) вируса. Пассивная иммунопрофилактика — это введение готовых антител тем, кто уже встретился с вирусом или с большой вероятностью сделает это. Такие лекарства существуют для респираторно-синцитиального вируса (рекомендованы недоношенным младенцам) и ветряной оспы (для людей с подавленным иммунитетом).
И, наконец, последняя стратегия на случай, если ничто не помогло и человек заболел, — антивирусные препараты. Их развитие подстегивали научный прогресс и насущные проблемы. Чтобы придумать противовирусный препарат, нужно сначала изучить вирус и его жизненный цикл и выбрать возможные мишени для атаки. Причем такие, чтобы они как можно сильнее отличались от человеческих аналогов. Иначе лекарство будет бороться и с вирусами, и с невинными человеческими клетками, вызывая сильные побочные эффекты.
В 80-е произошло другое громкое открытие — вирус иммунодефицита человека. Это породило шквал научных работ, посвященных разработке новых противовирусных лекарств. К тому времени связанный с ним СПИД уже распространился по миру, а в США началась эпидемия.
Какие бывают антивирусные препараты?
Их можно разделить на 13 групп, причем к шести относятся различные лекарства против ВИЧ. Это ингибиторы входа вируса в клетку, вирусных ферментов интегразы и протеазы, а также три вида ингибиторов вирусного фермента обратной транскриптазы, или ревертазы. Все они действуют на разные этапы жизненного цикла вируса:
1. Проникновение в клетку
Это первое, что должен сделать вирус, попав в организм. То, какую клетку он поразит, определяется рецептором на ее поверхности. У ВИЧ это рецептор CD4, который есть у Т-хелперов, макрофагов, а также некоторых других видов клеток. Кроме него в связывании вируса и его проникновении участвуют: рецепторы CXCR4 и CCR5 со стороны клетки и поверхностные гликопротеины gp120 и gp41 — со стороны вируса.
Сейчас FDA (американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) одобряет четыре лекарства, работающие на этой стадии. Каждый связывается с каким-то из участников процесса и мешает его работе. Например, к этой группе принадлежит самый новый препарат против ВИЧ — фостемсавир, его одобрили в США в июле 2020 года. В организме он превращается в активную форму темсавир, соединяется с вирусным гликопротеином gp120 и мешает ему связаться с клеточным рецептором CD4. Другой препарат — ибализумаб — связывается с самим CD4, причем так, что рецептор не может участвовать в проникновении вируса, но выполняет свою нормальную иммунную функцию — связывает и узнает антигены на поверхности антигенпрезентирующих клеток.
Подобные препараты также используются для лечения респираторно-синцитиального вируса, вирусов ветряной оспы и простого герпеса. Они тоже действуют на вирусные гликопротеины и их связывание с клеточными рецепторами. К этой же группе можно отнести препараты для пассивной иммунопрофилактики антителами.
2. Подготовка к размножению, часть 1
Когда вирус попал в клетку, он должен в ней размножиться, то есть создать копии себя, используя ресурсы самой клетки. Так как ВИЧ — ретровирус, его генетический материал — РНК, которая должна достроиться до двухцепочечной ДНК и встроиться в ДНК клетки. Процесс достраивания называется обратной транскрипцией, и для него необходим вирусный фермент обратная транскриптаза, ее еще называют ревертазой. Это самая популярная мишень препаратов против ВИЧ, которые делятся на две группы: нуклеозидные и ненуклеозидные.
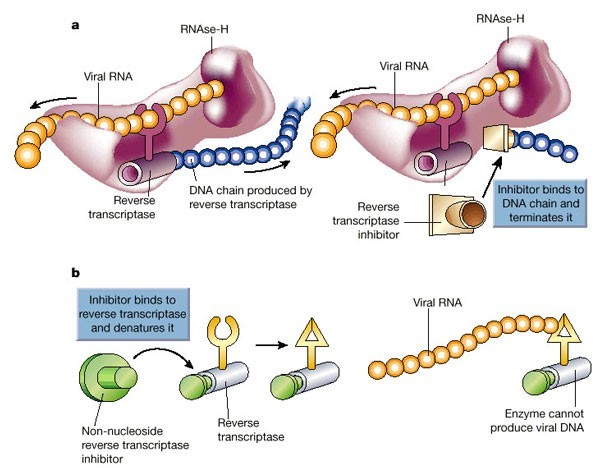
Механизм дейсвтия ингибиторов обратной транскриптазы
3. Подготовка к размножению, часть 2
Чтобы наконец размножиться, ВИЧ, уже в виде молекулы ДНК, необходимо встроиться в геном клетки-хозяина. В этом участвует другой вирусный фермент — интеграза. Ее ингибируют несколько одобренных лекарств, причем они часто используются вместе с другим препаратом — кобицистатом. Он никак не действует на вирус, но ингибирует некоторые ферменты печени и увеличивает биодоступность самих антивирусных препаратов.
4. Созревание
Другие препараты
Есть три группы антивирусных препаратов, которые мы еще не упоминали. Во-первых, это ингибиторы белков NS5A и NS5B вируса гепатита С, которые играют важную роль в репликации РНК вируса. Во-вторых, лекарства против вируса гриппа: три ингибитора вирусного белка нейраминидазы и один ингибитор РНК-полимеразы вируса. И, наконец, сборная солянка препаратов, которые не действуют прицельно на вирусные компоненты. Это интерфероны, а также иммуностимуляторы и ингибиторы митоза клеток.
Первые заслуживают особого внимания из-за обилия отечественных лекарств против гриппа и простуды на их основе. FDA одобряет инъекции (!) интерферонов только для лечения гепатита B и С, причем на практике они используются очень осторожно из-за серьезных побочных эффектов. Отечественные противовирусные препараты с интерферонами, которые выпускаются в форме мазей, спреев и суппозиториев, вряд ли работают. И слава богу. Иммуностимуляторы и ингибиторы митоза клеток выпускаются в виде мазей и используются для лечения генитальных бородавок, то есть папилломавируса человека.
Наука не стоит на месте, и разработка противовирусных препаратов продолжается, подстегиваемая новыми вирусами, эпидемиями, а также развитием резистентности к существующим лекарствам. Но по-прежнему самыми изученными и многочисленными препаратами остаются ингибиторы вирусных обратной транскриптазы или ДНК-полимеразы и протеазы. Для разработки других стратегий борьбы ученым еще предстоит изучить детали работы вирусов — как давно известных, так и совершенно новых.
Да, вирусы остаются источником зловещих идей в популярной культуре. Но существующих препаратов и методов уже достаточно, чтобы мы могли избежать заражения, быстро вылечиться или свести негативные последствия болезни к нулю.
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
Читайте также:

