Чем лечить нейроинфекцию герпеса
Обновлено: 25.04.2024
Именно эти виды герпеса ответственны за появление высыпаний – на коже лица, губах, слизистой оболочке полости рта, а также они являются причиной и генитального герпеса. Нужно отметить, что если раньше вирус герпеса ВПГ-2 – ассоциировался только с развитием генитального герпеса, то сейчас он также вызывает и герпес на лице, губах и слизистой оболочке рта – примерно у 10% пациентов. Герпес типа ВПГ-2 более патогенен (чем ВПГ-1), и у таких пациентов всегда наблюдаются – как более тяжелые клинические проявления, так и более высокая частота рецидивов.
Герпес: фото
Вирус простого герпеса клинически проявляется образованием группы скученных пузырьков, располагающихся на воспаленном основании (коже или слизистой оболочке). Пузырьки сначала заполнены прозрачным содержимым, которое достаточно быстро становится мутным. Если у вас появился герпес – лечение обязательно нужно начать до момента вскрытия герпетических пузырьков. В противном случае не только мазь от герпеса, но и самые лучшие таблетки от герпеса – уже не позволят хоть как-то заметно ускорить заживление.
Как выглядит герпес –
Вирус герпеса (как происходит заражение) –
Изначально дети рождаются с иммунитетом к вирусу герпеса – благодаря антителам, которые достаются каждому ребенку от матери (еще в период беременности). Однако постепенно количество антител уменьшается, и обычно в период от 6 месяцев до 3 лет максимум – у ребенка развивается первичная герпетическая инфекция. Обычно она протекает в виде первичного герпетического гингивостоматита. И в дальнейшем вирус герпеса сохраняется в организме на всю жизнь, периодически обостряясь.
Как передается герпес –
Лучшее средство от герпеса – это безусловно его профилактика, но ниже мы также расскажем и о специальных мазях и таблетках. Вы должны знать, что контактный путь является основным для передачи герпетической инфекции; более редким является воздушно-капельный путь передачи. Контактный путь передачи означает, что заражение вирусом герпеса происходит:
Наиболее заразными являются люди, имеющие клинические проявления герпеса – речь идет о целых или только что вскрывшихся герпетических пузырьках. Имейте в виду, что риск заражения не исчезает после образования корочек, а только чуть-чуть уменьшается. Современные исследования показывают, что заражение герпесом возможно даже от клинически полностью здорового человека.
Важно: у примерно 10% людей – вирус герпеса постоянно определяется в слюне (даже на фоне полного отсутствия у них каких-либо симптомов герпеса).
Из-за чего происходят рецидивы герпеса –
Под воздействием определенных пусковых факторов вирус активируется, вновь продвигается по нервным стволам к поверхностям кожи и/или слизистых оболочек – где и вызывает образование герпетических пузырьков (везикул). Рецидивы могут повторяться 1 или 2 раза в год, но иногда и намного чаще, что в конечном итоге зависит от состояния вашего иммунитета и нервной системы.
Факторы, которые вызывают рецидив герпеса –
- контакт с человеком, имеющим клинические проявления герпеса,
- снижение иммунитета на фоне гриппа или ОРВИ,
- иммунодефицитные состояния,
- переохлаждение, обезвоживание,
- физическая усталость и эмоциональный стресс,
- порезы и царапины кожи, например, после бритья,
- после визита к стоматологу (из-за того, что при длительном широком открывании рта происходит образование трещин в уголках рта),
- после инвазивных косметологических процедур,
- в период менструаций у женщин,
- длительное пребывание на солнце.
Симптомы герпеса –
Лабиальный герпес: фото
В зависимости от объема поражения кожи и тяжести клинических проявлений могут быть назначены либо крем для кожи с противовирусным действием, либо крем в комбинации с таблетированными противовирусными препаратами. Подробный обзор препаратов для лечения вы можете увидеть в конце статьи.
У детей герпетическому стоматиту очень часто сопутствует еще и гингивит. В этом случае (помимо множественных пузырьков и эрозий на каком-то участке слизистой оболочки полости рта) – можно увидеть ярко-красные воспаленные десны.
Общие симптомы герпеса –
первичная герпетическая инфекция может протекать с симптомами, похожими на грипп или ОРВИ (повышенная температура, мышечные боли и даже увеличение подчелюстных лимфатических узлов). Но такие острые симптомы наблюдаются только у 10% от всех заболевших. При повторных вспышках общее состояние организма обычно не нарушается.
Чем лечить герпес у взрослых (лекарства) –
Но, чтобы лечение герпеса было максимально эффективным – вы должны строго соблюдать следующие правила:
Терапия герпеса покажет хорошую эффективность, если она начата не позже 12 часов с момента появления первых герпетических высыпаний. Имейте в виду, что чем позже будет начато лечение – тем меньше будет эффективность даже самых лучших лекарств от герпеса.
Максимальную эффективность покажет терапия, которая начата еще в продромальном периоде (т.е. когда собственно герпетические пузырьки еще не появились, но пациент уже ощущает зуд, жжение или распирание тканей в этой области). Если лечение начинается в этот период, то количество и размер образовавшихся в дальнейшем герпетических пузырьков будет значительно меньшим, и в этом случае полное заживление может быть достигнуто всего за 4-5 дней.
Помните, что если вы начнете лечение позже 48 часов, либо уже после вскрытия герпетических пузырьков – такая терапия заметно не повлияет на скорость выздоровления (заживление очагов). Однако у пациентов с тяжело протекающими и частыми рецидивами – такая терапия может позволить избежать осложнений.
1. Выбираем мазь от герпеса –
Крем Зовиракс: оригинальный препарат ацикловира
Крем или мазь от герпеса с ацикловиром следует наносить на очаг поражения и кожу вокруг него – минимум 5 раз в день (но лучше каждые 2 часа пока вы не спите). Продолжительность терапии обычно составляет 5 дней, но в случае тяжелого герпетического поражения – длительность применения может быть увеличена до 7-10 дней. Нужно отметить, что форма в виде крема более предпочтительна перед мазью, т.к. из мазевой субстанции активные вещества значительно хуже проникают в кожу.
Стоит обращать внимание и на состав, например, эффективной концентрацией ацикловира является именно 5% (хотя в аптеках можно встретить и средства с 3% концентрацией). Кроме того, в составе желательно должны быть пропиленгликоль и/или цетомакрогол, которые увеличивают проникновение молекул ацикловира сквозь поверхностные слои кожи. Это важно, т.к. сам по себе ацикловир достаточно плохо проникает через эпидермис кожи и образующиеся корочки.
Лучшее средство от герпеса с ацикловиром –
На сегодняшний день лучший препарат для наружного применения от герпеса – это крем Зовиракс Дуо-Актив, который содержит комбинацию 5% ацикловира и 1% гидрокортизона. Ацикловир блокирует размножение вируса, а гидрокортизон уменьшает воспаление и отек. При этом, если применение крема начинается еще до появления герпетических пузырьков, то гидрокортизон иногда позволяет вообще предупредить их образование. Но если пузырьки и образуются, то их количество и размер будут меньшим, что уже само по себе позволит заметно ускорить заживление.
Недостатки препаратов на основе ацикловира –
ацикловир является устаревшим препаратом, но в принципе он неплохо работает у большинства пациентов (с некоторыми исключениями). Например, у пациентов с хорошим иммунитетом устойчивость вируса герпеса к ацикловиру встречается – в среднем всего в 3% случаев, что достаточно мало. Однако проблему составляют пациенты с ослабленным иммунитетом + частыми курсами применения ацикловира в прошлом – в таких группах пациентов устойчивость к ацикловиру может наблюдаться уже от 10 до 27% случаев.
Кроме того, молекулы ацикловира имеют очень низкую тропность к вирусу герпеса, что означает, что ацикловир обычно просто не находит какой-то процент вирусных частиц в клетках (к примеру у препаратов на основе пенцикловира/ фамцикловира – тропность в вирусу намного выше). Кроме того, молекулы ацикловира имеют свойство плохо проникать сквозь кожу, а также сквозь образующиеся корочки (к месту размножения вируса). Чтобы хоть как-то уменьшить эту проблему – часть производителей добавляют в состав наружных средств с ацикловиром пропиленгликоль и цетомакрогол.
Альтернативные наружные средства от герпеса –
Выше мы уже сказали, что у пациентов с ослабленным иммунитетом часто развивается устойчивость вируса герпеса к ацикловиру. Что делать таким пациентам? Международные рекомендации в этом случае говорят о необходимости применения курсов фамцикловира в таблетках – это такие препараты как Фавирокс или Фамвир. Таблетированные препараты на основе валацикловира (при подозрении на резистентность к ацикловиру) – применять не имеет смысла, т.к. валацикловир является предшественником ацикловира. Последнее означает, что при наличии устойчивости к ацикловиру – устойчивость будет и к валацикловиру.
Крем Девирс от герпеса –
К сожалению, клинических исследований эффективности местных средств на основе рибавирина – очень мало, и все они, на наш взгляд, имеют достаточно слабую степень доказательности. Знакомясь с исследованиями, мы обратили внимание на то, что этот препарат очень редко применялся в исследованиях в форме монотерапии (обычно его комбинировали – либо с пероральным рибавирином, либо с пероральным ацикловиром), что уже говорит о достаточно слабой эффективности крема. Поэтому наша редакция не может рекомендовать этот препарат для широкого применения – особенно для лечения герпеса губ и небольших поражений на лице. Но препарат вполне может использоваться в составе комплексной терапии, например, при генитальном герпесе.
Выбираем таблетки от герпеса –
Герпес лечение у взрослых: препараты в таблетках
- Ацикловир,
- Валацикловир,
- Фамцикловир.
1. Ацикловир в таблетках по 200 и 400 мг –
Таблетированный ацикловир обладает теми же недостатками, что и кремы: низкая тропность к вирусу (т.е. молекулы ацикловира плохо находят вирусные частицы); у пациентов с плохим иммунитетом + частыми курсами применения ацикловира в прошлом – в 10-27% случаев вирус герпеса может быть устойчив к ацикловиру; плюс низкая биодоступность при пероральном приеме. Плюсы – нет противопоказаний по возрасту, доступная цена, достаточно мало побочных эффектов.
Примеры препаратов с ацикловиром –

Ацикловир в таблетках безусловно работает, особенно если речь идет о пациентах с хорошим иммунитетом и редкими рецидивами герпеса. Если у вас ослабленный иммунитет, если слишком часто принимали ацикловир в прошлом, если вы решили начать принимать препарат более чем 24-48 часов с момента появления герпетических высыпаний – ацикловир не будет особенно эффективен. В этом случае вам лучше сразу начать принимать препарат Фамцикловир, который лучше работает даже при более поздних сроках начала терапии, а также у пациентов с иммунодефицитными состояниями.
Схема применения –
если смотреть официальную инструкцию, то стандартной схемой у взрослых и детей старше 2 лет – является прием ацикловира по 200 мг 5 раз в день (в течение 5 дней). Однократная дозировка 400 мг в официальной инструкции рекомендуется – либо только при тяжелом течении герпетической инфекции, либо у пациентов с ослабленным иммунитетом. Однако, большинство клинических исследований (источник) показывает, что дозировка 200 мг практически не влияет – ни на длительность симптомов, ни на время заживления герпеса.
Исследования показали, что эффективной однократной дозировкой является только 400 мг (соответственно, 5 раз в день, в течение 5 дней). У детей младше 2 лет дозировка уменьшается ровно в 2 раза – от взрослой дозировки. При тяжелом течении герпетической инфекции – прием препарата может быть продлен до 7-10 дней. Кстати, за рубежом, при хроническом рецидивирующем герпесе ацикловир в настоящий момент практически не применяют, отдавая предпочтение валацикловиру и фамцикловиру.
2. Таблетки Валацикловир (Валтрекс) –
Выше мы уже говорили, что таблетированный ацикловир имеет слабую биодоступность, т.е. всего около 10-20% от его количества всасывается в кишечнике, что затрудняет достижение высоких концентраций ацикловира в тканях. Эту проблему решает Валацикловир, имеющий биодоступность уже на уровне 50%. Валацикловир является предшественником ацикловира (т.е. он превращается в ацикловир, уже попав в кровь). Прием таблеток с валацикловиром позволяет создать такую концентрацию ацикловира в тканях, которую возможно достичь традиционным ацикловиром – только путем внутривенных инфузий последнего.
Схема приема –
существует короткая 1-дневная схема лечения. Клинические исследования показали, что прием высоких дозировок препарата в течение 1 дня – было наиболее эффективным для лечения герпеса на губах и коже лица, а также герпетического стоматита. В этом случае схема приема – по 2000 мг 2 раза в день, с интервалом 12 часов (всего 1 день). Но следует учесть, что такая короткая схема будет эффективной – только если лечение начинается не позже 12 часов с момента появления герпетических высыпаний, а также у пациентов с удовлетворительным или хорошим иммунитетом.
Если с момента появления высыпаний прошло больше 12 часов, а также если у вас ослабленный иммунитет – оптимально использовать стандартную схему лечения по 500 мг 2 раза в день, в течение 3-5 дней (при тяжелой форме герпетической инфекции – до 10 дней). При выборе препарата имейте в виду, что при устойчивости вашего вируса герпеса к ацикловиру – прием валацикловира у вас также будет неэффективен.
3. Таблетки Фамцикловир (Фавирокс, Фамвир) –
Преимущество препаратов фамцикловира типа Фавирокса – быстрый противовирусный эффект благодаря максимальной биодоступности (для фамцикловира она составляет около 74%, например, у валацикловира она всего 54%, а у ацикловира только 10-20%). Поэтому упаковки из трех таблеток по 500 мг – достаточно для короткого 1-дневного курса терапии для купирования проявлений герпеса на губе. Подробности о такой схеме применения – читайте ниже.

Схема применения фамцикловира –
существует короткая 1-дневная схема лечения: либо однократно принять 1500 мг, либо по 750 мг 2 раза в день (с 12 часовым интервалом между приемами) – наш опыт говорит о том, что второй вариант все-таки лучше. Такая 1-дневная схема эффективна только при условии, что вы начали прием препарата до 12 часов с момента появления герпетических высыпаний, а также при нормальном состоянии иммунитета у пациента. При ослабленном иммунитете, и/или если лечение начато позже 12 часов с момента появления герпетических высыпаний – нужно использовать стандартную схему применения.
Стандартная схема согласно инструкции – это по 250 мг 2 раза в день, в течение 5 дней (однако при тяжелой форме герпетической инфекции – прием может быть продлен до 7-10 дней). Тут хочется добавить, что многочисленные клинические исследования показывают слабую эффективность такой стандартной схемы – особенно у пациентов с плохим состоянием иммунной системы. Исследования показали, что эффективность терапии значительно возрастает при назначении фамцикловира в более высоких дозировках. У пациентов с хорошим иммунитетом более эффективной будет схема – по 500 мг 2 раза в день (в течение 5 дней). У пациентов с ослабленным иммунитетом – по 500 мг 3 раза в день (в течение 7 дней).
Важно : еще раз обращаем ваше внимание на то, что короткие 1-дневные схемы лечения герпеса у взрослых (герпеса на губах и кожи вокруг рта, на лице) – хорошо работают только при выполнении следующих условий. Во-первых – только если вы начинаете принимать препараты не позже 12 часов с момента появления герпетических высыпаний. Во-вторых – если у вас удовлетворительное или хорошее состояние иммунитета. Если лечение начато позже 12 часов с момента появления высыпаний, а также у пациентов с ослабленным иммунитетом – короткие 1-дневные курсы терапии обычно неэффективны. Тут уже нужна стандартная схема приема.
Важно : если с момента появления первых высыпаний прошло больше 12 часов (и тем более, если больше 24 или 48 часов) – лучше сделать выбор в пользу фамцикловира, т.к. последний лучше работает при более поздних сроках начала терапии герпетической инфекции.
Лечение иммуномодуляторами, профилактика герпеса –
Если у вас высокая частота рецидивов герпеса, либо пусть редкие, но тяжело протекающие вспышки – вам очень важно заняться профилактикой вспышек герпеса. И дело тут не только в том, что тяжелое течение герпетической инфекции и/или ее частые рецидивы – сами по себе свидетельствуют о проблемах с вашим иммунитетом. Дело в том, что вирус герпеса обладает иммуносупрессивным действием на всю систему иммунитета – и на клеточное, и на гуморальное звено иммунитета.
Это означает, что иммунная система под воздействием вируса герпеса – будет продолжать ослабевать, что приведет к дальнейшему увеличению частоты рецидивов и тяжести вспышек. На данный момент существуют следующие направления профилактики вспышек вируса простого герпеса (ВПГ-1, ВПГ-2), но выбирать тот или иной метод – вы должны только после консультации врача. Всем пациентам с частотой вспышек более 6-ти в течение года необходимо сделать анализ на количество специфических антител IgG и IgM к вирусу простого герпеса, а также получить консультацию врача-иммунолога и сделать иммунограмму (в которой оценивается субпопуляционный состав клеток, NK-активность, а также уровни α- и γ-интерферонов).
Важно : прием иммуномодуляторов показан не только для профилактики рецидивов герпетической инфекции – у часто и/или тяжело болеющих герпесом пациентов. Иммуномодуляторы должны использоваться в составе базовой терапии герпетических инфекций (в дополнение к терапии противовирусными препаратами) – у пациентов с ослабленным иммунитетом.
Прививка от герпеса (вакцина Витагерпавак) –
Прививка от герпеса (Вакцина Витагерпавак) –
Источники:
Нейроинфекции – группа инфекционных патологий, которые вызываются бактериями, вирусами, грибками или простейшими, характеризуются преимущественной локализацией возбудителя в ЦНС и признаками поражения ее отделов. Клинические проявления представлены менингеальным, интоксикационным, ликвородинамическим синдромами, вегетососудистыми расстройствами. В процессе диагностики используются анамнестические данные, результаты физикального, общеклинического лабораторного, серологического, бактериологического или вирусологического исследования. В ходе лечения назначаются антибиотики или противовирусные препараты, патогенетические и симптоматические средства.
МКБ-10
Общие сведения
Нейроинфекции – сравнительно распространенная группа патологий. По данным статистики, инфекционные поражения ЦНС достигают 40% в структуре неврологической заболеваемости. Основную часть составляют бактериальные и вирусные менингиты, распространенность которых в различных географических регионах находится в пределах 5-12 случаев на 100 000 населения в год. Для большинства болезней, входящих в данную группу, характерна осенне-зимняя сезонность. Они могут встречаться среди всех возрастных категорий населения, но основную часть пациентов составляют дети до 10-12 лет и лица, не получившие вакцины согласно календарю прививок.

Причины нейроинфекций
Этиология инфекционного поражения структур центральной нервной системы зависит от вида заболевания. В большинстве эпизодов источником заражения становится больной или здоровый человек-носитель. Способствующими факторами являются постоянный контакт с большим количеством людей, ЧМТ, иммунодефицитные состояния, хронические соматические патологии, беспорядочная половая жизнь. Выделяют следующие механизмы инфицирования:
- Воздушно-капельный. Реализуется при кашле, чихании, разговоре. Характерен для возбудителей бактериальных и вирусных менингитов, энцефалитов, полиомиелита, герпетической инфекции.
- Контактно-бытовой. Подразумевает передачу инфекционного агента при прямом контакте с больным, носителем или инфицированными предметами быта. Это один из путей распространения герпес-вирусов, полиомиелита, сифилиса.
- Фекально-оральный. Тип передачи, при котором возбудитель выделяется вместе с испражнениями, проникает в организм с продуктами питаниями или водой. Может реализовываться при герпес-инфекции, вирусах ЕСНО и Коксаки, ботулизме, полиомиелите.
- Половой. При этом варианте заражение происходит во время полового акта через слизистые оболочки половых путей. Таким способом распространяется ВИЧ-инфекция, сифилис, реже – вирусы-возбудители менингитов, энцефалитов.
Патогенез
Для каждой формы нейроинфекции характерны свои патогенетические особенности, но механизмы развития большинства синдромов и симптомов, как правило, аналогичны при всех вариантах этой группы заболеваний. Инфекционный синдром обуславливают комплексы антиген-антитело и токсины возбудителей, которые оказывают деструктивное воздействие на ЦНС, провоцируя нарушения тонуса сосудов, метаболизма и гемодинамики в целом. Менингеальный синдром развивается при воспалительном поражении мозговых оболочек и повышении внутричерепного давления. Вегетативные расстройства вызываются как прямым контактом инфекционных агентов с центрами автономной нервной системы, так и опосредованным воздействием через внутричерепную гипертензию. Ликвородинамические изменения потенцируются усиленной продукцией спинномозговой жидкости на фоне раздражения сосудистых сплетений и блокадой пахионовых грануляций, усложняющей процесс ее резорбции.
Классификация
Использование систематизации обусловлено необходимостью объединить между собой большое количество разнородных инфекционных патологий с вовлечением нервной системы. В зависимости от характера морфологических изменений, клинических особенностей и конкретного возбудителя в неврологии различают несколько групп поражений ЦНС инфекционного происхождения. Основными вариантами нейроинфекций являются:
1. Энцефалиты. Заболевания с воспалением ткани головного мозга. Наиболее распространенными считаются клещевой, герпетический, ветряночный и краснушный энцефалиты. Проявления зависят от типа возбудителя, могут включать общемозговые, очаговые симптомы, системную интоксикацию разной степени выраженности.
2. Менингиты. Болезни, при которых наблюдается поражение мозговых оболочек. Характеризуются наличием менингеального и интоксикационного синдромов, с учетом особенностей воспалительного процесса подразделяются на:
- Гнойные. Провоцируются бактериями, простейшими или грибами, могут быть первичными либо вторичными. К первичным относятся менингиты, вызванные менингококком, пневмококками, гемофильной палочкой. Вторичные поражения являются осложнением гнойных процессов других локализаций – околоносовых пазух, среднего уха и пр.
- Серозные. Сопровождаются преимущественно лимфоцитарным плеоцитозом. В роли возбудителей выступают туберкулёзная палочка, вирус паротита, энтеровирусы Коксаки и ЕСНО.
3. Полиомиелит. Поражение ЦНС, вызванное РНК-содержащим вирусом полиомиелита. Может протекать в двух формах: непаралитической (менингеальной, абортивной, инаппарантной) и паралитической (спинальной, мостовой, бульбарной, энцефалитической).
4. Абсцесс головного мозга. Представляет собой ограниченное капсулой скопление гнойных масс в тканях мозга. Может иметь отогенное, риногенное, метастатическое или посттравматическое происхождение. Проявляется системной интоксикацией, очаговой неврологической симптоматикой, реже – эпилептическим и гипертензивным синдромами.
5. Опоясывающий лишай. Вариант хронической нейроинфекции, обусловленный герпесвирусом человека III типа – Варицелла-Зостер. Наблюдается персистенция возбудителя в спинномозговых ганглиях с активацией при снижении иммунитета или травмах. К основным симптомам относятся острая боль, герпетические высыпания в области 1-2 дерматомов.
6. Нейросифилис. Инфекционная патология, провоцируемая бледной трепонемой. На ранней стадии поражения ЦНС отмечаются общеинфекционные, общемозговые и очаговые симптомы с нарушением функций II, III, VI, VIII пар черепно-мозговых нервов. На поздних стадиях развивается прогрессирующая деменция, выявляются психические расстройства, инсультоподобная симптоматика.
7. Ботулизм. Инфекционное заболевание, вызываемое Clostridium botulinum и сопровождающееся прерыванием передачи нервных импульсов в холинэргических синапсах. Обнаруживаются признаки поражения двигательных ядер ствола мозга, передних рогов.
8. НейроСПИД. Обусловлено инфицированием вирусом иммунодефицита человека. Зачастую представлено первичными поражениями ЦНС: энцефалопатиями, рецидивирующими ВИЧ-менингитами, вакуолярной миелопатией. Проявления разнообразны, включают парезы, афазии, атаксию, мнестические расстройства, психопатологические нарушения.
Симптомы нейроинфекций
Менингальный синдром возникает при вовлечении в патологический процесс мозговых оболочек, состоит из общемозговой симптоматики, мышечно-тонических и корешковых симптомов. В первую группу входит интенсивная диффузная распирающая головная боль; фотофобия, повышенная чувствительность к звукам и свету, рвота без тошноты, не приносящая облегчения. Зачастую наблюдается нарушение сознания по типу галлюцинаций, бреда, оглушения, сопора. У детей возможны фебрильные судороги. Мышечно-тонические и радикулярные проявления включают в себя ригидность затылочных мышц, симптомы Кернига, Брудзинского, Лессажа, Гордона, Менделя, Бехтерева и др.
Вегетативно-сосудистые расстройства при нейроинфекциях могут носить симпатоадреналовый, вагоинсулярный или смешанный характер. В первом случае обнаруживается учащение сердечного ритма, повышение артериального давления, чрезмерная потливость и жажда, во втором – брадикардия, артериальная гипотония, обильное мочеиспускание. При смешанном варианте симптомы из разных групп сочетаются между собой. Нарушение нормальной циркуляции ликвора может протекать по гипертензивному и гипотензивному типу. Более характерной для нейроинфекций является внутричерепная гипертензия, сопровождающаяся угнетением сознания, судорожными и дислокационными синдромами.
Диагностика
Диагностическая программа при инфекциях ЦНС основывается на анамнезе, физикальном исследовании, общеклинических и специфических лабораторных тестах. Лучевые методы диагностики используются редко, зачастую – с целью дифференциации с объемными поражениями нервной системы. Программа обследования больного может включать следующие процедуры:
- Выяснение анамнеза. При общении с пациентом или его родственниками лечащий инфекционист или невролог осуществляет детализацию имеющихся жалоб, выясняет динамику их развития. Важную роль играет эпидемиологический анамнез – контакт с инфекционными больными или выезд за границу на протяжении последних 21 дней.
- Общий и неврологический статус. При осмотре врач определяет уровень сознания, изучает кожу и слизистые оболочки с целью поиска высыпаний, определяет частоту сердечных сокращений и артериальное давление. При установлении неврологического статуса специалист оценивает тонус затылочных мышц, выявляет специфические симптомы, характерные для различных неврологических синдромов.
- Общеклинические лабораторные тесты. В общем анализе крови помимо повышения СОЭ отмечаются следующие изменения: при бактериальной инфекции – высокий нейтрофильный лейкоцитоз, при вирусной – лейкоцитоз со смещением лейкоцитарной формулы вправо, при ВИЧ-инфекции и тяжелых иммунодефицитах – лейкопения. Показатели биохимического анализа крови зависят от сопутствующих поражений внутренних органов.
- Спинномозговая пункция. При нейроинфекциях существует два основных варианта изменений ликвора (белково-клеточных диссоциаций) – по гнойному и серозному типу. При первом типе СПЖ мутная, имеет определенный окрас (белый, желтоватый), наблюдается нейтрофильный плеоцитоз от 1 000, повышение уровня белка от 1,0 г/л. При серозной форме ликвор прозрачный, опалесцирует, при цитологическом исследовании обнаруживается лимфоцитарный плеоцитоз более 100, уровень белка составляет выше 0,4 г/л.
- Серологическое исследование. Заключается в определении повышенного уровня антител в крови при помощи реакций подавления гемагглютинации, связывания комплемента или нейтрализации. Применяется ИФА, в ходе которого выявляется специфический IgM к возбудителю. Проводится ПЦР для уточнения ДНК или РНК инфекционного агента.
- Вирусологическая или бактериологическая диагностика. Предполагает определение возбудителя заболевания в крови или спинномозговой жидкости пациента путем посева образцов на специфические питательные среды. После идентификации патогенного агента целесообразно уточнение чувствительности к основным антибактериальным препаратам.
Лечение нейроинфекций
Все нейроинфекции являются показанием к госпитализации больного в инфекционный или неврологический стационар. При тяжелом состоянии, необходимости непрерывного контроля жизненно важных функций (дыхание, сердцебиение), пациента транспортируют в отделение ОРИТ. Лечебная программа включает следующие мероприятия:
- Этиотропная терапия. Основной целью является элиминация возбудителя из организма больного. Вначале используются препараты широкого спектра действия. После получения результатов серологического и бактериологического исследований медикаменты заменяют антибактериальными или противовирусными средствами, к которым выявленный возбудитель проявил наибольшую чувствительность.
- Патогенетические препараты. Применяются для борьбы с системной интоксикацией, отеком головного мозга и нарушениями гомеостаза, для коррекции водно-электролитного баланса, десенсибилизации и стимуляции иммунитета. Назначаются плазмозаменители, диуретики, глюкокортикостероиды, антигистаминные средства, интерфероны, донорские и искусственные иммуноглобулины, антикоагулянты.
- Симптоматические средства. К этой категории относятся медикаменты, купирующие отдельные симптомы и улучшающие общее состояние больного: анальгетики, жаропонижающие, противорвотные медикаменты, антиконвульсанты, нейролептики.
- Хирургическое лечение. Характер оперативного вмешательства зависит от обнаруженных изменений. Операция может потребоваться в случае абсцесса, туберкуломы головного мозга, компрессии спинного мозга при туберкулезном спондилите, больших областях некроза при опоясывающем лишае.
Прогноз и профилактика
Исход нейроинфекции определяется типом заболевания, общим состоянием больного, своевременностью и полноценностью лечения. В большинстве случаев вовремя поставленный диагноз и адекватная терапия позволяют сохранить жизнь пациента, минимизировать риск развития осложнений. При некоторых формах нейроинфекций, например – энцефалитах, летальность достигает 50-80%. Специфическая профилактика представлена вакцинами против конкретных возбудителей: вирусов герпеса, ботулизма, клещевого энцефалита, кори, полиомиелита, менингококка и т. д. Неспецифические превентивные мероприятия направлены на укрепление иммунитета, своевременное лечение иммунодефицитных состояний и предотвращение контакта с потенциальными носителями инфекционных заболеваний.
1. Инфекционные поражения головного мозга: учебное пособие/ Гладкий П.А., Сергеева И.Г., Тулупов А.А. – 2015.
Герпетический энцефалит — это диффузное или очаговое поражение мозгового вещества, вызванное герпесвирусами ВПГ-1, ВПГ-2, Varicella Zoster. Основные симптомы болезни: фебрильная лихорадка, прогрессирующее угнетение сознания, судорожные приступы. По завершении острого периода инфекции в течение длительного времени сохраняются резидуальные неврологические нарушения. Для установления диагноза необходимо проведение ПЦР-диагностики ликвора, томографии головного мозга, электроэнцефалограммы. Лечение патологии включает противовирусные препараты, противоотечную, нейрометаболическую и противосудорожную терапию.
МКБ-10
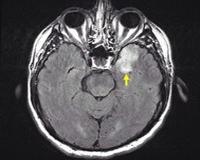
Общие сведения
Энцефалит герпетического происхождения составляет до 15-20% всех вирусных воспалительных процессов в мозговой ткани. Симптомы встречаются с частотой 4-5 случаев на 1 млн. населения, причем до трети больных составляют дети, а еще около 20% приходится на возрастную категорию старше 60 лет. Заболевание не теряет своей актуальности в современной неврологии, поскольку для успешного исхода патологии необходимо вовремя поставить диагноз и начать лечение, а промедление в оказании медицинской помощи чревато смертью пациента.

Причины
Болезнь в 95% случаев вызывается вирусом простого герпеса 1 типа, что объясняется высокой распространенностью возбудителя. По данным ВОЗ, около 2/3 населения мира в возрасте до 50 лет инфицированы ВПГ-1. На втором месте по частоте находится Varicella Zoster Virus (VZV) — возбудитель ветряной оспы, опоясывающего герпеса. Энцефалит, вызванный ВПГ-2, встречается редко, преимущественно у иммунокомпрометированных пациентов.
Ведущим среди факторов риска служит сниженный иммунный статус. Герпетическая инфекция протекает латентно, активизируется на фоне нарушения общей резистентности организма (при переохлаждении, стрессе, менструации у женщин). В группе риска находятся люди с врожденными и приобретенными иммунодефицитами, больные, получающие лечение иммуносупрессивными препаратами. К триггерам относят реинфицирование другими штаммами герпесвирусов, сопровождающееся аутоиммунными реакциями.
Патогенез
Первичное заражение ВПГ-1, как правило, происходит в детстве при попадании вирусных частиц на слизистые оболочки, после чего возбудитель начинает размножаться, мигрирует в нервные ганглии, где длительное время находится в состоянии латентной инфекции. Заражение ВПГ-2 наблюдается после начала сексуальной жизни через слизистые половых путей, а дальнейший путь развития патогена сходен с ВПГ-1.
Симптомы болезни в большинстве случаев возникают при реактивации инфекции под действием провоцирующих факторов. Герпесвирусы проникают в головной мозг гематогенным путем либо по нервным стволам (через тройничный или обонятельный нерв). Из гассерова узла они распространяются на таламус, подкорковые ядра, кору больших полушарий. При распространении по ольфакторному тракту первой страдает лимбическая система (гиппокамп, височная кора).
Симптомы герпетического энцефалита
В типичном течении острого мозгового воспаления выделяется несколько последовательных стадий: ранняя, период разгара болезни, регресс признаков, стадия остаточных явлений. В 70% патология манифестирует с внезапно возникшей высокой лихорадки (более 39°С), сопровождающейся интенсивными головными болями в лобно-височной зоне, сильной сонливостью, рвотой, не связанной с приемом пищи.
На вторые-третьи сутки симптомы дополняются нарушениями сознания: больные начинают путаться во времени и пространстве, не узнают родственников, испытывают разнообразные галлюцинации. По мере усугубления тяжести состояния появляются фокальные или генерализованные судорожные припадки. Изредка наблюдается оперкулярный автоматизм — повторяющиеся причмокивающие или сосательные движения.
В среднем через 3 дня заболевание переходит в стадию разгара. Основное проявление — глубокое угнетение сознания вплоть до комы. Пациенты не отвечают на звуковые и тактильные раздражители, однако двигательные реакции на болевые стимулы остаются в пределах нормы. Также могут возникать симптомы декортикации или децеребрации, аритмичное дыхание, двусторонние моторные нарушения.
Если пациенту было предоставлено комплексное лечение, с 3-4 недели начинается обратное развитие симптомов герпетического энцефалита. Этот этап длится от нескольких месяцев до 1 года, характеризуется постепенным восстановлением временно утраченных неврологических функций. По окончании третьей стадии около 80% больных имеют стойкие резидуальные (остаточные) явления, которые могут сохраняться пожизненно.
Осложнения
В остром периоде прогностическим неблагоприятным является прогрессирование отека мозга, что чревато его вклинением. При височно-тенториальной форме вклинения возникает триада признаков: потеря сознания, гемипарез, анизокория. Симптомами транстенториальной формы являются отсутствие реакции зрачков на свет, фиксация глазных яблок по срединной линии, двусторонний гипертонус мышц. Зачастую нарушается работа дыхательного центра.
Патология имеет тяжелое течение, при отсутствии своевременной медицинской помощи летальность достигает 70%. Даже если проводится этиотропное лечение, смертельный исход регистрируется у 15-20% пациентов, чаще у младенцев, пожилых людей, больных из группы риска. У выздоровевших полный регресс неврологической симптоматики наблюдается только в 20% случаев, а остальные сталкиваются с резидуальными симптомами.
Наиболее опасным хроническим осложнением заболевания считается прогрессирующее вегетативное состояние (акинетический мутизм), характеризующийся необратимым разрушением высших психических функций. У больных сохранено сознание, витальные функции (дыхание, кровообращение), однако полностью отсутствует познавательная деятельность. Такие пациенты не говорят, не реагируют на внешние раздражители, требуют постоянного ухода.
К типичным последствиям герпетической формы энцефалита относится синдром Клювера-Бьюси, при котором развиваются тяжелые длительные расстройства психической и когнитивной сферы. Симптомы расстройства включают ажитированное состояние, агрессивность, патологическую гиперсексуальность. Также наблюдаются интеллектуальные нарушения, проблемы с концентрацией внимания, ослабление памяти.
Диагностика
Обследованием пациента занимаются инфекционисты, неврологи, врачи экстренной помощи и реанимационного отделения. Заподозрить энцефалит удается по острому началу, наличию фебрильной лихорадки, сочетанию общемозговых и очаговых симптомов. Для подтверждения заболевания, уточнению этиологии воспалительного процесса назначаются следующие методы исследования:
Лечение герпетического энцефалита
Консервативная терапия
Герпетический энцефалит характеризуется быстрым нарастанием неврологического дефицита, прогрессированием общемозговых симптомов, поэтому комплексное лечение должно начинаться в максимально ранние сроки. Наилучшие шансы на полное выздоровление у пациентов, которые начали получать этиотропные препараты в первые сутки манифестации болезни. Лечение заболевания включает следующие группы медикаментов:
Реабилитация
Благотворное влияние на состояние ЦНС после перенесенного герпетического энцефалита оказывают витаминные комплексы (витамины группы В, аскорбиновая кислота) в сочетании с антиоксидантами. Восстановительное лечение также включает ноотропы и нейрометаболические препараты для улучшения когнитивных мозговых функций. Коррекция иммунологического статуса проводится адаптогенами, актопротекторами, неспецифическими иммуномодуляторами.
Для восполнения энергозатрат организма, стимуляции репаративных процессов показано адекватное по калорийности и витаминному составу энтеральное питание. Большое внимание уделяется физиотерапевтическим процедурам, массажу и лечебной физкультуре, направленным на улучшение двигательной функции. При наличии показаний рекомендуются занятия с логопедами, дефектологами.
Прогноз и профилактика
Несмотря на проводимое этиотропное лечение, прогноз при герпетическом энцефалите остается неблагоприятным, показатель летальности составляет 15-20%. У большинства выздоровевших сохраняется неврологический дефицит. Для предупреждения заболевания необходима рациональное лечение герпеса кожи и слизистых оболочек, своевременное консультирование больных с диссеминированной герпетической инфекцией.
2. Менингиты и энцефалиты: уч. пос. для врачей/ Д. А. Валишин, Р. Т. Мурзабаева, А. П. Мамон, М. А. Мамон, Л. В. Мурзагалеева. — 2012.
3. Герпетическое поражение нервной системы/ М.Н. Лебедюк, М.Э. Запольский, Ю.И. Горанский// Украинский журнал дерматологии, венерологии, косметологии. — 2011. — №2.
4. Герпетический энцефалит/ Т.В. Матвеева, Н.В. Токарева, Г.А. Шакирзянова// Неврология. — 2006. — №16.
Герпесвирусы широко распространены в человеческой популяции. После первичного инфицирования вирусы герпесгруппы переходят в латентное состояние и пожизненно персистируют в организме. При неблагоприятных условиях и снижении местного или системного иммунитета может происходить реактивация инфекции, что обусловливает развитие воспаления чаще всего на местном уровне. Разнообразие клинических форм герпесвирусных инфекций постоянно поддерживает научный интерес как в области изучения их патофизиологии, так и в области поиска эффективной противовирусной терапии. Особенно актуально это для β- и γ-герпесвирусов, т. к. группа α-герпесвирусов изучена достаточно хорошо.
Цель исследования: определить эффективность валацикловира в отношении репликации вируса Эпштейна – Барр (ВЭБ), вируса герпеса человека 6 типа (ВГЧ-6), цитомегаловируса (ЦМВ) в ротоглотке у часто болеющих взрослых с хроническими воспалительными заболеваниями верхних дыхательных путей (ВДП).
Материал и методы: нами амбулаторно обследованы 80 пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП. Всем пациентам проводились микробиологическое исследование мазков из ротоглотки и оценка вирусной нагрузки в смешанной слюне и цельной крови вне периода обострения. Пациенты получали терапию валацикловиром по схеме 500 мг 3 р./сут в течение 14 дней. Контроль вирусной нагрузки в биоматериале проводился после окончания лечения.
Результаты и обсуждение: микробный пейзаж ротоглотки часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой. В смешанной слюне обнаруживалась ДНК ВЭБ, ВГЧ-6, но не ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлялась. Применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у часто болеющих взрослых.
Выводы: целесообразно провести дальнейшие исследования по определению режима дозирования и оценке клинической эффективности ациклических нуклеозидов в лечении ВЭБ-инфекции.
Ключевые слова: герпесвирусы, вирус Эпштейна – Барр, вирус герпеса человека, цитомегаловирус, часто болеющие взрослые, вирусная нагрузка, валацикловир.
Human herpesviruses infections: clinical features and opportunities of therapy
R.V. Shubelko 1 , I.N. Zuykova 2 , A.E. Shulzhenko 2
1 JSC "K+31", Moscow
2 “National Research Center — Institute of Immunology” Federal Medical-Biological Agency of Russia, Moscow
Herpesviruses are widely spread among the human population. After the primary infection, the herpesviruses become latent and persistent in the human body for life. Adverse conditions and a low local or systemic immunity may reactivate the infection, which causes the inflammation, usually at the local level. The variety of clinical forms of herpesviruses infections constantly supports scientific interest both in the field of studying their pathophysiology and in the search for effective antiviral therapy. This is especially important for β- and γ-herpesviruses, since the α-herpesvirus group has been studied rather well.
Aim: to determine the efficacy of valacyclovir for replication of the Epstein-Barr virus (EBV), human herpesvirus type 6 (HHV-6), cytomegalovirus (CMV) in the oropharynx in frequently ill adults with chronic inflammatory diseases of the upper respiratory tract.
Patients and Methods: 80 patients with frequent recurrences of chronic inflammatory diseases of the upper respiratory tract were examined outpatiently. All patients underwent microbiological examination of swabs from the oropharynx and the viral load in mixed saliva and whole blood not in exacerbation period was assessed. Patients received valacyclovir therapy according to the scheme 500 mg x 3 times a day for 14 days. Control of viral load in the biomaterial was carried out after the end of treatment.
Results and Discussion: out of the period of exacerbation the oropharynx microflora in frequently ill adults is represented mainly by a normal or conditionally pathogenic microflora. EBV DNA, HHV-6, but not CMV DNA, were detected in the mixed saliva. The DNA of the herpesvirus was not detected in the blood samples of these patients. The use of valacyclovir in a dose
of 500 mg 3 times a day significantly reduces the replication of EBV in the oropharynx in frequently ill adults.
Conclusions: it is advisable to conduct further studies to determine the dosage regimen and evaluate the clinical efficacy of acyclic nucleosides in the treatment of EBV infection.
В статье рассмотрены клинические особенности и возможности терапии герпесвирусных инфекции человека. Определена эффективность валацикловира в отношении репликации вируса Эпштейна – Барр, вируса герпеса человека 6 типа, цитомегаловируса.
Введение
Герпесвирусы широко распространены в человеческой популяции и обладают большим разнообразием клинических проявлений, поражая различные органы и ткани. В настоящее время известно 8 видов герпесвирусов человека, разделенных на 3 группы: α-герпесвирусы — вирусы простого герпеса 1 и 2 типа (ВПГ-1, -2), вирус ветряной оспы (ВВО), β-герпесвирусы: цитомегаловирус (ЦМВ), вирус герпеса человека 6 типа (ВГЧ-6), ВГЧ-7 и γ-герпесвирусы: вирус Эпштейна – Барр (ВЭБ) и ВГЧ-8 [1, 2].
По данным ВОЗ, около 90% населения земного шара инфицированы одним или несколькими видами герпесвирусов. Первичное инфицирование, как правило, происходит в детском возрасте, после чего вирусы герпесгруппы переходят в латентное состояние, которое характеризуется отсутствием вирусной репликации и экспрессией вирусных белков. Реактивация герпесвирусов из латентной формы происходит на фоне транзиторных (инфекция, неблагоприятные факторы внешней среды, психоэмоциональные перегрузки, эндокринные нарушения и др.) или стойких (первичные или вторичные иммунодефициты, иммуносупрессивная терапия) иммунодефицитных состояний.
Распространенность герпесвирусов в мире и широкий клинический полиморфизм потенцируют проведение большого количества исследований в области изучения патофизиологии и иммунобиологии этой инфекции, а также поиск эффективной противовирусной терапии [1–3].
В своей практической деятельности врачи многих специальностей, в т. ч. и иммунологи, встречаются с заболеваниями, вызванными ВПГ 1 и 2 типа (лабиальный и генитальный герпес), ВВО (ветряная оспа, опоясывающий лишай), для которых разработаны и стандартизированы методы диагностики и терапии. Однако патофизиология и патоморфология хронических герпесвирусных инфекций, обусловленных β- и γ-герпесвирусами, недостаточно изучены, не разработаны четкие методы и стандарты их лечения, что создает определенные трудности в ведении таких пациентов.
Вирус Эпштейна – Барр
Цитомегаловирус
ЦМВ относится к семейству β-герпесвирусов. Для постнатальной цитомегаловирусной инфекции (ЦМВИ) входными воротами служат чаще всего слизистые оболочки ротоглотки и слюнные железы, где и происходит первичная репродукция вируса. Первичное инфицирование ЦМВ иммунокомпетентных лиц обычно протекает бессимптомно, лишь в 5% случаев — в виде мононуклеозоподобного синдрома (цитомегаловирусный мононуклеоз). Отличительными признаками острого процесса являются высокая лихорадка, интоксикационный синдром, сиалоаденит (чаще околоушных слюнных желез), фарингит, гепатомегалия, спленомегалия, выраженный и длительный астенический синдром. При этом для острого процесса поражение миндалин нехарактерно, увеличение регионарных лимфатических узлов отмечается редко. После разрешения первичной ЦМВИ вирус персистирует в латентном состоянии в моноцитах, эпителиальных клетках и клетках слюнных желез, которые являются резервуаром вирусных частиц.
ЦМВИ у взрослых протекает в латентной (локализованной) и генерализованной формах. Латентная форма обычно не проявляется четкими клиническими симптомами. Иногда наблюдаются легкие гриппоподобные состояния, субфебрилитет. У женщин латентно протекающая ЦМВИ может проявляться в виде повторного невынашивания беременности и мертворождения, а также в виде вульвовагинита, кольпита, цервицита, эндометрита, сальпингоофорита.
Генерализованная форма приобретенной ЦМВИ у взрослых наблюдается редко, чаще на фоне иммуносупрессии, и, безусловно, является прерогативой наблюдения инфекционистов. При этом могут поражаться желудочно-кишечный тракт (гепатит, сиалоаденит, эзофагит, гастрит, энтероколит), надпочечники (адреналит), бронхолегочная система (интерстициальная пневмония, бронхит, фиброзирующий бронхиолит, альвеолит), нервная система (энцефаловентрикулит, миелит, полирадикулопатия, полинейропатия), почки, глаза, миокард [1–3].
У иммунокомпетентных взрослых ЦМВ не поражает лимфоидную ткань, а его локальная реактивация проявляется репликацией в клетках эпителия слюнных желез, поэтому, вероятнее всего, он не играет какой-либо роли в развитии хронических воспалительных заболеваний ВДП у взрослых, характеризующихся в первую очередь поражением лимфоидных структур ротоглотки.
Вирус герпеса человека 6 типа
Еще один представитель семейства β-герпесвирусов — ВГЧ-6. Ведущий путь передачи герпесвирусной инфекции, вызванной ВГЧ-6, — воздушно-капельный. В таких случаях первичная репликация происходит в слюнных железах, лимфоидной ткани ротоглотки и шейных лимфатических узлах. Генерализация инфекции может происходить гематогенным или лимфогенным путем. Около 90% инфицированных клеток представлено Т-лимфоцитами (преимущественно CD4+), оставшаяся часть включает В-лимфоциты, моноцитарно-макрофагальные, глиальные клетки и мегакариоциты. Первичная ВГЧ-6-инфекция может протекать бессимптомно, в виде внезапной экзантемы, фебрильных или нефебрильных судорог.
На сегодняшний день считается доказанной роль ВГЧ-6 в формировании инфекционного мононуклеоза (или мононуклеозоподобного синдрома), который характеризуется непродолжительной фебрильной лихорадкой, умеренно выраженными симптомами интоксикации, умеренной лимфоаденопатией, поражением лимфоидной ткани ротоглотки (острый тонзиллит), умеренной гепатомегалией и, в половине случаев, спленомегалией, розеолоподобными высыпаниями (внезапная экзантема). В дальнейшем ВГЧ-6 переходит в латентную или персистирующую форму. Системная реактивация ВГЧ-6 чаще наблюдается у иммунокомпрометированных лиц и может приводить к развитию тяжелых органных поражений (энцефалит, пневмонит, миокардит и др.) и потенциально летальных системных поражений (вирусный сепсис) [1–3, 5].
К числу основных зон персистенции ВГЧ-6 относятся моноциты слюнных желез и лимфоидная ткань ротоглотки [2, 3, 5], поэтому реактивация хронической инфекции у иммунокомпетентных взрослых может происходить по типу мононуклеозоподобного синдрома, с воспалением слизистых оболочек и лимфоидных структур ротоглотки (тонзиллит, фарингиты). Не исключено также, что ВГЧ-6 играет определенную роль в снижении мукозального иммунитета ротоглотки и поддержании хронического воспалительного процесса на местном уровне.
Лечение герпесвирусных инфекций
Материал и методы
Результаты
Первичная герпесвирусная инфекция, обусловленная ВЭБ, ЦМВ, ВГЧ-6, протекает в большинстве случаев в виде инфекционного мононуклеоза. В дальнейшем герпесвирусы пожизненно персистируют в макроорганизме, в т. ч. и в области входных ворот инфекции (лимфоидная ткань ротоглотки). При неблагоприятных условиях и снижении местного или системного иммунитета может происходить локальная реактивация герпесвирусов, провоцируя развитие воспаления на местном уровне.
Микробный пейзаж ротоглотки у часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой.
В смешанной слюне часто болеющих взрослых вне периода обострения с высокой частотой достоверности обнаруживается ДНК ВЭБ, ВГЧ-6, и не обнаруживается ДНК ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлена, что свидетельствует не о системной, а о преимущественно местной реактивации герпесвирусной инфекции. Учитывая, что титры вирусной нагрузки ВЭБ при микст-инфекции выше (4,47 Lg, копий/10 5 клеток), чем при моноинфекции
(3,99 Lg, копий/105 клеток), можно предположить стимулирующее влияние ВГЧ-6 на активность ВЭБ.
Стандартная антибактериальная терапия без учета вирусной репликации зачастую неэффективна или недостаточно эффективна. Применение противовирусной терапии ациклическими нуклеозидами в комплексном лечении пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП позволяет повысить целенаправленность этиотропной терапии текущего воспалительного процесса.
Из ациклических нуклеозидов наиболее оптимальным и исследованным в лечении герпесвирусов является валацикловир, обладающий высокой биодоступностью и хорошим профилем безопасности. В нашей работе мы применяли дозу валацикловира в 2 раза меньшую, чем та, которая ранее апробировалась разными исследователями, главным образом потому, что мы воздействовали не на острый системный процесс, а на локальную реактивацию герпесвирусной инфекции. Выяснилось, что применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у пациентов с микст-инфекцией (ВЭБ + ВГЧ-6) — на 75%, в большей степени у пациентов с моноинфекцией (ДНК ВЭБ) — на 86%. В отношении инфекции, вызванной ВГЧ-6, не получено достоверных данных о снижении вирусной нагрузки.
Выводы
У часто болеющих взрослых микробный пейзаж вне периода обострения представлен сочетанной бактериально-вирусной микрофлорой: нормальной и/или условно-патогенной бактериальной флорой и представителями герпесгруппы (ВЭБ, ВГЧ-6), что может играть роль в хронизации воспаления в ротоглотке, способствовать снижению местного иммунитета и приводить к частым обострениям патологии ВДП.
Применение валацикловира в дозе 500 мг 3 р./сут в течение 14 дней оказалось эффективным в отношении ВЭБ — на фоне терапии вирусная нагрузка снижалась до нулевых или клинически незначимых титров.
Валацикловир обладает хорошей переносимостью и безопасностью как у молодых пациентов, так и у пациентов старшего возраста.
Дальнейшие исследования должны быть направлены на оценку клинической эффективности валацикловира в лечении реактивации ВЭБ-инфекции у часто болеющих взрослых.
1. Human Herpesviruses: Biology, Therapy, and Immunoprophylaxis / Eds A. Arvin, G. Campadelli-Fiume et al. Cambridge: Cambridge University Press, 2007. 1432 p.
2. Исаков В. А., Архипова Е. И., Исаков Д. В. Герпесвирусные инфекции человека. СПб.: СпецЛит., 2013. 670 с. [Isakov V.A., Arkhipova Ye.I., Isakov D. V. Gerpesvirusnyye infektsii cheloveka. SPb.: SpetsLit., 2013. 670 s. (in Russian)].
3. Иммунотерапия: Руководство для врачей / под ред. Хаитова Р. М., Атауллаханова Р. И., Шульженко А. Е. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2018. 768 с. [Immunoterapiya: Rukovodstvo dlya vrachey / pod red. Khaitova R. M., Ataullakhanova R. I., Shul’zhenko A. Ye. 2-ye izd., pererab. i dop. M.: GEOTAR-Media, 2018. 768 s. (in Russian)].
4. Lennon P., Crotty M., Fenton J. E. Infectious mononucleosis // British Medical Journal. 2015. Vol. 350. P. 1–7.
5. Agut H., Bonnafous P., Gautheret-Dejean A. Laboratory and Clinical Aspects of Human Herpesvirus 6 Infection // Clinical Microbiology Reviews. 2015. Vol. 28 (2).
P. 313–335. doi: 10.1128/CMR.00122–14.
6. Andersson J., Britton S., Ernberg I. et al. Effect of acyclovir on infectious mononucleosis: a double-blind, placebo-controlled study // J Infect Dis. 1986. Vol. 153. P. 283–290.
7. Andersson J., Sköldenberg B., Henle W. et al. Acyclovir treatment in infectious mononucleosis: a clinical and virological study // Infection. 1987. Vol. 15. P. 14–20.
8. Pagano J. S., Sixbey J. W., Lin J. C. Acyclovir and Epstein-Barr virus infection // J Antimicrob Chemother. 1983. Vol. 12 (Suppl B). P. 113–121.
9. Tynell E., Aurelius E., Brandell A. et al. Acyclovir and prednisolone treatment of acute infectious mononucleosis: a multicenter, double-blind, placebo-controlled study // J Infect Dis. 1996. Vol. 174. P. 324–331.
10. Van der Horst C., Joncas J., Ahronheim G. et al. Lack of effect of peroral acyclovir for the treatment of acute infectious mononucleosis // J Infect Dis. 1991. Vol. 164. P. 788–792.
11. Vouloumanou E. K., Rafailidis P. I., Falagas M. E. Current diagnosis and management of infectious mononucleosis // Current Opinion in Hematology. 2012. Vol. 19 (1). P. 14–20. doi: 10.1097/MOH.0b013e32834daa08.
12. Balfour Jr.H., Hokanson K. M., Schacherer R. M. et al. A virologic pilot study of valacyclovir in infectious mononucleosis // Journal of Clinical Virology. 2007. Vol. 39. P. 16–21.
13. Walling D. M., Flaitz C. M., Nichols C. M. Epstein-Barr Virus Replication in Oral Hairy Leukoplakia: Response, Persistence, and Resistance to Treatment with Valacyclovir // Journal of Infectious Diseases. 2003. Vol. 188. P. 883–890.
14. Cox A. J., Gleeson M., Pyne D. B. et al. Valtrex therapy for Epstein-Barr virus reactivation and upper respiratory symptoms in elite runners // Med. Sci. Sports Exerc. 2004. Vol. 36 (7). P. 1104–1110.
15. Vezina H. E., Balfour Jr. H., Weller D. R. et al. Valacyclovir pharmacokinetics and exploratory pharmacodynamics in young adults with Epstein-Barr virus infectious mononucleosis // J Clin Pharmacol. 2010. Vol. 50. P. 734–742.
16. Hoshino Y., Katano H., Zou P. et al. Long-Term Administration of Valacyclovir Reduces the Number of Epstein-Barr Virus (EBV) -Infected B Cells but Not the Number of EBV DNA Copies per B Cell in Healthy Volunteers // Journal of virology. 2009. Vol. 83 (22). P. 11857–11861.
17. De Paor M., O’Brien K., Fahey T., Smith S. M. Antiviral agents for infectious mononucleosis (glandular fever) // The Cochrane Database of Systematic Reviews. 2016. Issue 12. CD011487. doi: 10.1002/14651858.
Читайте также:

