Чем отличается цитомегаловирус от вируса простого герпеса
Обновлено: 18.04.2024
Пример внутриутробной смешанной ЦМВ и герпес инфекции у новорожденного ребенка
Перинатальная вирусная инфекция смешанной этиологии характеризуется выраженной общеинфекционной симптоматикой, гипотрофией, персистирующим течением с обострениями, периодами лихорадки, диспептических явлений, полиорганной патологией, резистентностью к терапии.
В качестве типичного клинического примера Н.И. Михайловская приводит сведения о ребенке Д.
Девочка Д. (дата рождения 26.06.2004 года, история болезни 1969/2004). Клинический диагноз: Перинатальная персистирующая смешанная инфекция — цитомегаловирусная и вируса герпеса 6 типа, фаза репликации (перинатальное поражение ЦНС, гепатит, гипотрофия, анемия, кардиопатия).
Ребенок от 4 беременности, протекавшей гестозом и угрозой прерывания на протяжении всей беременности. Первая беременность закончилась самопрооизволь-ным выкидышем, вторая — срочными родами, третья — медицинским абортом. Девочка родилась в срок с признаками внутриутробной гипотрофии (вес 2550,0, длина 51 см), перинатальной энцефалопатии, с желтухой. С рождения получала лечение у невропатолога. В возрасте 3 месяцев (27.09) вес — 5 100,0, жалоб на ребенка не было. Сделана первая вакцинация АКДС и полиомиелита. Спустя сутки мама стала обращаться к специалистам по поводу выраженного беспокойства, нарушения сна, отказа ребенка от еды, упорного срыгивания, потери веса.
В возрасте 3,5 месяца госпитализирована в Детскую областную больницу, где выявлено повышение активности печеночных ферментов: АЛТ — 240 ед, ACT— 126 ед. Госпитализирована в Центр гепатологии, где у ребенка и у мамы исключена инфекция вирусов гепатитов А, В, С, D, anti-HIV, RW отрицательны. При исследовании в Центре молекулярной диагностики ЦНИИЭ МЗ РФ у ребенка обнаружены anti-CMV IgG в концентрации 93 ME /мл (при допустимой > 10,0). Анемия: НВ — 92 г/л гипохромия, анизоцитоз. УЗИ — гепатомегалия, стенки сосудов печени подчеркнуты, добавочная долька селезенки. НСГ — четвертый желудочек расширен, углублен, глубина передних рогов — 7 мм, умеренная дилятация боковых желудочков головного мозга.
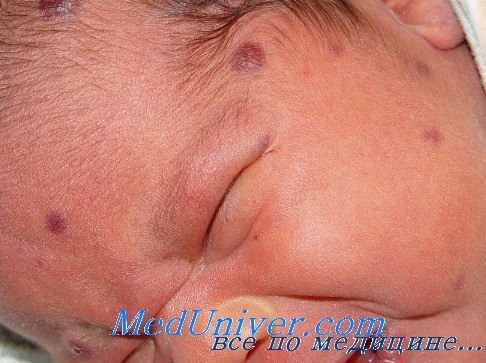
Диагностирована перинатальная цитомегаловирусная инфекция (поражение ЦНС — энцефалопатия с признаками вялотекущего энцефалита, гепатит, анемия). Проведены курсы противовирусной терапии (виферон, ацикловир), ликопида, гепатопротекторов, ак-тиферрина, выполнены назначения невропатолога. При обследовании в возрасте 5,5 месяцев (1.12.04) все функциональные пробы печени в норме. Повторно госпитализирована в возрасте 7 месяцев 8.02.2005 года. Со слов мамы за 3 недели до госпитализации — вакцинация против полиомиелита, после чего внезапное резкое ухудшение состояния, отказ от еды, потеря в весе. При поступлении состояние ребенка средней тяжести за счет интоксикации. Девочка вяла, беспокойна, не интересуется окружающим, крик монотонный, эмоционально не окрашен. Кожа бледна, с сероватым оттенком. Печень на 3—4—3 см выступает из подреберья, плотновата, болезненна, селезенка до 2 см.
Со стороны функциональных проб печени — резкое повышение активности цитолитических ферментов — АЛТ до 9 норм, ACT до 3 норм. Концентрация anti-CMV IgG повысилась до 177!! МЕ/мл. Для уточнения диагноза и тактики лечения девочка госпитализирована в Республиканскую детскую клиническую больницу. При обследовании выявлены маркеры смешанной вирусной внутриутробной инфекции: anti-CMV IgG 168 МЕ/мл, DNA CMV обнаружена в моче и слюне, DNA V. Herpes 6 типа — в крови. Микробиологическое исследование кала: лактозонегативная кишечная палочка (кп) 0, гемолизирующая кп 10* 9, обнаружены золотистый стафилококк, грибы рода Кандида, Клебсиелла, Цитробактер в высоких разведениях.
Допплерография печени и портальной системы — внутрипеченочные желчные протоки с фрагментарно уплотненными стенками. Стенки внутриорганного бассейна равномерно утолщены. УЗИ — Селезенка на верхней границе нормы, подчеркнут рисунок сосудов, почки — ЧЛК с уплотненными стенками. Специалистами РДКБ была назначена терапия: виферон по схеме не менее 6 месяцев, траумель по 1 /2 таблетки 3 раза между едой + хепель по 1 /2 таблетки 3 раза за 30 минут до еды, курсами по 2 месяца с перерывом в 1 месяц, поливалентный бактериофаг 2 курса по 4 дня, по схеме абомин, креон, гомеопатические препараты. Назначения невропатолога включали фенибут. Общее состояние и самочувствие ребенка улучшились, снизилась активности АЛТ и ACT (до 2—3 норм). Однако в возрасте 11 месяцев — вновь беспокойство, нарушение сна, снижение аппетита. За 5 месяцев девочка прибавила в весе лишь 700,0: вес в возрасте 6 месяцев— 7 500,0, в 8 месяцев— 7 300,0, в 9 месяцев — 7 000,0, в 11 месяцев — 8 200,0.
При поступлении в стационар состояние ребенка средней тяжести, явления интоксикации, клинико-лабораторная симптоматика гепатита.
Активность ферментов повысилась до 8 норм, появилась биохимическая симптоматика внутрипеченочного холестаза. Маркеры вирусов гепатитов А, В, С, D отрицательны. В анализах мочи — изостенурия, лейкоциты до 20 в поле зрения. Выписана с улучшением, с тенденцией к нормализации активности ферментов. Однако болезнь приняла хроническое течение, на фоне признаков вторичного иммунодефицитного состояния. Ребенок повторно направлен в РДКБ.
Таким образом, внутриутробная инфекция смешанной вирусной этиологии — цитомегаловирусная и вируса герпеса 6 типа — протекала у ребенка с признаками полиорганной патологии, приняла хроническое течение, осложнилась проявлениями вторичного иммунодефицитного состояния. Фактором, провоцирующим обострение в возрасте трех и шести месяцев, была вакцинация. Детям с признаками перинатальной вирусной инфекции показан медицинский отвод от живых вакцин сроком не менее 2 лет.
Рассказывает научный руководитель Кабинета терапии герпесвирусных инфекций и иммунореабилитации Центра здоровья КБ № 122 инфекционист и клинический иммунолог д.м.н. профессор, академик РАЕН и Нью-Йоркской академии наук, Почетный ученый Европы Валерий Александрович Исаков .

– Самый известный представитель этого семейства – вирус простого герпеса 1-го типа. Это наиболее распространенная форма, описанная еще Гиппократом. И хотя внешние проявления мы замечаем на носогубном треугольнике (простуда на губах, крыльях носа или слизистой), вирус поражает организм в целом. Он может проявляться в течение года несколько раз. Но встречаются и более тяжелые формы течения с повторением от 4–5 до 6 и более раз в год. Вирус герпеса 2-го типа, или генитальный герпес, может беспокоить раз в два-три месяца, а то и каждый месяц (особенно женщин). Жить с этим крайне тяжело. Мало того что приходится терпеть неприятные симптомы, частые проявления вируса свидетельствуют о существенных изменениях в иммунном статусе.
– А может, предположим, человек не знать, что страдает герпесом, обусловленным вирусами этих двух типов?
– Может. Например, мы часто видим в уголках губ так называемые заеды – трещинки. Исследования показывают, что у 20% таких пациентов есть вирус простого герпеса 1-го типа. То же самое и с генитальным герпесом: не обязательно будет сыпь и зуд, вполне возможно образуется просто трещинка.
– Я слышала, что вирус ветрянки – тоже герпес.
– Это 3-й тип – герпес Зостера, или ветрянки, который может поражать и после 40 лет. Считается, что у 40% детей, которые перенесли ветрянку, вирус ветряной оспы остается существовать дальше в ганглиях нервной системы (нервном узле – скоплении нервных клеток).
– Почему вирусы герпеса облюбовали именно эти клетки?
– Но основным-то источником заражения являются инфицированные люди?
– Да, а механизмы инфицирования – воздушно-капельный, оральный (через рот), контактный (через микротравмы на коже и слизистых оболочках) и гемоконтактный (через кровь). Факторами передачи инфекции могут быть инфицированные слюной или содержимым пузырьков детские игрушки, предметы обихода – полотенце, посуда, дверные ручки. Вирусы герпеса могут содержаться в слюне, крови, слезной жидкости, содержимом везикул, сперме, секрете влагалища и шейки матки, моче, грудном молоке, различных органах и тканях, используемых для пересадки.
– А если в семье кто-то болеет, значит ли это, что и другие больны или заболеют?
– Риск инфицирования внутри семьи гораздо выше, но это не означает, что все будут болеть одинаково. Бывает, у пациента два или три разных вируса герпеса одновременно, а у членов его семьи – другие комбинации. Поэтому каждого пациента надо обследовать и лечить отдельно.
– Мы поговорили лишь о наиболее распространенных вирусах этого семейства. Сколько же их всего?
– Известно восемь разновидностей вируса. Вирус герпеса 4го типа (вирус Эпштейна – Барр, ВЭБ) – единственный онкогенный среди своего семейства. Живет преимущественно в лимфоидной ткани и вызывает воспаление и боль в лимфоузлах шеи, подмышечных, паховых областях. У детей и взрослых острая форма инфекции называется инфекционным мононуклеозом. Как и в случае ветрянки, 30–40% детей, перенесших это заболевание, становятся пожизненными носителями ВЭБ. На долгий срок даже могут забыть о нем. Но в определенный момент наступает сбой в работе иммунной системы, и пациент начинает болеть. Первая реакция – недоумение. Почему? 10–15 лет не болел, а тут – частые ОРЗ, ангины, фарингиты, немотивированная слабость, повышение температуры. И длиться это может годами. Начинаются поиски причины. Пациенту делают мазки из зева, носа, выделяют, к примеру, стрептококки, назначают антибиотики, и на какое-то время эффект есть. А через три недели все повторяется снова: боли, налеты в горле, слабость, увеличение шейных лимфоузлов. В такой ситуации следует задуматься о герпетической природе такого недомогания и сдать анализы на ВЭБ. А поскольку схожую симптоматику дают еще цитомегаловирус и вирус герпеса 6го типа, то лучше подойти к решению проблемы комплексно.
– Цитомегаловирус имеет какие-то свои особенности?
– Это 5-й тип вируса герпеса, который живет в клетках иммунной системы и поражает в основном внутренние органы: щитовидную, поджелудочную, половые железы. Известны случаи аутоиммунного тиреоидита, тяжелого панкреатита вирусной природы. Особенно это опасно у беременных, так как беременность протекает на фоне физиологического подавления иммунитета (чтобы не было конфликта между матерью и развивающимся плодом) и снижения выработки гормонов. Это идеальные условия для его активации. Цитомегаловирус сильнее других вирусов поражает плод и приводит к нарушениям нервной системы, печени, легких.
– А как ведут себя в нашем организме менее известные вирусы герпеса?
– Вирусы герпеса человека 6-го и 7-го типов менее изучены. Вирус герпеса 6-го типа в чем-то похож на цитомегаловирус, вызывает чаще всего внезапную экзантему (острое инфекционное заболевание детей раннего возраста, протекающее с повышенной температурой и кожными высыпаниями). Герпес 6го типа у детей и взрослых вызывает первичную герпетическую инфекцию, проявляющуюся менингоэнцефалитом разной степени тяжести, поражением печени, воспалительными процессами в легких, бронхах и сердечной мышце.
– Герпес так многолик. С ним сталкиваются врачи многих специальностей: гинекологи, урологи, офтальмологи, неврологи, оториноларингологи, педиатры, дерматологи, иммунологи. У кого и как лечиться?
– Надо помнить, что герпесвирусы поражают весь организм в целом. И если необходим результат, нужно выявить причину и пройти комплексное лечение с участием врача-иммунолога, инфекциониста. И уж никак нельзя относиться к этому заболеванию легкомысленно. Герпесвирусы могут быть причиной бесплодия, мертворождения и выкидышей, инициируют процессы атеросклероза и развитие злокачественных новообразований, они могут свести на нет безупречно проведенное хирургическое вмешательство. Например, при протезировании клапанов сердца. Более того, Всемирная организация здравоохранения на ближайшее время поставила проблему борьбы с герпесвирусными инфекциями на первое место. Не ВИЧ и СПИД, не вирусные гепатиты и не грипп. Это такая же реальная опасность.
Поэтому нами создан Кабинет терапии герпесвирусных инфекций и иммунореабилитации. Здесь работают врачи-специалисты доктора и кандидаты медицинских наук: акушеры-гинекологи, инфекционисты, иммунолог, аллерголог. Консультируют терапевт, невролог, оториноларинголог, дерматовенеролог, офтальмолог. Лечение пациента проводится комплексно, применяются новые эффективные технологии с использованием современных противовирусных, иммуномодулирующих и антибактериальных препаратов, вакцин.
– Насколько эффективны эти препараты?
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Инфекции вызванные цитомегаловирусом: диагностика, лечение, профилактика
Вирусы герпеса — большие, покрытые оболочкой, двунитевые ДНК-вирусы (120—200 нм). Геном содержит 120—240 тыс. пар нуклеотидов, кодирующих более 35 белков. Оболочка состоит из гликопротеинов и Fc-рецепторов. Инфекция персистирует у человека на протяжении всей жизни, переходя в латентную форму после острой стадии и периодически рецидивируя (особенно при снижении иммунитета у человека).
Классификация герпес-вирусов
Все вирусы герпеса разделяют на:
• а-герпес-вирусы — быстрорастущие цитолитические вирусы, вызывающие латентную инфекцию и поражающие нейроны (вирусы простого и опоясывающего герпеса);
• бета-герпес-вирусы — медленно растущие вирусы, вызывающие латентные инфекции секреторных желёз и почек (цитомегаловирус);
• у-герпес-вирусы — вирусы, вызывающие латентный инфекционный процесс в лимфоидной ткани (вирус Эпштейна—Барр).
Недавно обнаруженные вирусы герпеса человека типа 6 и 7 (ВГЧ-6 и ВГЧ-7) относят к у-герпес-вирусам, так как они вызывают латентные инфекции лимфатических узлов и имеют генетические сходства именно с этой группой вирусов герпеса. ВГЧ-8, ассоциированный с саркомой Капоши, сходен с вирусом Эпштейна—Барр. Все вирусы герпеса, за исключением вируса простого герпеса типа 1 и 2, различны по антигенной структуре.
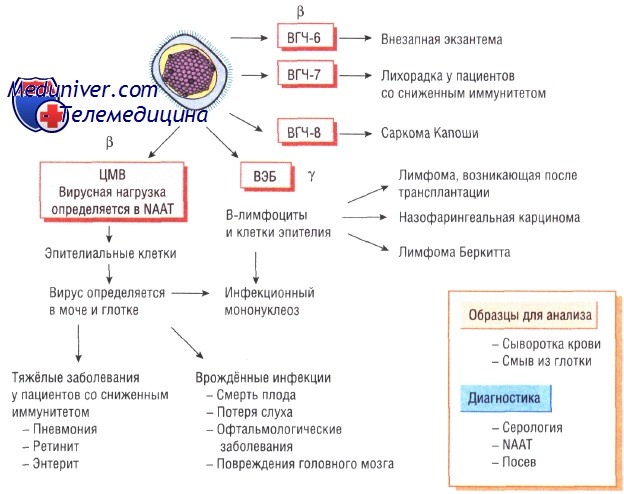
Инфекции вызванные цитомегаловирусом
По своей структуре цитомегаловирус похож на все остальные вирусы герпеса. Обычно он персистирует в организме на протяжении всей жизни. Его обнаруживают в моче и слюне человека. Примерно 50% населения Великобритании инфицированы ВГЧ-5.
Эпидемиология и патогенез цитомегаловирусной инфекции. Механизм передачи инфекции — вертикальный или контактный (от человека к человеку). Чем ниже социально-экономические условия, тем раньше происходит инфицирование. Возможен вертикальный механизм передачи инфекции. Кроме того, заражение может произойти при переливании крови или пересадке органов; в этом случае инфекции свойственно очень тяжёлое течение.
Клинические признаки инфекции вызванной цитомегаловирусом. Врождённая инфекция обычно протекает в тяжёлой форме. В начальном периоде выраженные симптомы заболевания отсутствуют. В дальнейшем возникает прогрессирующая глухота, задержка развития. При заражении после рождения заболевание протекает в лёгкой форме. У пациентов со сниженным иммунитетом (ВИЧ-инфекция, состояние после трансплантации органов) может развиться тяжёлая пневмония, ретинит, поражение кишечника, причём вирусная инфекция может быть приобретённой (от пересаженного органа) или собственной (латентная форма).
Диагностика инфекции вызванной цитомегаловирусом. Врождённую инфекцию диагностируют при проведении анализа мочи через 3 нед после рождения. У взрослых цитомегаловирус может быть культивирован либо определён молекулярно-генетическим методом в образцах мочи и крови. Исследование вирусной нагрузки имеет большое значение для диагностики тяжёлого течения инфекции и назначения своевременного лечения.
Лечение и профилактика инфекции вызванной цитомегаловирусом. При тяжёлой инфекции, угрожающей жизни пациента, а также при риске потери зрения лечение проводят ганцикловиром в комплексе с иммуноглобулином (при развитии пневмонии). Эфир ганцикловира, валганцикловир принимают внутрь, назначают в начале лечения и в качестве поддерживающей терапии. Ещё более токсичные альтернативные препараты (фоскарнет и цидофовир) ингибируют цепочечную ДНК-полимеразу. Важная мера профилактики заболевания — тщательный подбор донорских органов для пересадки и крови для переливания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

