Чем убить вирус чумы
Обновлено: 15.04.2024

В Средние века от чумы вымирали целые города, поэтому её считали Божьей карой. Долгое время эта болезнь считалась самой страшной и смертоносной. Известные истории эпидемии оспы, холеры, испанки и других болезней убивали не больше 30% заражённых. Но при чуме смертность была стопроцентной. Эта болезнь не исчезла до сих пор, но появилось эффективное лечение, и заразившиеся полностью выздоравливают.
Что такое чума
В последнее время люди постоянно слышат обо опасности вирусов, поэтому у многих возник вопрос: чума — это вирус или бактерия? Вирус имеет примитивную структуру: ДНК или РНК, покрытая оболочкой. Бактерия — это микроорганизм, который устроен гораздо сложнее, чем вирус. Несмотря на то, что вирусы вызывают опасные заболевания, большую угрозу здоровью представляют бактериальные инфекции, которые успешно лечатся антибиотиками. Именно с появлением антибиотиков смертность снизилась в десятки раз. Важно помнить, что в отличие от оспы, вызванной вирусом, чума — это бактериальная инфекция.
Возбудитель чумы — Yersinia pestis, чумная палочка, которая является грамотрицательной бактерий. Её переносчиками являются некоторые грызуны. Чумная палочка была открыта в 1894 году, когда в Гонконге бушевала эпидемия. Открытие сделали независимо друг от друга швейцарско-французский врач-бактериолог Александр Йерсен и японский медик Китасато Сибасабуро.
Получивший образование в Берлине Китасато Сибасабуро работал над исследованиями в соответствии с методом Роберта Коха. А. Йерсен был последователем школы Луи Пастера. Именно он доказал, что возбудителем средневековой чумы была именно Yersinia pestis. Прежде предполагали, что болезнь вызывается неизвестной бактерией из рода Bacterium или Pasteurella. В честь А. Йерсена был назван род бактерий, к которому принадлежит чумная палочка.
Особенности чумной палочки
Предполагается, что предком чумной палочки является псевдотуберкулезная — Yersinia pseudotuberculosis, которая обитает в почве и вызывает неопасные болезни ЖКТ. Учёные проводили многочисленные сравнения этих бактерий и узнали, что примерно 10 тыс. лет назад произошла мутация, в результате которой у псевдотуберкулёзной палочки возникли новые гены, позволяющие ей проникать в дыхательные пути человека и поражать лёгкие, а также стремительно проникать во все ткани организма и размножаться в них. Так образовалась чумная палочка.
Эта бактерия вновь мутировала в конце II или в начале III тысячелетий до н.э., и тогда появилась бубонная форма чумы. Учёные выделяют три исторических разновидности чумного возбудителя:
antiqua — вызвала Юстинианову чуму (около 541–683 годы н.э.);
medievalis — вызвала Чёрную смерть XIV веке;
orientalis — вызвала Третью пандемию (примерно 1855–1912 годы), а также современные случаи заражения.
Сейчас известно несколько сотен штаммов чумной палочки, но все заражённые получают эффективное лечение.
Чумная палочка способна сохраняться в мокроте из лёгких до 10 дней. На различных поверхностях она живёт неделями, а на трупах погибших — даже месяцами. Она хорошо переносит низкие температуры, но погибает при кипячении за считанные минуты. При нагревании до 60ºС она погибнет за час. Её легко убивают дезинфицирующие средства.
История и современность
Эпидемии чумы уносили миллионы жизни. Жители средневековых городов жили в тесноте, из-за этого риск заражения возрастал многократно. Это сыграло свою роль в том, что вспышки чумы в Европе были обыденностью в XIV–XVIII веках.
Чума существовала всегда с тех пор, как 10 тыс. лет назад появился её возбудитель. Во многих древних письменных источниках говорится о случаях бубонной чумы в Древнем Риме. В истории человечества известны три масштабные вспышки мора:
Юстинианова чума — продолжалась в 541–683 годах и вплоть до VIII века. Она возникла в египетском городе Пелусий (542 г.) и быстро проникла в Константинополь (544 г.), охватила Византию и все страны Средиземноморья, а позднее — всю Европу, Англию и Северную Африку. Вспышка случилась во времена Юстиниана I, бывшего императором Византии. Чума протекала в септической и бубонной формах. По приблизительным подсчётам жертвами стали 100 млн человек. Погибла почти половина жителей Византии.
Чёрная смерть — первоначально зародилась в пустыне Гоби примерно в 1320 году, позже пришла в области возле озера Иссык-Куль в 1338–1339 годах. За следующие несколько лет она поразила жителей Центральной Азии, Золотой Орды, Крыма и в 1347 году пришла в Константинополь, а затем в Сицилию. Оттуда чума распространилась на всю Европу. Пик пандемии пришёлся на 1346–1353 годы, но болезнь продолжала периодически бушевать вплоть до XVIII века. Погибло около 200 млн человек, некоторые поселения обезлюдели.
Третья пандемия — вспыхнула в середине XIX века (около 1855 года) и завершилась в 1920-е годы. Она началась в Китае и стремительно охватила всю Юго-Восточную Азию. Умерли 12 млн человек.
Первая вакцина была создана в 1896 году российским бактериологом, эпидемиологом и иммунологом Владимиром Хавкиным, который приехал из Франции в Бомбей во время бушевавшей там эпидемии.
В 1947 году обнаружено лечебное влияние стрептомицина, этим средством начали лечить заражённых. Сейчас каждый год заболевает примерно 2500 человек по всему миру. В настоящее время есть несколько вакцин и антибиотики. Смертность составляет около 5–10%. Важнейшую роль играет рано начатое лечение.
Формы болезни
Известно несколько форм заболевания, которые отличаются друг от друга по симптомам и степени заразности:
Бубонная — после проникновения инфекции через рану на коже воспаляется лимфатический узел.
Лёгочная — пневмония, возникающая при попадании чумной палочки в дыхательные пути.
Кожная — инфекция проникает через рану или царапину, но не вызывает воспаление лимфоузла (бубон).
Кишечная — осложнение любой из форм.
Все эти разновидности одинаково опасны для здоровья и прежде всегда приводили к неминуемой гибели.
Симптомы
Важно понимать, как происходит заражение. Бактерия попадает в организм через слизистые оболочки, конъюнктиву или через рану на коже. Лихорадка начинается через 1–7 дней после заражения.

Обзор
Автор
Редактор

Один монах, странствуя по белому свету, встретил Чуму, которая направлялась в его город.
— Ты куда это направляешься, Чума? — спросил он ее.
— Иду в твой родной город, — ответила она. — Мне нужно забрать там тысячу жизней.
Через некоторое время монах снова встретил Чуму на своем пути.
— Почему ты меня обманула тогда? — спросил он ее с укором. — Ты говорила, что должна забрать тысячу жизней, а забрала пять тысяч.
— Я тогда сказала тебе правду, — ответила Чума. — Я действительно забрала тысячу жизней. Остальные умерли от страха.
Жертвы чумы исчислялись сотнями тысяч и даже миллионами человек, вымирали города, становились безлюдными целые области, и ужас пандемий чумы затмевал ужасы всех войн, какие знала история человечества. Целые тысячелетия люди не понимали, что является источником заболевания [2].
Библия — одно из древнейших дошедших до нас свидетельств эпидемий чумы (1 книга Царств, глава 5; 4 книга Царств, глава 19, стихи 35–36). В мировой истории отмечают три пандемии этой болезни:
Бубонная форма чумы является наиболее распространенной формой заболевания и при отсутствии лечения приводит к гибели 40–60% заболевших. Легочная форма возникает либо как осложнение бубонной или септической форм, либо при вдыхании воздуха, зараженного возбудителем чумы. Если лечение не начинают в первые 24 часа после появления симптомов, смерть наступает через 48 часов [8].
В природе чумной микроб встречается практически на всех континентах, исключая Австралию, Антарктиду, а также Арктику, что обусловливает ежегодно регистрируемые случаи этой болезни. Стремительная эволюция микроорганизмов приводит к появлению популяций бактерий (штаммов), устойчивых к антибиотикам [9], что в случае с возбудителем чумы особенно опасно. Кроме того, этих бактерий могут использовать в качестве агента биотерроризма. Все вышесказанное объясняет необходимость изучения чумного микроба.
Возбудитель чумы Yersinia pestis — самая опасная бактерия в мире [10]. Что делает ее столь смертоносной?
Факторы вирулентности, или вооружен и очень опасен
Со времен открытия возбудителя чумы в 1894 году французом Александром Йерсеном и японцем Китасато Сибасабуро ученые пытались выяснить, что определяет патогенность Y. рestis. В результате многолетней тяжелой и рискованной работы, которая продолжается и по сей день, выделили следующие факторы патогенности возбудителя:
- белки внешней мембраны (Yersinia outer proteins — называемые Yop-белками, эффекторными белками, или комплексом Yop-вирулона) [11];
- комплекс области пигментации [12];
- активатор плазминогена [13];
- капсульный антиген [14];
- пили адгезии или pH6-антиген [15].
Белки внешней мембраны, или зачем возбудителю чумы шприц?

Рисунок 1. Схема действия системы секреции III типа.
Комплекс области пигментации, или может ли стать потребность в чем-либо фактором патогенности?
Активатор плазминогена, или двуликий Янус
При вдыхании чумных микробов (и развитии легочной чумы) этот белок обеспечивает быстрое размножение бактерий в тканях легких и приводит к развитию молниеносной пневмонии и отеку легких, тогда как в отсутствии Pla инфекция не развивается в смертельную пневмонию. Установлено, что активатор плазминогена нарушает постоянство внутренней среды организма хозяина и блокирует иммунные реакции, направленные на уничтожение патогена [27].
Капсульный антиген, или скользкий тип этот возбудитель чумы
Бактерии окружены капсулой из слизистого вещества (фракция I, Fra1), которая препятствует поглощению и обезвреживанию Y. pestis иммунными клетками организма-хозяина в процессе фагоцитоза. На выявлении этого вещества-антигена основаны многие современные методы лабораторной диагностики чумы, оно входит в состав многих экспериментальных химических вакцин против чумы. Однако позднее обнаружили популяции бактерий, лишенные капсулы [28]. Кроме того, слизистая капсула есть у многих других микроорганизмов, например, возбудителя сибирской язвы, туляремии. Капсульное вещество иерсинии образуют при температуре 37 °С.
Антигены, схожие с рН6, были обнаружены у ряда возбудителей, вызывающих менее опасные болезни — кишечные инфекции (Y. pseudotuberculosis [31], Y. enterocolitica [32], Escherichia coli [8]).
Температурный фактор, или то, что действительно имеет значение
Необходимо заострить внимание на особой роли температуры в физиологии чумного микроба. Именно при температуре 37 °С у него повышаются питательные потребности [33] и синтезируются практически все известные детерминанты вирулентности (рис. 2) [34]. У других бактерий подобная зависимость выражена в меньшей степени, что позволяет говорить о ведущей роли температурного фактора в вирулентности возбудителя чумы [8].
Геном или все важное внутри
Помимо хромосомы у чумного микроба есть плазмиды — внехромосомные участки ДНК [38]. Большинство белковых факторов вирулентности закодированы на плазмидах: эффекторные белки на плазмиде pCad; капсула — pFra; активатор плазминогена — рPla (pPst, pPCP). Плазмиды pFra и рPla обнаружены только у Y. pestis (видоспецифические), pCad является общей с возбудителем псевдотуберкулеза (родоспецифическая) [20].
Заключение
В настоящее время продолжается работа по выявлению новых, еще не изученных маркеров вирулентности [39]. С использованием 2D-электрофореза, масс-спектрометрии, полногеномного секвенирования проводят сравнительный анализ отличающихся по вирулентности популяций чумного микроба для выявления различий в их белковых спектрах и геномных последовательностях. Ранее не известные белки и участки генома становятся объектом пристального внимания и изучения как потенциальные детерминанты вирулентности.
Таким образом, патогенность возбудителя чумы — это множественный (полидетерминантный) признак. Соединение многих факторов в единое целое создает страшную угрозу чумных эпидемий, с противостоянием которым, однако, прогрессивное человечество успешно справляется.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Бубонная чума – это карантинная природно-очаговая инфекция. Основным клиническим симптомом является наличие чумного бубона. Для нозологии характерна высокая лихорадка, выраженная интоксикация, при иммуносупрессии возможно висцеральное поражение, генерализация инфекции. Диагностика построена на обнаружении возбудителя в биологических материалах (микроскопия, посев, ПЦР), серологические методы малоинформативны, практически не применяются. Лечение проводится в условиях обязательного карантина, включает в себя антимикробную этиотропную терапию, массивную дезинтоксикацию, симптоматические методы. Реже прибегают к хирургическим вмешательствам.
МКБ-10
Общие сведения

Причины
Возбудитель болезни – бактерия Yersinia pestis. Источником и резервуаром инфекции служат больные люди, грызуны, зайцы, лисы, верблюды, домашние кошки и другие животные. Переносчики – блохи, в пищеварительном тракте которых размножаются чумные палочки. Заразными насекомые становятся уже через 3-5 суток после попадания в них возбудителя и остаются таковыми в течение года. При укусе блоха срыгивает внутрь ранки содержимое желудка с большим количеством бактерий. Также описаны воздушно-капельный, фекально-оральный и контактно-бытовые пути инфицирования.
Основными факторами риска заражения бубонной чумой считаются проживание и несение воинской службы на эндемичных территориях, профессии, связанные с истреблением грызунов, работой в зернохранилищах, ветеринарной службе. Опасности подвергаются археологические экспедиции, вскрывающие места старинных захоронений, а также животноводы, медицинский персонал, пастухи, туристы, работники международных аэропортов, зоопарков. Бубонной чуме наиболее подвержены дети, лица, не достигшие 20-ти лет, и взрослые мужчины.
Патогенез
После проникновения в организм чумные бактерии размножаются в месте внедрения, образуя воспалительный уплотненный участок либо папулу, пустулу с геморрагическим содержимым. Распространение возбудителя происходит лимфогенно до регионарных лимфатических узлов, внутри которых бактерии размножаются. Особенностью Y. рestis является способность к подавлению фагоцитарной активности макрофагов, внутриклеточному размножению в них. При этом выделяется большое количество токсинов, продуктов распада тканей, возбудителей, что обусловливает интоксикационные симптомы.
Плотная фиброзная нодулярная оболочка препятствует попаданию в очаг воспаления полиморфно-ядерных лейкоцитов и специфических антител. Активная репликация возбудителя способствует расплавлению и увеличению лимфатической ткани регионарных узлов, вследствие чего возникают конгломераты. Длительная персистенция, массивный воспалительный процесс приводит к геморрагическому некрозу нодулярной ткани и выходу чумной палочки в системный кровоток с последующей генерализацией инфекции; в 10-20% случаев развиваются симптомы вторично-легочной чумы.
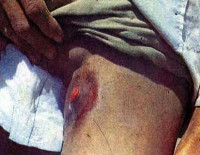
Симптомы бубонной чумы
Инкубационный период составляет 2-6 суток, реже 1-12 суток, ведущими симптомами являются нарастающие локальные боли (обычно в паху), лихорадка до 39-40° C и более. Пациенты вынуждены сохранять крайне неудобные позы для уменьшения болевых ощущений. Характерны сильные ознобы, выраженная слабость, головные боли, расстройства сна, беспокойство, дискоординация движений, иногда бред, галлюцинации. Около половины заболевших бубонной чумой отмечают симптомы расстройств ЖКТ: абдоминальные боли, тошноту, рвоту, эпизоды диареи.
Спустя 1-3 дня без лечения преимущественно в паховой области, реже в зоне подмышек или шеи обнаруживается очень плотное, резко болезненное образование с гиперемированной, горячей, иногда лоснящейся над ним кожей. Конгломерат неподвижен, поскольку спаян с окружающей клетчаткой. Движения в конечности (чаще – нижней) ограничиваются. Через несколько дней образование размягчается, в нем появляются пульсирующие боли, может образовываться свищевое отверстие с изливающимся гнойным содержимым. После вскрытия бубона больные отмечают некоторое улучшение самочувствия, уменьшение выраженности симптомов.
Осложнения
К наиболее частым негативным последствиям бубонной чумы относят симптомы со стороны свертывающей системы крови (до 86% больных), что в 5-10% случаев приводит к возникновению сухой гангрены кожи, верхних и нижних конечностей. 5-50% пациентов имеют осложнения в виде единичных, множественных, либо массивных кровоизлияний. У больных бубонной чумой с нарушениями иммунитета, тяжелыми сопутствующими болезнями системного характера на 2-3 сутки заболевания возникает переход в генерализованную форму.
Диагностика
Стандарты диагностики бубонной чумы предусматривают консультацию инфекциониста, другие врачи привлекаются для осмотра и лечения по показаниям. Важным элементом диагностического поиска является сбор эпидемиологического анамнеза, строгое соблюдение правил осмотра, взятия, транспортировки и исследований биологических субстанций; работа с ними разрешена только в условиях лабораторий карантинных инфекций. Наиболее информативными инструментальными и лабораторными исследованиями при бубонной чуме считаются:
- Физикальные данные. Объективно определяются симптомы интоксикационного вовлечения ЦНС: больные возбуждены, беспокойны, речь невнятная. Пальпаторно бубон представляет собой резко болезненный малоподвижный конгломерат лимфоузлов с нечеткими контурами, гиперемированной горячей кожей над ним, флюктуацией либо свищами; около образования возникают чумные фликтены. Отмечается вынужденная поза пациента. Патологические изменения со стороны внутренних органов обычно отсутствуют.
- Лабораторные исследования. Общеклинический анализ крови характеризуется выраженным лейкоцитозом, сдвигом лейкоцитарной формулы влево, нейтрофилезом, нарастающей тромбоцитопенией, вторичной анемией, ускорением СОЭ. Изменения биохимических параметров транзиторны, чаще отмечается увеличение активности АЛТ, АСТ, общего билирубина, мочевины, креатинина, гипопротеинемия. В общем анализе мочи обнаруживается эритроцитурия.
- Выявление инфекционных агентов. Через 1-2 часа лаборатория должна предоставить результаты микроскопии свищевого отделяемого или пунктата бубона; разрешается применение ПЦР. Обязательным является посев биологических материалов на питательные среды. Серологические методики (ИФА, РПГА) можно оценить только со 2-ой недели инфекции, исследуя парные сыворотки с интервалом 14 дней для фиксации роста титра антител не менее чем четырехкратно.
- Инструментальные методики. Обязательно проведение рентгенографии грудной клетки для исключения рентгенологических симптомов чумной пневмонии; реже показаны КТ, МРТ. С целью дифференциального диагноза со злокачественными новообразованиями рекомендуется ультразвуковое исследование молочных желез, малого таза, органов брюшной полости, мягких тканей, забрюшинного пространства, лимфатических узлов; под контролем УЗИ возможна пункция бубона.
Дифференциальная диагностика осуществляется с туляремией (малоболезненный, не спаянный с кожей бубон). При туберкулезе рост лимфоузла постепенный, есть указания на иммунодефицит, симптомы туберкулеза в анамнезе. Укус крысы, пятнисто-уртикарная сыпь или оцарапывание кошкой, лимфангоит свидетельствуют в пользу содоку и болезни кошачьих царапин соответственно. Лимфогранулематоз манифестирует симптомами поражения легких, костей, ЖКТ. Хламидиозная инфекция иногда протекает с паховым односторонним лимфаденитом, спаиванием с окружающими тканями, формированием свищей.
Лечение бубонной чумы
Все пациенты с подозрением на заболевание либо с патогномоничными симптомами обязательно госпитализируются в боксированную палату инфекционного отделения для немедленного начала лечения. Постельный режим назначается до 4-5 дней нормализации температуры тела, передвижение ограничивается боксом. Диетические рекомендации неспецифичны, обусловлены необходимостью введения антибиотиков с широким спектром нежелательных токсических явлений, поэтому из рациона больного исключается тяжелая пища и алкоголь. Питьевой режим увеличивается с целью дезинтоксикации.
Консервативная терапия
Лечение больных с бубонной чумой направлено на снижение выраженности симптомов, профилактику заражения других людей. Пациентам обязательно назначаются антибактериальные средства, эффективные в отношении возбудителя и вводимые парентерально. К таковым относятся стрептомицин, тетрациклины, фторхинолоны, аминогликозиды, цефалоспорины, рифампицин. Требуется массивная внутривенная дезинтоксикация глюкозо-солевыми, сукцинат-содержащими растворами, назначение обезболивающих, противовоспалительных, жаропонижающих средств. Объем симптоматического лечения зависит от клинической необходимости.
Хирургическое лечение
Местное лечение бубонов вне их размягчения не проводится. С лечебно-диагностической целью может осуществляться тонкоигольная пункционная биопсия лимфатических узлов с одновременным опорожнением бубона. При наличии кожной язвы проводят её иссечение с целью гистологического исследования. Хирургическое вскрытие и дренирование бубонов рекомендовано при появлении симптома флюктуации конгломератов, одновременно внутрибубонно вводят антибиотики, активные в отношении Y. Pestis, стрептококков и стафилококков.
Экспериментальное лечение
В ходе современных исследований установлено, что макрофаги несут на себе рецептор к кортикостероидам, что способствует потенцированию действия собственной иммунной системы при симптомах бубонной чумы. В экспериментах с лечением мышей было доказано повышение макрофагальной способности инфильтрировать инфицированные ткани и поглощать апоптозные нейтрофилы под действием указанных гормональных препаратов. Также было отмечено усиление бактериального поглощения и улучшение выживаемости зараженных животных.
Прогноз и профилактика
Прогноз при отсутствии лечения серьезный, смертность достигает 7-26%. Наиболее неблагоприятными локализациями считаются подмышечные (15-20%) и шейные (5%) зоны из-за риска развития симптомов легочной формы болезни и отека воздухопроводящих путей. Общая продолжительность стационарного лечения для больных, страдающих бубонной чумой, должна составлять не менее 4-х недель, медицинское наблюдение после выписки – не менее 3-х месяцев. Срок изоляции контактных лиц – 7 дней.
Специфическая профилактика показана лицам, проживающим в эндемичных регионах, туристам, военным. Вакцинация осуществляется сухой живой вакциной. К неспецифическим мерам относится строгий санитарный контроль над системами водоснабжения и водоотведения, плановая дератизация в канализационных коллекторах, надзор за мигрантами, туристами, ввозимыми продуктами, животными. Важными мерами борьбы с распространением чумы являются ранняя изоляция и лечение больных, карантинизация контактных лиц, дезинфекция в очаге, улучшение санитарно-гигиенических условий жизни.
3. Adjunctive Corticosteroid Treatment Against Yersinia pestis Improves Bacterial Clearance, Immunopathology, and Survival in the Mouse Model of Bubonic Plague/ Yinon Levy, Yaron Vagima, Avital Tidhar// The Journal of Infectious Diseases – 2016 - V.214, №6.
Читайте также:

