Что лучше генферон или виферон при папилломах
Обновлено: 24.04.2024
На сегодняшний день вирус папилломы человека (ВПЧ) является одной из самых распространенных вирусных инфекций. Согласно статистике, он присутствует практически у 90% населения планеты. Также учеными доказано, что два типа вируса (16 и 18) встречаются примерно 70% пациенток, у которых обнаружен рак шейки матки и предраковые патологические состояния шейки матки. 1 Установлено, что у женщин с длительным сохранением вируса в организме риск развития рака шейки матки возрастает в 80 раз. По этой причине борьбе с этим заболеванием врачи уделяют повышенное внимание.
Вирус папилломы человека (ВПЧ) относится к роду папилломавирусов (Papillomavirus) и принадлежит к подгруппе А семейства Papovaviridae. Он населяет глубокие слои эпителия (кожи и слизистых оболочек), а его размножение происходит в верхних слоях эпителия. Весь жизненный цикл вируса проходит только внутри клеток организма, но некоторое время он может существовать и во внешней среде, чем и обусловлена его высокая контагиозность – свойство инфекционных болезней передаваться от больных людей здоровым путем передачи возбудителя при непосредственном контакте или через факторы передачи. Возможно повторное заражение, поскольку иммунитет к этому вирусу не вырабатывается.
Типы ВПЧ онкогенного риска
В настоящее время известно более 600 типов (штаммов) папилломавируса, обнаруженных у человека. Из них примерно 40 могут вызвать поражение аногенитального тракта мужчин и женщин, которое проявляется образованием кондилом или развитием предраковых изменений внутри эпителия с последующим развитием рака шейки матки, влагалища, вульвы, ануса, полового члена.
Все типы папилломавирусов делят на три группы по онкогенной опасности для человека 1 :
- вирусы папилломы человека низкого онкогенного риска: 6, 11, 40, 42, 43, 44;
- вирусы среднего онкогенного риска: 35, 51, 52, 58;
- вирусы высокого онкогенного риска: 16, 18, 31, 33, 45, 56.
Онкогенность вируса объясняется его способностью интегрировать свою ДНК в геном клеток человека.

Какие виды ВПЧ существуют
ВПЧ-инфекция аногенитальной локализации может протекать в латентной, субклинической и клинической формах. При латентной форме вирус выявляется, но изменения эпителия отсутствуют. Субклиническая инфекция выявляется только с помощью пробы с 3% уксусной кислотой и проявляется мелкими плоскими бородавками. Клиническая форма папилломавирусной инфекции может протекать в виде интраэпителиальных поражений (внутри эпителия) у женщин и мужчин, которые не видны невооруженным глазом, но обнаруживаются при кольпоскопии и цитологическом/гистологическом исследовании и могут привести к предраковым заболеваниям и раку. А также в виде генитальных бородавок, которые представляют собой мягкие сосочковидные образования на ножке, склонные к слиянию. Сливаясь, они образуют колонии, внешне напоминающие цветную капусту.
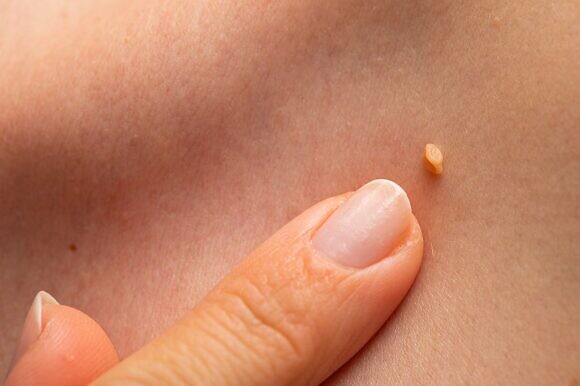
Проявления вируса папилломы человека вариабельны и зависят от типа вируса. ВПЧ низкого онкогенного риска также приводят к появлению бородавок и папиллом:
- Вульгарные бородавки – это твердые новообразования диаметром более 1 мм с грубой, ороговевшей поверхностью. Возможно слияние папиллом с образованием значительных участков поражения.
- Подошвенные бородавки – это твердые плоские образования на коже стопы, возвышающиеся над ее уровнем и покрытые слоем ороговевшего эпителия.
Имеют выступающий ободок. Иногда от одной бородавки образуются дочерние. - Плоские бородавки – это кожные образования в виде плоских узелков размером до 5 мм. Плоские бородавки, как правило, множественные и располагаются группами на лице, тыле кистей, голенях.
- Нитевидные папилломы поражают область вокруг глаз, пах, шею и подмышечные впадины. Они представляют собой вытянутые образования эластичной консистенции размером 5-6 мм.
Известны три пути передачи ВПЧ:
- контактно-бытовой;
- половой (генитальный, анальный, орально-генитальный);
- в родах от матери к ребенку.
Предрасполагающими факторами, которые способствуют заражению и развитию инфекции, являются авитаминоз, иммунодефициты, курение, эндометриоз, физические перегрузки и хроническая усталость, беременность, урогенитальные инфекции, а также любые хронические заболевания, которые отрицательно воздействуют на иммунитет. Риск заражения возрастает при частых контактах с обнаженной кожей человека, например при массаже.
ВИФЕРОН Свечи при ВПЧ
Поскольку заражение вирусом и появление папиллом и кондилом на коже и слизистых оболочках неразрывно связано с состоянием иммунитета, лечение при обнаружении вируса папилломы человека в организме включает препараты, которые не только борются с вирусами, но и способствуют восстановлению иммунитета. Один из таких препаратов – ВИФЕРОН, который обладает широким спектром противовирусной активности и укрепляет иммунитет. Рекомбинантный интерферон альфа-2b, который входит в состав этого препарата, обладает иммуномодулирующими, противовирусными свойствами (блокирует размножение вируса) и способствует восстановлению иммунной системы. Он идентичен человеческому интерферону альфа-2b, но производится с помощью современных технологий без использования донорской крови.

Форма выпуска и состав
Препарат, который выпускается в виде свечей, геля и мази, разработан в результате фундаментальных исследований в области иммунологии, доказавших, что в присутствии антиоксидантов (витамины С, Е) усиливается противовирусное действие интерферона.
ВИФЕРОН Свечи производятся в виде ректальных суппозиториев пулевидной формы бело-желтого или желтого цвета. Препарат подавляет активность вирусов и повышает эффективность собственного иммунного ответа организма на патогенные микроорганизмы. Масло какао, которое входит в состав препарата, содержит фосфолипиды, благодаря чему лекарственные вещества равномерно распределяются по всему суппозиторию, что обеспечивает их быстрое и практически 100% поступление в кровь. В отличие от порошка какао, масло не содержит естественных аллергенов и не оказывает раздражающего действия на слизистую оболочку. Свойства масла какао позволяют избежать необходимости добавления синтетических токсичных эмульгаторов, которые, в случае использования твердого жира в качестве основы суппозиториев, применяются для равномерного распределения и повышения биодоступности (всасываемости) действующего вещества.
Показания к применению при ВПЧ
Препарат в виде Свечей (суппозиториев) можно применять при беременности (с 14-й недели), а также в период грудного вскармливания и при лечении детей.
Препарат применяется у детей и взрослых в составе комплексной терапии для борьбы с рядом заболеваний, в том числе инфекционно-воспалительными заболеваниями урогенитального тракта у взрослых (вирус папилломы человека, хламидиоз, цитомегаловирусная инфекция, уреаплазмоз, трихомониаз, гарднереллез, бактериальный вагиноз, рецидивирующий влагалищный кандидоз, микоплазмоз). Он снижает частоту рецидивов и препятствует прогрессированию патологии шейки матки, связанной с ВПЧ-инфекцией.
Свечи ВИФЕРОН при ВПЧ: дозировка препарата
Информация о том, как применять ВИФЕРОН Свечи при вирусе папилломы человека , содержится в инструкции. Рекомендуемая доза для взрослых – ВИФЕРОН 500 000 ME по 1 суппозиторию 2 раза/сут через 12 ч ежедневно в течение 5-10 суток. По клиническим показаниям терапия может быть продолжена.
Перед тем, как вводить свечи, проверьте срок их годности. Не рекомендуется использование свечей и истекшим сроком годности. Перед использованием ректальной свечи необходимо тщательно вымыть руки. Обертку свечи нужно аккуратно разрезать ножницами и вытащить ее содержимое. Потом необходимо лечь на любой удобный для процедуры бок, полностью выпрямив нижнюю ногу и согнув верхнюю к животу. Затем нужно медленно ввести свечу в анус, пропихнув ее кончиком пальца за мышечный сфинктер. После введения свечи ягодицы следует свести и удерживать их в таком положении на протяжении нескольких секунд.
Применение суппозиториев Виферон против ВПЧ при беременности
Гель и мазь ВИФЕРОН при ВПЧ
Сведения о применении ВИФЕРОН Мазь и Гель при ВПЧ в инструкции препарата отсутствуют. Их применение показало свою эффективность в некоторых авторских схемах лечения, однако пока производители не внесли информацию о показаниях к применению этих форм препарата при терапии заболеваний, вызванных вирусом папилломы человека.
Правда и мифы о вирусе папилломы человека
ФАКТ 1. Вирус папилломы человека может вызывать патологию шейки матки в виде предраковых изменений и рака шейки матки.
Это правда. Определенные типы вируса могут вызвать серьезные проблемы со здоровьем. Вирус обнаруживается у большинства пациенток с раком шейки матки. Вирус папилломы человека среднего и низкого онкогенного риска приводят к появлению кондилом, папиллом и бородавок на всем теле и половых органах. Эти образования не являются предраковыми и требуют лечения по косметическим соображениям.
ФАКТ 2. Презервативы и другие барьерные средства контрацепции защищают от передачи ВПЧ.
Это миф. Конечно, использование презервативов снижает риск заражения вирусом, но они не способны полностью защитить от инфицирования. Особенно в тех случаях, когда образования в интимной зоне находятся за пределами органов, защищенных контрацептивом. 2
ФАКТ 3. Наличие вируса папилломы человека в организме определяется по анализу крови на антитела.
Это миф. В крови антитела могут определяться как свидетельство того, что организм ранее уже встречался с ВПЧ. Сам вирус обнаружить можно только в клетках плоского эпителия, которые присутствуют на слизистых оболочках и коже.
ФАКТ 4. Можно полностью избавиться от вируса папилломы человека.
Это миф. На данный момент пока не существует метода борьбы с вирусом, который навсегда бы устранил его из организма. Однако, с проявлениями вируса можно успешно бороться при помощи курса лечения иммуномодулирующими препаратами с противовирусной активностью, в том числе препаратом ВИФЕРОН. 1,2
ФАКТ 5. Вирус папилломы человека может исчезнуть самостоятельно без лечения.
Справочно-информационный материал
Автор статьи
Врач общей практики
Источники
2. Гинекология: национальное руководство / под ред. Г.М. Савельевой, Т.Г. Сухих, В.Н. Серова, И.Б. Манухина, В.Е. Радзинского. М.: ГЭОТАР-Медиа, 2019. – 1008 с.
К настоящему моменту накоплен значительный опыт использования а-, b- и у-интерферонов (ИФН) в лечении ПВИ. В большинстве исследований отмечается их невысокая активность при местном применении. Известны различные схемы и методы введения интерфероновых препаратов. Используют внутриочаговое введение ИФН-а, если плоские генитальные бородавки плохо поддаются терапии другими средствами. Назначение таким больным ИФН-а в дозе 1 млн ME приводило к клиническому излечению в 78% случаев (Гомберг М. А., 1997, 1998). В методических материалах ЦНИКВИ МЗ РФ (2003) как для внутриочагового, так и для системного применения рекомендованы большие дозы ИФН. Предлагается использовать по 1,5-3,0 млн ME ИФН 3 раза в неделю в течение 4 недель.
Рекомбинантный ИФН-а2а назначают 1-3 млн ME 3 раза в неделю подкожно в течение 1-2 месяцев или, у мужчин с перианальными остроконечными кондиломами, по 3 млн ME в день в течение 14 дней и затем 3 раза в неделю в течение 1 месяца. Рекомбинантный ИФН-а2b вводят в основание кондилом 3 раза в неделю (через день) в течение 3 недель. Одновременно проводят лечение не более 5 участков поражения. Суммарная еженедельная доза ИФН не должна превышать 15 млн ME. При отсутствии эффекта после первого курса можно провести повторный курс (Гаращенко Т. И. и др., 1993). ИФН-b (человеческий фибробластный ИФН-b) вводят в зону поражения или прилегающую область в дозе 3 млн ME в течение 5 дней в неделю на протяжении 1-3 недель.
Во время беременности видимые кондиломы часто рецидивируют, имеют тенденцию к пролиферации и становятся рыхлыми. Лечение беременных желательно проводить на ранних сроках, соблюдая особую осторожность. Рекомендуется применять только физические деструктивные методы (криотерапию и С02-лазер). Цитотоксические препараты — подофиллин, подофиллотоксин и 5-фторурацил противопоказаны для лечения беременных. Аналогичные подходы должны соблюдаться при выборе метода лечения ВПЧ-инфекции у детей.
Обследовано 124 женщины в III триместре беременности с разными субклиническими и клиническими формами ВПЧ-инфекции (Тапильская Н. Н. и др., 2006). Диагноз ставился клинически, изучение соскоба с шейки матки методом ПЦР и реакции транскрибционной амплификации NASBA-Real-time (определение клинически значимой концентрации вируса в ткани). Методом ПЦР ВПЧ выявлен у 87 (67,7%), а уточняющим методом NASBA-Real-time результаты диагностированы как клинически значимые у 41 (32,3%) беременной. Обследованы все новорожденные сразу и на 5-й день после рождения, определена цитотоксическая активность NK-клеток методом проточной цитофлюореметрии. Выявлены ВПЧ типов 6, 11, 16, 18, 31, 33, 39, 45, 56, 58, 66. Шесть из 41 (14,6%) новорожденного были инфицированы ВПЧ (6, 11, 16, 45 и 59 типы). У беременных с клинически манифестной формой ВПЧ-инфекции функциональная активность NK-клеток была достоверно сниженной.
Инфицированные беременные женщины основной группы получали препарат интерферона в виде ректальных свечей виферон-2 (500 тыс. ME интерферона-а-2b в комплексе с мембраностабилизирующими и антиоксидантными препаратами — 2,5 мг токоферола ацетата и 22 мг аскорбиновой кислоты) по 1 свече 2 раза в день 10 дней, а далее по 1 свече 2 раза в день 2 раза в неделю до родоразрешения. Виферон единственный препарат из класса рекомбинантных интерферонов, разрешенных для лечения беременных женщин. Указанную терапию ви-фероном-2 в течение 4 недель в сочетании с интравагинальным применением противовирусного препарата эпиген (синергический эффект) получили 49 беременных женщин с ВПЧ-инфекцией. В контрольной группе использовали только эпиген. Среди новорожденных основной группы инфицированных вирусом не было, в контрольной группе у 4 из 27 (14,8%) новорожденных обнаружен ВПЧ 6, 11, 33 и 59 типов. После курса лечения вифероном-2 восстановилась функциональная активность NK-клеток у беременных женщин.
Комбинированное, двухэтапное лечение папилломавирусной инфекции, когда на 1 -м этапе тем или иным способом в зависимости от выраженности и распространенности инфекционного процесса проводится разрушение папилломатозных очагов, а на 2-м этапе с целью минимизации риска рецидивирования инфекции используются имммунотропные средства, представляется наиболее перспективным. Показано, что назначение ИФН-а даже 1 раз в неделю в течение 8 недель после лазерного удаления остроконечных кондилом снижает частоту рецидивов с 24 до 7% (Klutke J. J. с соавт., 1995). Комплексное лечение распространенных кондилом электрокоагуляцией с последующим внутриочаговым и системным применением а-ИФН (1-2 раза в неделю) и лейкинферона по 10 000 ME внутримышечно, через день на курс 10-15 инъекций, значительно повышает эффективность терапии и снижает процент рецидивов (Дубинский В. В. с соавт., 1996). Снизить частоту рецидивирования ВПЧ-инфекции позволяет также назначение отечественного иммуномодулирующего препарата галавит после предварительного удаления папилломатозных элементов. Так, внутримышечное назначение этого препарата по следующей схеме: 200 мг — первый день, 100 мг — второй день, а с третьего дня по 100 мг через 48 часов, всего от 10 до 15 инъекций, в сочетании с местным назначением 1% мази галавит у 50% больных с изначально рецидивирующим течением заболевания позволяет снизить частоту рецидивирования до 12% (Ермоленко Д. К., Исаков В. А., 2003).
Хороший эффект получен при комбинированном лечении кондилом урогенитального тракта с использованием криодеструкции, затем местно наружную лекарственную форму на косметической эмульсионной основе, содержащей рекомбинантный ИФН-у для стимуляции местного клеточного иммунитета и снижения процессов пролиферации в очагах поражения (Богатырев И. И. и др., 1996). Несмотря на низкую эффективность интерферонотерапии считают, что местное и системное использование интерферонов повышает восприимчивость (чувствительность) опухолевых клеток к интерферону.
Отдельные авторы рекомендуют локальное удаление очагов папилломавирусной инфекции производить не ранее чем через 2-3 недели после окончания системной противовирусной терапии, поскольку возможно полное исчезновение кондилом или их значительное уменьшение в количестве и размерах только на фоне правильно подобранной системной терапии (Дубенский В. В., 1996; Семенов А. В., 2005).
При остроконечных кондиломах по 2 т. изопринозина 3 раза в день в течение 14-28 дней в качестве монотерапии. При комбинированном лечении с лазерной терапией С02 либо солкодермом — по 2 т. 3 раза в день в течение 5 дней, проводят 3 курса с интервалом 1 месяц. Комбинированное лечение кондиломы цервикса и вульвовагины у 64 больных изопринозином с лазерной терапией после первого курса сопровождалось выздоровлением 93%, в контрольной группе в 68% случаев. Терапия свыше 14 дней предполагает контроль содержания мочевой кислоты и трансаминаз в сыворотке крови. Возможно использование изопринозина в сочетании с ИФН. В случае вульгарных бородавок рекомендуется по 500 мг изопринозина 3 раза в день в течение 10 дней, повторные курсы проводят с интервалом в 1 месяц (Димтриев Г. А., Биткина О. А., 2006).
Галавит (активный компонент — производное фталгидразида) — новый иммуномодулирующий и противовоспалительный препарат, ампулы по 0,1 г. После обработки папиллом вводят внутримышечно по следующей схеме: 200 мг — первый день, 100 мг — второй день, а с третьего дня по 100 мг через 48 часов; курс 10-15 инъекций в сочетании с местным назначением 1% мази галавит у 50% больных с изначально рецидивирующим течением заболевания позволяет снизить частоту рецидивирования до 12% (Ермоленко Д. К., Исаков В. А., 2003).
Аллокин-алъфа — отечественный антивирусный препарат нового типа. Действующим веществом препарата является цитокиноподобный пептид аллоферон. Аллокин-альфа относится к иммунотропным лекарственным препаратам. Его действие направлено на усиление распознавания вирусных антигенов и инфицированных клеток натуральными (естественными) киллерами, нейтрофилами и другими эффекторными системами естественного иммунитета, ответственными за элиминацию вируса. Аллокин-альфа усиливает продукцию интерферона-у (ИНФ) НК-клетками в ответ на стимуляцию ИЛ-12 (Ершов Ф. И. и др., 2003). В отличие от известных индукторов ИФН, аллокин-альфа выступает в качестве кофактора, позволяя продуцирующим ИНФ-а лейкоцитам эффективно реагировать на вирусный антиген. Это дает возможность сфокусировать эффект препарата в месте размножения вируса и избежать избыточной реакции лейкоцитов за пределами очага инфекции.
Больным назначают 3-5 подкожных инъекций аллокина-альфа в дозе 1 мг с интервалом в один день. С интервалом 1 месяц возможно еще 2 курса препарата. Перспективно сочетанное использование аллокина-альфа с ИФН (свечи виферон-3), 5% линиментом циклоферона.
Алломедин (ООО Аллофарм) — гидрогель для наружного применения, предназначенный для лечения и профилактики заболеваний кожи, вызываемых вирусами простого герпеса и папилломы человека, а также для ускорения регенерации поврежденных участков кожи. Основным действующим компонентом алломедина является синтетический пептид аллоферон-3. Аллофероны — новая группа иммунотропных антивирусных препаратов природного происхождения, обладающих антипролиферативной активностью. Действие аллоферонов направлено на усиление распознавания вирусов и инфицированных ими клеток естественными киллерами, нейтрофилами и другими эффекторами естественного иммунитета. Аллоферон-3 представляет новое поколение аллоферонов, созданное с использованием методов протеомики на базе аллоферона-1 (аллокин-альфа). 8 больных женщин с ВПЧ-инфекцией шейки матки (16 и 18 тип) получали аппликации алломедина в виде монотерапии 1 раз в день в течение 3 дней, а 50 пациенткам дополнительно с алломедином еще назначались подкожно 3 инъекции аллокина-альфа ежедневно. После лечения вирус не определялся в 94-100% случаев, клиническая эффективность отмечена у 95% пролеченных больных (Черныш С. И. и др., 2005).
В настоящее время за рубежом для лечения аногенитальных папиллом рекомендуют использовать новый иммуномодулятор имиквимод (и резиквимод — более сильный аналог имиквимода), стимулирующий выработку прежде всего а-интерферонов. Препарат применяется в виде 5% крема, который наносится на очаги поражения 3 раза в неделю, что приводит к исчезновению кондилом и заживлению без образования рубцов (Tyring S. et al., 1997). После завершения успешного лечения у пациентов имеется тенденция становиться устойчивыми к появлению бородавок, что предполагает формирование иммунной памяти (Miller R. L. с соавт., 2002).
Вакцины. Ведется работа по созданию вакцин для профилактики и лечения ПВИ у человека. Считают, что вирусоподобные частицы могут защищать от первичного инфицирования, однако маловероятна их протективная роль при хронических папилломатозах. Предполагается вакцинация девочек до начала половой жизни. Наиболее перспективными мишенями для конструирования терапевтических вакцин являются онкобелки Е6 и Е7, поскольку они экспрессируются в тканях рака шейки матки и развитие опухоли обусловлено их присутствием. Ученые работают над созданием белковых вакцин Е6 и Е7, поскольку продемонстрирован цитотоксический иммунитет, индуцируемый рекомбинантным белком Е7 ВПЧ-16. Эта вакцина эффективна в отношении ВПЧ-18, а также ВПЧ-6 и ВПЧ-11, с которыми связывают развитие остроконечных кондилом (Шахова Н. М. и др., 2006).
Индукция иммунитета может быть достигнута использованием для вакцинации очищенной ДНК. Поэтому при конструировании ДНК вакцин используются вирусы осповакцины, аденовирусы, ВПГ. Технологическое производство таких вакцин легче, чем выделение белков. Препарат ДНК вакцины может содержать несколько рекомбинантных плазмид, кодирующих необходимый набор полипептидов, обеспечивающих иммунную реакцию.
Таким образом, ни один из методов лечения ВПЧ-инфекции не является безупречным, так как при использовании любого из них возможно рецидивирование инфекционного процесса. По-видимому, в ряде случаев (профилактика рака шейки матки) более эффективной может быть вакцинация, однако придется найти ответы на многие вопросы, прежде чем новые технологии будут внедрены в клиническую практику (Villa L. L., 2003).
М.А.Гомберг, д.м.н., профессор, А.М.Соловьев, к.м.н., доцент, МГМСУ, Москва
В последнее время папилломавирусная инфекция привлекает особое внимание в связи с ролью этой группы вирусов в развитии рака. В 2008 г. Нобелевской премией по медицине было отмечено доказательство того, что некоторые типы вируса папилломы человека (ВПЧ) способны вызывать рак шейки матки. По Handley J.M., et al. (1994), к ВПЧ-поражениям относят: клинические формы — аногенитальные бородавки (остроконечные кондиломы, вульгарные бородавки), симптоматические внутриэпителиальные неоплазии на ранних стадиях при отсутствии дисплазии (плоские кондиломы); субклинические формы — бессимптомные внутриэпителиальные неоплазии при отсутствии дисплазии; латентные формы (отсутствие морфологических или гистологических изменений на фоне обнаружения ДНК ВПЧ).
Лечение аногенитальных ВПЧ-поражений, согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, должно быть направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса. Во всех основных рекомендациях по ведению больных с ВПЧ-инфекцией — CDC, Европейских рекомендациях, рекомендациях ВОЗ, и в том числе в рекомендациях РОДВ, приведен именно такой подход.
Роль вирусов папилломы человека (ВПЧ) в развитии множества доброкачественных и злокачественных новообразований кожи и слизистых оболочек не вызывает сомнений. Полагают, что все 500тыс. случаев рака шейки матки, ежегодно диагностируемые в мире, вызваны генитальной ВПЧ-инфекцией (Bulletin Word Health Organization, 2007).
В различных клинических рекомендациях и протоколах подробно описываются методы лечения именно клинических проявлений ВПЧ, но обходится стороной вопрос так называемого вирусоносительства или бессимптомного выделения вируса. Причем вопросу тактики врача при бессимптомном выделении вируса у пациента ВПЧ уделяется мало внимания не только в практических рекомендациях, но и в научно-исследовательской литературе.
Мы предлагаем свой подход к этой проблеме.
Прежде всего мы исходим из того, что наш долг — ставить во главу угла интересы пациента. Если он встревожен наличием ВПЧ и желает избавиться от этой инфекции, мы должны постараться успокоить его и обсудить все имеющиеся в настоящее время возможности лечения. В противном случае нам будет трудно рассчитывать на доверие с его стороны.
Мы считаем, что такое обсуждение должно состоять из 3 частей.
1. Информирование пациента относительно характера течения и последствий инфекции.
2. Методы профилактики рака шейки матки (при выявлении вируса у женщин).
3. Возможности воздействия на ВПЧ с целью его элиминации.
1. ИНФОРМИРОВАНИЕ ПАЦИЕНТА
При первом же визите необходимо рассказать человеку о возможных рисках, связанных с инфицированием ВПЧ. Однако консультирование нужно проводить очень осторожно, чтобы не спровоцировать у человека развитие психоневроза и канцерофобии.
Пациент с выявленным ВПЧ должен знать о своей потенциальной заразности для неинфицированных лиц, поэтому ему надо рекомендовать использовать презерватив при половых контактах и обязательно информировать своего полового партнера о вирусоносительстве.
Следует проинформировать пациентов о том, что возможно самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
2. ПРОФИЛАКТИКА РАКА ШЕЙКИ МАТКИ (ПРИ ВЫЯВЛЕНИИ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА У ЖЕНЩИН)
Всем женщинам, инфицированным ВПЧ, следует провести кольпоскопическое исследование, в том числе с окраской раствором Люголя или раствором уксусной кислоты, а также цитологические тесты по Папаниколау. Периодичность обследований обсуждается с гинекологом в зависимости от степени онкогенности выявленных вирусов и результатов кольпоскопии и цитологии. Цитологические исследования следует проводить не реже, чем 1 раз в 6 месяцев. Для женщин старше 26 лет этот подход является практически единственным способом профилактики рака шейки матки.
Имеются публикации об эффективности российского препарата индинол для профилактики рака шейки матки у женщин, инфицированных ВПЧ. Однако контролированных плацебо-исследований не проводилось.
3.ВОЗДЕЙСТВИЕ НА ВПЧ
Наиболее дискуссионным является вопрос о воздействии на выделение вируса, поэтому остановимся на нем подробнее. Врач, безусловно, должен информировать пациента о том, что в настоящее время нет методов, позволяющих достоверно и с высокой степенью вероятности устранить вирус из организма.
Необходимость проведения лечебных мероприятий обсуждается индивидуально с каждым пациентом. Желательно, чтобы врач принимал решение о проведении лечения с целью устранения ВПЧ в отсутствие клинических проявлений только после подписания пациентом информированного согласия, во избежание возможных последующих недоразумений.
Теоретически, учитывая локализацию вируса в эпителиальных клетках и то, что происходит постоянное слущивание эпителия, можно предположить, что ВПЧ может исчезнуть вместе со старыми эпителиальными клетками. Видимо, именно этим объясняются случаи самопроизвольного исчезновения ВПЧ. Между тем очевидно, что элиминации ВПЧ из организма с гораздо большей эффективностью можно добиться при активизации противовирусного иммунитета, ингибирующего размножение ВПЧ и его внедрение в другие клетки. Доказать возможность достижения такого результата на практике можно только путем проведения соответствующих специальных исследований.
Потенциально возможны 3 способа инфицирования: от матери к ребенку (трансплацентарно; во время родов, в том числе путем кесарева сечения; возможно — через слюну или грудное молоко), посредством передачи вируса воздушно-капельным или контактно-бытовым путями. Cчитается, что ВПЧ-инфекция передается в основном половым путем, что объясняет ее широкую распространенность среди сексуально активного населения. В частности, в США ежегодно диагностируют 6,2 млн новых случаев генитальной ВПЧ-инфекции (Steinbrook R., 2006).
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность. Этого можно достичь как неспецифическими, так и специфическими методами.
К неспецифическим относят различные способы укрепления защитных сил организма, так называемый здоровый образ жизни: правильное питание, профилактический прием витаминов, биологически активных добавок.
Отдельный вопрос — проведение гомеопатического лечения. Но поскольку об этих способах часто упоминается в научно-популярной литературе, в рамках данной статьи мы их комментировать не будем.
Установлено, что при применении интерферонов снижается количество вирусной ДНК (по данным ПЦР) у пациентов в очагах поражения [Arany I., et al., 1995].
Интерферон применяют местно и системно (подкожно, внутримышечно, внутривенно или ректально).
В большинстве исследований была показана невысокая эффективность наружного применения интерферона [Keay S., et al, 1988] при наличии клинических проявлений, а при лечении больных с субклиническими очагами ВПЧ-инфекции и цервикальных неоплазиях (ЦИН) были получены обнадеживающие результаты [Gross G., 1996].
По данным различных авторов, при системном применении альфа-интерферона в дозе от 1,5 до 3 млн МЕ внутримышечно или подкожно через день в течение 4 недель в качестве монотерапии у 11—100% пациентов наблюдается полное исчезновение бородавок [Gross G., et al., 1986; Zwiorek L., et al., 1989], что свидетельствует о возможном ингибирующем влиянии препаратов интерферонов на ВПЧ.
При системном применении интерферонов побочными эффектами обычно являются гриппоподобные состояния, выраженность которых зависит от полученной дозы [Handley, et al., 1994]. Эти побочные явления можно ослабить приемом нестероидных противовоспалительных препаратов.
Считается возможным самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
На российском рынке представлен широкий выбор интерферонов различных производителей, как отечественных, так и зарубежных, — генферон, виферон, кипферон, реаферон, роферон-А, интрон А, реальдирон и т.д. Предпочтительнее назначать рекомбинантные, а не человеческие интерфероны.
При назначении интерферонов надо учитывать не только частые побочные реакции, но и то, что их введение может подавлять синтез собственных эндогенных интерферонов. Поэтому в отсутствие клинических проявлений интерфероны применяют только в том случае, когда о целесообразности такого назначения свидетельствуют результы исследования иммунного статуса. Следует также отметить и высокую стоимость качественных препаратов интерферона.
Воздействовать на противовирусный иммунитет можно с помощью индукторов эндогенного интерферона и других активаторов иммунитета. На российском фармацевтическом рынке представлено много иммуноактивных препаратов, которые, согласно инструкции производителя или рекомендациям исследователей, можно применять для комбинированного лечения аногенитальных бородавок (в сочетании с различными деструктивными методами). На основании этого их можно рекомендовать для противовирусной терапии при отсутствии клинических проявлений.
Гепон — синтетический олигопептид, состоящий из 14 аминокислотных остатков, относится к группе иммуномодуляторов. Препарат показан для повышения эффективности иммунной защиты от инфекций, лечения и профилактики оппортунистических инфекций, вызванных бактериями, вирусами или грибами. Гепон оказывает иммунофармакологическое и противовирусное действие:
У больных с ослабленной иммунной системой гепон:
Так, например, после удаления очагов ВПЧ-поражений любым деструктивным методом, аппликации гепона (от 3 до 6 аппликаций через день) позволяют ускорить процесс заживления и снизить уровень рецидивирования. Системно препарат применяют по 2 мг перорально 3 раза в неделю. Курс можно повторять с интервалом в 1 неделю [Соловьев А.М., 2003].
Изопринозин (инозин пранобекс) — противовирусное средство с иммуномодулирующими свойствами. Препарат, индуцируя созревание и дифференцирование Т-лимфоцитов и Т1-хелперов, потенцируя индукцию лимфопролиферативного ответа в митогенных или антиген-активных клетках, нормализует дефицит или дисфункцию клеточного иммунитета. Изопринозин моделирует цитотоксичность Т-лимфоцитов и натуральных киллеров, функцию Т8-супрессоров и Т4-хелперов, а также повышает количество иммуноглобулина G и поверхностных маркеров комплемента. Препарат повышает синтез интерлейкина-1 (ИЛ-1) и интерлейкина-2 (IL-2), регулирует экспрессию рецепторов IL-2, существенно увеличивает секрецию эндогенного γ-интерферона и уменьшает продукцию интерлейкина-4 в организме. Изопринозин усиливает действие нейтрофильных гранулоцитов, хемотаксис и фагоцитоз моноцитов и макрофагов. Кроме этого, он оказывает прямое противовирусное действие, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной и-РНК. Одним из показаний для применения препарата являются инфекции, вызванные вирусом папилломы человека: остроконечные кондиломы, папилломавирусная инфекция вульвы, вагины и шейки матки (в составе комплексной терапии).
Для женщин старше 26 лет цитологическое исследование слизистой шейки матки, проводимое 2 раза в год, является практически единственным способом профилактики рака шейки матки.
В литературе описаны различные схемы и результаты применения изопринозина.
При инфекциях, вызванных ВПЧ, изопринозин назначают по 3 г/сут (2 таблетки 3 раза в сутки) как дополнение к местной терапии или хирургическому вмешательству на протяжении 14—28 дней для пациентов с низкой степенью риска или 5 дней в неделю последовательно в течение 1—2 недель в месяц в течение 3 мес для пациентов с высокой степенью риска.
Известно о зарубежном опыте применения инозин пранобекса в качестве терапии, дополняющей деструкцию аногенитальных бородавок [Davidson-Parker J., et al., 1988]. Препарат назначали по 1 г 3 раза в сутки в течение 14—28 дней.
В работе Забелева А.В. и соавт. (2005) показано исчезновение атипичного эпителия у женщин с ВПЧ-ассоциированными плоскоклеточными интраэпителиальными поражениями низкой степени после проведения курсов лечения изопринозином. Препарат назначали по 1 грамму 3 раза в сутки в течение 5 дней, 3 курса с интервалом в 1 месяц. В исследовании, проведенном Sun Kuie Tay (1996), показаны аналогичные результаты — улучшение морфологической картины эпителия вульвы. Инозин пранобекс назначали по 1 г 3 раза в сутки в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, тогда как в группе, принимавшей плацебо, только у 16,7%. О прекращении выделения ВПЧ у 65,6% больных после проведения комбинированной терапии (изопринозин + деструкция очагов) ЦИН низкой степени сообщает Прилепская В.Н. (2007). При использовании только деструкции очагов этот результат был достигнут у 46,9% больных. Изопринозин назначали за 7—10 дней до проведения деструкции по 1 г 3 раза в сутки в течение 5 дней. В исследовании Шевниной И.В. (2009) показаны похожие результаты — прекращение выделения ВПЧ у 77% больных при комбинированной терапии женщин с ЦИН и аногенитальными бородавками. Изопринозин назначали по 1 г 3 раза в сутки в течение 10 дней, затем по 0,5 г 3 раза в сутки в течение 20 дней.
Для решения поднятой в этой статье проблемы интересным является факт прекращения обнаружения ВПЧ из очагов поражения в ходе проводимой комбинированной терапии с применением иммуномакса. При проведении вирусологического обследования пациентов до лечения в среднем у 70% выявлялся ВПЧ в очагах поражения. После проведенного комбинированного лечения в ходе контрольного наблюдения у 45% больных было отмечено прекращение выделения ВПЧ [Перламутров Ю.Н. и соавт., 2003]. Полученные результаты свидетельствуют, что проведение терапии иммуномаксом влияет на противовирусный иммунитет и приводит к прекращению не только рецидивов, но и выделения ВПЧ из очагов поражения. В связи с этим в перспективе иммуномакс можно будет использовать не только для лечения остроконечных кондилом, но и для предотвращения вирусовыделения у больных без клинических проявлений инфекции.
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ С ИММУНОМОДУЛИРУЮЩИМ ДЕЙСТВИЕМ
Панавир — растительный полисахарид, полученный из растения Solanum tuberosum, относится к классу высокомолекулярных гексозных гликозидов сложного строения с молекулярной массой 1000 кД. В настоящее время в России он является одним из самых популярных препаратов, использующихся для противовирусной терапии. Причем лечение папилломавирусной инфекции является лишь одним из показаний к его применению.
После однократной инъекции панавира в 2,7—3 раза повышается уровень лейкоцитарного интерферона, что соответствует воздействию терапевтических доз интерферона [Колобухина и соавт., 2005].
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность.
Со степенью распространенности неопластического процесса связывают эффективность препарата в отношении прекращения вирусовыделения [Иванян А.Н. и соавт., 2004]. Так, после проведения комплексного лечения у пациенток с 1-й степенью распространенности процесса вирус не выявлялся в 90,5%, при 2-й степени — в 71,1%, при 3-й степени — в 39,6%, при 4-й степени — в 9,4% случаев. Достоверное снижение вирусной нагрузки с 398,2 RLU до 176,2 RLU (p<0,05) через 1 месяц после окончания монотерапии панавиром ВПЧ-инфекции отмечает Мелехова Н.Ю. (2005).
Продолжаются исследования противовирусной активности панавира с целью установления мишени, объясняющей его высокую противовирусную активность, а также по расширению показаний к его применению. Но уже сейчас можно говорить о том, что он является одним из наиболее перспективных противовирусных агентов с доказанным иммуномодулирующим действием.
В этой статьей мы начали дискуссию о целесообразности попытки устранения папилломавирусной инфекции при отсутствии ее клинических проявлений. Существующие рекомендации по наблюдению таких пациентов могут не удовлетворить тех из них, которые хотели бы получить квалифицированную помощь в устранении этой инфекции. Поэтому мы предлагаем 3-х этапную тактику ведения таких больных: консультирование, цитологический контроль у женщин и использование противовирусных препаратов с иммуномодулирующим действием.
В последние годы увеличивается заболеваемость папилломавирусной инфекцией. По данным ВОЗ, ежегодно в мире около 250 000 женщин с ВПЧ-инфекцией умирает от рака шейки матки. На этом фоне поиск эффективных методов лечения этой инфекции становится чрезвычайно важным. Проблема ее диагностики и лечения привлекает внимание врачей различных специальностей: дерматологов, гинекологов, урологов, онкологов, иммунологов, вирусологов, патоморфологов. На данный момент большинство ученых пришли к единому мнению – с проявлениями вируса папилломы человека можно бороться при помощи применения иммуномодуляторов с противовирусной активностью.
Что такое иммуномодуляторы
К иммуномодулирующим средствам относятся препараты химической и биологической природы, способные модулировать (угнетать или стимулировать) реакции иммунитета. При этом иммунологический эффект иммуномодуляторов зависит от исходного состояния иммунитета человека: эти лекарственные средства понижают повышенные и повышают пониженные показатели иммунитета. Особенно данный постулат относится к препаратам интерферона. К иммунотерапии также относятся методы лечения, основанные на использовании иммунотропных средств при заболеваниях, в патогенезе которых имеются нарушения, затрагивающие систему иммунитета.
Основной критерий для назначения иммуномодуляторов – это клиническая картина заболевания (острого или хронического инфекционно-воспалительного процесса), который сопровождается снижением параметров иммунитета и трудно поддается лечению. В этом случае иммуномодуляторы играют роль главного помощника, который способствует эффективной терапии и избавляет от проявлений многих заболеваний.

Поскольку ВПЧ-инфекция тоже относится к недугам, с которыми достаточно непросто бороться, а исход лечения зависит от состояния иммунитета, при лечении этой инфекции широко применяют различные иммуномодуляторы.
Иммуномодуляторы при ВПЧ: список препаратов
Препараты, которые являются синтетическими комплексными производными пурина
Эта группа иммуномодуляторов, применяющихся при лечении проявлений вируса папилломы человека, обладают иммуностимулирующей активностью и неспецифическим противовирусным действием. Они восстанавливают активность лимфоцитов, которые являются главными клетками иммунной системы. Клинически доказано, что именно низкая активность лимфоцитов является предрасполагающим фактором к яркому развитию клинических проявлений ВПЧ. Также этот вид препаратов повышает функционирование натуральных киллеров и так называемыхТ-хелперов – T-лимфоцитов, главной функцией которых является координация иммунного ответа.
Некоторые из препаратов этой группы имеют обширный список побочных действий, включающих проблемы с работой ЖКТ, печени и желчевыводящих путей. Также возможны побочные реакции в виде головной боли, сонливости, бессонницы, зуда и болей в суставах. Среди противопоказаний – детский возраст до 3 лет, беременность, заболевания почек и повышенная чувствительность к компонентам препарата.
Препараты с действующим веществом глюкозаминилмурамилдипептид (ГМДП)
ГМДП – это фрагмент оболочки патогенных бактерий, вызывающих инфекционно-воспалительные заболевания различных органов и систем. При попадании этого фрагмента в организм иммунная система воспринимает его как чужеродный патогенный агент и сразу же начинает выработку антител. Благодаря этому происходит общая активация всей иммунной системы, что способствует выздоровлению или же снижению частоты рецидивов вирусных инфекций, в том числе ВПЧ.
Среди побочных эффектов – повышение температуры тела до субфебрильных и фебрильных значений, также возможна диарея. Препараты этой группы противопоказаны при нарушениях обмена веществ и женщинам в период беременности и грудного вскармливания.
Препараты, содержащие в качестве активных компонентов натуральное растительное сырье
Эта группа препаратов была создана на основе открытия лауреата Нобелевской премии Н.Н. Семенова о мощных иммуностимулирующих свойствах биологически активных веществ, содержащихся в клетках растений. Экстракты из растений и вспомогательные компоненты усиливают неспецифическое звено иммунитета, что повышает устойчивость организма человека к различным вирусным и некоторым бактериальным инфекциям. Иммуномодулирующий эффект активизирует лейкоциты, что особенно важно при борьбе с хроническими и затяжными воспалительными процессами.
При применении этих препаратов возможны аллергические реакции. Среди противопоказаний к применению – заболевания выделительной системы, беременность, период лактации и детский возраст до 18 лет.
Противовирусные препараты против ВПЧ
После заражения клетки вирус может пребывать в свободном виде или проникает в геном клетки. В любом случае вирус изменяет нормальные клеточные процессы. И вместо того, чтобы производить все необходимое для своей жизнедеятельности, клетка обеспечивает механизмы синтеза вирусных молекул ДНК, которые в дальнейшем будут использоваться для создания новых вирусных частиц. Но не всегда вирусы способны вызывать заболевание. При адекватном иммунном ответе организм самостоятельно избавляется от вируса. При неэффективном иммунном ответе организма возможно долгое носительство вируса, что может привести к доброкачественным или злокачественным, в зависимости от типа вируса, проявлениям болезни.
Чтобы разорвать цепь бесконечного размножения вируса и последующего развития заболевания, признана необходимость лечения ВПЧ-инфекции иммуномодуляторами с противовирусной активностью, т.к. на сегодняшний день не разработано ни одного противовирусного от ВПЧ, действующего прицельно на вирус папилломы человека.
ВИФЕРОН при ВПЧ
Существуют ли препараты, которые борются с вирусами и одновременно способствуют восстановлению иммунной системы? Безусловно, такие препараты есть. Одним из таких препаратов, способствующих восстановлению иммунной системы и обладающих широким спектром противовирусной активности, является препарат ВИФЕРОН.
Рекомбинантный интерферон альфа-2b, который входит в состав этого препарата, препятствует синтезу вирусных ДНК и блокирует размножение вируса, способствует восстановлению иммунной системы, а также обладает антипролиферативными свойствами. Он идентичен человеческому интерферону альфа-2b, но производится с помощью современных технологий без использования донорской крови.
Препарат, который выпускается в виде свечей, геля и мази, разработан в результате фундаментальных исследований в области иммунологии, доказавших, что в присутствии антиоксидантов (витамины С, Е) усиливается противовирусное действие интерферона.
Способ применения и дозировки свечей ВИФЕРОН при ВПЧ
ВИФЕРОН Свечи производятся в виде ректальных суппозиториев пулевидной формы бело-желтого или желтого цвета. В процессе лечения препарат подавляет активность вирусов и повышает эффективность собственного иммунного ответа организма на патогенные микроорганизмы.
Препарат в виде Свечей (суппозиториев) можно применять при беременности (с 14-й недели), а также в период грудного вскармливания и при лечении детей.

Рекомендуемая доза для взрослых – ВИФЕРОН 500 000 ME по 1 суппозиторию 2 раза/сут через 12 ч ежедневно в течение 5-10 суток. По клиническим показаниям терапия может быть продолжена.
Можно ли применять ВИФЕРОН Свечи при ВПЧ вагинально?
Противовирусные суппозитории ВИФЕРОН выпускаются только для ректального использования. Вагинальное использование не предусмотрено в инструкции к лекарству. Применение в комплексной терапии препарата направлено на повышение уровня иммунной защиты организма в целом. Поэтому введение свечей непосредственно в очаг инфекции не требуется.
В прямой кишке присутствует множество кровеносных сосудов, всасывающих лекарство, непосредственно введенное в полость прямой кишки. Кровь от прямой кишки, минуя печень, непосредственно попадает в большой круг кровообращения. Таким образом обеспечивается системное действие препарата. Более того, печень не претерпевает дополнительной нагрузки, что является неоспоримым преимуществом препаратов с ректальным способом введения.
Лечение слизистой при ВПЧ у мужчин
При лечении проявлений вируса папилломы на слизистой у мужчин также применяются суппозитории ректальные ВИФЕРОН, которые помогут избавиться от неприятных проявлений вируса и будут способствовать укреплению иммунной системы.
Без консультации уролога не рекомендуется применять никакие лечебные кремы и мази, заниматься самолечением или вообще отказываться от терапии, назначенной врачом. При отсутствии лечения кондиломы могут разрастаться, охватывая все новые территории и поражая мочеиспускательный канал и другие внутренние органы. Предупредить развитие осложнений можно при помощи своевременного обращения к специалисту и применения противовирусных препаратов.
Альтернативные методы лечения ВПЧ на коже
Медикаментозная терапия проявлений вируса папилломы человека прекрасно сочетается с удалением новообразований в виде бородавок, папиллом на теле и кондилом, которые располагаются у мужчин и женщин в аногенитальной области (включая кожу гениталий, анус и слизистую оболочку влагалища, шейки матки, головки полового члена, прямой кишки).
Сегодня существует несколько продуктивных методов избавления от указанных новообразований, которые в большинстве своем безболезненны, безопасны и не оставляют шрамов.
Методы удаления папиллом и кондилом
Хирургическое иссечение
В настоящее время подобное вмешательство применяется нечасто, в основном используется при лечении злокачественных новообразований, когда необходимо широкое иссечение.
Медикаментозное удаление (прижигание) при ВПЧ
Это удаление наростов на коже при помощи лекарственных препаратов – растворов кислот, щелочей, солей. Новообразования на коже удаляются с помощью этих препаратов путем прижигания. Как правило, на месте удаления образуется корочка, которая отпадает в течение 5-7 дней. Полное заживление тканей происходит в течение 10-14 дней. При множественных новообразованиях могут потребоваться дополнительные процедуры.
Лазерное удаление папилломы
При этом способе удаления папилломы и кондиломы сжигаются при помощи луча лазера. При удалении не повреждаются соседние участки. После процедуры обычно остается микроскопичная ранка, которая заживает в течение 2-3 недель. Удалить лазером можно как единичные, так и множественных образования, расположенные на лице и теле, в том числе в деликатных местах (на веках, подмышками, в промежности).
Радиоволновое удаление при ВПЧ
Криодеструкция папиллом
Криодеструкция папиллом заключается в точечном воздействии на образование очень низкой температурой (около -196° С). Для этого обычно применяется жидкий азот и специальная металлическая точечная насадка, выполняющая роль проводника. Во время такой процедуры клетки папилломы погибают. Здоровые ткани в области ее формирования покрываются небольшой коркой, которая через небольшой промежуток времени отваливается.
Электрокоагуляция папиллом при ВПЧ
Этот метод предусматривает удаление патологических тканей путем воздействия на них электрическим током. Процедуру проводят при помощи специальных аппаратов, оснащенных электродом или петлей, которые нагреваются под воздействием электрического тока до высоких температур. На месте удаленной бородавки также образуется корочка, которая со временем отпадает.
Все методы удаления папиллом и кондилом имеют свои плюсы и минусы, оценить которые можно только со своим лечащим врачом с учетом индивидуальных особенностей пациента. Применение любых рецептов народной медицины, найденных на просторах интернета, также допускается только после консультации со специалистом.
Таблеток и процедур, которые раз и навсегда избавят от вируса папилломы человека, пока не существует. Однако уже сегодня существуют препараты и методы лечения, которые помогут сократить рецидивы проявлений инфекции или вообще забыть о них.
Читайте также:

