Что общего между вирусами и прокариотами
Обновлено: 25.04.2024
• В составе клеточной оболочки археев находятся уникальные компоненты и отсутствует пептидогликан клеточной стенки
• По характеру основных процессов метаболизма и наличию некоторых структур, например жгутиков, археи напоминают бактерии
• По характеру репликации ДНК, транскрипции и трансляции археи напоминают клетки эукариот, однако в регуляции активности генов у них участвует много белков, напоминающих бактериальные
Прокариоты подразделяются на две группы, в настоящее время известные под названиями бактерии и археи. Вначале оказалось, что различия между этими группами проявляются в последовательности рРНК, однако они также отмечаются при сопоставлении их важнейших физиологических и биохимических характеристик. Особенно у археев, как следует из рисунка ниже. проявляется ряд общих свойств с клетками эукариот. Более того, хотя археи, несомненно, относятся к прокариотам, поскольку не обладают ядерной мембраной, они отличаются от хорошо известных бактерий по своим фундаментальным свойствам. В особенности это проявляется в отсутствии пептидогликана в их клеточной стенке и наличии в мембранах липидов, связанных с глицерином эфирной связью. Вообще говоря, об архе-ях мы знаем гораздо меньше, чем о бактериях.
Большая часть хорошо изученных видов археев характеризуется универсальностью метаболизма и способностью существовать в экстремальных условиях. Некоторые из них могут расти при очень высоких температурах (> 80 °С). Очевидно, что лишь один белок, обратная гираза, является специфичным для гипертермофильных археев. Таким образом, способность перекручивать ДНК может представлять собой единственный критический фактор, необходимый для адаптации этих микроорганизмов к условиям высокой температуры. Многие виды археев приспособлены к существованию в условиях экстремальных величин pH (ацидофилы и алкалофилы) или концентрации солей (галофилы).
К организмам, обладающим особенностями метаболизма, относятся метаногены (например, Methanococcus janaschii), которые в анаэробных условиях используют двуокись углерода, соединения содержащие метальную группу или ацетат; термофильные восстановители серы (например, Archaeglobus fulgidis) которые в качестве акцепторов электронов при дыхании используют окисленные соединения серы; и галофилы (например, Halobacterium salinarum), которые адаптировались к высокой концентрации соли. Crenarchaeotes (например, Sulfolobus solfataricus) представляют собой совершенно самостоятельную ветвь археев. Наиболее изученными представителями этой ветви являются термофилы, зависимые от источников серы. Филогенетическое родство основных групп археев представлено на рисунке ниже.
В настоящее время полностью отсеквенирован геном многих представителей археев. Так же как бактерии, археи имеют относительно компактные кольцевые хромосомы размерами порядка 1,5-3 мнп. Секвенирование генома позволило рассчитать способность каждого организма к кодированию белков. Исходя из рассчитанного набора белков, можно прийти к выводам относительно структуры и функций археев. В целом, больше всего сходства между археями и бактериями проявляется в клеточной структуре и в организации генома. У архей и бактерий существует много таких общих компонентов мембран и клеточной оболочки, как АВС транспортеры и капсулярные полисахариды. Археи также напоминают бактерии по характеру основных метаболических процессов и по наличию таких адаптивных функций, как подвижность, обусловленная наличием жгутиков, и хемотаксис.

Археи обладают общими свойствами с бактериями и эукариотами.
Наряду с этим, в геноме археев содержится много инсерционных последовательностей и экстрахромосомальных элементов (например, плазмид), которые напоминают находящиеся в геноме бактерий.
Аппарат транскрипции у археев достаточно сложен, и основная РНК-полимераза и факторы инициации транскрипции напоминают таковые у эукариот. Так, основная РНК полимераза обычно состоит из 11 субъединиц, большинство которых у бактериальных полимераз отсутствует. Инициация транскрипции контролируется факторами, в основном гомологичными соответствующим факторам у эукариот. Основным фактором, участвующим в распознавании базального промотора, является белок, связывающийся с последовательностью ТАТА (ТВР). У археев отсутствует сигма-фактор, являющийся ключевым участником в инициации транскрипции и в узнавании промотора у бактерий. В настоящее время мы еще мало знаем о регуляции транскрипции у археев.
Однако удивительно, что последовательности генома археев, вероятно, содержат много регуляторов транскрипции, близких к таковым бактерий. Это позволяет предполагать, что активация и репрессия генов у археев могут осуществляться так же, как и у бактерий, хотя сама по себе полимераза напоминает соответствующий фермент клеток эукариот.
Большинство археев содержит основной белок деления FtsZ, не не содержит прочих бактериальных или эукариотических белков деления. Более того, Crenarchaeota отличаются от остальных археев тем, что не содержат FtsZ. Это позволяет предполагать, что механизм клеточного деления у археев может сильно отличаться от характерного для всех прочих организмов.
На основании вышесказанного, археи можно рассматривать как некие гибриды со смешанными свойствами, характерными как для эукариот, так и для бактерий, но также обладающие некоторыми уникальными свойствами. Такие свойства археев, вероятно, отражают их положение в системе эволюции. В основном клеточная организация археев напоминает таковую прокариотической клетки, однако многие фундаментальные клеточные события, особенно связанные с реализацией генетической информации, гораздо больше похожи на соответствующие процессы у эукариот, чем у бактерий. В настоящее время исследователи проявляют большой интерес к исследованиям некоторых из этих процессов, поскольку в результате они должны получить много новых сведений о процессе эволюции эукариот. Более того, поскольку эти процессы протекают проще, чем у эукариот, не исключено, что некоторые археи в экспериментальном плане окажутся проще и будут все больше использоваться в качестве модельных систем в исследовании таких процессов, как репликация и транскрипция ДНК.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Обзор
cGAS и виперины — редкие примеры известных противовирусных систем прокариот, унаследованных эукариотами
Автор
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Что мы знаем об иммунитете прокариот?
Что объединяет грипп [1], оспу [2], бешенство [3], краснуху [4], геморрагическую лихорадку Эбола и COVID-19? Правильно, все эти заболевания человека вызываются вирусами. Есть названия и у некоторых вирусных инфекций других многоклеточных организмов: чума собак, паралич сверчка, табачная мозаика. Однако никто не придумал имена инфекционным заболеваниям прокариот. Между тем, вирусы и им изрядно досаждают. Разумеется, и прокариоты, и эукариоты обзавелись целым арсеналом средств для борьбы с паразитами, причем о защитных системах последних, а особенно об иммунной системе человека, науке известно куда больше, и информация о принципах работы врожденного и приобретенного иммунитетов давно вошла в школьный учебник.
А что у прокариот? Любой молекулярный биолог знает системы рестрикции-модификации и CRISPR-Cas, поскольку их компоненты нашли широкое применение в лабораторной практике [5], [6]. Однако это далеко не все антивирусные приспособления прокариот, известные ученым. Долгое время поиск был сосредоточен на Escherichia coli и еще нескольких модельных бактериях, но даже в такой узкой группе микроорганизмов удалось обнаружить несколько антивирусных систем с различными механизмами действия. Настоящую революцию в поиске новых антифаговых систем произвело обнаружение защитных островков (defence islands) — участков геномов прокариот, которые кодируют компоненты защитных систем [7]. Таким образом, если какой-то ген Х находится вблизи генов уже известных защитных систем в большом количестве прокариотических геномов, можно предположить, что Х тоже кодирует какой-то белок, участвующий в борьбе с вирусами. Поскольку количество прочитанных прокариотических геномов в последнее время растет как на дрожжах, этот подход позволяет ученым ежегодно находить новые гены, вовлеченные в защиту от вирусов . Так, в одной из статей 2018 года авторы описали сразу девять новых защитных систем [8], а в 2020 году одновременно две группы сообщили об обнаружении антифаговой активности у некоторых ретронов — крайне странных генетических элементов прокариот, казавшихся ранее абсолютно бесполезными [9], [10].
Еще в 2011 году обнаружили, что в защитных островках часто находятся гены, кодирующие белки-аргонавты , и с тех пор были получены убедительные свидетельства их роли в защите клеток от фагов [7], [15]. Эта находка интересна тем, что в отличие от остальных известных нам антивирусных систем прокариот, аргонавты широко распространены и среди эукариот. Странно, что до недавнего времени белки-аргонавты были единственным подобным примером. К счастью, два недавних открытия устранили это недоразумение.
cGAS — универсальный сигнальный компонент антивирусных систем
Узнавание вирусной нуклеиновой кислоты — важнейший этап активации врожденного антивирусного иммунитета у животных. Один из рецепторов, узнающих двунитевую ДНК в цитоплазме, получил название cGAS (cyclic GMP-AMP synthase), поскольку после связывания мишени начинает синтезировать циклический динуклеотид cGAMP (циклический гуанозинмонофосфат-аденозинмонофосфат, цГАМФ) из АТФ и ГТФ. cGAMP в свою очередь запускает сигнальный каскад, который активирует синтез интерферонов, необходимых в борьбе с вирусом [17].
Ученые из Weizmann Institute of Science в Израиле проанализировали 38 167 микробных геномов и обратили внимание, что из 637 прокариотических гомологов гена cGAS 417 (65,5%) находятся в защитных островках в составе оперона из 2–4 генов (рис. 1) [18]. Предположив, что такая локализация может указывать на антифаговую активность, они решили проверить, будет ли cGAS обеспечивать иммунитет штамму E. coli, в норме не содержащему такой системы. Для этого были выбраны два оперона: один из штамма E. coli TW11681, а другой из холерного вибриона Vibrio cholerae El Tor. Оказалось, что оба оперона повысили устойчивость лабораторного штамма E. coli к некоторым бактериофагам, то есть действительно функционируют как защитная система. Ученые дали этой системе название CBASS (cyclic-oligonucleotide-based antiphage signalling system).

Рисунок 1. Опероны, кодирующие cGAS, находятся в защитных островках. Желтым показаны известные системы противофаговой защиты.
Теперь предстояло понять механизм действия CBASS. Первым делом исследователи проверили, появляется ли cGAMP в клетках с CBASS в ответ на фаговую инфекцию. Для этого они проанализировали состав клеточных лизатов методом масс-спектрометрии. Как и предполагалось, cGAMP обнаружился только в клетках, содержащих систему CBASS, и только после заражения фагом.
Интересно, что в обоих исследованных оперонах ген cGAS соседствовал с геном фосфолипазы CapV, которая активируется cGAMP’ом и расщепляет липиды клеточной мембраны. Выходит, что зараженная вирусом бактерия включает систему самоубийства.
Такое поведение — не редкость в мире прокариот: известен целый класс антифаговых систем под названием Abi (abortive infection), принцип действия которых заключается в том, что клетка, обнаружив фаговую инфекцию, совершает суицид до того, как фаг успеет размножиться. Таким образом, ценой жизни одной клетки достигается защита целой популяции.
Для доказательства функционирования CBASS по механизму абортивной инфекции клетки смешали с разными концентрациями фаговых частиц. В случае, когда на пять бактериальных клеток приходилась одна фаговая частица (multiplicity of infection, MOI = 0,2), то есть зараженной оказывалась лишь часть клеток, популяция бактерий, обладающих CBASS, успешно справлялась с инфекцией, а когда концентрация фаговых частиц вдвое превышала концентрацию бактерий (MOI = 2), то есть заражались сразу все клетки, лизис культуры произходил еще быстрее, чем в штамме без CBASS (рис. 2). Это означает, что суицидальная система CBASS в первом случае спасла популяцию от полного уничтожения, а во втором спровоцировала немедленную гибель всех клеток в культуре.

Рисунок 2а. Графики роста культуры E. coli в зависимости от наличия CBASS и фаговой инфекции

Рисунок 2б. Схема действия CBASS: в ответ на заражение cGAS продуцирует cGAMP, который включает фосфолипазу, разрушающую клеточную мембрану
Хотя ученым и удалось обнаружить новую защитную систему прокариот, многое всё еще непонятно. Во-первых, остается загадкой, что является триггером для активации cGAS. Вряд ли это двунитевая ДНК, как у эукариот, ведь у прокариот ядра нет, и отличить геномную ДНК от вирусной не так-то просто. Во-вторых, неясно, во всех ли случаях CBASS ведет себя как система абортивной инфекции. Дело в том, что вместо фосфолипазы в состав CBASS могут входить другие белки с неизвестной активностью.
Так или иначе, cGAS заслужил место в ряду белков, вовлеченных в антивирусную защиту у представителей и прокариот, и эукариот.
Виперины — универсальная защита против вирусных РНК-полимераз
Виперин — один из белков, продуцируемый клетками животных в ответ на обработку интерферонами. Известно, что виперин подавляет репликацию многих вирусов за счет продукции ddhСTP (3′-deoxy-3′4′-didehydro-CTP, 3′-дезокси-3′4′-дидегидро-ЦТФ, ддгЦТФ) — производного одного из четырех нуклеотидов, из которых РНК-полимеразы строят РНК. ddhCTP узнается вирусными РНК-полимеразами и включается в состав РНК, но из-за отсутствия 3′-концевого гидроксила фермент не может продолжить синтез. Один из вирусов, с которым борется человеческий виперин — печально известный вирус Зика , [19].
Всё те же исследователи из Израиля заметили, что некоторые гомологи виперинов у прокариот кодируются генами, находящимися в защитных островках (рис. 3) [22]. Для подтверждения их участия в борьбе с вирусами ученые помещали гены 59 представителей прокариотических виперинов в лабораторный штамм E. coli и проверяли, придают ли они устойчивость к фаговым инфекциям. Около половины исследуемых белков показали хорошие результаты в защите от целого ряда фагов, что позволило заявить об открытии новой антивирусной системы прокариот.

Рисунок 3. Прокариотические виперины локализуются в защитных островках. Желтым выделены гены известных систем противофаговой защиты.
Для выяснения механизма работы виперинов ученые вновь прибегли к масс-спектрометрическому анализу клеточных лизатов после заражения фагом Т7. На этот раз искали ddhСTP, но нашли не только его: оказалось, что разные прокариотические виперины синтезируют производные разных нуклеотидов: ЦТФ, УТФ и ГТФ (рис. 4). Забавно, что среди продуктов виперинов не обнаружили производных АТФ. Сами авторы работы предполагают, что это связано с несовершенством системы детекции.

Рисунок 4. Филогенетическое дерево виперинов. Обозначены человеческий виперин и исследованные в работе прокариотические виперины, а также их субстратная специфичность.
Чтобы проверить эффект виперинов на работу фаговой РНК-полимеразы, исследователи экспрессировали под контролем промотора фага Т7 ген зеленого флуоресцентного белка GFP в клетках E. coli, кодирующих РНК-полимеразу фага Т7, и наблюдали, что клетки флуоресцируют. Но если в таких клетках экспрессировать один из генов виперинов, GFP не синтезируется (рис. 5).

Рисунок 5. Виперины подавляют активность РНК-полимеразы Т7 in vivo. МоаА — отрицательный контроль. В присутствии виперинов снижается экспрессия гена GFP, находящегося под контролем промотора Т7-РНК-полимеразы.
Полученные данные подтверждают, что прокариотические виперины борются с вирусами по тому же принципу, что и виперины животных. Хотя правильнее будет сказать, что виперины животных работают как прокариотические: филогенетический анализ свидетельствует о том, что эукариотические виперины — лишь небольшая веточка на разветвленном дереве этого белкового семейства (рис. 4).
Микробы — это модно
Людям свойственно интересоваться прежде всего собой, и уж если не видом Homo sapiens, то хотя бы животными или на худой конец растениями. Однако во все времена находились энтузиасты, исследующие необъятный мир микробов. Может, этим энтузиастам следует заняться какими-то действительно важными проблемами? Неужели мы уже все болезни научились лечить? Только вот без любителей микробов не было бы у нас ни эндонуклеаз рестрикции для клонирования, ни термофильных ДНК-полимераз для ПЦР, ни CRISPR-Cas для редактирования геномов. Если хорошенько поискать, то у прокариот непременно найдется еще много интересного и полезного! А искать сейчас удобно как никогда: информация о новых секвенированных геномах поступает непрерывным потоком, только успевай анализировать. Исследования в области прокариотических систем защиты от фагов — отличный пример такого поиска. Открытие новых антивирусных систем, общих для бактерий, архей и эукариот, показывает, что можно узнавать что-то новое про нас с вами, изучая захватывающе разнообразный мир микробов.

Обзор
Многообразие мобильных генетических элементов
Автор
Редакторы

Организмы и геномы можно таким образом расценивать как секции биосферы, по которым гены глобально циркулируют с различной интенсивностью, и в которые персональные гены и опероны могут включаться, если они предоставляют достаточные преимущества.
K. Jeon и J. Danielli [1]

Основные сокращения
МГЭ мобильные генетические элементы ГГП горизонтальный генетический перенос ОРС открытая рамка считывания, последовательность нуклеотидов между инициирующим и терминирующим кодонами гена ori T место начала переноса цепи плазмидной ДНК при мобилизации ori V место начала репликации (копирования, воспроизводства) плазмидной ДНК rep ген белка-инициатора репликации многих бактериальных плазмид
Вирусы: суперпаразиты и помощники
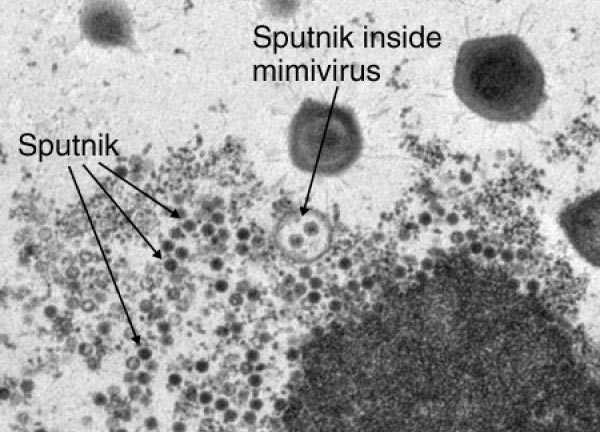
В 2012 году охарактеризовали интегрированную в ДНК мимивирусов форму вирофага и даже новый класс МГЭ — трансповироны, способные встраиваться в ДНК и мимимирусов, и вирофагов [7]. Подобно бактериофагам, переносящим гены от одних бактерий к другим, вирофаги могут играть важную роль в ГГП между разными группами вирусов и их хозяевами.
Многие профаги кодируют факторы вирулентности, трансформируя нетоксигенные бактерии в агентов-убийц: профаг CTXphi из Vibrio cholerae кодирует холерный токсин, а упомянутый выше P22 — ферменты конверсии О-антигена сальмонеллы, позволяя ей уходить от иммунного надзора.
В составе фагов обнаруживают другие МГЭ (например, транспозоны, несущие гены антибиотикорезистентности) и их модули (системы репликации и переноса конъюгативных плазмид). Самый известный пример слияния модулей фагового и плазмидного происхождения — фаг Р1, способный реплицироваться и длительно поддерживаться вне хромосомы, ничем не отличаясь от плазмиды. Профаги разных бактерий детально рассмотрены в обзоре [8].
Плазмиды — маленькие гиганты больших процессов
Плазмиды — внехромосомные двуцепочечные молекулы ДНК, способные к длительному автономному существованию в клетках прокариот и некоторых эукариот. Чаще всего плазмидные ДНК суперскручены и ковалентно замкнуты в кольцо, однако у актиномицетов и спирохет встречаются и линейные формы, что обычно сочетается с линейной организацией хромосом. Размер плазмид обычно варьирует от 0,85 т.п.н. (pRKU1 из Thermotoga petrophila) до 600 т.п.н., но у бруцелл и ризобий описаны мегаплазмиды размером более 1 млн п.н., что иногда делает вопрос их дифференцировки от дополнительных хромосом риторическим [9]. Элиминация мегаплазмид, в отличие от хромосом, обычно не вызывает фатальных для бактериальной клетки последствий, однако вместе с плазмидами могут утратиться такие важные функции, как способность к фиксации азота и формированию симбиотических клубеньков (у ризобий).
На долю плазмидной ДНК может приходиться 1–15% наследственной информации бактериальной клетки, однако известны случаи, когда плазмидами контролируется до 25% (у некоторых Archaea) и даже до 40% информации (2 мегаплазмиды размером около 1,4 и 1,6 млн п.н. у Sinorhizobium meliloti).
Плазмидами часто мобилизуются сосуществующие с ними в одной клетке неконъюгативные МГЭ (но обладающие как минимум сайтом начала переноса oriT, а чаще и генами mob) и даже хромосомы. Мобилизация генов хромосомы возможна в случае интеграции в неё конъюгативной плазмиды. Это возможно, когда в обеих молекулах присутствуют одинаковые инсерционные последовательности (IS-элементы), обеспечивающие гомологичную рекомбинацию (типичный пример — F-фактор E.coli). Однако интеграция может быть и RecA-независимой, если плазмида кодирует тирозиновую интегразу (плазмиды стрептомицетов pSE101, pSAM2 и псевдомонад pKLK106). В этом случае интеграция чаще происходит в гены тРНК, но в некоторых хозяевах эта закономерность нарушается [3].
Транспозоны — универсальные генетические челноки
Транспозоны — МГЭ, перемещающиеся как в пределах одной молекулы ДНК, так и между разными репликонами одного генома (конъюгативные транспозоны — и между геномами). Фланкированы инвертированными повторами, а в центральной части содержат гены, ответственные за перемещение. Транспозоны прокариот подразделяют на IS-элементы, Tn-элементы и Mu-подобные фаги [10].
Интегроны — природные системы клонирования и экспрессии
В процессе перемещения от одного интегрона к другому или от одного сайта в интегроне к другому сайту, генная кассета существует как автономная и неспособная к репликации двунитевая кольцевая молекула ДНК. Кассеты, захватываемые интегронами и суперинтегронами, могут содержать гены факторов патогенности, метаболических путей, детерминанты антибиотико- и дезинфектантоустойчивости или гены рестрикционных ферментов. Интеграза IntI катализирует сайт-специфическую рекомбинацию между сайтами attI и attC, в результате чего происходит интеграция или вырезание кассеты. Множество событий интеграции ведет к образованию мультикассетных рядов, в которых все кассеты фланкированы attC-сайтами. Известны хромосомные суперинтегроны, включающие до 179 генных кассет (у Vibrio cholerae), однако среди клинически значимых бактерий большинство интегронов содержит до 5–8 генных кассет. Наиболее эффективно экспрессируются кассеты, расположенные ближе к промотору, но изменение селективного давления может способствовать перестройкам в составе интегрона.

Рисунок 3. Интегрон — ДНК, улавливающая генные кассеты и распространяемая в составе более высокоорганизованных МГЭ. а — Структура интегрона класса 1. Pint — промотор интегразы, Pant — промотор кассет антибиотикорезистентности. Остальные элементы объяснены в тексте; б — Иерархическая организация МГЭ.
Все интегроны, несущие кассеты антибиотикорезистентности, разделяют на 5 классов на основании гомологии последовательностей кодируемых ими интеграз. Большинство интегронов антибиотикорезистентности относится к классу 1 (часто ассоциированы с Tn21-семейством). Они включают два концевых невариабельных региона, называемых константными последовательностями (constant sequences, CS), и высоковариабельный центральный участок. В одном конце интегрона (5’-CS), обычно находятся intI, attI и промотор, от которого экспрессируются гены кассеты. В другом конце (3’-CS), находится часть гена qacEΔ1, который, будучи интактным, несёт устойчивость к четвертичным аммониевым соединениям. За ним расположен ген sul, определяющий резистентность микроорганизма к сульфаниламидам, и 1–2 гена с неустановленной функцией — orf5 и иногда orf6 (рис. 3, а). Интегроны класса 2 ассоциированы с Tn7-семейством, классов 3 и 5 — с плазмидами, класса 4 — с конъюгативным геномным островом SXT Vibrio cholerae.

Рисунок 4. Схематическое изображение структуры геномного острова в составе бактериальной хромосомы. DR — прямые повторы ДНК хромосомы, фланкирующие ГО; IS — инсерционные элементы.
Геномные острова гонококков (GGI) кодируют систему секреции типа IV (T4SS), родственную плазмидным системам конъюгационного переноса. Посредством T4SS распространяется не только сам элемент и его продукты, но секретируется в окружающую среду и хромосома Neisseria gonorrhoeae, которая затем может трансформировать другие бактерии и участвовать в рекомбинационных событиях.
Главные нарушители границ и их мекка
Из обитателей отстойников, а что самое опасное — из бактерий вод, уже прошедших очистку, — в большом количестве выделяют плазмиды IncP-1-группы несовместимости (в системе классификации плазмид псевдомонад) [12]. Эти относительно небольшие молекулы дарят хозяевам массу селективных преимуществ (от множественной резистентности до биодеградации хлорорганики) и способны распространяться не только среди псевдомонад, но и практически всех грамотрицательных и некоторых грамположительных бактерий. Кроме того, они способны мобилизовать неконъюгативные R-плазмиды (например, IncP-4) к переносу в ещё более широкий спектр бактерий, а также в дрожжи и клеточные линии млекопитающих [17].
Биология плазмид в России и за рубежом. Что же можно возвести на крепком фундаменте?

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Читайте также:

