Что означает ингибировать репликацию вируса
Обновлено: 24.04.2024
Острые респираторные вирусные инфекции (ОРВИ), включая грипп, составляют основную часть всей мировой инфекционной заболеваемости и, несмотря на огромное к ним внимание, продолжают являться нерешенной проблемой. Эпидемии гриппа остаются непредсказуемыми, а время их возникновения и структура очередного штамма вируса практически непрогнозируемы. Больше всего от гриппа страдают дети и пожилые люди, а также хронические больные. Вместе с тем, как показала вспышка, обусловленная пандемическим вирусом A/California/04/2009 (H1N1), группой риска могут стать и лица среднего возраста, а также отдельные специфические контингенты: беременные, лица с рядом сопутствующих заболеваний (сахарный диабет, ожирение и т.д.). Характеризуя эпидемиологическую ситуацию в мире и России, необходимо иметь в виду, что данные заболеваемости обычно являются заниженными, это, в первую очередь, связано с низкой обращаемостью населения за медицинской помощью. На самом деле в период подъема заболеваемости простудные заболевания в той или иной форме переносит подавляющая часть населения, особенно его активная составляющая.
По данным ВОЗ, в 6% случаев грипп является причиной летальных исходов, около 60% случаев смерти связано с вирус-ассоциированными респираторными болезнями. Непосредственной причиной смерти обычно является развитие на фоне вирусной респираторной инфекции тяжелых осложнений, таких как пневмонии, бронхиты, синуситы, отиты, энцефалопатия, бронхиальная астма. Во время эпидемий гриппа смертность от соматических (неинфекционных) заболеваний существенно повышается, причем до 50% избыточной смертности приходится на сердечно-сосудистые заболевания и 15-20% на болезни легких и злокачественные новообразования. Особое место среди осложнений занимает так называемый синдром послевирусной астении, который может развиваться у 65% больных в течение 1 месяца от начала инфекции.
Низкая эффективность современных методов борьбы с гриппом и ОРВИ обусловлена целым рядом причин: убиквитарность, скорость распространения, массовость поражения; высокая контагиозность вирусов и чувствительность макроорганизма к инфицированию; полиэтиологичность возбудителей и смешанный характер инфекций; уникальная изменчивость антигенных свойств вирусов, особенно гриппа; быстро развивающая резистентность к препаратам; развитие вторичного иммунодефицита; узкая специфичность действия большинства этиотропных лекарственных препаратов и нерациональная фармакотерапия.
В структуре мер, направленных на улучшение ситуации по ОРВИ и гриппу, одно из важнейших составляющих - это рациональная фармакотерапия и профилактика, которая подразумевает комплексный и системный подход с учетом периода эпидемии. На первом, предэпидемическом этапе особую значимость приобретает комплекс санитарно-оздоровительных мероприятий, средства специфической профилактики (вакцинация) и применение препаратов, повышающих неспецифическую резистентность организма (иммунокорректоры, адаптогены, поливитамины). Во время эпидемического подъема заболеваемости ведущую роль начинают играть этиотропные препараты, которые становятся средствами первой линии защиты и обладают прямым и ингибирующим действием на репродукцию вирусов. Основными требованиями, которые предъявляются к данным средствам являются: широкий спектр противовирусной активности, низкая токсичность, хорошее проникновение в мозговую ткань, отсутствие отрицательного влияния на иммунитет; подавление размножения вируса, сочетаемость с другими лекарственными средствами, доступность, удобные формы применения, высокая комплаентность. Также большое значение имеет и обоснованное использование иммунокорригирующих средств, особенно индукторов интерферона. При появления типичных симптомов гриппа или ОРВИ, уже в первые 24-48 ч необходимо использовать средства, предназначенные для интенсивной терапии (химиопрепараты и индукторы интерферона) наряду с симптоматической терапией (противокашлевые, жаропонижающие, бронхолитические, антигистаминные препараты).
Останавливаясь на этиотропных средствах для лечения ОРВИ и гриппа необходимо отметить, что имеется целый ряд средств, которые потенциально действуют на различные этапы взаимодействия вируса и клетки: часть из них подавляет внеклеточные вирионы, другие препятствуют проникновению вируса внутрь клетки, третьи ингибируют процессы репликации, сборки вирусов на различных этапах и выход вируса из клетки. Вместе с тем, круг препаратов, с реальной и достаточной противовирусной активностью, отвечающий вышеуказанным требованиям, прошедший многоцентровые клинические исследования и рекомендованный во всем мире к практическому применению крайне ограничен. К данным препаратам относятся ингибиторы нейраминидазы (осельтамивир, занамивир), блокаторы М2-белка гриппа А (амантадин, римантадин) и новый препарат Ингавирин ® .
Одно из больших достижений в области фармакотерапии гриппа - это создание таких препаратов, как осельтамивир и занамивир. Оба препарата блокируют ключевой фермент репликации вирусов гриппа А и В-нейраминидазу. При ингибировании данного фермента нарушается способность вируса проникать в здоровые клетки, нарушается выход вирионов из инфицированной клетки, что приводит к ограничению распространения инфекции в организме. Препараты характеризуются системностью действия, относительно медленным формированием резистентности, их применение резко снижает развитие вторичных бактериальных осложнений.
С конца 60-х годов XX века известны такие химиопрепараты как римантадин (мидантан) и амантадин. В педиатрической практике применяется римантадин в сиропе со специальным матричным носителем, усиливающим противовоспалительное действие римантадина и снижающим его токсичность (альгирем). Римантадин используется как для профилактики, так и для лечения гриппа А в период эпидемий у взрослых и детей от 2-х лет и старше. Противовирусный эффект римантадина реализуется путем ингибирования синтеза М-белка вируса гриппа, при этом нарушается процесс репродукции и сборки полноценных вирионов. Опыт массового применения в течение последних 20 лет показал его эффективность, особенно при раннем назначении в первые дни заболевания. Тем не менее, высокая токсичность и быстрое развитие устойчивости вирусов к римантадину существенно ограничивают его применение.
Известный российский препарат Арбидол ® (подавляет слияние липидной оболочки вируса с мембранами эндосом) показал меньшую противовирусную эффективность в отношении вируса гриппа в эксперименте, вместе с тем, он обладает иммуномодулирующими потенциями.
Необходимо отметить, что ингибиторы нейраминидазы и блокаторы M2-белка имеют узкий спектр действия и проявляют противовирусное действие только в отношении вирусов гриппа (или даже отдельных видов гриппа). И ингибиторы нейраминидазы и амантадин применяются для профилактики и лечения уже более 20-40 лет. Особенности механизмов антивирусной активности данных препаратов, наряду с длительным периодом использования, обуславливают формирование резистентности вирусов гриппа к данным средствам и при их назначении необходимо всегда учитывать актуальный циркулирующий штамм вируса и его устойчивость к противовирусным медикаментам.
Создание новых средств для лечения гриппа крайне важная и сложная задача современной медицины. В свете этого крайне важным, особенно с учетом последней пандемии гриппа, является появление на рынке противовирусного препарата Ингавирин ® , активного в отношении вирусов, вызывающих ОРВИ, таких как грипп А, В, парагрипп, аденовирус и респираторно-синцитиальный вирус, который является синтетическим аналогом эндогенного псевдопептида, выделенного из тканей морского моллюска Aplysia californica. Механизм противовирусного действия Ингавирина ® заключается в нарушении конформационного созревания и задержки миграции синтезированного нуклеокапсидного белка вируса гриппа из цитоплазмы в ядро. К настоящему времени завершен весь необходимый цикл исследований, предваряющий появления лекарственного средства на рынке. Так, результаты экспериментального изучения противовирусной активности Ингавирина ® в отношении вирусов гриппа А и В в культуре клеток и на лабораторных животных свидетельствуют о высокой лечебной и профилактической эффективности препарата при экспериментальной гриппозной инфекции белых мышей, вызванной вирусом A(H3N2) A(H1N1sw1), A(H5N1) и B.
Особенно важными представляются результаты, полученные при оценке эффективности Ингавирина ® в отношении возбудителей аденовирусной инфекции. Подавление репродукции аденовируса в культуре клеток открывает дальнейшие перспективы для практического использования препарата после проведения необходимых исследований.
В эксперименте проведено изучение хронической и специфической токсичности субстанции Ингавирина ® . Результаты показали, что активное вещество Ингавирина ® не обладает токсическим эффектом, канцерогенным и мутагенным действием. При доклиническом изучении субхронической токсичности лекарственной формы Ингавирина ® на кроликах не отмечено каких-либо изменений в поведении и общем состоянии животных, не выявлено патологических изменений гематологических и биохимических показателей, в структуре внутренних органов, местно-раздражающее действие отсутствовало.
При изучении интерферонового статуса у добровольцев показано, что Ингавирин ® обуславливает повышение содержания интерферона в крови до физиологической нормы, стимулирует и нормализует сниженную α-интерферон продуцирующую способность лейкоцитов крови, стимулирует γ-интерферон продуцирующую способность лейкоцитов. Вызывает генерацию цитотоксических лимфоцитов и повышает содержание NK-T клеток, обладающих высокой киллерной активностью по отношению к трансформированным вирусами клеткам и выраженной противовирусной активностью.
Безопасность и переносимость препарата изучена в первой фазе клинических исследований у 15 здоровых добровольцев при однократном приеме препарата Ингавирин ® в дозе 90 мг. Значимых нежелательных явлений в течение первых суток и в отдаленный период после приема препарата не отмечалось.
Существенным преимуществом Ингавирина ® в сравнении с ингибиторами нейраминидазы является его более высокая комплаентность (препарат принимается перорально однократно в сутки). Нельзя, конечно, забывать и о медико-экономических аспектах использования лекарственных средств, и в этом отношении превосходство Ингавирина ® над ингибиторами нейраминидазы неоспоримо.
Диагноз - грипп A/H1N1/California/04/2009- SW подтвержден 29.11.2009 г. методом ПЦР с назального смыва.
29.11.2009 г. назначен Ингавирин ® по 90 мг 1 раз в сутки курсом на 5 дней. Через 24 ч от начала лечения температура снизилась до субфебрильной, головная боль, боли в костях и мышцах практически исчезли. Слабость значительно уменьшилась. Заложенность носа и кашель на 3-и сутки лечения исчезли. Утром 02.12.2009 г. по окончании лекарственной терапии жалоб на состояние здоровья больной не предъявлял. Развития осложнений не отмечено и больной выписан на 6-е сутки пребывания в стационаре в удовлетворительном состоянии.
Заключая краткий анализ химиотерапевтических средств, используемых для лечения ОРВИ и гриппа, необходимо отметить, что, на наш взгляд, эффективная стратегия по борьбе с ОРВИ и гриппом предполагает комплексный подход к проблеме с использованием вакцинации для выработки специфического иммунитета, индукторов интерферона для мобилизации неспецифической системы защиты и, наконец, этиотропных химиопрепаратов для завершения процесса ингибирования репликации вируса с учетом актуальных штаммов вируса и их резистентности, а также медико-экономических составляющих.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
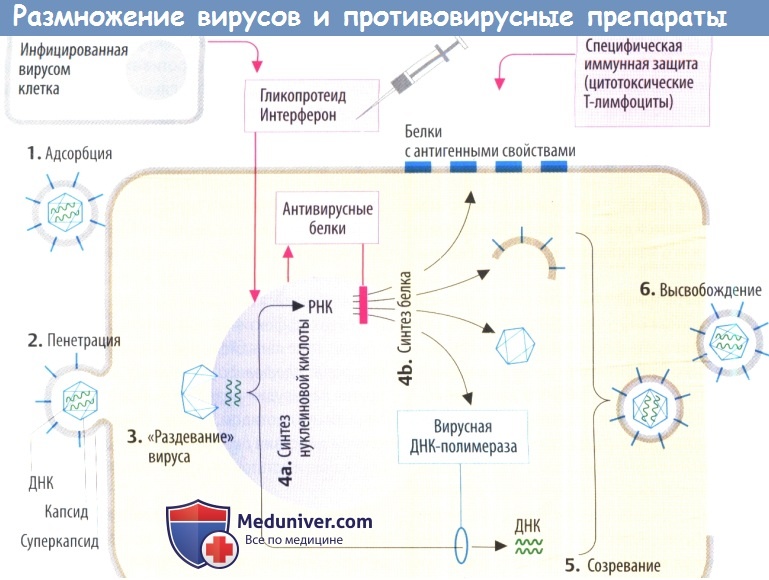
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
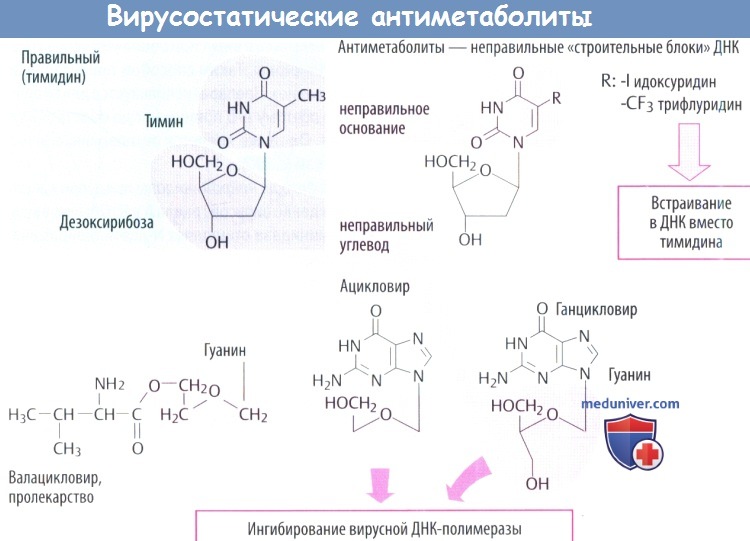
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
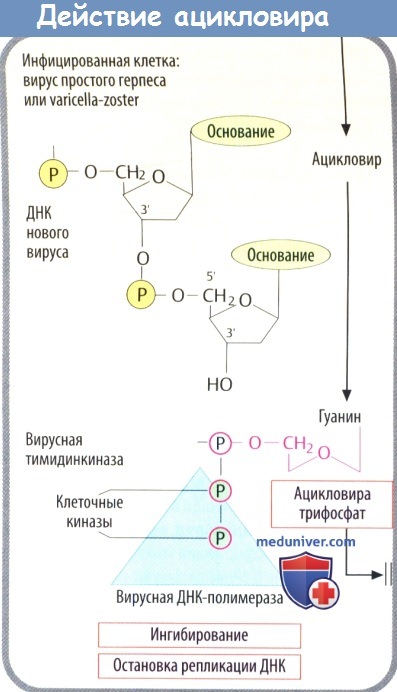
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
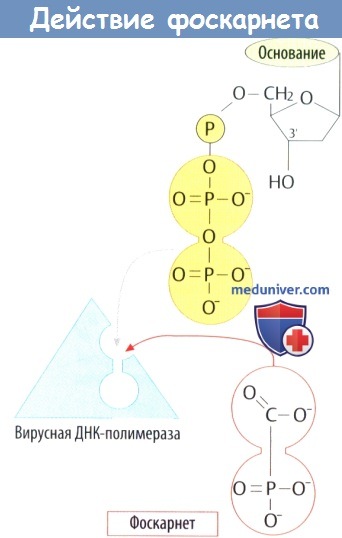
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
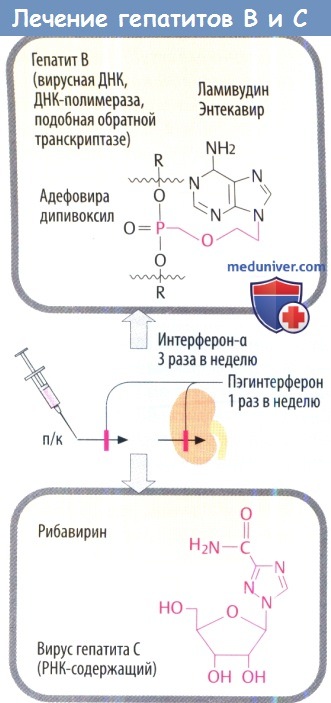
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
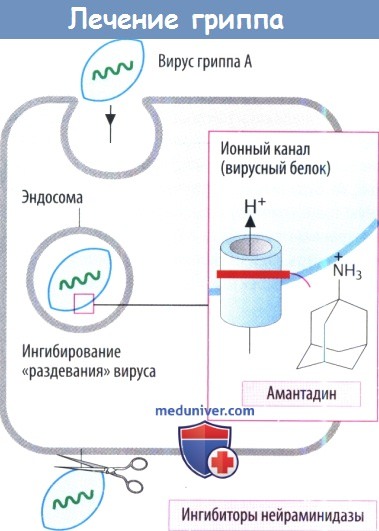
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ингибирование вирусов. Подавление активности вирусов
Вирусные инфекции могут поражать любой орган человека. Большинство вирусных инфекций протекает бессимптомно, но если инфекция носит симптоматический характер, ее тяжесть варьирует в широких пределах: от кратковременного заболевания, такого как насморк, до продолжительной, потенциально фатальной инфекции, например вызываемой вирусом иммунодефицита человека (ВИЧ) типа 1.
Вирусы можно избирательно ингибировать с помощью лекарств.
Избирательной ингибиции вирусов можно добиться двумя способами:
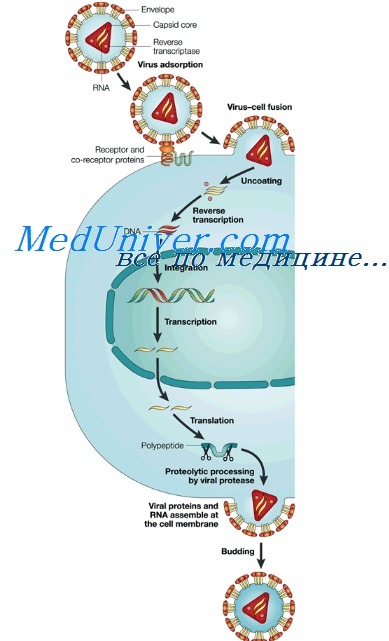
• ингибицией таких уникальных этапов репликации вируса, как связывание вируса с клеточными рецепторами, пенетрация, декапсидация, сборка или высвобождение вируса;
• преимущественной ингибицией этапов, свойственных также клеткам организма-хозяина, включая транскрипцию и трансляцию.
Потенциальную терапевтическую эффективность антивирусного препарата можно оценить in vitro, однако прогностическое значение этих данных существенно ниже, чем в случае определения in vitro лекарственной чувствительности бактерий. Отсутствие стандартизированных методов тестирования in vitro и недостаточное знание фармакокинетических и фармакодинамических отношений затрудняют точное определение соотношения между концентрацией лекарства и антивирусным эффектом.
Развитие резистентности вирусов часто ограничивает применимость антивирусных препаратов. Считается, что возникновение резистентности в процессе лечения наблюдается при использовании всех современных антивирусных препаратов, за исключением рибавирина, трифтортимидина, цидофовира и соривудина. Резистентность возникает в результате мутаций нуклеотидов, однако такие вирусы все еще могут оставаться чувствительными к другим антивирусным веществам, обладающим иным механизмом действия. Появление резистентных штаммов можно свести к минимуму, применяя комбинацию многих лекарственных веществ, как это принято при лечении инфекции, вызываемой ВИЧ-1.
Успех антивирусной химиотерапии зависит от иммунокомпетентности организма. Существующие в настоящее время антивирусные препараты обладают лишь вирусостатическим действием.
Симптомы и признаки вирусной инфекции обусловлены характером ответа организма. Ответ организма-хозяина на вирусную инфекцию варьирует от острого воспаления (например, менингоэнцефалит) до гипертрофии и гиперплазии (бородавки) или онкогенеза (например, Т-клеточный лейкоз, вызываемый лимфотропным вирусом 1 человека).
Воспалительный ответ клеток обычно ингибирует репликацию вируса и приводит к выздоровлению. У пациентов с нарушением иммунного ответа вирусная инфекция может носить затяжной характер и иметь более тяжелое течение. Иногда сам иммунный ответ организма вызывает патологические явления (например, при геморрагической лихорадке Денге). В редких случаях репликация вируса вызывает лишь слабую воспалительную реакцию или реакция отсутствует полностью, но тем не менее инфекция оказывается летальной (например, бешенство).
Антивирусные препараты эффективны против некоторых часто встречающихся вирусных инфекций. Антивирусные препараты дают терапевтический эффект при инфекциях, вызываемых следующими вирусами:
• вирусы герпеса (HSV-1, HSV-2, HHV-8, VZV и CMV);
• вирус гриппа А и В;
• респираторный синцитиальный вирус (RSV);
• вирусы гепатита В и С (HBV и HCV);
• вирусы папилломы человека (HPV);
• аренавирус лихорадки Ласса;
• вирус иммунодефицита человека (ВИЧ-1, ВИЧ-2).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ИНГИБИТОРЫ ВИРУСОВ (лат. inhibere удерживать, останавливать) — вирусотропные вещества, образующиеся в организме человека или животного и обладающие способностью в результате взаимодействия с вирусами подавлять их инфекционную активность. Кроме того, И. в. могут подавлять и отдельные функции вирусов, напр, гемагглютинацию, обусловливаемую вирусом гриппа. В отличие от антител (см.), к-рым присуща строгая специфичность, ингибиторы обладают более широким спектром активности в отношении различных видов вирусов, что дало основание называть их неспецифическими факторами иммунитета.
Впервые И. в. были обнаружены в сыворотке крови. В 1910 г. С. Флекснер и Льюис (J. Lewis) описали способность нормальной сыворотки овец нейтрализовать вирус полиомиелита. В последующем ингибиторы к различным вирусам были найдены в сыворотках крови обезьян, кроликов, собак, птиц, коров, лошадей и других животных. В 1942 г. Херст (G. К. Hirst) обнаружил ингибиторы к вирусу гриппа в сыворотке крови здорового человека. Результаты большого числа исследований, проведенных в различных лабораториях, позволяют сделать вывод, что в сыворотках человека и животных содержатся ингибиторы, активные по отношению ко многим как РНК-, так и Д H K-со держащим вирусам. Установлено также, что И. в., выявляемые в сыворотках крови разных животных, различаются как качественно, так и количественно. Так, в сыворотке крови человека содержатся ингибиторы вирусов гриппа А и В, но отсутствуют ингибиторы вируса гриппа С, в сыворотке же крыс содержатся в большом количестве ингибиторы вирусов гриппа С, но мало ингибиторов вирусов гриппа А и В.
Помимо видовых различий в содержании И. в., характерных для различных животных, наблюдаются как индивидуальные колебания у отдельных особей, так и изменения количества И. в. у одного и того же животного в зависимости от возраста и времени года: содержание И. в. в сыворотке лабораторных животных резко уменьшается в зимне-весенние месяцы и возрастает летом и осенью. Аналогичные закономерности возрастной и сезонной динамики установлены и для человека. Сыворотки крови детей первых 2—5 мес. жизни обладают высокой вируснейтрализующей активностью (в этом случае имеют место И. в. материнского происхождения). Затем содержание И. в. резко падает и до 1,5—2 лет сыворотка крови детей характеризуется низким содержанием ингибиторов. Количество И. в. начинает возрастать после 3 лет, достигая высоких показателей к 9—10 годам. У стариков содержание И. в. в сыворотке крови также невелико.
Изучение хим. природы И. в. различных животных и человека позволило прийти к заключению об их неоднородности и достаточно сложном строении. Оказалось, напр., что вирусингибирующая активность сыворотки крови морской свинки В отношении вирусов гриппа А и ECHO связана с липопротеидами, входящими в состав глобулиновой фракции белков сыворотки, а ингибитор вируса Сендай был обнаружен в составе альбуминовой фракции.
Гетерогенность И. в. обусловила появление различных классификаций. В основу одной из них положено распределение И. в. по принципу устойчивости к прогреванию при различной температуре. Так, для ингибиторов миксовирусов и респираторных вирусов Т. Я. Лузяниной предложена следующая классификация. 1. Термолабильныe ингибиторы, которые разрушаются после прогреваний при t° 62—65° в течение часа (бета-ингибиторы). Большинство из них относится к бета-липопротеидам.
2. Термостабильные ингибиторы, которые в свою очередь делятся на две группы — ингибиторы умеренной термостабильности и ингибиторы высокой термостабильности.
И. в. умеренной термостабильности разрушаются после прогревания при t° 75° в течение часа (ингибитор Франсиса, альфа-ингибитор). Они относятся к мукопротеинам, простетической группой которых являются нейраминовая к-та и ее производные.
И. в. высокой термостабильности не разрушаются при t° 100° (гамма-ингибитор). По хим. структуре они относятся к гликопротеинам, преимущественно связаны с альфа2-глобулиновой фракцией сывороток, но обнаруживаются также и среди альбуминовой и бета-глобулиновой фракций.
Помимо сыворотки крови, И. в. найдены также в тканях, секретах и экскретах человека и позвоночных животных. Они обнаружены в экстрактах из тканей легкого, печени, селезенки, почки, мозга, в слюне, моче и т. д. В частности, в слюне здоровых людей найдены ингибиторы, подавляющие репродукцию вируса полиомиелита в различных культурах клеток. Следует заметить, что в ряде случаев ингибиторам, выделяемым из тканей, присуща более сложная структура, чем И. в., получаемых из сывороток крови. Установить какую-либо зависимость между содержанием ингибиторов в сыворотке крови и тканях не удалось.
По мнению В. М. Жданова, П. Н. Косякова, 3. И. Ровновой и др., муко- и липопротеиновые И. в., выявляемые в различных тканях, секретах и экскретах организма, а также некоторые виды термостабильных сывороточных ингибиторов следует считать рецепторами клеток или веществами, тождественными по своему составу этим рецепторам.
Механизм действия
Несмотря на то, что антивирусная активность И. в. порой бывает достаточно высокой (показано, напр., что сыворотки крови морских свинок могут нейтрализовать до 10 млн. DL50 для мышей некоторых штаммов вируса гриппа), судьба их в процессе заболеваний, обусловленных вирусами, изучена крайне недостаточно. Тем не менее установлено, что развитие вируса гриппа в эмбрионах кур, в мозге и легких мышей приводит к падению титров ингибиторов. Подобное понижение ингибирующей активности смывов из верхних дыхательных путей человека, наблюдавшееся в остром периоде гриппозной инфекции, было предложено использовать в качестве метода ранней диагностики гриппа. В процессе выздоровления от вирусной инфекции (в частности, от гриппа) количество ингибиторов вновь увеличивается. При этом титры сывороточных ингибиторов начинают нарастать примерно в те же сроки, когда появляются и антитела к вирусам. Повышение содержания И. в. и антител обычно идет параллельно. В последующем увеличение неспецифических И. в. сменяется снижением их количества, к-рое наступает раньше, чем начинает снижаться титр антител.
Наблюдавшаяся порой высокая антивирусная активность И. в. дала основание для попыток использовать их в качестве профилактического и леч. средства при некоторых экспериментальных вирусных инфекциях. Однако несмотря на полученные положительные результаты в ряде таких экспериментов И. в. не нашли практического применения в терапии вирусных инфекций.
Библиография: Косяков П. Н. и Ровно в а 3. И. Противовирусный иммунитет, М., 1972; Л у з я н и н а Т. Я. Особенности взаимодействия термолабильных сывороточных ингибиторов с различными вирусами, Acta virologica, т. 6, № 6, с. 498, 1962; Проблемы патогенеза и иммунологии респираторных вирусных инфекций, под ред. А. А. Смо-родинцева и др., т. 1, с. 35, Л., 1969.
Читайте также:

