Что препятствует созданию вакцины против вич
Обновлено: 07.05.2024
Перед тем как говорить о вакцине против ВИЧ, стоит начать с более общего вопроса: что мы понимаем под прививками и вакцинами с научной точки зрения?
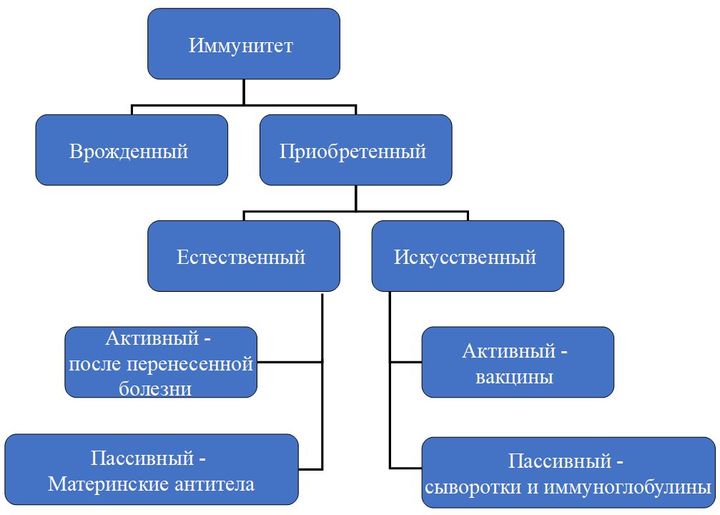
По механизму возникновения иммунитет делится на два вида: врожденный и приобретенный. Первый есть у каждого человека с рождения, он выработан эволюционно. Благодаря нему человек не болеет многими болезнями, которыми, например, страдают животные.
Второй возникает в течение жизни и у каждого может отличаться в зависимости от того, с какими возбудителями человеку довелось встретиться.
Приобретенный иммунитет может быть активным (он возникает вследствие реакции организма на перенесенную болезнь, присутствие возбудителя в организме), а может быть пассивным, когда антитела, например, передаются от матери ребенку во время беременности.
Именно по этим антителам, как правило, и ставится диагноз, если мы пользуемся экспресс-тестами. В случае с ВИЧ существует и пассивный иммунитет. Но при передаче вируса от матери ребенку, к сожалению, он не обладает достаточным защитным эффектом.
Еще одно направление — это искусственный иммунитет. Он тоже бывает активным и пассивным. Пассивный — это иммуноглобулины, выработанные либо у лабораторных животных, либо у других иммунизированных лиц, и сыворотки. Активный же достигается собственно путем вакцинации.
Какие бывают вакцины?
Вакцины бывают профилактические (защитные) и лечебные. Они различаются по типу воздействия на организм и по своим результатам.
Пассивный иммунитет возникает быстрее, сразу после того, как в организм ввели чужие антитела. Однако он бывает совсем недолговременным. Активный иммунитет держится долго, чаще — пожизненно, но и возникает не сразу.
Иммунный ответ: как это все работает?
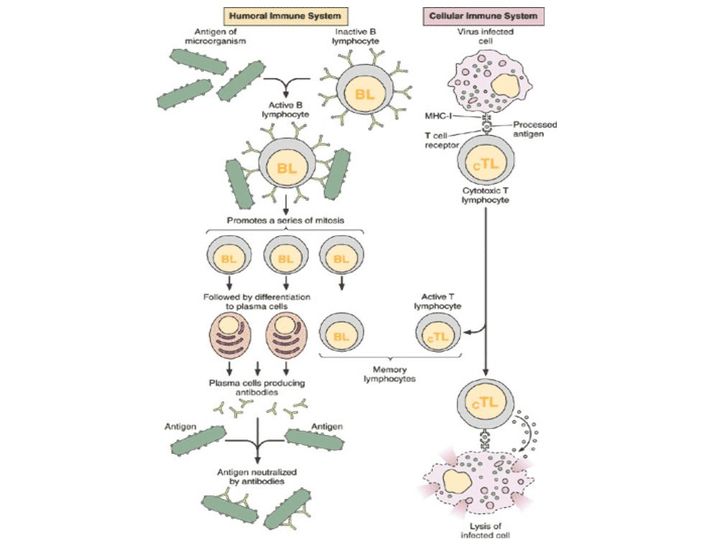
Ученые обычно говорят о гуморальном и клеточном иммунитете. Принцип работы гуморального заключается в следующем: в нашем организме есть специальные клетки — лимфоциты. Они постоянно циркулируют в крови и проверяют все, что попадается им на пути, по принципу свой/чужой.
Например, антитела к ВИЧ-инфекции появляются где-то через месяц после заражения, соответственно, все это время вирус может циркулировать в организме. Почему они неэффективны? Во-первых, потому что появляются слишком поздно.
Во-вторых, потому что вирус, с которым мы имеем дело, очень изменчив. Если даже В-клетки обнаружили его антиген, выработали к нему антитела, способные нейтрализовать заразу, то за время, которое ушло на все это, сам вирус успевает мутировать и оказаться неуязвимым для выработанного организмом оружия.
Когда мы говорим о клеточном иммунитете, речь идет об уничтожении тех вирусов, которые преодолели гуморальный барьер и успели забраться в саму клетку.
Клетки CD4 частично регулируют весь процесс и выполняют функцию клеток памяти. Их принято называть хелперами. CD8 — собственно занимаются уничтожением, за это их зовут киллерами.
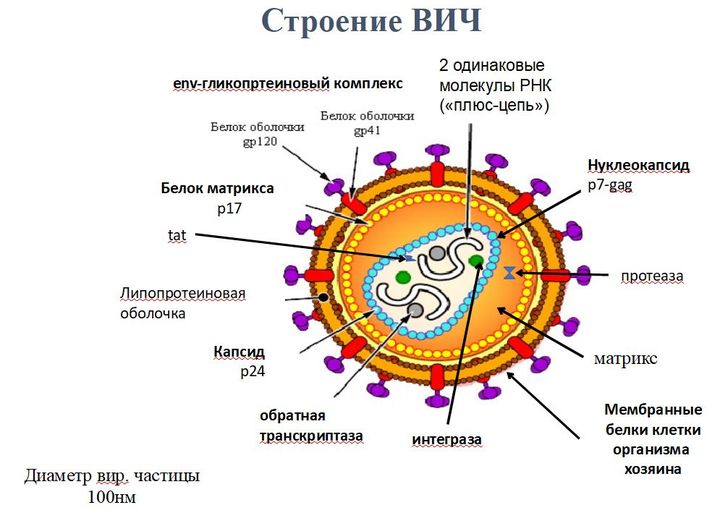
ВИЧ — единственный вирус, который поражает не просто клетки организма, а собственно клетки иммунной системы. Той самой, которая с вирусом должна, по идее, бороться.
Именно поэтому против ВИЧ-инфекции иммунитет не может сработать так, как это было бы с любым другим вирусом.
Какие возникают трудности при создании вакцины против ВИЧ?
На данный момент в рамках более ста испытаний уже протестировано более сорока видов вакцин с участием тысяч добровольцев, и есть целая система, в которой регистрируются все исследования по вакцинации от ВИЧ.
Последнее время в разного рода СМИ регулярно появляется информация, что той или иной компанией разрабатывается новая вакцина против ВИЧ. Однако обнадеживающих результатов не так уж и много. Почему?
Лучшая из существующих вакцин, которая дошла до третьей фазы исследований, показала свою защитную эффективность только в 60 % случаев в течение одного года, а в течение уже трех лет — только в 30 %. Это очень мало для вакцины. Она должна давать до 90 % эффективности.
И связано это с тем, что существует ряд препятствий для создания вакцины от ВИЧ-инфекции. Во-первых, такая вакцина не может состоять из ослабленного или живого вируса, как многие другие. Если ввести даже одну-две частицы ВИЧ в организм, это вызовет не иммунный ответ, а инфицирование организма.
Во-вторых, и мы об этом уже сказали, вирус находится внутри CD4-лимфоцитов. Мы пока не научились извлекать вирус из клетки, не повреждая ее саму. И на данный момент до конца не понимаем, какие именно механизмы могли бы обеспечить полную защиту от ВИЧ-инфекции.
В-третьих, многие вакцины пока разрабатываются, испытываются на подопытных животных: мышах, свиньях. В случае с ВИЧ кроме обезьян, на которых можно было бы воспроизвести инфекцию, у нас нет подходящих подопытных животных, результаты работы с которыми можно было бы легко перенести на человека.
Исследования на людях дороги и имеют ряд этических ограничений. Можно было бы привить группу здоровых добровольцев, но инфицировать их, чтобы проверить, как работает вакцина, врачи не могут. Ни один подопытный на такое не согласится. А вдруг вакцина не сработает?
Разработки вакцины. Дорожная карта
Тем не менее ученым уже удалось выработать основные направления в иммунотерапии ВИЧ-инфекции. С одной стороны — это попытка активации специфического иммунитета, который не срабатывает при естественном течении ВИЧ-инфекции. С другой стороны — профилактическая пассивная иммунизация.
Что значит пассивная? Мы подозреваем, что существуют люди, которые не инфицируются ВИЧ даже при достаточно частом контакте с вирусом. Видимо, у них возникает хороший иммунный ответ, и иммунная система справляется с вирусом самостоятельно. А значит, мы можем попытаться либо взять у уже иммунизированных лиц готовые антитела, либо создать их генно-инженерным путем, чтобы потом ввести в организм.
Клинические исследования в области ВИЧ-инфекции по пассивной иммунизации начались еще в начале 80-х годов, то есть одновременно с обнаружением самого вируса.
Они встречаются как раз у того типа пациентов, который мы только что назвали. В эксперименте на животных было показано: если у организма есть эти антитела, даже в случае нарочного введения вируса заражения не происходит.
Интересно, что эти антитела не убивают вирус, но они могут с ним соединяться, блокируя его рецепторы, как бы окружая и покрывая вирус, не давая ему обычным способом проникнуть в клетку. Через какое-то время вирус, не найдя клетки, где он может размножиться, погибает.
Суть этой экспериментальной вакцины заключается в том, что состоит она из двух разных антигенов, синтезированных искусственно, но идентичных белкам настоящего вируса.
Искусственная комбинация белков не может сама по себе вызвать развитие инфекции, но, по идее, должна вызвать развитие антител — такое, каким бы оно было в норме при попадании вируса в организм.
В течение первых 12 месяцев исследования каждая из женщин, участвующих в нем, получит шесть инъекций: три инъекции — в течение первого месяца и по одной — каждый последующий.
Первые результаты ожидаются где-то к 2021 году. Однако здесь есть нюансы: белки, с которыми работают ученые в рамках указанного исследования, аналогичны для субтипа ВИЧ, распространенного в Африке, но редко встречающегося у нас, в России.
Итоги: ДКП, ПКП, АРВТ
В настоящее время есть некоторые инфекции, которые человечество эффективно научилась контролировать с помощью вакцинации, а некоторые и вовсе победить, как оспу. Но рассчитывать на скорый результат в случае с ВИЧ пока не приходится.
Возможно, комбинация всех перечисленных подходов, пассивного и активного иммунитета, одновременно сможет стать эффективной, чтобы оказывать профилактическое воздействие.
Однако пока в контексте ВИЧ-инфекции действовать нам придется на популяционном уровне — традиционными способами профилактики распространения заболевания. В первую очередь это: практики более безопасного сексуального поведения, использование стерильных инструментов во всех медицинских сферах, доконтактная профилактика, постконтактная профилактика и эффективная антиретровирусная терапия.
Перед тем как говорить о вакцине против ВИЧ, стоит начать с более общего вопроса: что мы понимаем под прививками и вакцинами с научной точки зрения?
По механизму возникновения иммунитет делится на два вида: врожденный и приобретенный. Первый есть у каждого человека с рождения, он выработан эволюционно. Благодаря нему человек не болеет многими болезнями, которыми, например, страдают животные.
Второй возникает в течение жизни и у каждого может отличаться в зависимости от того, с какими возбудителями человеку довелось встретиться.
по теме
Лечение
Как устроен иммунитет: Объясняем по пунктам
Приобретенный иммунитет может быть активным (он возникает вследствие реакции организма на перенесенную болезнь, присутствие возбудителя в организме), а может быть пассивным, когда антитела, например, передаются от матери ребенку во время беременности.
Именно по этим антителам, как правило, и ставится диагноз, если мы пользуемся экспресс-тестами. В случае с ВИЧ существует и пассивный иммунитет. Но при передаче вируса от матери ребенку, к сожалению, он не обладает достаточным защитным эффектом.
Еще одно направление — это искусственный иммунитет. Он тоже бывает активным и пассивным. Пассивный — это иммуноглобулины, выработанные либо у лабораторных животных, либо у других иммунизированных лиц, и сыворотки. Активный же достигается собственно путем вакцинации.
Вакцины бывают профилактические (защитные) и лечебные. Они различаются по типу воздействия на организм и по своим результатам.
Пассивный иммунитет возникает быстрее, сразу после того, как в организм ввели чужие антитела. Однако он бывает совсем недолговременным. Активный иммунитет держится долго, чаще — пожизненно, но и возникает не сразу.

Иммунный ответ: как это все работает?
Ученые обычно говорят о гуморальном и клеточном иммунитете. Принцип работы гуморального заключается в следующем: в нашем организме есть специальные клетки — лимфоциты. Они постоянно циркулируют в крови и проверяют все, что попадается им на пути, по принципу свой/чужой.
по теме

Лечение
Гид по вакцинам. Когда и какую прививку сделать? А главное: надо ли вообще прививаться? (Спойлер: конечно, надо)
Например, антитела к ВИЧ-инфекции появляются где-то через месяц после заражения, соответственно, все это время вирус может циркулировать в организме. Почему они неэффективны? Во-первых, потому что появляются слишком поздно.
Во-вторых, потому что вирус, с которым мы имеем дело, очень изменчив. Если даже В-клетки обнаружили его антиген, выработали к нему антитела, способные нейтрализовать заразу, то за время, которое ушло на все это, сам вирус успевает мутировать и оказаться неуязвимым для выработанного организмом оружия.
Когда мы говорим о клеточном иммунитете, речь идет об уничтожении тех вирусов, которые преодолели гуморальный барьер и успели забраться в саму клетку.
Клетки CD4 частично регулируют весь процесс и выполняют функцию клеток памяти. Их принято называть хелперами. CD8 — собственно занимаются уничтожением, за это их зовут киллерами.
ВИЧ — единственный вирус, который поражает не просто клетки организма, а собственно клетки иммунной системы. Той самой, которая с вирусом должна, по идее, бороться.

Именно поэтому против ВИЧ-инфекции иммунитет не может сработать так, как это было бы с любым другим вирусом.
Какие возникают трудности при создании вакцины против ВИЧ?
На данный момент в рамках более ста испытаний уже протестировано более сорока видов вакцин с участием тысяч добровольцев, и есть целая система, в которой регистрируются все исследования по вакцинации от ВИЧ.
Последнее время в разного рода СМИ регулярно появляется информация, что той или иной компанией разрабатывается новая вакцина против ВИЧ. Однако обнадеживающих результатов не так уж и много. Почему?

Рис. 1. Общий принцип действия мРНК-вакцин. Вакцина, содержащая матричную РНК (мРНК) целевого белка патогена, попадает в клетку. В цитоплазме клетки мРНК считывается рибосомами — клетка начинает производить белки-антигены, которые (в числе прочих белков, производимых клеткой) презентируются на клеточной мембране. Там этот чужеродный белок распознается иммунными клетками, которые запускают синтез антител к нему. Так формируется иммунитет к белку патогена, позволяющий в будущем снизить вероятность заболевания при встрече с самим патогеном. Рисунок с сайта genome.gov
Глобальная эпидемия вируса иммунодефицита человека (ВИЧ) и вызываемого им синдрома приобретенного иммунодефицита (СПИД) длится уже почти четыре десятилетия. ВИЧ хорошо изучен — уже давно существуют препараты, которые позволяют инфицированному сдерживать его размножение в организме и жить с ВИЧ-инфекцией почти полноценной жизнью. Также разработаны эффективные меры борьбы с его распространением. Однако вакцины от ВИЧ-инфекции пока нет. Вакцины на основе мРНК продемонстрировали свою эффективность против COVID-19, добавив оптимизма и в борьбе с другими вирусами. Исследователи из США опубликовали результаты проведенного на макаках доклинического исследования вакцины от ВИЧ-1 (самого распространенного типа ВИЧ) на основе мРНК, кодирующих продукты генов env и gag вирусов иммунодефицита. Авторы показали, что вакцинация разработанным ими препаратом стимулирует выработку нейтрализующих антител в организме макак, а вероятность развития инфекции снижается на 79%. Прототип вакцины еще требует доработки, однако уже видно, что по крайней мере у животных он вызывает иммунный ответ на различные варианты ВИЧ.
Основная причина того, что вакцина от коронавируса разработана быстро, — платформы для получения вакцин на основе нуклеиновых кислот (ДНК и РНК) и различных векторов (например, аденовирусов) уже давно известны. Работа над вакцинами на основе мРНК началась более 30 лет назад с исследований того, могут ли мРНК, введенные в клетки мышей или человека, производить белки (M. Ostro et al., 1978. Evidence for translation of rabbit globin mRNA after liposomemediated insertion into a human cell line; G. Dimitrias, 1978. Translation of rabbit globin mRNA introduced by liposomes into mouse lymphocytes). Были разработаны методы получения как стабильных мРНК, так и липидных наночастиц для их доставки, а первые клинические исследования вакцины от гриппа на основе мРНК были опубликованы в 1995 году (K. L. Nichol et al., 1995. The Effectiveness of Vaccination against Influenza in Healthy, Working Adults).
Принцип действия мРНК-вакцин состоит в том, что мРНК, попавшая в клетки, считывается рибосомами, синтезируя закодированный в ней белок. Таким образом, синтезируется белок, который затем распадается на небольшие пептиды и выставляется на поверхность клетки, вызывая дальнейший иммунный ответ (рис. 1). Хотя мРНК может быть захвачена различными клетками, самую важную роль в образовании иммунного ответа на мРНК вакцины играют дендритные клетки. Именно они мигрируют позже в лимфатические узлы и доставляют антигены к Т- и В-лимфоцитам.
Но несмотря на то, что существуют различные подходы к получению вакцин, их эффективность все равно сильно зависит от особенностей вируса. Например, аденовирусные векторы уже использовали для разработки вакцины против ВИЧ, но клинические исследования, к сожалению, провалились. ВИЧ оказался одним из таких патогенов, чьи особенности пока не позволяют получить эффективные вакцины. Как и все вирусы он мутирует, увеличивая разнообразие вирусных частиц в одном организме. Оно также поддерживается постоянным присутствием провирусов ВИЧ в геноме, от которых можно избавиться только вырезав их физически (например, с помощью CRISPR-Cas9, как предлагают некоторые исследователи). Иммунная система практически не в состоянии создать антитела ко всем вариантам вируса, которые образуются в организме. Есть отдельные, сверхспособные группы В-лимфоцитов, которые могут производить антитела широкого спектра действия, но их чрезвычайно мало.
Еще одна плохая (для нас) особенность ВИЧ заключается в том, что он поражает иммунные клетки. У ВИЧ есть поверхностные белки, которые необходимы для нахождения и связывания вириона с белком CD4 — рецептором клеток-мишеней (в первую очередь T-хелперов, моноцитов и дендритных клеток). Они кодируются геном env, который, как и другие элементы генома ВИЧ, подвержен мутационным изменениям. Продукты гена env — белки gp41 и gp120 (далее комплекс из этих двух белков будем обозначать Env) — образуют тример (по три молекулы Env), связывающийся с CD4. Белок gp120 содержит шесть доменов, которые способны взаимодействовать с этим рецептором (рис. 2). Проблема в том, что в ответ на ВИЧ-инфекцию антитела не всегда образуются ко всем доменам. Кроме того, аминокислоты, входящие в состав этих доменов, связаны с олигосахаридами, которые защищают домены от антител. Это еще одна особенность вируса, которая помогает ему уходить от иммунного ответа. Подробнее о том, как ВИЧ умудряется ускользать от иммунной системы, читайте в статье Устойчивость ВИЧ и его взаимоотношения с иммунной системой.


Рис. 2. Различия между поверхностным гликопротеином Env вируса ВИЧ-1 (слева) и спайк-белком коронавируса SARS-CoV-2 (справа). У белкового комплекса Env есть несколько участков, которые связываются с рецептором CD4 (CD4bs, синий) клеток-мишеней. Блокирование этих участков антителами затруднено из-за присутствия многочисленных остатков олигосахаридов (показаны красным, зеленым и оранжевым). Желтым цветом указаны места связывания с другими белками (interface). На поверхности спайк-белка SARS-CoV-2 находится гораздо меньше олигосахаридов (оранжевые). Антитела в основном образуются против рецептор-связывающего домена (RBD, красный) и в меньшей степени — против N-концевого домена (NTD, бирюзовый). Рисунок из статьи L. Morris, 2021. mRNA vaccines offer hope for HIV
Один из подходов к созданию действенной вакцины против ВИЧ — синтез искусственных белковых тримеров из продуктов гена env. Такие тримеры состоят из укороченных вариантов субъединиц, которые соединены общим основанием. На основе таких тримеров можно создать вакцину, стимулирующую в организме синтез различных вариантов Env. Но несмотря на то, что молекулы Env действительно вызывают иммунный ответ, большинство образующихся антител не являются нейтрализующими, так как в основном образуются к основанию тримера, а не к доменам, которые непосредственно связываются с рецептором CD4.
Используя всю эту информацию, исследователи из нескольких научных учреждений США и Канады создали прототип мРНК-вакцины против ВИЧ-1 (самого распространенного типа ВИЧ). Результаты этой работы опубликованы в недавнем выпуске журнала Nature Medicine.
Ученые начали с экспериментов на клеточных культурах. Они ввели мРНК гена env вируса иммунодефицита человека первого типа (ВИЧ-1) и мРНК гена gag вируса иммунодефицита обезьян (дальнейшие эксперименты проходили на макаках) в клетки линии HEK293. Это, как и ожидалось, приводило к образованию вирусоподобных частиц (рис. 3). Они имели размер чуть меньший, чем вирионы ВИЧ (приблизительно 90 мкм против 120 мкм), но обладали мембраной, на которой были шипы из Env. Количество этих шипов было больше, чем у обыкновенных вирионов ВИЧ-1, что позволило ожидать формирования более выраженного иммунного ответа.

Рис. 3. Вверху: липидные наночастицы (lipid nanoparticles), содержащие мРНК генов env ВИЧ-1 и gag вируса иммунодефицита обезьян (simian immunodeficiency virus, SIV), стимулируют выделение вирусоподобных частиц (virus-like particles, VLP) клетками. На поверхности VLP располагается комплекс Env ВИЧ-1, а их капсид состоит из продуктов гена gag. Внизу: электронная микрофотография вирусоподобных частиц. Рисунок из обсуждаемой статьи в Nature Medicine
Затем исследователи переключились на мышей, чтобы проверить, насколько эффективнее окажется введение мРНК сразу двух генов env и gag по сравнению с введением мРНК одного только гена env. Мышам дважды (с интервалом в 28 дней) вводили мРНК, заключенные в липидные наночастицы. В обоих случаях — и при введении env+gag, и при введении только env — у животных возникал иммунный ответ, однако частицы с двумя мРНК давали нейтрализующие антитела чаще, чем частицы, которые содержали только мРНК env.
Дальнейшие исследования проводили на макаках-резусах, в исследовании были задействованы 14 особей: 7 — в группе вакцинированных и 7 — в контрольной группе. Авторы использовали сложную схему вакцинации (рис. 4), каждый этап которой был тщательно продуман, чтобы решать различные проблемы, связанные с появлением антител к комплексу Env: присутствие различных подтипов и линий ВИЧ и затруднение распознавания Env антителами из-за олигосахаридов на его поверхности.


На первом этапе вакцинации, состоявшем из трех инъекций, ученые вводили макакам мРНК гена env одной из линий подтипа B ВИЧ-1 (в литературе эта линия обозначается WITO4160.27 или WITO). Подтип В — самый распространенный в Северной Америке и Европе. Авторы выбрали эту линию вируса, потому что его комплекс Env имеет все самые распространенные варианты эпитопов, к которым образуются антитела. Кроме того, он способен взаимодействовать с рецептором CD4 макак.
На втором этапе вводили мРНК env двух других подтипов ВИЧ-1, которые обозначаются BG505 и DU422. Линия BG505 относится к подтипу А, она хорошо изучена, а ее Env распознается нейтрализующими антителами. Линия DU422 имеет такую конформацию комплекса Env, что В-клетки образуют всего лишь небольшое количество антител, не способных нейтрализовать вирус. Такие вакцины вводили 4 раза. Подгруппе макак, которым ранее вводили рекомбинантные тримеры Env, во время четвертого укола на этом этапе опять вводили не мРНК, а белковую вакцину.
Наконец, на третьем этапе делали еще три инъекции: сначала укол рекомбинантного тримера JR-FL SOSIP.664 (для всей вакцинированной группы), затем укол мРНК или тримера Env WITO, а затем еще один укол белковой вакциной, содержащей рекомбинантные тримеры WITO, BG505, DU422 и JR-FL SOSIP.664. Этот этап первоначально не планировался, но авторы решили добавить его, чтобы увеличить титр антител перед тем, как заразить макак вирусом иммунодефицита. В общей сложности вакцинированные животные получили по 10 инъекций. Несмотря на это животные довольно неплохо переносили вакцинацию — основными побочными эффектами были боли в месте введения и потеря аппетита.


Рис. 5. Слева: титры нейтрализующих антител к тримеру Env WITO в сыворотке макак. Справа: образование нейтрализующих антител против тримеров Env различных штаммов ВИЧ-1 (small global HIV-1 Env panel). Рисунок из обсуждаемой статьи в Nature Medicine
Наконец, авторы протестировали эффективность вакцины против самого вируса in vivo. Через две недели после последней инъекции исследователи 13 раз вводили макакам ВИЧ-1, модифицированный так, чтобы он мог заразить макак. Попытки заражения делались раз в неделю. У животных из контрольной группы (которые, напомню, не получали никаких компонентов вакцины) вирусные частицы в крови обнаружились уже через три недели. Из семи макак в экспериментальной группе (которые получили полный курс вакцинации) у двух даже после 13 еженедельных инъекций ВИЧ не наблюдалось никаких признаков заражения. У пяти животных инфекция проявилась, но происходило это в среднем через 8,1 недель после первой попытки заражения. По оценкам авторов вакцинация снижала вероятность заболевания ВИЧ на 76% (для подгруппы 1) и на 86% (для подгруппы 2) при каждой попытке заражения (если усреднить по обеим подгруппам, то получится, что риск снижается на 79%).
Безусловно, пока это исследование носит лишь предварительный характер, а до клинических испытаний на людях еще очень далеко. Во-первых, протокол вакцинации сложный и в нем задействовано много разных препаратов. Практическая реализация такого протокола вряд ли возможна в реальных условиях — особенно в регионах с большой долей ВИЧ-положительного населения (например, на юге Африки). Во-вторых, используются очень высокие дозы мРНК — до 400 мкг (для сравнения, доза мРНК в вакцине Cominarty составляет всего 30 мкг, а в вакцине Spikevax — 100 мкг). Также есть вопросы относительно эффективности. В исследованиях на животных, а особенно на приматах, по финансовым и этическим соображениям обычно используется минимально необходимое для статистической значимости количество особей. Семь макак в экспериментальной группе — это допустимое количество, но пока сложно оценить, какова будет эффективность на большей выборке. У двух макак, судя по результатам исследования, после вакцинации выработался довольно сильный иммунитет к ВИЧ — они не заболели даже после 13 попыток их заразить. Однако остальные макаки рано или поздно заражались. При этом у них образовывались антитела, способные нейтрализовать самые распространенные линии ВИЧ-1, но их титры были недостаточно высоки, чтобы обеспечить полную защиту. Авторы пишут, что такая эффективность достаточно хорошая для варианта вируса, против которого плохо образуются нейтрализующие антитела. Поэтому они с осторожным оптимизмом указывают, что разработанный ими прототип мРНК-вакцины можно использовать для дальнейшей разработки полноценной вакцины от ВИЧ для людей.
Источник: Peng Zhang, Elisabeth Narayanan, Qingbo Liu, Yaroslav Tsybovsky, Kristin Boswell, Shilei Ding, Zonghui Hu, Dean Follmann, Yin Lin, Huiyi Miao, Hana Schmeisser, Denise Rogers, Samantha Falcone, Sayda M. Elbashir, Vladimir Presnyak, Kapil Bahl, Madhu Prabhakaran, Xuejun Chen, Edward K. Sarfo, David R. Ambrozak, Rajeev Gautam, Malcom A. Martin, Joanna Swerczek, Richard Herbert, Deborah Weiss, Johnathan Misamore, Giuseppe Ciaramella, Sunny Himansu, Guillaume Stewart-Jones, Adrian McDermott, Richard A. Koup, John R. Mascola, Andrés Finzi, Andrea Carfi, Anthony S. Fauci & Paolo Lusso. A multiclade env–gag VLP mRNA vaccine elicits tier-2 HIV-1-neutralizing antibodies and reduces the risk of heterologous SHIV infection in macaques // Nature Medicine. 2021. DOI: 10.1038/s41591-021-01574-5.

Почему ВИЧ сложно лечить
Вирус иммунодефицита человека (ВИЧ) вызывает хроническое инфекционное заболевание, прогрессирующее без лечения. Это один из уникальных вирусов, которые поражают клетки иммунной системы — так называемые CD4+ Т-лимфоциты, функция которых состоит в распознавании и уничтожении чужеродных для организма агентов.
Без лечения ВИЧ-инфекция медленно прогрессирует, истощая иммунную систему организма. Через 5–10 лет после инфицирования начинается стадия вторичных проявлений, когда у ВИЧ-положительного развиваются другие сопутствующие заболевания.
Профилактика: значимое снижение рисков инфицирования ВИЧ
Доконтактная профилактика (ДКП или PrEP) — это прием неполной схемы тех же препаратов, которые принимают люди, живущие с ВИЧ: сочетания тенофовир + эмтрицитабин или тенофовир + ламивудин.
Если препараты ДКП успели попасть в организм заранее, то при проникновении в него вируса вещества ДКП убивают ВИЧ еще до того, как тот успеет закрепиться в теле человека. Препараты нужно принимать ежедневно в одно и то же время.
Защита, которую обеспечивает PrEP при правильном приеме таблеток, — почти 100%. Требуется консультация и контроль врача.
В экстренных случаях, когда есть риск заболевания после незащищенного контакта с инфицированным, используют постконтактное лечение (ПКП, PEP). Это месячный курс терапии. При быстром начале лечения в течение первых 24–72 часов есть высокие шансы избежать инфицирования. Но эти шансы никогда не равны 100%.
Лечение ВИЧ: антиретровирусная терапия
Основной способ взять ВИЧ-инфекцию под контроль — антиретровирусная терапия. Она включает в себя препараты, останавливающие жизненный цикл ВИЧ на разных этапах.
Антиретровирусная терапия меняет качество жизни пациентов с ВИЧ:
- останавливает размножение вируса;
- позволяет иммунной системе самой восстановиться;
- предотвращает передачу ВИЧ половому партнеру;
- позволяет женщине родить детей без вируса.
Ученые доказали, что ВИЧ-положительный человек, принимающий эффективную терапию, не может передать вирус при незащищенных сексуальных контактах.
Прорыв 2021 года в лечении ВИЧ — регистрация первых инъекционных форм антиретровирусной терапии на рынках Канады, США и Европы. В ближайший год эта форма должна появиться в России. Исследования доказали эффективность терапии при однократных инъекциях каждые 1–2 месяца (вместо ежедневного приема терапии). Следующее поколение лечения — инъекционный препарат с введением один раз в полгода. Потенциально эти же лекарства можно будет использовать для снижения риска инфицирования с той же продолжительностью действия.
Исследования новых методов лечения ВИЧ: генетические ножницы
Известные случаи излечения от ВИЧ связаны с пересадкой костного мозга от доноров с мутацией генов CCR5, делающих носителей этой мутации неуязвимыми для ВИЧ. В настоящее время ученые отслеживают состояние еще 38 пациентов с ВИЧ, которым был трансплантирован устойчивый к вирусу материал.
Этот метод не может быть масштабирован по двум причинам: ущерб для здоровья от трансплантации несоизмеримо выше, чем от ВИЧ-инфекции (излечившиеся пациенты проходили процедуру не в связи с ВИЧ, а из-за онкологических заболеваний), а сама мутация не может служить надежной защитой перед быстро мутирующим вирусом, новые штаммы которого могут стать невосприимчивы к этой естественной защите.
Тем не менее случаи излечения именно этим путем создали значительное поле для исследований: на их основе появились как возмутивший общественность эксперимент на генетически модифицированных детях, итог которого общественности неизвестен, так и испытание метода редактирования гена CCR5 в организме живого человека, которое завершатся в Санкт-Петербурге в 2022 году.
Разработки вакцин от ВИЧ
Эффективной вакцины против ВИЧ не существует — пока.
За все время в клинических исследованиях испытывали более 40 вакцин. Максимальный эффект в сокращении новых случаев ВИЧ — только 25%. Созданию вакцины препятствует особенность жизненного цикла ВИЧ и его высокая изменчивость — особенно его внешней оболочки. Это позволяет вирусу быстро обходить искусственный иммунитет.
Продолжается исследование бельгийской вакцины Mosaico. В 2022 году планируется публикация исследования перспективной кадидатной вакцины HIVconsvX от Оксфордского университета.

Диагностика: шесть видов анализов
Рынок средств диагностики ВИЧ активно растет. Согласно исследованию американского агентства GMI, к 2024 году объем мирового рынка средств диагностики ВИЧ превысит $5 млрд.
Диагностика включает скрининг и подтверждающие тесты для проверки на заболеваемость ВИЧ-1, 2 и группы О. Эти тесты имеют основное применение для скрининга и дифференциации различных групп и подтипов вируса иммунодефицита человека. Благодаря технологическому развитию стали доступны экспресс-тесты на уровень клеток CD4, нуклеиновые кислоты NAT, антиген p24 и диагностика для новорожденных EID.
Антитела к ВИЧ появляются после начала активного размножения вируса. Они обычно обнаруживаются в сыворотке крови через 6–12 недель после инфицирования. Тесты на антитела ВИЧ высоко надежны при относительно низкой стоимости.
При определении антигена p24 в крови ВИЧ-инфекция может быть выявлена раньше, чем традиционными тестами для определения антител. Тесты на антиген имеют низкую чувствительность. Они не дают ложноположительных результатов, но возможны ложноотрицательные. То есть отрицательный результат не исключает инфицирование, а положительный — подтверждают с помощью тестов на антитела. Тест на антиген p24 всегда применяется вместе с тестами на антитела.
- Тесты на ВИЧ четвертого поколения
В тестах четвертого поколения объединили разные технологии, чтобы обнаружить как антиген p24, так и антитела. Тесты четвертого поколения менее дорогие, чем NAT. Широко распространены в России.
- Тесты на нуклеиновые кислоты (NAT\NAAT)
Определяет наличие и количество ВИЧ в миллилитре крови и других биологических жидкостях. Имеет высокую точность и стоимость, для скрининга не применяется. Используется для определения вирусной нагрузки у ВИЧ-положительных пациентов.
Этот тест не выявляет ВИЧ, а служит для измерения уровня клеток CD4 или Т-лимфоцитов — показатели, важные для для качества жизни пациентов с ВИЧ. Это белые клетки крови, предназначенные для распознавания болезнетворных организмов в нашем теле, которые должны уничтожаться иммунной системой. Снижение уровня CD4-клеток ниже 200 означает очень серьезные нарушения иммунной системы.
Эпидемия ВИЧ началась раньше пандемии коронавируса. Согласно UNAIDS, в 2020 году во всем мире насчитывалось не менее 37,6 млн пациентов с ВИЧ. Но главный тренд — за последние десятилетия инновации существенно изменили качество и продолжительность их жизни, а доступность диагностики и лечения снизили смертность на 61% по сравнению с максимумом в 2004 году. Также с 1996 года более чем на 30 лет выросла общая продолжительность жизни человека с ВИЧ при условии раннего обнаружения и использования терапии.
Подробнее о подходах к лечению и о том, как инновации продолжают улучшать качество жизни с ВИЧ, расскажут ученые-медики из разных стран на онлайн-конференции PROHIV 2021, которая пройдет 20–21 сентября.
Читайте также:

