Что такое фибропластический вирус в крови
Обновлено: 30.04.2024
Миелофиброз (myelofibrosis) - миелопролиферативное заболевание, для которого характерны анемия различной выраженности - от умеренной до тяжелой, весьма разнообразные изменения в периферической крови, фиброз костного мозга и миелоидная метаплазия селезенки, печени и других органов. Болезнь возникает в результате пролиферации мутантного клона, происходящего из стволовой кроветворной клетки, способной дифференцироваться в направлении эритроцитов, гранулоцитов и тромбоцитов [Adamson, Fialkow, 1978]. Нередко наблюдается также пролиферация остеобластов и образование новой костной ткани. Неизвестно, является ли фиброз костного мозга реакцией на нарушения пролиферативной активности клеток кроветворной системы или же компонентом таких патологических пролиферативных реакций. Миелоидная метаплазия селезенки, печени и других органов обычно рассматривается как компенсаторный процесс; возможно, однако, что она является результатом пролиферации стволовой клетки.
Что провоцирует / Причины Миелофиброза:
Патогенез (что происходит?) во время Миелофиброза:
Симптомы Миелофиброза:
Миелофиброз может возникнуть на фоне истинной полицитемии или тромбоцитемии, однако обычно он развивается как первичный процесс. Следует еще раз подчеркнуть, что это болезнь людей среднего и пожилого возраста: максимальная заболеваемость отмечается в возрастной группе 50-70 лет. Лица обоего пола болеют одинаково часто.
Болезнь прогрессирует медленно, и из-за скрытого начала диагноз часто ставят при обследовании пациента по совершенно иному поводу. Часто наблюдаются симптомы, обусловленные анемией: сонливость, слабость и одышка при физической нагрузке. Иногда первыми проявлениями заболевания бывают симптомы, обусловленные увеличением селезенки, а именно вздутие живота, ощущение дискомфорта после приема пищи, изжога и даже отеки в области лодыжек. Спленомегалия - почти постоянный признак, селезенка в одних случаях слегка увеличена, в других же достигает огромных размеров, фактически занимая всю брюшную полость. Инфаркт селезенки сопровождается острой болью в левом подреберье и шумом трения брюшины. Часто выявляется гепатомегалия. Портальная гипертензия возникает в результате тромбоза селезеночной вены, образования экстрамедуллярных инфильтратов пролиферирующих клеток по ходу портального тракта или его увеличенного кровенаполнения. У больных с портальной гипертензией могут возникать кровотечения, варикозное расширение вен пищевода и асцит.
Нередко обнаруживаются признаки подагры. Больные также страдают от зуда, который становится особенно мучительным в тепле. Возникают судороги в икроножных мышцах, боли в костях, причем все эти симптомы очень легко можно отнести за счет возраста пациента.
Встречающиеся иногда функциональные нарушения тромбоцитов бывают причиной внутрикожных кровоизлияний и желудочно-кишечных кровотечений. Примерно у 1/3 больных миелофиброзом обнаруживается очаговый остеосклероз, обычно захватывающий кости осевого скелета и проксимальные эпифизы плечевых и бедренных костей. Изредка поражаются и другие участки скелета, например череп.
Течение и прогноз
Состояние многих пациентов долгие годы остается стабильным при нормальном уровне гемоглобина и минимальной спленомегалии. У некоторых больных заболевание протекает менее доброкачественно, характеризуется постепенным ухудшением состояния здоровья, прогрессированием анемии и спленомегалии. Средний срок жизни от момента установления диагноза составляет 3 года, но многие больные живут дольше. Неблагоприятными прогностическими признаками являются тяжелая анемия, которую не удается устранить с помощью переливаний крови, выраженная лейкопения, спонтанные кровотечения и быстрая потеря массы тела. Все эти симптомы могут быть обусловлены дефицитом фолиевой кислоты. Причиной смерти чаще всего является прогрессирующая анемия, примерно 20 % больных умирают от острого миелобластного лейкоза.
Диагностика Миелофиброза:
Ко времени обращения за медицинской помощью анемия обнаруживается у 2/3 всех больных. Будучи слабо или умеренно выраженной на ранних стадиях заболевания, по мере его прогрессирования она становится более тяжелой. Отмечаются полихромазия, анизоцитоз, пойкилоцитоз, появляются клетки каплевидной формы. В периферической крови нередко встречаются ядросодержащие эритроциты и незрелые гранулоциты. Часто возникает дефицит фолиевой кислоты, вызванный недостаточным поступлением ее с пищей и повышенным оборотом клеток крови. В случае кровопотерь возникает дефицит железа. Число лейкоцитов часто увеличено, они представлены главным образом зрелыми лейкоцитами, обычно встречаются и незрелые формы.
Число тромбоцитов может быть снижено или увеличено в зависимости от стадии заболевания. На ранних фазах их число может достигать 1000·10 9 /л. Морфология тромбоцитов изменена, в мазке периферической крови встречаются гигантские формы и фрагменты циркулирующих мегакариоцитов. По мере прогрессирования болезни и увеличения селезенки число тромбоцитов уменьшается.
Уровень мочевой кислоты в крови при миелофиброзе обычно высок.
Лечение Миелофиброза:
Специфического лечения нет. Больные с умеренно выраженными симптомами нуждаются только в периодическом обследовании. Анемия является главным поводом для начала терапии. Нередко возникающий дефицит фолатов хорошо поддается лечению фолиевой кислотой. Миелофиброз — одна из немногих болезней, при которых показан длительный профилактический прием фолиевой кислоты в дозе 5 мг/сут. Следует убедиться в том, что у больного не нарушено всасывание витамина B12. Многим больным назначают андрогены, однако последние не всегда эффективны, улучшение состояния если и наступает, то только спустя несколько недель.
Если анемия настолько тяжела, что вызывает сердечно-сосудистые нарушения, то необходимо переливать кровь, стараясь поддерживать гемоглобин на уровне 90-100 г/л. Однако прежде чем приступить к программе повторных гемотрансфузий, следует внимательно оценить общее состояние пациента. После переливания крови подъем уровня гемоглобина часто бывает меньше ожидаемого, и в конечном итоге его прирост становится все меньше по величине и короче по времени, а улучшение состояния длится только 1-2 нед. Это может быть обусловлено разрушением перелитых эритроцитов в селезенке.
Депонирование крови в селезенке является важной причиной развития анемии, степень депонирования необходимо определять с помощью 51 Сг. Очень эффективным средством уменьшения размеров селезенки является миелосан - короткий курс лечения этим препаратом приводит к длительному улучшению состояния больного.
Для уменьшения размеров селезенки используют также ее облучение, результаты которого неоднозначны. Прибегать к спленэктомии у больных пожилого возраста не рекомендуется из-за высокой летальности и многочисленных осложнений, а также из-за возможного реактивного увеличения содержания тромбоцитов. Более безопасен метод эмболизации через внутриартериальный катетер.
Профилактика Миелофиброза:
К каким докторам следует обращаться если у Вас Миелофиброз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Миелофиброза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус папилломы человека: причины появления, симптомы, диагностика и способы лечения.
Определение
Вирусы папилломы человека (ВПЧ) — это группа чрезвычайно распространенных и генетически разнородных ДНК-содержащих вирусов, поражающих эпителий кожных покровов и слизистых оболочек. Вирус папилломы человека относится к семейству папилломавирусов. Было выявлено и описано более 190 типов ВПЧ. Каждый тип отличается более чем на 10% от ближайшего родственного штамма. Из их числа более 30 типов ВПЧ могут инфицировать эпителиальный слой урогенитального тракта. В зависимости от онкогенного потенциала выделяют вирусы высокого (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) и низкого (типы 6, 11, 42, 43, 44) онкогенного риска.
На долю двух высокоонкогенных типов ВПЧ (16 и 18) приходится до 70% случаев рака шейки матки, 80% рака вульвы и влагалища, 92% анального рака, 95% рака ротовой полости, 89% рака ротоглотки, 63% рака полового члена.
При этом 16-й тип имеет самый высокий канцерогенный потенциал. Генотипы ВПЧ 6 и 11 вызывают практически все виды аногенитальных бородавок и большинство случаев рецидивирующего респираторного папилломатоза, который наблюдается в основном у детей младше 5 лет или у лиц 20-30 лет.
Причины появления ВПЧ
Заболевания, вызванные вирусом папилломы человека (ВПЧ), относятся к болезням с латентным началом, хроническим персистирующим течением и проявляются доброкачественными и злокачественными новообразованиями в зоне входных ворот инфекции.
Источником возбудителя инфекции является больной человек или носитель. ВПЧ передается от человека к человеку при оральном, генитальном и анальном половых контактах, а также контактно-бытовым и вертикальным (от матери к ребенку) путями.
Вирус папилломы человека — единственный вирус, который не проникает в кровь, вследствие чего инфекционный процесс протекает без развития воспалительной реакции. В процессе инфицирования вирус папилломы человека поражает незрелые клетки, чаще базального слоя, которые затем становятся постоянным источником инфицирования эпителиальных клеток. Инфицированию способствует наличие микротравм и воспалительных процессов кожи и слизистых оболочек, приводящих к снижению местного иммунитета.
Вирус способен персистировать (хронически присутствовать) в месте проникновения как угодно долго. Инкубационный период заболевания может длиться от нескольких месяцев до нескольких лет. Среднее время между инфицированием ВПЧ и развитием аногенитальных бородавок составляет от 3 месяцев у женщин и до 11 месяцев у мужчин. Инфицирование человека может происходить как одним, так и несколькими типами ВПЧ.
Интервал между инфицированием ВПЧ и прогрессированием до инвазивного рака составляет, как правило, 10 лет или более.
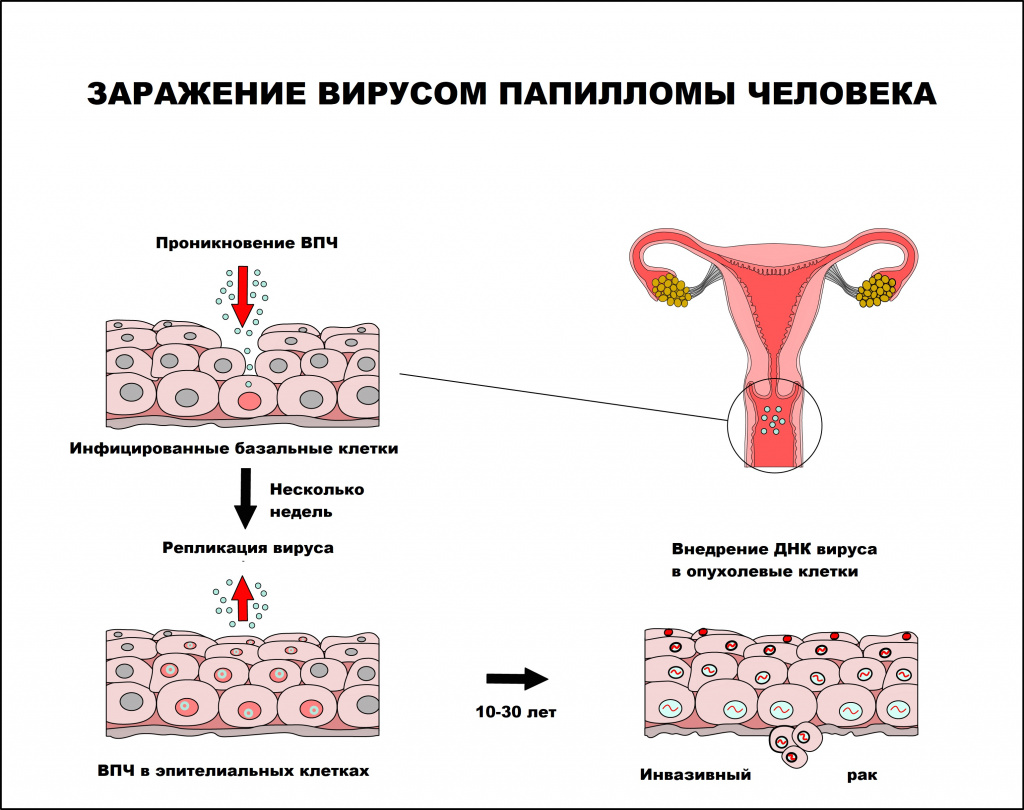
Папилломавирусная инфекция чаще регистрируется у лиц молодого возраста, имеющих большое число половых партнеров. По данным ВОЗ, 50-80% населения инфицировано ВПЧ, но лишь 5-10% инфицированных лиц имеют клинические проявления заболевания.
Классификация заболевания
Общепринятой классификации аногенитальных (венерических) бородавок не существует. Однако выделяют несколько их клинических разновидностей:
- остроконечные кондиломы;
- бородавки в виде папул;
- поражения в виде пятен;
- внутриэпителиальная неоплазия;
- бовеноидный папулез и болезнь Боуэна;
- гигантская кондилома Бушке-Левенштайна (карциномоподобная остроконечная кондилома).
Симптомы ВПЧ
- наличие одиночных или множественных образований в виде папул, папиллом, пятен на кожных покровах и слизистых оболочках половых органов;
- зуд и парестезии (расстройство чувствительности) в области поражения; болезненность во время половых контактов (диспареуния);
- при локализации высыпаний в области уретры наблюдается зуд, жжение, болезненность при мочеиспускании (дизурия); при обширных поражениях в области уретры – затрудненное мочеиспускание;
- болезненные трещины и кровоточивость кожных покровов и слизистых оболочек в местах поражения.
Бородавки в виде папул – папулезные высыпания без пальцеобразных выпячиваний, локализующиеся на кератинизированном эпителии половых органов.
Поражения в виде пятен – серовато-белые, розовато-красные или красновато-коричневые пятна на коже и/или слизистой оболочке половых органов;
Бовеноидный папулез и болезнь Боуэна – папулы и пятна с гладкой или бархатистой поверхностью; цвет элементов в местах поражения слизистой оболочки – бурый или оранжево-красный, а поражений на коже – пепельно-серый или коричневато-черный.
Гигантская кондилома Бушке-Левенштайна – мелкие бородавчатоподобные папилломы, сливающиеся между собой и образующие очаг поражения с широким основанием.
Респираторный папилломатоз – заболевание, при котором папилломы формируются в дыхательных путях, ведущих от носа и полости рта в легкие.
Диагностика ВПЧ
Латентно протекающая инфекция диагностируется только с помощью молекулярно-биологических методов исследования. Субклиническая инфекция диагностируется при молекулярно-биологическом, кольпоскопическом, цитологическом и морфологическом исследовании.
Для улучшения визуализации аногенитальных бородавок может быть проведена проба с 3-5% раствором уксусной кислоты. Тест считается отрицательным, если после обработки уксусной кислотой на поверхности шейки матки нет белых участков. И положительным при выявлении на шейке матки участков белого цвета (ацетобелых участков), отличных от остальной поверхности шейки матки.
Изменения эпителия шейки матки, вызванные ВПЧ, могут быть выявлены цитологическим методом микроскопии слущенных клеток с окраской по Папаниколау (Пап-тест).
Метод окрашивания по Папаниколау - специально разработанный метод, позволяющий с наибольшей степенью достоверности выявить ранние предраковые заболевания шейки матки. Рак шейки матки в структуре злокачественных новообразований репродуктивной системы занимает третье место. До 1992 г. заб.

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
Промотор репликации плазмидного вектора показан оранжевым. Короткие толстые зеленые стрелки представляют экзоны, кодирующие латентные белки: (EBNAs 1, 2, 3A, 3B and 3C, and EBNA‑LP, LMPs 1, 2A and 2B, BHRF1,BARF1). Короткие голубые стрелки сверху представляют наиболее транскрибириуемые полиаденилированные ВЭБ-кодируемые РНК (EBER1, EBER2). Средняя длинная зеленая линия представляет транскрипцию ВЭБ при 3-ем типе латентности, в которой белки EBNA транскрибированы с промотора Ср или Wp. Различные EBNA кодированы индивидуальными мРНК, которые сгенерированы различным сплайсингом одного и того же длинного первичного транскрипта. Внутренняя красная линия представляет транскрипт EBNA1, который берет начало от промотора Qp при 1 и 2 типе латентности.
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.

Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.

Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV

Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.

Иммунитет играет важную роль в исходе острых инфекций. Быстрый, сильный и мультиспецифичный ответ против многих белков вирусов гепатита В (HBV) и гепатита C (HCV) приводит к острой инфекции, устраняемой клеткой-хозяином.
Источники
Oncogenes and RNA splicing of human tumor viruses. Masahiko Ajiro & Zhi-Ming Zheng.(September 2014)
Carcinogenic human papillomavirus infection. Mark Schiffman, John Doorbar, Nicolas Wentzensen, Silvia de Sanjosé, Carole Fakhry, Bradley J. Monk, Margaret A. Stanley & Silvia Franceschi.( December 2016)
Human T-cell lymphotropic virus type 1 and its oncogenesis Lan-lan ZHANG, Jing-yun WEI, Long WANG, Shi-le HUANG, Ji-Long CHEN.(2017)
Immunoblastic Lymphoma in Persons with AIDS-Associated Kaposi's Sarcoma: a Role for Kaposi's Sarcoma–Associated Herpesvirus. Eric A Engels M.D., Stefania Pittaluga M.D., Denise Whitby Ph.D., Charles Rabkin M.D., Yoshiyasu Aoki M.D., Elaine S Jaffe M.D. & James J Goedert M.D.(may 2003)
Kaposi’s sarcoma-associated herpesvirus ORF34 is essential for late gene expression and virus production. Mayu Nishimura, Tadashi Watanabe, Syota Yagi, Takahiro Yamanaka & Masahiro Fujimuro( march 2017)
Саркома Капоши: патогенез и основы терапии Н.С. Потекаев, Г.А. Паньшин, Н.П. Теплюк, Н.С. Арсентьев, Е.Ю.,Вертиева,Г.И. Махов, Е.С. Сизова, В.С. Пауков, М.Г. Карташова. (март 2013)
Human T-Cell Lymphotropic Virus: A Model of NF-κB-Associated Tumorigenesis. Zhaoxia Qu and Gutian Xiao(June 2011)
Immune responses and immunopathology in acute and chronic viral hepatitis. Eui-Cheol Shin, Pil Soo Sung & Su-Hyung Park(July 2016)
Pathogenic mechanisms in HBV and HCV-associated hepatocellular carcinoma. Alla Arzumanyan, Helena M. G. P. V. Reis and Mark A. Feitelson(February 2013) Epstein–Barr virus: more than 50 years old and still providing surprises. Lawrence S. Young, Lee Fah Yap & Paul G. Murray( September 2016)
Медицинская микробиология, вирусология и иммунология. В.В. Зверев, А. С. Быков.
Читайте также:

