Что такое гепатит при котором повышен билирубин
Обновлено: 18.04.2024
Оценка способности печени транспортировать органические анионы и метаболизм ксенобиотиков
Билирубин
Билирубин — продукт катаболизма гемовых соединений. Ежедневно вырабатывается 250-350 мг билирубина. Его концентрация в сыворотке зависит от:
- эффективность сосудистого полюса печеночной клетки;
- усиление этерификации билирубина (глюкуроновой, серной, тауриновой кислотами);
- эффективность желчного полюса гепатоцитов;
- желчная непроходимость.
Причины повышения билирубина
Нарушения образования или метаболизма билирубина приводят к повышению уровня билирубина в сыворотке крови. Наиболее частые причины:
- Чрезмерный распад эритроцитов (гемолиз) или образование непрямого билирубина из негемоглобинового гема или его предшественников в обход основного пути метаболизма (так называемая шунтирующая гипербилирубинемия);
- Нарушение всасывания билирубина клеткой печени из-за нарушения функции сосудистого полюса гепатоцита.
Это происходит при следующих состояниях:
- Негемолитическая врожденная гипербилирубинемия (синдром Жильбера);
- Токсическое поражение печени;
- Вирусное поражение печени;
- Нарушение конъюгации билирубина с гликуроновой, серной, тауриновой кислотами в гепатоците в результате:
- Дефицит UDP-глюкуронилтрансферазы при негемолитической врожденной гипербилирубинемии (синдром Криглера-Наджара типа II);
- Прием некоторых лекарств (включая хлорамфеникол, хлорамбуцил, стрептомицин, прогестерон, рифампицин);
- Повреждение печени токсинами или вирусами;
- Нарушение транспорта глюкуронатов, сульфатов и тауратов билирубина при негемолитической врожденной гипербилирубинемии (синдром Дубина-Джонсона, синдром Ротора);
- Повреждение гепатоцитов и их секреторного полюса из-за:
- Воспаление (вирусное, токсическое или лекарственное);
- Жирная печень;
- Цирроз печени;
- Нарушение транспорта билирубина во внутри- и внепеченочном тракте, вызванное холестазом (поражение более 2/3 желчных протоков проявляется желтухой).
Свободный и связанный билирубин
Биохимическая реакция Ван ден Берга позволяет идентифицировать две фракции билирубина:
- Свободный (неконъюгированный, переносится в крови с альбумином) — иначе известный как непрямой;
- Связанный (конъюгированный с глюкуроновой, серной, тауриновой кислотами) — иначе известный как прямой.
В нормальных условиях общий билирубин сыворотки составляет 0,2–1,2 мг / дл (3,4–20,5 мкмоль / л); > 80% — это непрямой билирубин. Причины повышения непрямого билирубина в сыворотке крови это:
- усиление распада красных кровяных телец;
- нарушение всасывания билирубина в печеночную клетку;
- нарушение кислотно-билирубиновой конъюгации.
Другие нарушения, особенно заболевания печени и желчевыводящей системы с холестазом, характеризуются гипербилирубинемией со значительным повышением прямого билирубина.
В клинической практике чаще всего определяют концентрацию общего билирубина, определение концентрации отдельных фракций важно при диагностике негемолитической врожденной гипербилирубинемии:
- При синдроме Криглера-Наджара I и II типа и при синдроме Жильбера наблюдается гипербилирубинемия с избытком непрямого билирубина;
- При синдроме Дубина-Джонсона и синдроме Ротора, характеризующемся гипербилирубинемией с преобладанием прямого билирубина.
Соотношение концентрации прямого и общего билирубина
Отношение концентрации прямого билирубина к уровню общего билирубина оказалось важным при диагностике острого поражения печени. Используется как прогностический фактор при остром поражении печени (независимо от этиологии): прогноз неблагоприятный, если он превышает 0,3.
Желчные кислоты
Общая концентрация желчных кислот (первичная и вторичная) более чувствительна при оценке транспортной способности печени, а также процессов секреции и резорбции. Общие концентрации желчных кислот в сыворотке крови определяют натощак (в норме
Повышение концентрации желчных кислот происходит при:
- Паренхиматозные заболевания печени;
- Внепеченочный холестаз;
- Внутрипеченочный холестаз у беременных (характерны высокие значения, превышающие норму в 10-100 раз).
Аммиак
При тяжелом поражении печени наблюдаются нарушения выведения аммиака из организма и повышение его сывороточной концентрации. Аммиак — продукт дезаминирования аминокислот; служит субстратом для производства мочевины и, таким образом, устраняется.
- 27-102 мкг / дл (16-60 мкмоль / л) у мужчин;
- 19-87 мкг / дл (11-51 мкмоль / л) у женщин.
Концентрация аммиака определяется при диагностике печеночной энцефалопатии. Симптомы энцефалопатии при тяжелом поражении печени появляются, когда концентрация аммиака превышает 150 мкг / дл и коррелируют с тяжестью заболевания. При печеночной коме концентрация аммиака превышает 300 мкг / дл.
Оценка дезинтоксикационной активности и лекарственной трансформации
Дыхательный тест на аминопирин
Этот тест очень чувствителен при диагностике метаболической функции печени. Аминопирин метаболизируется почти исключительно микросомальной окислительной системой гепатоцитов.
После перорального приема аминопирина, меченного углеродом, через различные интервалы времени определяют концентрацию радиоактивного диоксида углерода в выдыхаемом воздухе. Поскольку это нетипичный биохимический тест, его рассмотрение выходит за рамки данной главы.
Оценка метаболизма соединительной ткани
Концентрация проколлагенового пептида III типа (P-III-P) используется для оценки фиброза и используется для определения степени тяжести цирроза.
Диагностика рака печени
При диагностике гепатоцеллюлярной карциномы измеряется α-фетопротеин (AFP). Это α 1 -глобулин, продуцируемый в печени плода и в небольших количествах другими клетками желудочно-кишечного тракта плода, а у взрослых — опухолевыми клетками, происходящими из гепатоцитов, но также встречается при остром и хроническом гепатите, циррозе и метастазах рака в печень. Норма ≤5 нг / мл, концентрация> 20 нг / мл — показание к ультразвуковому исследованию печени,> 400 нг / мл — гепатоцеллюлярная карцинома.
Диагностика асцита
Биохимические лабораторные тесты полезны для диагностики этиологии асцита при асците
- Количество гранулоцитов; например, идиопатическое бактериальное воспаление диагностируется не только на основании бактериологических тестов — асцитическая жидкость, собранная во время диагностического парацентеза, показывает высокий плеоцитоз (> 250 нейтрофилов с полиморфным ядром в мм 3). Причем источник инфекции не может быть обнаружен в брюшной полости;
- Активность ЛДГ — помогает различать экссудат (высокая активность ЛДГ) и транссудат (низкая активность ЛДГ);
- Уровни белка и холестерина (в асцитной жидкости и сыворотке); отношение концентрации белка и холестерина в плазме к их концентрации в перитонеальной жидкости> 4 указывает на транссудатный характер жидкости, значения
- Сывороточный альбумин и асцитная жидкость; градиент альбумина (SAAG), то есть разница в концентрации альбумина в сыворотке и асцитической жидкости — это важный биохимический индикатор портальной гипертензии. SAAG> 11 г / л предполагает асцит, связанный с портальной гипертензией (обычно при циррозе, патологии сосудов печени или сердечной недостаточности). Значения
Серологические исследования

Серологические исследования
Серологические тесты проводятся для выявления этиологических факторов заболевания печени. Наиболее часто ищутся серологические маркеры вирусных гепатитов HAV, HBV, HCV, HDV, HEV, цитомегаловирус (CMV) и вирус Эбштейна-Барра (EBV).
Инфекция HAV
Диагноз гепатита А основан на определении наличия в сыворотке крови:
- РНК ВГА;
- Анти-ВГА IgM (анти-ВГА IgG указывают на инфекцию и служат свидетельством приобретенного иммунитета).
Инфекция HBV
Диагноз гепатита В ставится на основании ряда серологических тестов, включая определение в сыворотке крови:
- ДНК ВГВ;
- HBsAg;
- HBeAg;
- IgM и IgG анти-HBs;
- IgM и анти-HBc IgG.
Инфекция ВГС
Диагностика ВГС-инфекции включает определение:
Инфекция HDV
Диагноз гепатита D предполагает определение:
- РНК HDV;
- HDAg;
- IgM к HDV;
- IgG к HDV.
Инфекции другими гепатотропными вирусами
При серологической диагностике других вирусных гепатитов определяются специфические IgM и IgG (например, анти-CMV IgM и IgG, анти-EBV IgM и IgG).
Аутоиммунный гепатит
При диагностике аутоиммунного гепатита в сыворотке измеряют неспецифические антитела, при рутинной диагностике это:
- Антиядерные антитела (ANA);
- Антитела против гладких мышц (ASMA — антитела против гладких мышц);
- Антитела к микросомальным антигенам печени и почек (LKM-1 — антитела к микросомам печени и почек);
- Растворимые антитела печени (SLA).
Иногда дополнительно отмечают:
- Антитела против цитоплазматических антигенов нейтрофилов (ANCA — антинейтрофильные цитоплазматические антитела);
- (Относительно редко) антитела против рецепторов асиалогликопротеинов (ASGP-R — антитела к рецепторам асиалогликопротеинов);
- (Также редко) антитела против цитозоля печени (LC1).
Антимитохондриальные антитела (АМА) — это основной параметр иммунологической диагностики первичного билиарного цирроза.
Резюме
Лабораторная диагностика заболеваний верхних и нижних отделов желудочно-кишечного тракта носит вспомогательный характер, в основе лежат визуальные и морфологические исследования.
Биохимическая основа диагностики целиакии — серологические тесты, то есть определение антител:
- против эндомизма (EmA);
- против тканевой трансглутаминазы (тТГ).
Биохимические тесты, включая определение активности липазы и амилазы в сыворотке и моче, играют ключевую роль в диагностике острого панкреатита.
Диагноз хронического панкреатита основывается в основном на визуализирующих исследованиях, при этом лабораторные тесты имеют второстепенное значение.
Диагностика патологии печени во многом основывается на лабораторных показателях. Высокая активность индикаторных ферментов свидетельствует о поражении паренхимы печени, а повышенная активность выделительных ферментов — о патологии желчевыводящей системы, например, холестазе.
Обратный индекс де Ритиса (АСТ / АЛТ> 1) может указывать на алкогольную болезнь печени.
Серологические тесты проводятся для поиска причины заболевания печени.
Синдром Жильбера - врожденное заболевание печени, основным проявлением которого является гипербилирубиномия преимущественно за счет неконъюгированного (свободного) непрямого билирубина, желтуха, накопление в гепатоцитах пигмента липофусцина.
Интерес к этой болезни обусловлен тем, что она встречается не так редко, как предполагалось ранее. В различных регионах частота встречаемости синдрома Жильбера составляет от 5 до 11% в популяции. В связи с этим синдром Жильбера необходимо включать в программу диагностического скрининга у больных с гипербилирубиномией. Мужчины страдают синдрмом Жильбера в 10 раз чаще женщин.
Клиническая симптоматика (симптомы)
В основе патогенеза болезни Жильбера лежит нарушение захвата, транспорта или конъюгации билирубина в гепатоцитах, связанное с генетически обусловленным дефектом микросомного фермента уридиндифосфатглюкуронилтрансферазы (УДФГТ), при участии которого в микросомах цитоплазматической сети происходит связывание билирубина с глюкуроновой кислотой. Из-за недостаточной активности УДФГТ печень может полностью терять способность конъюгировать (обезвреживать) билирубин
В патогенезе заболевания, кроме того, важную роль играет нарушение транспортной функции белков, доставляющих билирубин к микросомам гепатоцита.
Как правило, заболевание проявляется в подростковом возрасте и продолжается в течение всей жизни. Около 30% больных не предъявляют никаких жалоб. Длительное время оно может протекать латентно, не сопровождаться изменением цвета кожи и склер, заметных для пациента и родственников. В большинстве случаев синдром бывает случайной находкой при обследовании больного по поводу других заболеваний.
Обычно заболевание протекает триадой симптомов:
- перемежающаяся желтуха – гипербилирубиномия обусловлена преимущественно повышением уровня неконъюгированного билирубина;
- астеноневротические симптомы;
- абдоминальные боли и диспепсические нарушения.
Для клиники заболевания типична легкая иктеричность склер, желтушное окрашивание кожи. Появление желтухи провоцируется влиянием самых разнообразных факторов: нервного и физического напряжения, острых простудных заболеваний, приема некоторых препаратов, острой, жареной пищи, а также голодания. Отмечается непереносимость алкогольных напитков.
Кроме того, необходимо учитывать, что из-за сниженной активности микросомных ферментов печени проявляется токсическое действие метаболитов парацетамола, образующихся в системе цитохрома Р-450.
Больные часто могут жаловаться на тяжесть, постоянные тупые боли в правом подреберье, тошноту, рвоту, отсутствие аппетита, отрыжку, чередование запоров и поносов. В связи с увеличением концентрации в крови свободного билирубина могут появляться симптомы поражения центральной нервной системы, сопровождающиеся повышенной утомляемостью, раздражительностью, головной болью, реже – нарушением сна.
Прогноз благоприятный. Однако при длительном течении заболевания нередко развивается желчнокаменная болезнь, обнаруживаются дуоденальные язвы. При пальпации печень увеличена или определяется у края реберной дуги. У некоторых больных нерезкая гепатомегалия может быть обусловлена сопутствующим болезни Жильбера гемолитическим компонентом. Селезенка у большинства больных нормальных размеров. Общий анализ крови: в 30% случаев выявляется увеличение содержания гемоглобина (свыше 160 г/л), эритроцитоз, уменьшенная СОЭ. Моча остается обычной окраски, не содержит билирубин, иногда обнаруживаются следы уробилиногена. Активность цитолитических ферментов сыворотки крови в период ремиссии остается нормальной. В период обострения заболевания их активность может незначительно увеличиваться. Кал обесцвечен, иногда слабо окрашен за счет стеркобилина.
Течение болезни Жильбера длительное, волнообразное. С течением времени она может трансформироваться в хронический персистирующий гепатит.
Лабораторные исследования
Назначается общий анализ крови; общий анализ мочи с определением билирубина, уробилина; копрограмма с определением стеркобилина. Общий анализ крови при синдроме Жильбера, как правило остается без изменений.
Исследуют биохимические показатели: содержание билирубина и его фракций, холестерина, активность АЛТ, АСТ, ГГТ, определяют наличие маркеров вирусных инфекции - гепатит В, гепатит С и гепатит G. Для болезни Жильбера характерно увеличение уровня свободной фракции билирубина. Прямой генетический анализ позволяет выявить полиморфизм генов, ответственных за клинические проявления синдрома Жильбера.
Инструментальное обследование
Для детально диагностики болезни Жильбера проводят УЗИ органов брюшной полости, в сомнительных случаях пункционную биопсию печени. В биоптатах печени больных синдромом Жильбера выявляется нормальная морфологическая картина при значительном накоплении в гепатоцитах липофусцина.
Болезнь Жильбера: лечение
Синдром Жильбера не является поводом для назначения какого-либо специфического лечения. Рекомендуется полноценное, калорийное питание с достаточным содержанием жиров. Запрещается употребление алкоголя, следует избегать эмоциональных и физических перегрузок, приема лекарственных препаратов, способных индуцировать желтуху.
При частых эпизодах гипербилирубиномии для лечения больных с синдромом Жильбера применяют фенобарбитал, который назначают по 0,05-0,1 г 2-3 раза в день в течение 1-2 недели. Обычно через 7-10 дней уровень билирубина в крови снижается до нормы.
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Синдром Жильбера — это генетический пигментный гепатоз с аутосомно-доминантным типом наследования, протекающий с повышением уровня неконъюгированного (свободного) билирубина, чаще проявляющееся в период полового созревания и характеризующийся доброкачественным течением [1] .
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
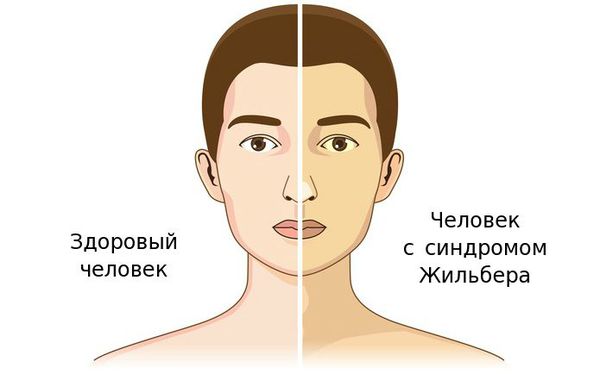
К провоцирующим факторам проявления синдрома можно отнести:
- голодание или переедание;
- жирную пищу;
- некоторые лекарственные средства;
- алкоголь;
- инфекции (грипп, ОРЗ, вирусный гепатит);
- физические и психические перегрузки;
- травмы и оперативные вмешательства.
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
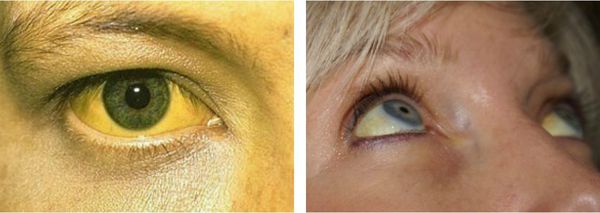
- желтуха различной степени выраженности;
- ксантелазмы век (жёлтые папулы);
- периодичность появления симптомов [1] .
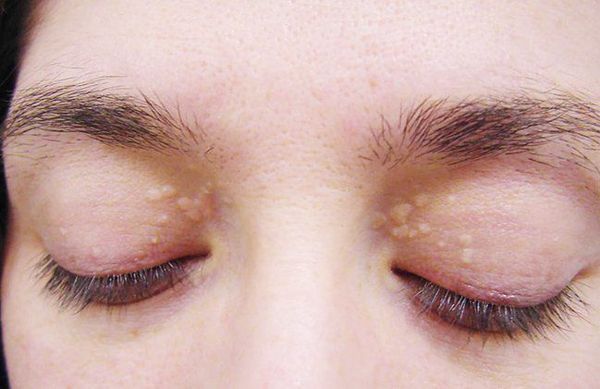
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
- слабость;
- недомогание;
- подавленность;
- плохой сон;
- снижение концентрации внимания.
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
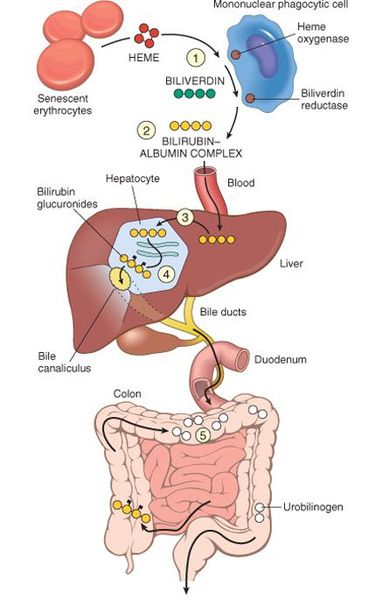
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами ("жирами") клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
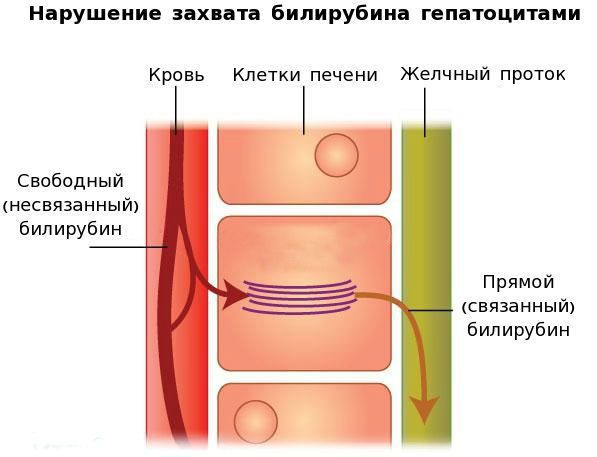
В конечном итоге вышеперечисленные патологические процессы приводят к увеличению содержания свободного (несвязанного) билирубина в плазме, что обуславливает клинические проявления заболевания [6] .
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Что такое гепатит Б? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит В (Б) — острое и хроническое инфекционное заболевание, вызываемое вирусом гепатита В, с гемоконтактным механизмом передачи (через кровь), протекающее в различных клинико-морфологических вариантах, и возможным развитием цирроза печени и гепатоцеллюлярной карциномы. Всего в мире, по самым скромных оценкам, инфицировано более 250 млн человек.
Этиология
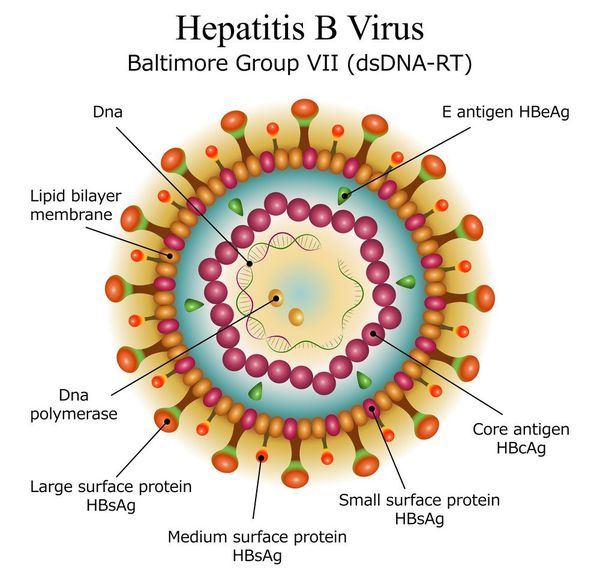
вид — вирус гепатита В (частица Дейна)
Развитие вируса гепатита Б происходит в гепатоцитах (железистых клетках печени). Он способен к интеграции в ДНК человека. Имеются 9 генотипов вируса с различными подтипами — генетическая изменчивость позволяет вирусу образовывать мутантные формы и ускользать от действия лекарств.
Имеет ряд собственных антигенов:
- поверхностный HbsAg (австралийский). Появляется за 15-30 дней до развития болезни, свидетельствует об инфицировании (не всегда). Антитела к HbsAg выявляются через 2-5 месяцев от начала заболевания, а сам HbsAg исчезает из крови (при благоприятном течении процесса);
- сердцевинный HbcorAg (ядерный, коровский). Появляется в инкубационном периоде и совместно с ним появляются антитела (HbcorAb). Длительное присутствие HbcorAg в крови свидетельствует о вероятной хронизации процесса (неадекватный иммунный ответ);
- антиген инфекциозности и активного размножения вируса (HbeAg). Появляется совместно с HbsAg и отражает степень инфицированности. Его продолжительная циркуляция в крови является свидетельством развития хронизации процесса, а антитела к нему являются благоприятным прогностическим признаком (не всегда, но по меньшей мере указывают на возможность более благоприятного процесса, срок их циркуляции после выздоровления окончательно не определён, но не более пяти лет после благоприятного разрешения процесса);
- HbxAg — регулятор транскрипции, способствует развитию гепатокарциномы.
Вирус гепатита В чрезвычайно устойчив к действию всевозможных естественных факторов окружающей среды, инактивируется при 60 °C за 10 часов, при 100 °C за 10 минут, при оптимальной температуре сохраняется до 6 месяцев, при автоклавировании погибает за 5 минут, в сухожаровом шкафу — через 2 часа, 2% раствор хлорамина убивает вирус за 2 часа. [1] [3]
Эпидемиология
Источник инфекции — только человек, больной острой или хронической формой инфекции.
Механизм передачи: гемоконтактный и вертикальный (от матери к ребёнку), не исключается трансмиссивный механизм передачи (например, при укусах комаров в результате раздавливания и втирания инфицированного тела комара в поврежденную ткань человека).
Пути передачи: половой, контактно-бытовой, гемотрансфузионный (например, при переливании крови или медицинских манипуляциях). Восприимчивость всеобщая. Заболеваемость — 30-100 человек на 100 тысяч населения (зависит от страны). Летальность от острых форм — до 2%. После перенесённого острого заболевания при условии выздоровления иммунитет стойкий, пожизненный.
Для заражения характерна малая заражающая доза (невидимые следы крови). [1] [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита Б
Инкубационный период гепатита В длится от 42 до 180 дней (следует иметь в виду, что наличие клинической симптоматики характеризует лишь незначительную долю всех случаев заболевания).
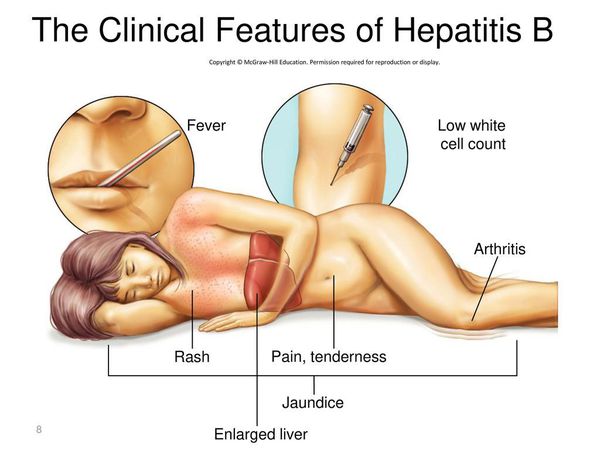
Начало постепенное. Характерные синдромы:
- общей инфекционной интоксикации (проявляется как астеноневротический синдром);
- холестатический (нарушение секреции желчи);
- артрита;
- нарушения пигментного обмена (появление желтухи при уровне общего билирубина свыше 40 ммоль/л);
- геморрагический (кровоточивость кровеносных сосудов);
- экзантемы;
- отёчно-асцитический (скопление жидкости в брюшной полости);
- гепатолиенальный (увеличение печени и селезёнки).
При первых признаках гепатита B нужно обратиться к доктору.
Первые признаки гепатита B
Начальный (преджелтушный) период продолжается 7-14 дней. Чаще протекает по многообразному типу с болевыми ощущениями в различных суставах по ночам и утром, уртикарными высыпаниями, астеновегетативными проявлениями (снижение аппетита, апатия, нервозность, слабость, разбитость, повышенная утомляемость). Изредка развивается синдром Джанотти-Крости — симметричная, яркая пятнисто-папулёзная сыпь. Не исключены умеренные диспептические явления (расстройства пищеварения). К концу периода происходит потемнение мочи, обесцвечивание кала.
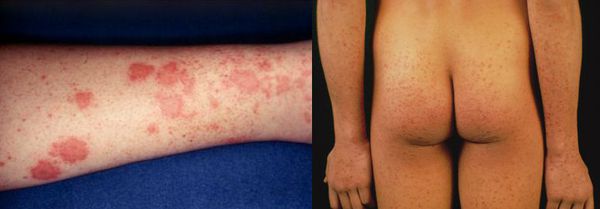
Желтушный период
Этот период продолжительностью около одного месяца характеризуется возникновением желтушного окрашивания кожи (различных оттенков) на фоне продолжающегося или ухудшающегося общего состояния. Характерна длительность и стойкость симптоматики. Появляется тяжесть и болезненность в правом подреберье, горечь во рту, тошнота, выражённый зуд кожи (практически не снимаемый никакими средствами). На фоне усиления астеноневротического компонента появляются геморрагические проявления, урежение пульса, гипотензия, отёки (отражает степень интоксикации и нарушения функций печени).
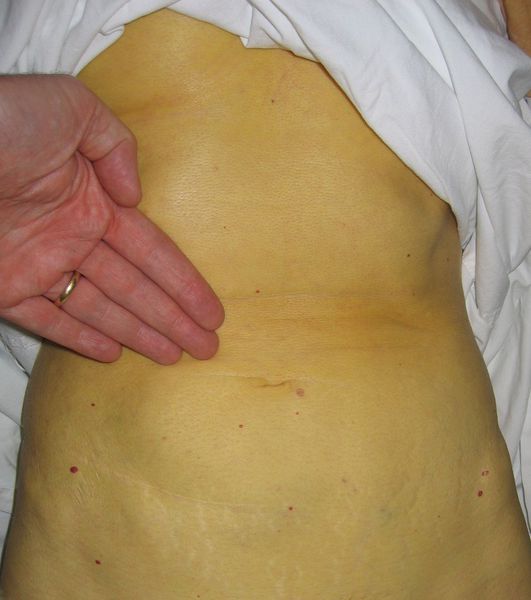
Выздоровление
Следующим этапом в развитии болезни является нормализации общего состояния, спадение желтухи и реконвалесценция, которая в зависимости от конкретной ситуации и состояния иммунной системы может закончиться как выздоровлением, так и движением развития заболевания в хроническое течение, характеризующееся маловыраженой неусточивой симптоматикой, преимущественно в виде слабости, периодического дискомфорта в правом подреберье, бурно сигнализирующим лишь на стадии цирроза и полиорганных осложнений.
- гепатиты другой этиологии;
- желтухи другой этиологии (например, гемолитическая болезнь, токсическое поражение, опухоли);
- малярия; ;
- лептоспироз;
- ревматоидный артрит.
Гепатит В у беременных
Острый гепатит характеризуется более тяжёлым течением у беременной, возникновении повышенного риска преждевременных родов, аномалий развития плода на ранних сроках и кровотечений. Вероятность передачи при острой форме зависит от сроков беременности: в первом триместре риск 10% (но более тяжёлые проявления), в третьем триместре — до 75% (чаще бессимптомное течение после родов). У большинства детей при заражении во внутриутробном и постнатальном периодах происходит хронизация инфекции. [1] [3] [6]
Патогенез гепатита Б
С движением кровяной массы вирус попадает в печеночную ткань, где локализуется в гепатоцитах и теряет свою протеиновую сферу в лизосомах. Происходит выход вирусной ДНК с последующим ресинтезом аномальных протеинов LSP, а параллельно образование новых частиц Дейна.
В процессе эволюции вирусчеловеческого взаимодействия возможно развитие двух вариантов:
При репликативном пути происходит следующее: белки LSP совместно с HbcorAg вызывают увеличение продукции гамма-интерферона, что приводит к активации главного комплекса гисотсовместимости (HLA), проистекает преобразование молекул гистосовместимости 1 и 2 классов, в результате чего клетка становиться для организма враждебной в антигенном формате.
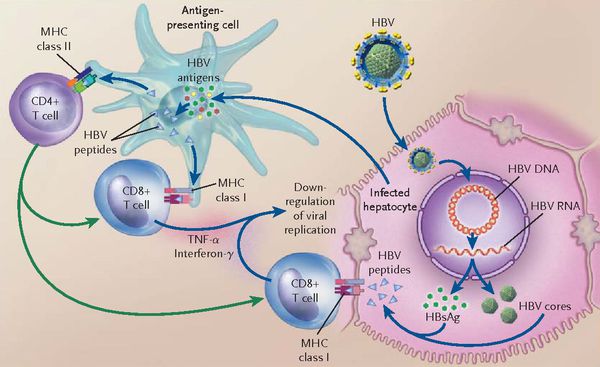
Антигенпрезентирующие макрофаги содействуют изменению В-лимфоцитов в плазматические клетки и экспрессии ими агрессивных белков-антител к посторонним антигенам. В итоге на поверхности печёночных клеток формируются вирусспецифические иммунные комплексы (антиген + антитело + фракция комплемента С3в).
В динамике может реализоваться два сценария:
- в первом варианте запуск каскада комплимента ведёт к появлению в составе иммунных комплексов агрессивной фракции С9 (мембранатакующий комплекс) — наблюдается значительный некроз гепатоцитов без участия лимфоцитов (молниеносная форма гепатита В);
- при альтернативной варианте (наблюдающимся в большинстве случаев) каскад комплемента в силу иммуноиндивидуалистических свойств не активируется — тогда идёт умеренное разрушение Т-киллерами меченых антителами заражённых вирусом гепатоцитов. Образуются ступенчатые некрозы с образованием на месте гибели гепатоцитов соединительной ткани — рубцов (то есть острый гепатит В при плохом иммунном ответе постепенно переходит в хронический).
Непременным атрибутом патогенеза является формирование иммунопатологического процесса. Гибель гепатоцитов, инфицированных вирусом гепатита В, следует за счёт иммунокомпетентных частиц, Т-киллеров и макрофагальных элементов.
Серьёзным значением является нарушение свойств мембраны клеток печени, что сопровождается экскрецией (выделением) лизосомальных ферментов, разрушающих гепатоциты. Сообразно этому, гибель гепатоцитов происходит за счёт иммунокомпетентных клеток, лизосомальных ферментов и противопечёночных гуморальных аутоантител, то есть острая болезнь наступает (и благоприятно заканчивается) только при хорошем иммунитете, а при плохом идёт хронизация.
При тяжёлом цитолитическом синдроме (массивные некрозы гепатоцитов) возникает гипокалиемический алкалоз, острая печёночная недостаточность, печёночная энцефалопатия (ПЭП), церебротоксическое действие, нарушение функции обмена нервной ткани. [2] [3] [6]
Классификация и стадии развития гепатита Б
По цикличности течения:
- острый;
- острый затяжной;
- хронический.
По клиническим проявлениям:
- субклинический (инаппарантный);
- клинически выраженный (желтушный, безжелтушный, холестатический, фульминантный).
По фазам хронического процесса:
Группы риска хронического гепатита B
Хроническим гепатитом чаще страдают дети младше шести лет. При заражении в первый год жизни он развивается в 80–90 % случаев, от года до шести лет — в 30–50 %, у взрослых без сопутствующих заболеваний — менее чем в 5 %. [7]
Осложнения гепатита Б
Чем опасен гепатит Б
Заболевание может привести к острой печёночной недостаточности (синдрому острой печеночной энцефалопатии).
Выделяют четыре стадии болезни:
Диагностика гепатита Б
Многообразие форм, тесная взаимосвязь с иммунной системой человека и зачастую достаточно высокая стоимость исследований часто затрудняют принятие конкретного решения и диагноза в стационарный отрезок времени, поэтому во избежание роковых (для больного) ошибок следует подходить к диагностике с учётом всех получаемых данных в динамическом наблюдении:
- общеклинический анализ крови с лейкоцитарной формулой (лейкопения, лимфо- и моноцитоз, уменьшение СОЭ, тромбоцитопения);
- общий анализ мочи (появление уробилина);
- биохимический анализ крови (гипербилирубинемия в основном за счёт связанной фракции, повышение уровня АЛТ и АСТ, ГГТП, холестерина, щелочной фосфатазы, снижение протромбинового индекса, фибриногена, положительная тимоловая проба);
- маркеры гепатита В: HbsAg, HbeAg, HbcorAg, HbcorAb IgM и суммарные, HbeAb, anti-Hbs, ПЦР в качественном и количественном измерении);
- УЗИ органов брюшной полости, КТ и МРТ диагностика;
- фиброскан (применяется для оценки степени фиброза). [3][4]
Скрининг при хроническом гепатите
Пациентам с хроническим гепатитом В рекомендуется не реже чем раз в полгода проходить обследование: УЗИ органов брюшной полости, клинический анализ крови, АЛТ, АСТ, тест на альфа-фетопротеин. Скрининг позволяет вовремя заметить обострение болезни и начать специфическую терапию.
Лечение гепатита Б
Лечение острых форм гепатита В должно осуществляться в стационаре (учитывая возможность быстрых и тяжёлых форм болезни), хронических — с учётом проявлений.
Диета и режим при гепатите В
В острый период показан постельный режим, печёночная диета (№ 5 по Певзнеру): достаточное количество жидкости, исключение алкоголя, жирной, жареной, острой пищи, всё в мягком и жидком виде.
Медикаментозная терапия
При лёгкой и средней тяжести острого гепатита этиотропная противовирусная терапия (ПВТ) не показана. При тяжёлой степени и риске развития осложнений назначается специфическая противовирусная терапия на весь период лечения и возможно более длительное время.
В лечении хронических форм гепатита показаниями к назначению ПВТ является наличие уровня DNA HBV более 2000 МЕ/мл (при циррозе печении независимо от уровня), умеренное и высокое повышение АЛТ/АСТ и степени фиброза печёночной ткани не менее F2 по шкале METAVIR, высокая вирусная нагрузка у беременных женщин. В каждом конкретном случае показания определяются индивидуально, в зависимости от выраженности процесса, временной тенденции, пола, планирования беременности и другого.
Существует два пути противовирусного лечения:
- терапия пегилированными интерферонами (имеет ряд существенных противопоказаний и серьёзных побочных эффектов — не менее 12 месяцев);
- нуклеозидно-аналоговой терапии NA (используются препараты с высоким порогом резистентности вируса, длительно — не менее пяти лет, удобство применения, хорошая переносимость).
В отдельных случаях может рассматриваться применение комбинированной терапии.
Из средств патогенетической терапии в острый период используются внутривенно вводимые растворы 5% глюкозы, дезинтоксикантов, антиоксидантов и витамины. Показан приём энтеросорбентов, ферментных препаратов, при выраженном холестазе применяются препараты Урсодезоксихолевой кислоты, при тяжёлом течении — глюкокортикостероиды, методы аппаратного плазмофереза.
В хронической стадии заболевания при наличии соответствующей активности процесса и невозможности назначения ПВТ может быть показан приём групп гепатопротекторов и антиоксидантов. [1] [3]
Прогноз. Профилактика
Основное направление профилактики на сегодняшний день — это проведение профилактической вакцинации против гепатита В в младенческом возрасте (в том числе усиленная вакцинация детей, рождённых от матерей с гепатитом В) и далее периодические ревакцинации раз в 10 лет (или индивидуально по результатам обследования). Достоверно показано, что в странах, где была введена вакцинация, резко сократилось количество вновь выявленных случаев острого гепатита В.
Вторая составляющая стратегии профилактики включает обеспечение безопасности крови и её компонентов, использование одноразового или стерилизованного инструментария, ограничение числа половых партнёров и использование барьерной контрацепции. [1] [2]
Читайте также:

