Что такое иммуноферментный анализ на гепатит в
Обновлено: 17.04.2024
В основе всех серологических реакций лежит взаимодействие антигена и антитела.
Метод обнаружения с диагностической целью антител в сыворотке крови обследуемого .
В этом случае из двух компонентов реакции (антитело, антиген) неизвестным является сыворотка крови, так как постановка реакции проводится с заведомо известными антигенами. Положительный результат реакции свидетельствует о наличии в крови антител, соответствующих применяемому антигену; отрицательный результат указывает на отсутствие таковых.
С внедрением в практику лабораторий метода иммуноферментного анализа (ИФА) стало возможным определять в крови больных антитела, относящиеся к различным классам иммуноглобулинов (JgM и JgG), что существенным образом повысило информативность серологических методов диагностики.
Метод полимеразной цепной реакции (ПЦР)
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать. Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеинов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется.
Для диагностики достаточно одной молекулы ДНК, т. е. одной бактерии или вирусной частицы. Введение в реакцию дополнительного этапа — синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы — позволило тестировать РНК-вирусы, например вирус гепатита С.
ПЦР — это трехступенчатый процесс , повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
-
Преимущество ПЦР в диагностике инфекционных заболеваний перед другими методами исследований заключается в следующем:
- возбудитель инфекции может быть обнаружен в любой биологической среде организма, в том числе и в материале, получаемом при биопсии;
- возможна диагностика инфекционных болезней на самых разных стадиях заболевания;
- возможность количественной оценки результатов исследований ( сколько вирусов или бактерий содержится в исследуемом материале);
- высокая чувствительность метода.
Исследования вирусов гепатита
В настоящее время выделяют следующие формы вирусных гепатитов: гепатит А, гепатит В, гепатит С, гепатит D, гепатит Е, гепатит G и гепатит ТТ. Для диагностики каждой из перечисленных форм вирусных гепатитов используется определенный перечень маркеров.
Вирусный гепатит А
Гепатит А — острая энтеровирусная инфекция. Возбудитель — вирус гепатита А (ВГА,HAV) — энтеровирус типа 72. Геном вируса представлен однонитчатой РНК. Вирус гепатита А содержит единственный антиген (HA-Ag). Удельный вес гепатита А в суммарной заболеваемости вирусными гепатитами составляет 70-80%. В структуре заболеваемости гепатитом А дети составляют до 80%, причем основная масса — дошкольники и школьники начальных классов.
Вирусный гепатит В
Гепатит В – вирусная антропонозная инфекция. Возбудитель вирус гепатита В (ВГВ, HBV) – относится к семейству гепаднавирусов, ДНК-содержащих вирусов, поражающих клетки печени. Вирионы ВГВ имеют наружную липопротеидную оболочку и нуклеокапсид, содержащий двунитчатую ДНК и ДНК-зависимую ДНК-полимеразу.
В диагностике вирусного гепатита В ведущее значение имеет определение комплекса маркеров гепатита. Свыше 5% населения планеты охвачено этой инфекцией, а частота безжелтушных форм ВГВ составляет, по данным разных авторов, от 60 до 82%.
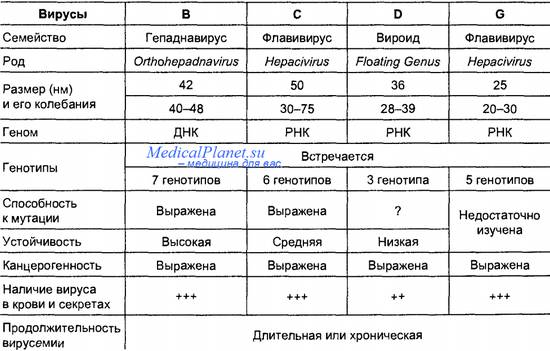
Вирус гепатита С, генотипы
Гепатит С (ВГС) – вирусное заболевание, наиболее часто протекающее в виде посттрансфузионного гепатита с преобладанием безжелтушных и легких форм и склонное к хронизации процесса.
Возбудитель - вирус гепатита С – имеет сходство с флавовирусами, содержит РНК. На основе филогенетического анализа выделено 6 генотипов ВГС и более 80 субтипов.
Генотип 1 - наиболее распространенный генотип во всем мире (от 40 до 80%). Генотип 1а является доминирующим для США, а 1b преобладает в Западной Европе и Южной Азии.
Генотип 2 распространен во всем мире, однако встречается с меньшей частотой, чем генотип 1 (от 10 до 40%).
ВГС тип 3 характерен для Индии, Пакистана, Австралии и Шотландии. Генотип 4 распространен преимущественно в Средней Азии и Египте, генотип 5 – в Южной Африке, а генотип 6 – в Гонконге и Мокао.
Примерно 90% всех случаев посттрансфузионных гепатитов связано с ВГС. Среди доноров антитела к вирусу гепатита С (анти-ВГС) обнаруживают в 0,2-5% случаев.
У 40-75% пациентов регистрируется бессимптомная форма болезни, у 50-75% больных острым ВГС формируется хронический гепатит, у 20% из них развивается цирроз печени. Важная роль ВГС отводится и в этиологии гепатоклеточной карциномы.
Геном вируса гепатита С представлен одноцепочечной положительно заряженной РНК, которая кодирует 3 структурных и 5 неструктурных белков. К каждому из этих белков вырабатываются антитела, обнаруживаемые в крови больных гепатитом С.
Отличительной чертой ВГС является волнообразное течение заболевания, в котором разграничивают 3 фазы: острую, латентную и фазу реактивации.
Для острой фазы характерно повышение активности печеночных ферментов в сыворотке крови, уровня антител класса IgM и IgG к ВГС с нарастанием титров, а также РНК ВГС.
Латентная фаза характеризуется отсутствием клинических проявлений, наличием в крови антител класса IgG к ВГС в высоких титрах, отсутствием антител класса IgM и РНК ВГС либо их присутствием в низких концентрациях на фоне незначительного повышения активности печеночных ферментов в периоды обострения.
Для фазы реактивации характерно появление клинических признаков, повышение активности печеночных ферментов, наличие антител класса IgG (к нуклеокапсидному белку core и неструктурным белкам NS) в высоких титрах, присутствие РНК ВГС и нарастание титров антител класса IgM к ВГС в динамике.
Вирусный гепатит D
Гепатит D – вирусная инфекция, вследствие биологических особенностей вируса протекающая исключительно в виде ко- или суперифекции при гепатите В, характеризующаяся тяжелым течением,
часто неблагоприятным исходом.
Самостоятельно, без вируса В, вирус гепатита D не может попасть в организм человека
Возбудитель – вирус гепатита D (ВГD), по своим биологическим свойствам приближается к вироидам – обнаруженным молекулам нуклеиновых кислот. Печень человека – единственное место размножения (репликации) ВГD.
Известно существование двух вариантов инфекции: коинфекция (одновременное заражение ВГВ и ВГD) и суперинфекция (заражение HBsAg-позитивных пациентов). Сочетание ВГВ и ВГD сопровождается развитием более тяжелых форм патологического процесса, что определяется главным образом действием ВГD.
Летальность при суперинфекции достигает 15-20%. Инфицирование дельта-вирусом может вызывать острое заболевание, заканчивающееся выздоровлением, или формировать хроническое носительство ВГD.
При гепатите D могут отсутствовать в крови маркеры гепатита В – анти НВс и НВs-антиген – и наблюдается угнетение ДНК-полимеразной активности, так как ВГD ингибирует репликацию вируса гепатита В.
ИФА в диагностике вирусных гепатитов. Возможности иммуноферментного анализа
Специфическая лабораторная диагностика вирусных гепатитов основывается на применении иммунохимических и молекулярно-биологических методов исследований. Основными иммунохимическими методами являются радиоизотопный или радиоиммунный (РИА) и иммуноферментный (ИФА). В основе иммунохимических методов диагностики лежит специфическое взаимодействие антиген — антитело с последующим выявлением комплекса при помощи специальных меток. Наиболее распространенным является иммуноферментный анализ.
В результате инкубации иммуносорбента и испытуемой сыворотки при наличии определяемого агента происходит их связывание в комплекс антиген — антитело. После процедуры промывки, в ходе которой удаляются несвязанные антигены и антитела, проводится инкубация с конъюгатом. В качестве конъюгата при детекции HBsAg используют анти-HBs, при детекции антител к вирусу гепатита С —антитела к иммуноглобулинам человека (антивидовой конъюгат), меченные пероксидазой хрена. В итоге этой инкубации происходит присоединение к уже имеющимся комплексам антиген — антитело дополнительно внесенного конъюгата. После удаления несвязавшегося конъюгата (отмывки) в лунки вносится субстрат. При использовании пероксидазного конъюгата в качестве субстрата используют перекись водорода в сочетании с индикатором, в качестве которого наиболее часто применяют ортофенилендиамин (ОФД) или тетраметилбензидин (ТМБ). Результат оценивается фотометрически.
Качество и надежность аналитических возможностей иммуноферментного метода характеризуются рядом критериев, к числу которых относятся чувствительность, специфичность, правильность и воспроизводимость.

Чувствительность — то минимальное количество вещества, которое может быть обнаружено при помощи иммуноферментного анализа. При этом нижним пределом чувствительности данного метода является концентрация исследуемого вещества в образце, которая соответствует наименьшему положительному результату определения, статистически достоверно отличающемуся от показателей заведомо отрицательных образцов. Чувствительность ИФТС зависит от ряда обстоятельств, связанных как с конструкцией тест-системы (аффинность иммуносорбента, качества экстракционных и буферных систем), так и разрешающей способностью и точностью метода регистрации.
Специфичность — способность выявлять именно те компоненты, для определения которых предназначена данная иммуноферментная тест-система. Специфичность ИФА определяется во многом перекрестной реакцией антител или антигенов (то есть композиции, используемой в качестве иммуносорбента), с близкородственными соединениями, а также составом инкубационной среды (матрикс-эффект).
Правильность — соответствие среднего значения результатов повторных определений одного и того же контрольного образца с истинной величиной измеряемого параметра. Правильность определения в ИФА зависит от качества самой тест-системы и контрольного образца. Для хороших иммуноферментных тест-систем показатели правильности лежат в пределах 90-110 %. Особенностью медико-биологических исследований в ИФА является невозможность установления точной величины, и поэтому за истинную величину принимается средняя от нескольких экспертных лабораторий. Статистическим критерием правильности служит средняя арифметическая и степень ее отклонения от истинного значения, выраженная в процентах.
Воспроизводимость — способность тест-системы показывать одни и те же значения при повторных исследованиях одного и того же образца. Воспроизводимость зависит как от случайных погрешностей (ошибок) при проведении процедуры постановки реакции, так и от качества тест-систем и точности метода регистрации результатов. Считается, что воспроизводимость одних и тех же контрольных образцов одной фирмы в разных лабораториях не должна превышать величину коэффициента вариации в 15%.
Из молекулярно-биологических методов диагностики вирусных гепатитов чаще используются полимеразная цепная реакция и гибридизация. Эти методы, особенно ПЦР, позволяют выявлять очень малые количества специфической вирусной ДНК или РНК и, таким образом, судить о репликации, а в ряде случаев и об активности репликации.
Современная диагностика гепатита В. Выявление HBsAg
Серологическая диагностика гепатита В в настоящее время строится на основании определения маркеров НВ-вирусной инфекции, как правило, с помощью имуноферментного анализа, то есть антигенов вируса гепатита В или антител к ним в биологических субстратах, главным образом, в сыворотке крови. В качестве основных маркеров гепатита В, имеющих самостоятельное значение для серологической диагностики, сегодня признаны:
HBsAg (поверхностный антиген вируса гепатита В) — основной маркер, свидетельствующий о наличии вируса гепатита В. При остром гепатите В HBsAg можно обнаружить еще в продромальном периоде, и длительность его персистенции при неосложненном течении составляет до 10 недель;
HBeAg — показатель высокой степени активности инфекционного процесса. Маркер репликации HBeAg определяется, как правило, при наличии HBsAg, однако циркулирует в крови менее продолжительное время — в среднем 4 недели;
anti-HBc класса IgM — показатель острого инфекционного процесса или, при хронических формах гепатита В, косвенный показатель активной репликации HBV. Возможна их длительная циркуляция;
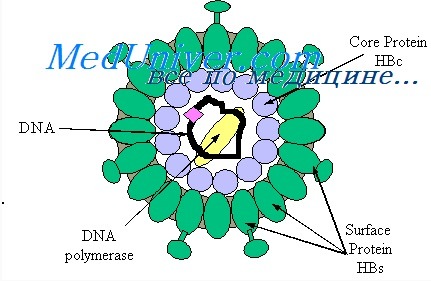
anti-HBe — не являются показателем, характеризующим какое-либо конкретное состояние при гепатите В. Эти антитела могут быть и в конце острого гепатита В и при хроническом гепатите и в случаях, так называемого здорового носительства HBsAg.
Хронический гепатит В: в фазу обострения наблюдается следующий профиль маркеров: HBsAg, HBeAg, DNA HBV, anti-HBc IgM и суммарные. В период стихания процесса обнаруживаются HBsAg, anti-HBc IgG (суммарные), возможна сероконверсия HBeAg на anti-HBe.
В основе всей серологигеской диагностики гепатита В: как острых, так и хронигеских форм—лежит определение HBsAg. Современные иммуноферментные тест-системы позволяют выявлять HBsAg в концентрациях до 0,1 нг/мл. Схема определения у разных тест-систем, как правило, одна и та же. В качестве иммуносорбента используются антитела к HBsAg. Как правило, применяются моноклональные антитела.
Именно они обеспечивают строгую специфичность применяемых в настоящее время диагностических наборов.
ПЦР (полимеразная цепная реакция) в диагностике гепатита В
Метод полимеразной цепной реакции используют для подтверждения НВ-вирусной инфекции, наличия репликации вируса при остром и хроническом гепатите В, а также определения эффективности курса лечения. Наибольшей чувствительностью обладает двойной нестед-метод, который предполагает использование двух пар праймеров. Чувствительность нестедметода весьма высока и позволяет выявлять несколько копий DNA HBV в образце, что существенно превосходит возможности ИФА.
Сегодня разработаны соответствующие технологии производства отечественные тест-системы для детекции DNA HBV с помощью ПЦР, которые активно применяются в практическом здравоохранении. Высокая чувствительность ПЦР-диагностики при гепатите В расширила возможности раннего определения вируса гепатита В при острой инфекции. Длительность инкубационного периода при гепатите В достигает 6 месяцев, а в ряде случаев и больше. В это время вирус попадает в кровь, проникает в клетки печени, запускается механизм репликации, и в результате размножение приобретает устойчивый характер.
Эти процессы не затрагивают в значительной степени жизнедеятельность печени и других органов в течение длительного времени. В этот период эффекторные реакции иммунной системы организма не задействованы. Число вирусных частиц резко возрастает к концу инкубационного периода и становятся максимальными. В этот период методом ПЦР можно обнаружить в крови вирус гепатита В, тогда как остальные маркеры НВ-вирусной инфекции, главным образом серологические, ещё отсутствуют. Таким образом, с помощью полимеразной цепной реакции стала возможной более ранняя диагностика острого гепатита В.
Диагностика гепатитов В и С у гематологических больных - анализы, особенности
Современная этиологическая диагностика вирусных гепатитов основана на обнаружении специфических маркеров соответствующих вирусов. Один из методов их выявления — тестирование различных антигенов вируса и антител к ним в ИФА. Наиболее прогрессивна и информативна так называемая генная диагностика: обнаружение вирусной РНК или ДНК с помощью ПЦР.
Для диагностики гепатита В в ИФА исследуют:
1) HBsAg-поверхностный антиген гепатита В, ранее называвшийся австралийским. Он указывает на факт инфицированности гепатитом В;
2) HbeAg — антиген инфекционности, свидетельствующий об активной вирусной репликации;
3) анти-НВс —антитела к ядерному антигену вируса гепатита В: класса IgM—ранние антитела острого периода, класса IgG—поздние антитела к ядерному антигену;
4) анти-НВе — антитела к HBeAg, чаще всего характеризующие прекращение активной репликации вируса (так называемая сероконверсия);
5) анти-HBs—антитела к HBsAg, обеспечивающие протективный иммунитет.
С помощью ПЦР для диагностики гепатита В тестируют ДНК вируса гепатита В — основного маркера репликации вируса.
Для диагностики гепатита С исследуют:
1) с помощью ИФА наличие анти-HCV-антител к вирусу гепатита С (для их выявления желательно использовать тест-системы второго — третьего поколения, отличающиеся большей специфичностью). Они указывают только на инфицированность вирусом гепатита С;
2) с помощью ПЦР наличие РНК вируса гепатита С — основного маркера репликации вируса.
Говоря о специфической диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями (ОГЗ), следует рассмотреть вопрос о применимости стандартных подходов к выявлению различных маркеров этих вирусов у данного контингента в связи с возможным нарушением процесса антителообразования на фоне глубокой иммуносу-прессии, развивающейся в ходе полихимиотерапии (ПХТ).
Исследования, в которых сделана попытка подтвердить или опровергнуть роль антительных маркеров у пациентов с онкологическими гематологическими заболеваниями, пока единичны.
Так, в отдельных работах сообщается, что при гепатите В иммуносупрессия нарушает обычную последовательность обнаружения в сыворотке крови антигенов и антител: у больных, которые до начала ПХТ были анти-НВs-позитивными, в процессе лечения могут вновь определяться HBsAg и HBeAg, свидетельствуя о несостоятельности анти-HBs в качестве протективных антител. Угнетение механизмов, ограничивающих вирусную репликацию, ведет к тому, что виремия нередко достигает высокого уровня.
Если антитела к столбняку, дифтерии и полиомиелиту сохраняются во время и после ПХТ, то титры антител к вирусам (ветряной оспы, кори и гепатита В) резко снижаются. Это в большей мере относится к детям с лейкозами, чем с солидными опухолями. Снижение или отсутствие выработки анти-HBs отметили также R. Repp и соавт. и R. Rokicka-Milewska и соавт.. Если при гепатите В эта особенность может отразиться только на ретроспективной диагностике, то для распознавания гепатита С, основанного чаще всего на обнаружении анти-HCV с помощью ИФА, такое положение может иметь принципиальное значение, препятствуя полному и своевременному выявлению всех инфицированных.
Антитела к вирусу гепатита С (анти-HCV) вообще образуются медленно, в течение 8—15 нед от момента инфицирования, но у иммунокомпетентных лиц персистируют в организме длительно и в большинстве случаев пригодны для выявления гепатита С, являясь в настоящее время рутинным и скрининговым маркером.
Некоторые авторы, проводившие немногочисленные и небольшие по объему исследования у иммунокомпрометированных пациентов, указывают на возможность отсроченного образования антител к вирусу гепатита С и считают недостаточным использование только ИФА для диагностики данного заболевания у этого контингента пациентов. В частности, С. Cornu и соавт. обнаружили, что у 5 из 6 обследованных ими иммунокомпрометированных пациентов анти-HCV начали обнаруживаться лишь спустя 14 мес и более от момента инфицирования, установленного с помощью ПЦР.
По данным М. Arico и соавт., антительная диагностика позволяет выявить около 70 % детей с ОЛЛ, инфицированных вирусом гепатита С. Значение ПЦР в выявлении пациентов, инфицированных вирусами гепатитов В и С, продемонстрировано при обследовании турецких детей: у 13,9 % больных с онкологическими гематологическими заболеваниями диагноз гепатита В установлен только при обнаружении ДНК вируса гепатита В, а 5,8 % анти-HCV-негативных детей оказались инфицированными вирусом гепатита С при тестировании РНК.
В то же время синтез анти-НВс IgM, сопутствующий в иммунокомпетентном организме вирусной репликации и являющийся одним из ее маркеров, у пациентов с онкологическими гематологическими заболеваниями почти отсутствует, а у пациентов без онкологических гематологических заболеваний происходит их активная наработка (7,7 % против 78,6 %).
С общебиологической точки зрения, выявленные феномены ждут объяснения, а в прикладном плане они демонстрируют особенности специфической диагностики инфицированности вирусом гепатита В у больных с онкологическими гематологическими заболеваниями и необходимость поиска других подходов к распознаванию болезни. Этой цели служит использование ПЦР, которая позволяет существенно повысить выявляемость пациентов с онкологическими гематологическими заболеваниями, инфицированных вирусом гепатита В: в 16 % случаев обнаружение ДНК этого вируса было единственным маркером инфицирования.
Более того, у 50 % детей, находившихся на полихимиотерапии и позитивных по каким-либо маркерам вируса гепатита В, вирусная ДНК выявлялась в отсутствие HBeAg, т. е. была единственным показателем репликации вируса, в то время как среди детей без онкологических гематологических заболеваний подобная ситуация встречалась лишь в 14,5 % случаев, т. е. в 3,5 раза реже.
При гепатите С также не обнаружено параллелизма между выявлением анти-HCV и РНК вируса гепатита С. Весьма демонстративным было преимущество тестирования РНК перед антительной диагностикой: у 44,4 % детей с онкологическими гематологическими заболеваниями РНК вируса гепатита С оказалась единственным маркером инфицирования.
Как и при гепатите В, диагностическая значимость генных и антительных маркеров зависит от фазы ПХТ. Период интенсивного и поддерживающего лечения онкологического гематологического заболевания при гепатите С — это время абсолютной репликативной активности и резкого снижения антителообразования, способность к которому частично восстанавливается по завершении полихимиотерапии. В наших наблюдениях у 74,9 % детей это сопровождалось продолжением вирусной репликации.
Практические выводы о специфической диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями сводятся к следующему:
1) рутинные подходы недостаточны для распознавания инфицированности пациентов с онкологическими гематологическими заболеваниями вирусами гепатитов В и С;
2) необходимо комплексное исследование всего известного спектра маркеров;
3) ведущую, определяющую роль в диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями играет тестирование ДНК вируса гепатита В и РНК вируса гепатита С в ПЦР;
4) только путем внедрения ПЦР-диагностики в учреждениях для больных с онкологическими гематологическими заболеваниями можно обеспечить полную и своевременную диагностику гепатитов В и С;
5) обязательность обследования всех пациентов с помощью современных маркеров:
— при поступлении;
— при повышении активности АЛТ на этапах ПХТ;
— каждые 3—6 мес в ходе и в течение года после ПХТ.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

