Что такое ингибирование вирусов
Обновлено: 19.04.2024
ИНГИБИТОРЫ (лат. inhibere останавливать, удерживать) — вещества разнообразной химической природы, тормозящие или полностью угнетающие скорость химических, физико-химических и биологических процессов; находят применение в медицине в качестве лекарственных средств, активность некоторых ингибиторов в сыворотке крови является дополнительным диагностическим тестом при ряде заболеваний; в народном хозяйстве используются в борьбе с сельскохозяйственными вредителями; многие ингибиторы являются отравляющими веществами.
И. хим. процессов тормозят реакции окисления смазочных масел, коррозии металлов, окисления различных видов топлива, останавливают или полностью предотвращают процесс полимеризации т. п. И. биофиз, процессов являются разнообразные хим. соединения, которые резко снижают скорость цепных реакций, т. к. при столкновении с образующимся в такой реакции свободным радикалом И. в свою очередь образуют малоактивные радикалы, не способствующие развитию цепного процесса. И. роста растений являются вещества, тормозящие или полностью угнетающие прорастание семян, рост стебля, распускание почек и т. п.
Случаи, когда И. ферментативного процесса избирательно угнетает только един фермент, очень редки. Чаще всего И. действуют на определенные центры фермента, а в них — на конкретные функциональные группы — SH-группы (так наз. сульфгидрильных яды), NH2-группы и др. К избирательным сульфгидрильным ядам относятся n-хлормеркурибензоат, йодацетамид, N-этилмалеимид, йодозобензоат, арсенит, феррицианид.
И. специфически связываются с активаторным, коферментным или субстратным центрами на молекуле фермента, лишая фермент возможности проявить свою активность. Ряд И. специфически связывается с имидазольной группой или остатком серина в активном центре фермента (напр., диизопропилфторфосфат). Ингибирующее действие на фермент могут оказать вещества, неспецифически адсорбирующиеся на поверхности ферментного белка, денатурирующие его или гидролитически его расщепляющие. Некоторые И., обладающие способностью образовывать внутрикомплексные (хелатные) соединения, извлекают из молекулы холофермента (собственно фермента — апофермента, связанного с коферментом) ион металла, без к-рого фермент не может проявить свою активность. К таким И. относятся ЭДТА (этилендиаминтетраацетат) и др.
И. фосфорилазы (КФ 2.4.1.1.) являются ацетилхолин, карбахол, действие которых в свою очередь ингибируется атропином.
Гексокиназа (см.) ингибируется адреналином и, возможно, глюкокортикоидами.
Монойодацетат, ингибируя глицеральдегидфосфатдегидрогеназу (КФ 1.2.1.9; 1.2.1.12 и 1.2.1.13) угнетает гликолиз на стадии реакции оксидоредукции (см. Гликолиз), а фтористый натрий, И. фосфопируват-гидратазы (КФ 4.2.1.11), ингибирует гликолиз уже после стадии фосфорилирования.
Фермент цикла Трикарбоновых к-т (см. Трикарбоновых кислот цикл)— сукцинатдегидрогеназа (КФ 1.3.99.1) ингибируется малонатом, а вступление ацетил-КоА в цикл блокируется фторацетатом.
Цитохромы (см.) ингибируются цианидом; антимицин А и амитал являются И., блокирующими дыхательную цепь: первый — между цитохромами b и c1 второй — между НАД-H2 и флавопротеидами. Динитрофенол разобщает окисление и фосфорилирование, ингибируя последнее.
Ферменты пентозного цикла ингибируются солями тяжелых металлов, которые, так же как и уабаин, являются И. и АТФ-азы (КФ 3.6.1.3. и 3.6.1.8).
В организме человека и животных имеются И. эндогенного происхождения, действие которых противоположно действию многочисленных активаторов, т. е. носит регуляторный характер. К таким регуляторам относится ацетилхолин (см.), регулирующий активность холинацетилтрансферазы (КФ 2. 3. 1. 6), фермента, участвующего в синтезе ацетилхолина, обеспечивающего ритмические сокращения сердца. При раздражении блуждающего нерва освобождается экстраацетилхолин, который ингибирует холинацетилтрансферазу по типу обратной связи, т. е. фермент ингибируется продуктом реакции. Феномен остановки сердца при раздражении и. vagus объясняется, т. о., действием И. Благодаря И. трипсина и пепсина железистые клетки желудка защищены от действия вырабатываемых ими протеолитических ферментов.
Все шире И. различных ферментов используются в качестве лекарственных средств.
При лечении острых панкреатитов применяют ингибитор трипсина и химотрипсина — трасилол (см.). Ингибиторы КоА альфа-фенилмасляная к-та и ее амид (гипостерол, артосклерол) обладают способностью снижать содержание холестерина в крови человека. При травматическом шоке, острой кровопотере, хирургических вмешательствах на сердце, легких, матке, предстательной железе и других органах происходит активирование фибринолитической системы. Одной из главных причин этого явления может быть выброс при повреждении клеток тканевого активатора плазминогена. Лечение фибринолиза успешно лишь в том случае, когда используется специфическая терапия, направленная на блокаду образования плазмина и ингибирование существующего плазмина. К таким препаратам относятся синтетические И. фибринолиза ε-аминокапроновая к-та (АКК), n-аминометилбензойная к-та (ПАМБК) и транс-4-аминометилциклогексанкарбоновая к-та (АМЦГКК). Кроме этих соединений, для ингибирования фибринолиза используют трасилол и контрикал (полипептид, получаемый из легких крупного рогатого скота), который также применяется как лекарственное средство для лечения острого панкреатита.
И. биохим, процессов, происходящих в микробной клетке, являются антибиотики; И. моноаминоксидазы (см.) используются в клинике в качестве антидепрессантов, И. карбоангидразы (см.) обладают мочегонным действием.
В сыворотке крови человека в сравнительно большом количестве присутствуют И. трипсина, связывающие этот фермент при повышенном поступлении его в кровь. Нормальные значения активности общего И. в сыворотке крови человека составляют от 300 до 600 миллиединиц (активность И. выражают в миллиединицах ингибируемого трипсина). При различных воспалительных процессах активность И. трипсина в сыворотке крови возрастает до 1500—2000 миллиединиц; при тяжелых формах хрон, панкреатита она может снижаться до 100—150 миллиединиц.
И. широко пользуются в экспериментальных исследованиях в области биохимии, физиологии, фармакологии, цитологии, генетики и др.
В практике находят широкое применение И. холинэстераз (см.), которые используются в народном хозяйстве в качестве гербицидов, фунгицидов, пестицидов и т. п. И. холинэстеразы являются четвертичные аммониевые соединения, сложные эфиры карбаминовой к-ты — карбаматы (см. Карбаминовые соединения) и фосфорорганические соединения (см.). Реактиваторы холинэстераз нашли практическое применение в качестве антидотов при отравлении фосфорорганическими соединениями животных и человека (см. Антидоты ОВ).
Библиография: Ашмарин И. П. и Ключapeв Л. А. Ингибиторы синтеза белка, Л., 1975, библиогр.; Биофизика, под ред. Б. Н. Тарусова и О. Р. Колье, М., 1968, библиогр.; Волькенштейн М. В. Молекулярная биофизика, с. 365 и др., М., 1975, библиогр.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
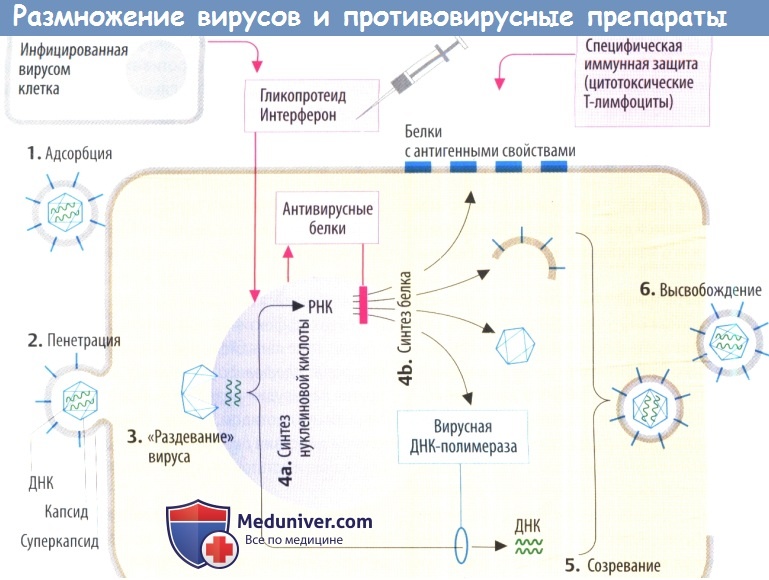
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
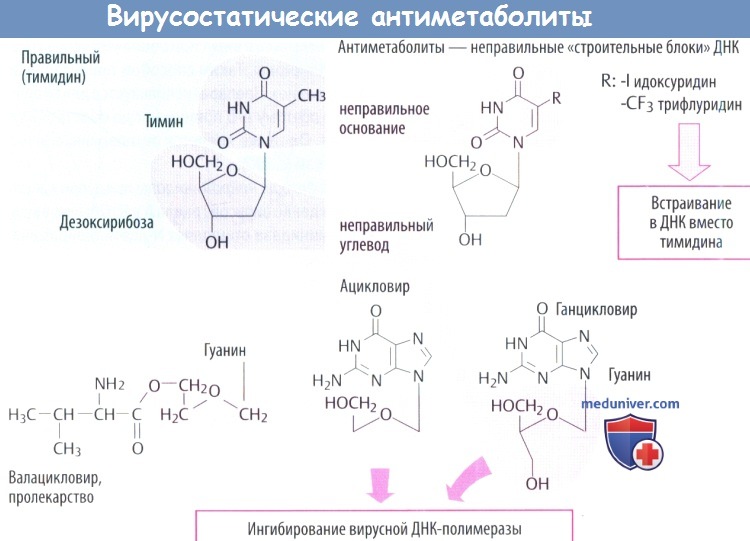
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
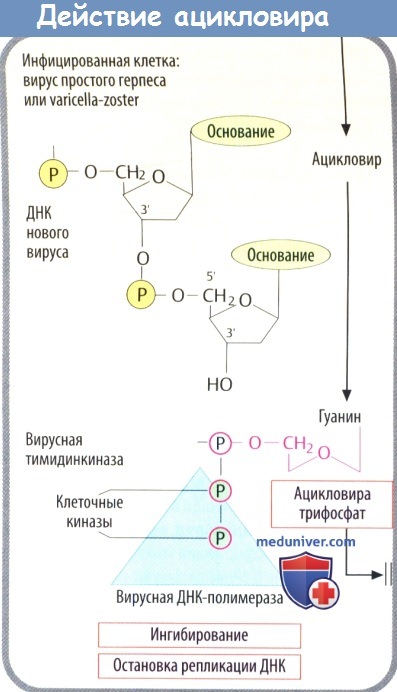
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
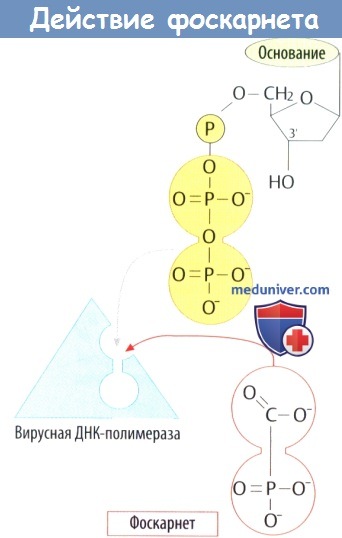
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
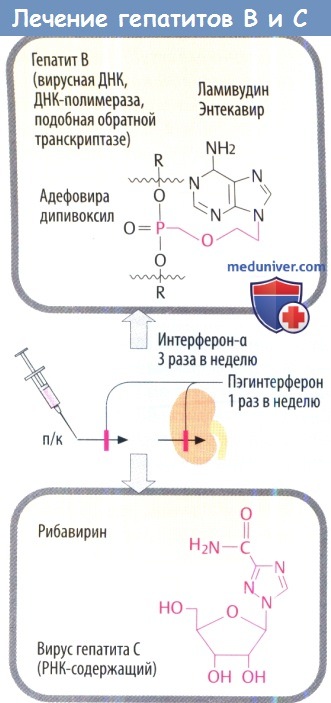
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
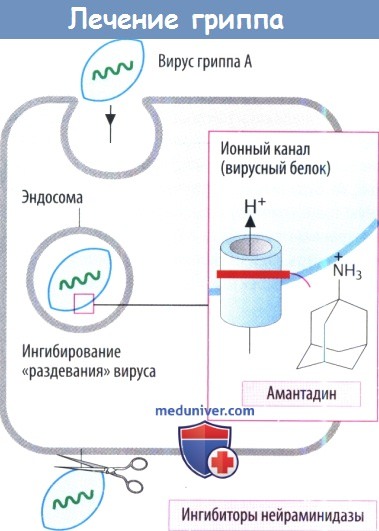
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ИНГИБИТОРЫ ВИРУСОВ (лат. inhibere удерживать, останавливать) — вирусотропные вещества, образующиеся в организме человека или животного и обладающие способностью в результате взаимодействия с вирусами подавлять их инфекционную активность. Кроме того, И. в. могут подавлять и отдельные функции вирусов, напр, гемагглютинацию, обусловливаемую вирусом гриппа. В отличие от антител (см.), к-рым присуща строгая специфичность, ингибиторы обладают более широким спектром активности в отношении различных видов вирусов, что дало основание называть их неспецифическими факторами иммунитета.
Впервые И. в. были обнаружены в сыворотке крови. В 1910 г. С. Флекснер и Льюис (J. Lewis) описали способность нормальной сыворотки овец нейтрализовать вирус полиомиелита. В последующем ингибиторы к различным вирусам были найдены в сыворотках крови обезьян, кроликов, собак, птиц, коров, лошадей и других животных. В 1942 г. Херст (G. К. Hirst) обнаружил ингибиторы к вирусу гриппа в сыворотке крови здорового человека. Результаты большого числа исследований, проведенных в различных лабораториях, позволяют сделать вывод, что в сыворотках человека и животных содержатся ингибиторы, активные по отношению ко многим как РНК-, так и Д H K-со держащим вирусам. Установлено также, что И. в., выявляемые в сыворотках крови разных животных, различаются как качественно, так и количественно. Так, в сыворотке крови человека содержатся ингибиторы вирусов гриппа А и В, но отсутствуют ингибиторы вируса гриппа С, в сыворотке же крыс содержатся в большом количестве ингибиторы вирусов гриппа С, но мало ингибиторов вирусов гриппа А и В.
Помимо видовых различий в содержании И. в., характерных для различных животных, наблюдаются как индивидуальные колебания у отдельных особей, так и изменения количества И. в. у одного и того же животного в зависимости от возраста и времени года: содержание И. в. в сыворотке лабораторных животных резко уменьшается в зимне-весенние месяцы и возрастает летом и осенью. Аналогичные закономерности возрастной и сезонной динамики установлены и для человека. Сыворотки крови детей первых 2—5 мес. жизни обладают высокой вируснейтрализующей активностью (в этом случае имеют место И. в. материнского происхождения). Затем содержание И. в. резко падает и до 1,5—2 лет сыворотка крови детей характеризуется низким содержанием ингибиторов. Количество И. в. начинает возрастать после 3 лет, достигая высоких показателей к 9—10 годам. У стариков содержание И. в. в сыворотке крови также невелико.
Изучение хим. природы И. в. различных животных и человека позволило прийти к заключению об их неоднородности и достаточно сложном строении. Оказалось, напр., что вирусингибирующая активность сыворотки крови морской свинки В отношении вирусов гриппа А и ECHO связана с липопротеидами, входящими в состав глобулиновой фракции белков сыворотки, а ингибитор вируса Сендай был обнаружен в составе альбуминовой фракции.
Гетерогенность И. в. обусловила появление различных классификаций. В основу одной из них положено распределение И. в. по принципу устойчивости к прогреванию при различной температуре. Так, для ингибиторов миксовирусов и респираторных вирусов Т. Я. Лузяниной предложена следующая классификация. 1. Термолабильныe ингибиторы, которые разрушаются после прогреваний при t° 62—65° в течение часа (бета-ингибиторы). Большинство из них относится к бета-липопротеидам.
2. Термостабильные ингибиторы, которые в свою очередь делятся на две группы — ингибиторы умеренной термостабильности и ингибиторы высокой термостабильности.
И. в. умеренной термостабильности разрушаются после прогревания при t° 75° в течение часа (ингибитор Франсиса, альфа-ингибитор). Они относятся к мукопротеинам, простетической группой которых являются нейраминовая к-та и ее производные.
И. в. высокой термостабильности не разрушаются при t° 100° (гамма-ингибитор). По хим. структуре они относятся к гликопротеинам, преимущественно связаны с альфа2-глобулиновой фракцией сывороток, но обнаруживаются также и среди альбуминовой и бета-глобулиновой фракций.
Помимо сыворотки крови, И. в. найдены также в тканях, секретах и экскретах человека и позвоночных животных. Они обнаружены в экстрактах из тканей легкого, печени, селезенки, почки, мозга, в слюне, моче и т. д. В частности, в слюне здоровых людей найдены ингибиторы, подавляющие репродукцию вируса полиомиелита в различных культурах клеток. Следует заметить, что в ряде случаев ингибиторам, выделяемым из тканей, присуща более сложная структура, чем И. в., получаемых из сывороток крови. Установить какую-либо зависимость между содержанием ингибиторов в сыворотке крови и тканях не удалось.
По мнению В. М. Жданова, П. Н. Косякова, 3. И. Ровновой и др., муко- и липопротеиновые И. в., выявляемые в различных тканях, секретах и экскретах организма, а также некоторые виды термостабильных сывороточных ингибиторов следует считать рецепторами клеток или веществами, тождественными по своему составу этим рецепторам.
Механизм действия
Несмотря на то, что антивирусная активность И. в. порой бывает достаточно высокой (показано, напр., что сыворотки крови морских свинок могут нейтрализовать до 10 млн. DL50 для мышей некоторых штаммов вируса гриппа), судьба их в процессе заболеваний, обусловленных вирусами, изучена крайне недостаточно. Тем не менее установлено, что развитие вируса гриппа в эмбрионах кур, в мозге и легких мышей приводит к падению титров ингибиторов. Подобное понижение ингибирующей активности смывов из верхних дыхательных путей человека, наблюдавшееся в остром периоде гриппозной инфекции, было предложено использовать в качестве метода ранней диагностики гриппа. В процессе выздоровления от вирусной инфекции (в частности, от гриппа) количество ингибиторов вновь увеличивается. При этом титры сывороточных ингибиторов начинают нарастать примерно в те же сроки, когда появляются и антитела к вирусам. Повышение содержания И. в. и антител обычно идет параллельно. В последующем увеличение неспецифических И. в. сменяется снижением их количества, к-рое наступает раньше, чем начинает снижаться титр антител.
Наблюдавшаяся порой высокая антивирусная активность И. в. дала основание для попыток использовать их в качестве профилактического и леч. средства при некоторых экспериментальных вирусных инфекциях. Однако несмотря на полученные положительные результаты в ряде таких экспериментов И. в. не нашли практического применения в терапии вирусных инфекций.
Библиография: Косяков П. Н. и Ровно в а 3. И. Противовирусный иммунитет, М., 1972; Л у з я н и н а Т. Я. Особенности взаимодействия термолабильных сывороточных ингибиторов с различными вирусами, Acta virologica, т. 6, № 6, с. 498, 1962; Проблемы патогенеза и иммунологии респираторных вирусных инфекций, под ред. А. А. Смо-родинцева и др., т. 1, с. 35, Л., 1969.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

