Что такое ингибировать репликацию вирусов
Обновлено: 26.04.2024
ИНГИБИТОРЫ ВИРУСОВ (лат. inhibere удерживать, останавливать) — вирусотропные вещества, образующиеся в организме человека или животного и обладающие способностью в результате взаимодействия с вирусами подавлять их инфекционную активность. Кроме того, И. в. могут подавлять и отдельные функции вирусов, напр, гемагглютинацию, обусловливаемую вирусом гриппа. В отличие от антител (см.), к-рым присуща строгая специфичность, ингибиторы обладают более широким спектром активности в отношении различных видов вирусов, что дало основание называть их неспецифическими факторами иммунитета.
Впервые И. в. были обнаружены в сыворотке крови. В 1910 г. С. Флекснер и Льюис (J. Lewis) описали способность нормальной сыворотки овец нейтрализовать вирус полиомиелита. В последующем ингибиторы к различным вирусам были найдены в сыворотках крови обезьян, кроликов, собак, птиц, коров, лошадей и других животных. В 1942 г. Херст (G. К. Hirst) обнаружил ингибиторы к вирусу гриппа в сыворотке крови здорового человека. Результаты большого числа исследований, проведенных в различных лабораториях, позволяют сделать вывод, что в сыворотках человека и животных содержатся ингибиторы, активные по отношению ко многим как РНК-, так и Д H K-со держащим вирусам. Установлено также, что И. в., выявляемые в сыворотках крови разных животных, различаются как качественно, так и количественно. Так, в сыворотке крови человека содержатся ингибиторы вирусов гриппа А и В, но отсутствуют ингибиторы вируса гриппа С, в сыворотке же крыс содержатся в большом количестве ингибиторы вирусов гриппа С, но мало ингибиторов вирусов гриппа А и В.
Помимо видовых различий в содержании И. в., характерных для различных животных, наблюдаются как индивидуальные колебания у отдельных особей, так и изменения количества И. в. у одного и того же животного в зависимости от возраста и времени года: содержание И. в. в сыворотке лабораторных животных резко уменьшается в зимне-весенние месяцы и возрастает летом и осенью. Аналогичные закономерности возрастной и сезонной динамики установлены и для человека. Сыворотки крови детей первых 2—5 мес. жизни обладают высокой вируснейтрализующей активностью (в этом случае имеют место И. в. материнского происхождения). Затем содержание И. в. резко падает и до 1,5—2 лет сыворотка крови детей характеризуется низким содержанием ингибиторов. Количество И. в. начинает возрастать после 3 лет, достигая высоких показателей к 9—10 годам. У стариков содержание И. в. в сыворотке крови также невелико.
Изучение хим. природы И. в. различных животных и человека позволило прийти к заключению об их неоднородности и достаточно сложном строении. Оказалось, напр., что вирусингибирующая активность сыворотки крови морской свинки В отношении вирусов гриппа А и ECHO связана с липопротеидами, входящими в состав глобулиновой фракции белков сыворотки, а ингибитор вируса Сендай был обнаружен в составе альбуминовой фракции.
Гетерогенность И. в. обусловила появление различных классификаций. В основу одной из них положено распределение И. в. по принципу устойчивости к прогреванию при различной температуре. Так, для ингибиторов миксовирусов и респираторных вирусов Т. Я. Лузяниной предложена следующая классификация. 1. Термолабильныe ингибиторы, которые разрушаются после прогреваний при t° 62—65° в течение часа (бета-ингибиторы). Большинство из них относится к бета-липопротеидам.
2. Термостабильные ингибиторы, которые в свою очередь делятся на две группы — ингибиторы умеренной термостабильности и ингибиторы высокой термостабильности.
И. в. умеренной термостабильности разрушаются после прогревания при t° 75° в течение часа (ингибитор Франсиса, альфа-ингибитор). Они относятся к мукопротеинам, простетической группой которых являются нейраминовая к-та и ее производные.
И. в. высокой термостабильности не разрушаются при t° 100° (гамма-ингибитор). По хим. структуре они относятся к гликопротеинам, преимущественно связаны с альфа2-глобулиновой фракцией сывороток, но обнаруживаются также и среди альбуминовой и бета-глобулиновой фракций.
Помимо сыворотки крови, И. в. найдены также в тканях, секретах и экскретах человека и позвоночных животных. Они обнаружены в экстрактах из тканей легкого, печени, селезенки, почки, мозга, в слюне, моче и т. д. В частности, в слюне здоровых людей найдены ингибиторы, подавляющие репродукцию вируса полиомиелита в различных культурах клеток. Следует заметить, что в ряде случаев ингибиторам, выделяемым из тканей, присуща более сложная структура, чем И. в., получаемых из сывороток крови. Установить какую-либо зависимость между содержанием ингибиторов в сыворотке крови и тканях не удалось.
По мнению В. М. Жданова, П. Н. Косякова, 3. И. Ровновой и др., муко- и липопротеиновые И. в., выявляемые в различных тканях, секретах и экскретах организма, а также некоторые виды термостабильных сывороточных ингибиторов следует считать рецепторами клеток или веществами, тождественными по своему составу этим рецепторам.
Механизм действия
Несмотря на то, что антивирусная активность И. в. порой бывает достаточно высокой (показано, напр., что сыворотки крови морских свинок могут нейтрализовать до 10 млн. DL50 для мышей некоторых штаммов вируса гриппа), судьба их в процессе заболеваний, обусловленных вирусами, изучена крайне недостаточно. Тем не менее установлено, что развитие вируса гриппа в эмбрионах кур, в мозге и легких мышей приводит к падению титров ингибиторов. Подобное понижение ингибирующей активности смывов из верхних дыхательных путей человека, наблюдавшееся в остром периоде гриппозной инфекции, было предложено использовать в качестве метода ранней диагностики гриппа. В процессе выздоровления от вирусной инфекции (в частности, от гриппа) количество ингибиторов вновь увеличивается. При этом титры сывороточных ингибиторов начинают нарастать примерно в те же сроки, когда появляются и антитела к вирусам. Повышение содержания И. в. и антител обычно идет параллельно. В последующем увеличение неспецифических И. в. сменяется снижением их количества, к-рое наступает раньше, чем начинает снижаться титр антител.
Наблюдавшаяся порой высокая антивирусная активность И. в. дала основание для попыток использовать их в качестве профилактического и леч. средства при некоторых экспериментальных вирусных инфекциях. Однако несмотря на полученные положительные результаты в ряде таких экспериментов И. в. не нашли практического применения в терапии вирусных инфекций.
Библиография: Косяков П. Н. и Ровно в а 3. И. Противовирусный иммунитет, М., 1972; Л у з я н и н а Т. Я. Особенности взаимодействия термолабильных сывороточных ингибиторов с различными вирусами, Acta virologica, т. 6, № 6, с. 498, 1962; Проблемы патогенеза и иммунологии респираторных вирусных инфекций, под ред. А. А. Смо-родинцева и др., т. 1, с. 35, Л., 1969.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
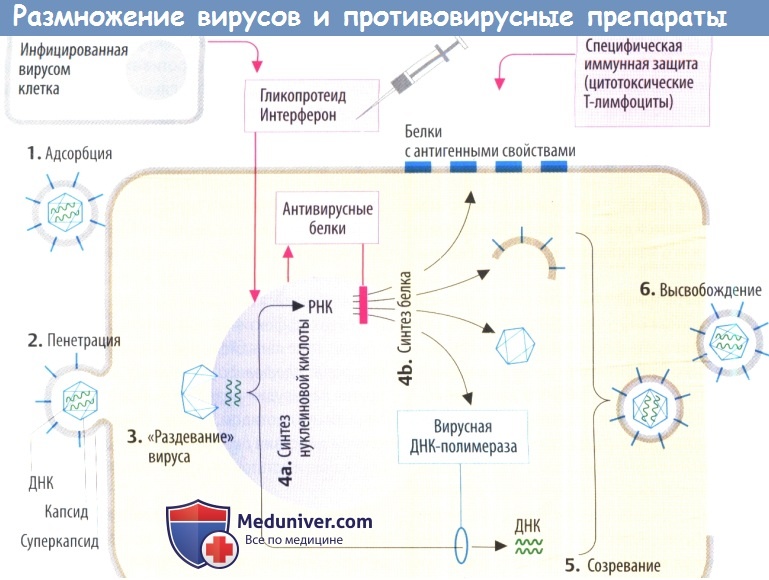
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
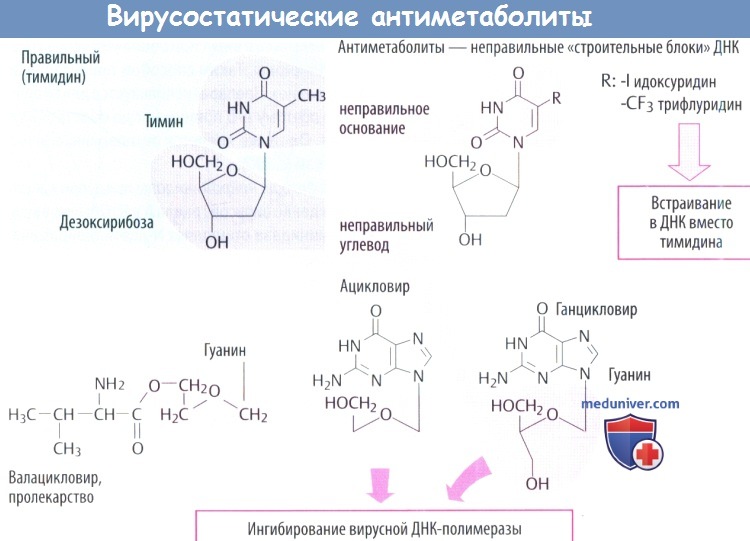
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
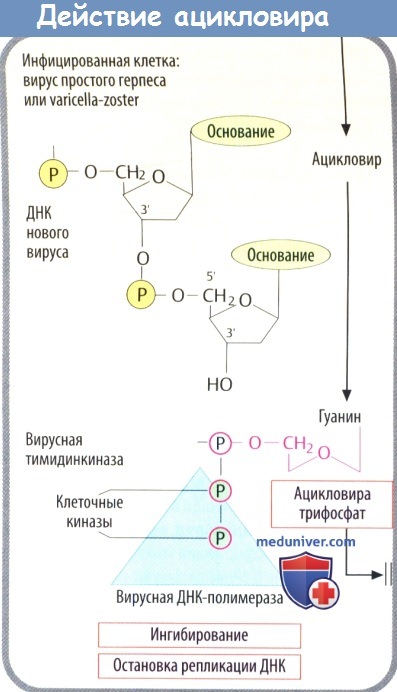
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
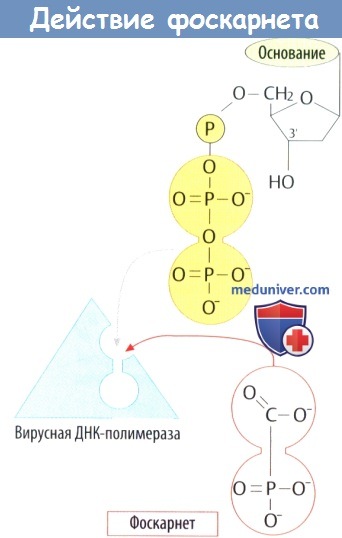
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
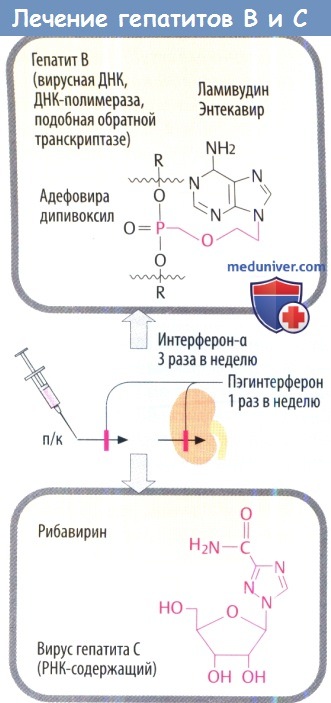
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
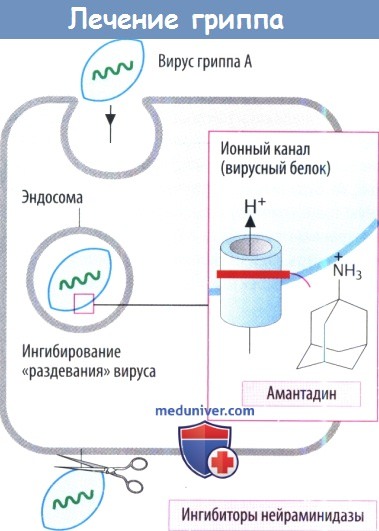
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ингибиторы репликации ВИЧ. Нуклеозидные ингибиторы обратной транскриптазы
Пандемия, вызванная ВИЧ-1, стимулировала интенсивный поиск новых антивирусных препаратов для лечения этого заболевания. Терапевтически эффективными оказались лекарственные вещества нескольких различных классов:
• нуклеозидные ингибиторы обратной транскриптазы (NRTI);
• ненуклеозидные ингибиторы обратной транскриптазы (NNRTI);
• ингибиторы протеаз (PI);
• антиретровирусный ингибитор слияния.
Лечение антивирусными препаратами замедляет возникновение СПИДа, улучшает состояние и выживаемость пациентов, если оценивать их по суррогатным маркерам, т.е. числу CD4+ Т-лимфоцитов и содержанию вируса в плазме. Применение 1 или 2 лекарственных препаратов ассоциируется с высокой скоростью прогрессирования болезни и возникновением резистентности вируса, поэтому в настоящее время для лечения ВИЧ-инфекции одновременно используют 3 антивирусных препарата или более. Попытки индуцировать супрессию вируса с помощью трех антивирусных препаратов, а затем поддерживать достигнутый эффект только двумя лекарствами привели к неприемлемо высокой частоте возврата заболевания. Как правило, одновременно используют комбинацию лекарств, относящихся к нескольким классам.
Нуклеозидные ингибиторы обратной транскриптазы
Зидовудин, аналог тимидина, является прототипным нуклеозидным ингибитором обратной транскриптазы. Он был первым антивирусным агентом, допущенным для лечения ВИЧ-инфекции. Зидовудин ингибирует ВИЧ-1, ВИЧ-2, вирус 1 Т-клеточного лейкоза/лимфомы человека и другие ретровирусы.
NRTI обладают следующими общими характеристиками:
• после активации в клетках под действием клеточных ферментов превращаются в соответствующие трифосфаты;
• утрачивают антиретровирусную активность в результате мутаций вирусной обратной транскриптазы, которые снижают аффинность фермента к NRTI. Частота возникновения резистентности и ее степень варьируют в зависимости от типа препарата;
• избирательность действия обусловлена более высокой аффинностью NRTI-трифосфатов к обратной транскриптазе по сравнению с ДНК-полимеразой клеток организма-хозяина.
Первоначально ретровирус ВИЧ должен синтезировать провирусную ДНК-копию своего РНК-генома, чтобы начать репликацию. Специфичный для ВИЧ фермент — обратная транскриптаза, или ревертаза (RT) — синтезирует комплементарную ДНК-цепь, используя пул дезоксинуклеотидов инфицированной клетки (тимидин, гуанозин, аденозин, цитидин). Поскольку NRTI являются дидезоксинуклеотидными аналогами и не имеют второй гидроксильной группы, существенной для последовательного присоединения оснований к растущей ДНК-цепи, их включение под действием RT терминирует элонгацию ДНК-цепей. Они оказывают также конкурентный ингибирующий эффект на саму RT.
NRTI быстро элиминируются из плазмы; Т1/2 из сыворотки варьирует от 1 час для ставудина до 3-4 час для ламивудина. Однако удаление внутриклеточных NRTI-нуклеотидов происходит медленнее, в связи с этим возможен нечастый прием препарата. Все NRTI, за исключением абакавира, выводятся с мочой. Экскреция зидовудина происходит после его глюкуронизации в печени. Другие NRTI выводятся в неизмененном виде. При почечной недостаточности дозу NRTI снижают от 50% для зидовудина, ставудина и зальцитабина до 80-90% для ламивудина и диданозина. Метаболизм NRTI не зависит от цитохрома Р-450. NRTI слабо связываются с белками и проникают в ЦНС в значительных концентрациях.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.

II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.

в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.

г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).

е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.

Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

