Что такое лечение объектов на вирусы
Обновлено: 23.04.2024
Инфекции кожи и мягких тканей: причины, диагностика, лечение, профилактика
Бактериальные инфекции кожи. Передача кожных инфекций осуществляется посредством контактного механизма. Заболевания быстро распространяются в местах скопления людей и в условиях антисанитарии. Возбудителями кожных инфекций могут быть многие микроорганизмы. Наиболее распространены Staphylococcus aureus и Streptococcus pyogenes.
Бактерии возбудители инфекций кожи и мягких тканей:
- S. aureus: импетиго, фурункулёз, невскрывающийся фурункул, токсический эпидермальный некролиз, острая паронихия
- S. pyogenes: целлюлит, рожа, импетиго
- С. diphtheriae: дифтерия (кожная форма)
- М. tuberculosis: волчанка обыкновенная
- М. marinum: хронические язвенные поражения кожи
- М. ulcerans: деструктивные язвы (язва Бурули)
- С. minutissimum: эритразма
- Pseudomonas aeruginosa: колонизация ожогов
- Erysipelothrix rhusiopathiae: эризипелоид
При целлюлите, вызванном S. pyogenes, S. aureus, Pasteurella multocida, реже вибрионами, обитающими в морской воде, и грамотрицательными бациллами, происходит поражение всех слоев кожи. Микроорганизмы проникают в организм человека через повреждённые участки кожи, раны и места укусов насекомых. Эмпирическое лечение флуклоксациллином необходимо начинать до получения результатов бактериологического исследования. В тяжёлых случаях применяют внутривенные антибактериальные препараты (бензилпенициллин и флуклоксациллин).
Некротизирующий фасцит — быстро прогрессирующая инфекция, поражающая также кожу и подкожную клетчатку. Заболевание развивается в результате микст-инфекции, вызванной аэробными и анаэробными микроорганизмами, а также вследствие моноинфекции S. pyogenes. Болезнь быстро прогрессирует и может привести к смерти пациента за очень короткое время. Большую роль в лечении играет успешное иссечение инфицированных некротических тканей, проводимое на фоне лечения бензилпенициллином, цефалоспоринами третьего поколения и метронидазолом.
Эритразма — поверхностная инфекция, возникающая на сгибательных поверхностях конечностей и вызываемая Corynebacterium minutissimum. Очаги поражения флюоресцируют в ультрафиолетовом свете. Возбудитель может быть выделен при посеве. Для лечения применяют эритромицин или тетрациклин.
Рожа — стрептококковая инфекция, поражающая органические участки кожи на лице или голенях. При обследовании отмечают обычно повышение количества лейкоцитов в периферической крови. Для лечения назначают приём внутрь амоксициллина и флуклоксациллина; в тяжёлых случаях может потребоваться внутривенное введение антибиотиков.
Эризипелоид — зоонозная инфекция, вызываемая Erysipelothrix rhusiopathiae. Местный очаг (обычно пальцы рук) характеризуется развитием эритемы красно-фиолетового цвета. В группу риска входят мясники (поражаются пальцы рук при работе с инфицированным мясом, чаше свиньи) и рыбаки. В большинстве случаев заболевание разрешается самостоятельно, но применение внутрь пенициллина или тетрациклина позволяет ускорить процесс выздоровления, назначение антибиотиков обязательно при развитии вторичной бактериемии.
Ожоги могут стать причиной инфекции, вызванной Pseudomonas aeruginosa, S. aureus, S. pyogenes и иногда бактериями кишечной группы. Возможно заражение антибиоти-коустойчивыми формами микроорганизмов. Бактериальное поражение может привести к отторжению пересаженной кожи и вторичной бактериемии.
Паронихия. Паронихия, или воспаление околоногтевой ткани, — распространённое заболевание, возникающее вследствие бактериальной инвазии (например, S. aureus) в местах повреждения кутикулы. При этом возникают боль, отёчность с последующим формированием небольшого абсцесса. Абсцесс дренируют и назначают антибактериальную терапию (флуклоксациллин и др.).
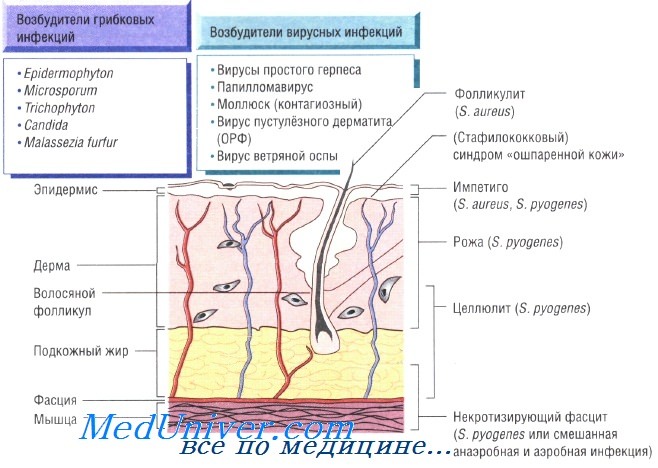
Причины инфекций кожи
Кожные проявления системных инфекций
На коже могут отражаться проявления системных инфекций. Ярким примером может служить петехиальная сыпь при менингококковой септицемии — несомненный признак тяжёлого сепсиса. У пациентов с синегнойной септицемией на коже возникают гангренозные очаги (гангренозная эктима). Менее выражены кожные изменения при эндокардите (кровоизлияния у оснований ногтей). При стафилококковой септицемии возникают участки инфаркта кожи, а при некоторых вирусных заболеваниях высыпания на коже становятся частью характерной клинической картины (ветрянка и корь).
Для вируса простого герпеса кожные покровы — первичный очаг инфекции. Некоторые штаммы Staphylococcus aureus и бета-гемолитических стрептококков вызывают системные заболевания, обусловленные действием токсинов и сопровождающиеся различными кожными изменениями: при синдроме токсического шока — генерализованная и сыпь на ладонях, при скарлатине — сыпь с бледностью носогубного треугольника, а при синдроме ошпаренной кожи у новорождённых — сильное шелушение.
Бородавки как инфекция кожи
Папилломавирус человека поражает клетки кожи и усиливает их репликацию, в результате чего формируется бородавка (папиллома). Существуют папулёзные, пятнистые и мозаичные виды папиллом, а также подошвенная (роговая) бородавка. Заболевание передаётся при непосредственном контакте с больным, а также через предметы общего пользования особенно при повышенной влажности (при совместном купании в бассейне).
Передача генитальных бородавок (остроконечных кондилом) осуществляется половым путём. Диагноз устанавливают на основании клинических признаков. Для определения вируса остроконечных кондилом применяют реакцию иммунофлюоресценции и полимеразную цепную реакцию.
Папилломавирусы вызывают злокачественные новообразования шейки матки (тип 16 и 18) и гортани (тип 6 и 11). В настоящее время существуют вакцины против виусов типа 16 и 18, которые формируют продолжительный иммунитет.
Папилломы со временем самостоятельно исчезают, не оставляя рубцов (за исключением случаев у людей со сниженным иммунитетом). Очень часто для самолечения применяют местные кератолитические вещества (салициловая кислота). При генитальных бородавках используют подофил щитовидный*. В качестве альтернативы применяют криотерапию, ускоряющую исчезновение папиллом. Прижигание в настоящее время не рекомендуют для частого использования у одного пациента.
Некоторые штаммы поксвирусов поражают кожный покров и вызывают возникновение характерных симптомов (например, контагиозный моллюск и контагиозный пустулёзный дерматит).
Дерматофитозы - грибковые инфекции кожи
Клинические признаки дерматофитозов. При дерматофитии (стригущем лишае) возникают бляшки, сопровождаемые зудом и покраснением. Со временем их диаметр увеличивается, а в центре образуется бледное пятно. При хроническом поражении ногтей наблюдают обесцвечивание и истончение ногтей, а при заболеваниях кожи головы — облысение и рубцевание. В основе названия заболевания лежит место заражения, например дерматофития головы (tinea capitis — стригущий лишай), дерматофития туловища (tinea corporis).
Лабораторная диагностика грибковых инфекций кожи. При инфекции кожного покрова отмечают свечение поражённых участков в ультрафиолетовом свете.
В лабораторию доставляют сухие соскобы с поражённых участков кожи, образцы ногтей и волос. При нагревании в растворе натрия гидроксида они обесцвечиваются, и во время микроскопии становятся видны гифы грибов. Дерматофиты растут на декстрозосодержащем агаре Сабурада при температуре 30 °С в течение четырёх недель.
В основе идентификации лежат морфологические свойства колоний, особенности микроскопической картины (окраска лактофеноловым синим), биохимическое исследование, а также секвенирование 18S рибосомальной РНК гена.
Лечение грибковых инфекций кожи. При дерматофитозах применяют местные препараты группы имидазола (миконазол, клотримазол, тиоконазол или аморолфин). При некоторых формах инфекции назначают тербинафин (внутрь) в течение нескольких недель.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
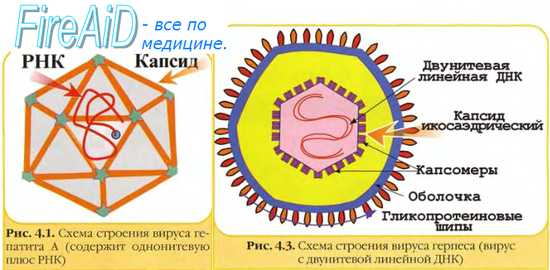
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
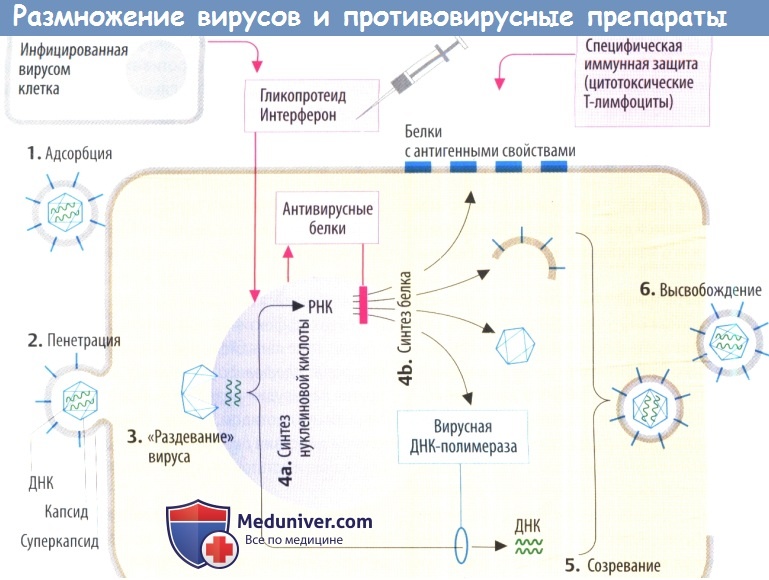
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
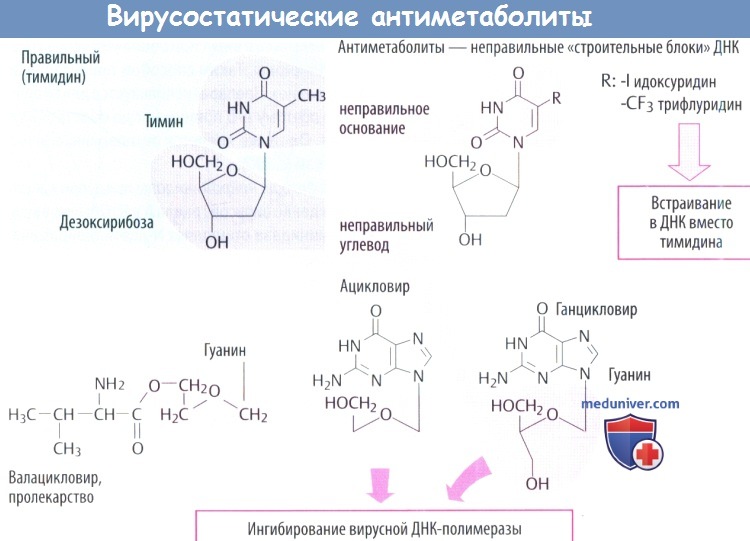
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
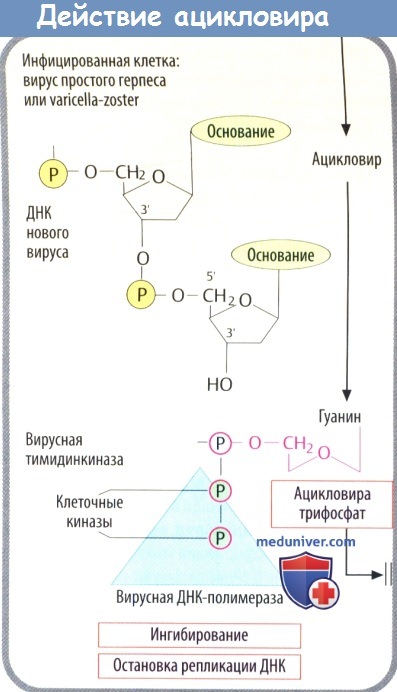
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
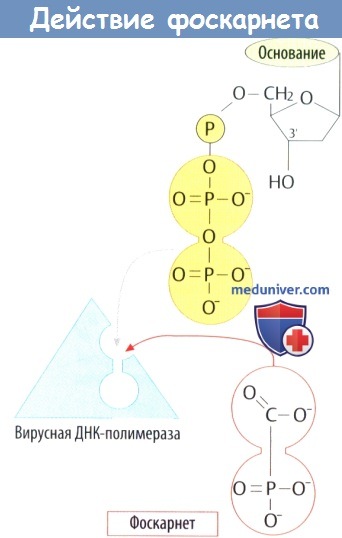
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
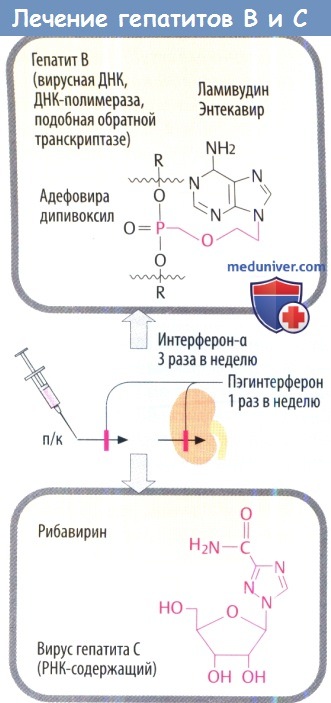
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
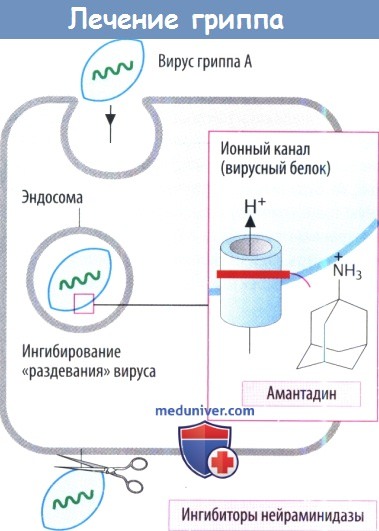
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

