Что такое литическая вирусная инфекция
Обновлено: 18.04.2024
Резюме
Актуальность Эпштейна - Барр вирусной инфекции объясняется широкой циркуляцией вируса Эпштейна - Барр среди детского и взрослого населения, его тропностью к иммунокомпетентным клеткам с пожизненной персистенцией после первичного инфицирования и полиморфизмом клинических проявлений от субклинических форм, инфекционного мононуклеоза до формирования онкологических, аутоиммунных гематологических заболеваний. Персистенция Эпштейна -Барр вируса приводит к подавлению клеточного звена иммунитета, снижению продукции интерферонов и факторов неспецифической защиты, что способствует реактивации персистирующей инфекции, чаще всего без мононуклеозоподобного синдрома, и появлению атипичных мононуклеаров в крови с формированием лимфопролиферативного, интоксикационного, астеновегетативного синдромов, длительного субфебрилитета, что диктует необходимость применения иммунокоррегирующей терапии. В статье приведен клинический случай, в котором изложены описание и анализ течения хронической Эпштейна - Барр вирусной инфекции у ребенка дошкольного возраста (5 лет 8 мес.) с отягощенным преморбидным фоном. Эпизоды реактивации хронической персистирующей инфекции протекали под маской острой респираторной инфекции с лимфопролиферативным синдромом, гнойного тонзиллита, гнойного аденоидита. Терапия, включавшая антибиотики, препараты с противовирусной активностью коротким курсом, бактериальные лизаты, физиотерапию, имела временный и непродолжительный эффект. В силу отсутствия полного мононуклеозоподобного синдрома в клинике и атипичных мононуклеаров в гемограмме обследование на Эпштейна - Барр вирусную инфекцию не проводилось до пятилетнего возраста, в связи с чем она не была верифицирована, и, соответственно, ребенок не получал адекватной иммунотропной терапии. Только в 5 лет 8 мес. при очередном эпизоде активации хронической Эпштейна - Барр вирусной инфекции в состав комплексной терапии был включен меглюмина акридонацетат, на фоне которого была достигнута хорошая клинико-лабораторная динамика. Описанный клинический случай демонстрирует эффективность включения в состав комплексного лечения Эпштейна - Барр вирусной инфекции меглюмина акридонацетата, обладающего противовирусным, иммуномодулирующим и противовоспалительным действиями, что позволило получить достаточно быструю положительную клиническую динамику купирования интоксикационно-лихорадочного и лимфопролиферативного синдромов в острый период, а в дальнейшем - и астеновегетативного синдрома и достигнуть перехода активной хронической Эпштейна - Барр вирусной инфекции в латентную форму.
Ключевые слова: острая респираторная инфекция, гнойный тонзиллит, гнойный аденоидит, лимфопролиферативный синдром, меглюмина акридонацетат, иммунотропная терапия.
Chronic Epstein-Barr viral infection in children: a clinical case
Svetlana P. Kokoreva, Veronika B. Kotlova®, Oleg A. Razuvaev
Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia
Abstract
The urgency of Epstein-Barr virus infection is explained by wide circulation of Epstein-Barr virus among children and adults, its tropism to immunocompetent cells with lifelong persistence after primary infection and polymorphism of clinical manifestations from subclinical forms, infectious mononucleosis to formation of oncological, autoimmune hematological diseases. Persistence of Epstein - Barr virus leads to suppression of cellular immunity, decreased production of interferons and nonspecific protection factors, which contributes to reactivation of persistent infection, most often without mononucleosis-like syndrome, and the appearance of atypical mononuclears in blood with the formation of lymphoproliferative, intoxication, astheno-vegetative syndrome, long-term subfebrile condition, which dictates the need for immunocorrective therapy. This article presents a clinical case describing and analyzing the course of a chronic Epstein-Barr virus infection in a preschool child (5 years 8 months) with a pre-morbid background. Episodes of reactivation of chronic persistent infection occurred under the mask of acute respiratory infection with lymphoproliferative syndrome, purulent tonsillitis, purulent adenoiditis. Therapy, including antibiotics, short-course antiviral agents, bacterial lysates, and physiotherapy, had a temporary and short-lived effect. meglumine acridonacetate. The described clinical case demonstrates the effectiveness of the inclusion of meglumine acridonacetate, which has antiviral, immunomodulatory and anti-inflammatory effects, in the complex treatment of Epstein-Barr virus infection, This allowed to obtain fairly rapid positive clinical dynamics of relieving intoxication and febrile and lymphoproliferative syndromes in the acute period, and subsequently - astheno-vegetative syndrome and achieve the transition of active chronic Epstein - Barr virus infection into a latent form.
Keywords: acute respiratory infection, purulent tonsillitis, purulent adenoiditis, lymphoproliferative syndrome, meglumine acridonacetate, immunotropic therapy.
Введение
Сегодня Эпштейна - Барр вирусная инфекция (ЭБВИ) представляет собой междисциплинарную проблему и активно изучается не только инфекционистами, но и врачами других специальностей: педиатрами, оториноларингологами, ревматологами, гематологами, онкологами, неврологами, иммунологами. Это объясняется тем, что вирус Эпштейна - Барр (ВЭБ) является одним из наиболее распространенных возбудителей, выявляемых как в детском возрасте, так и среди взрослого населения. По данным различных исследователей, инфицированность ВЭБ составляет 17,7% в периоде новорожденности и возрастает до 90% и выше у лиц старших возрастных групп 1. Являясь оппортунистической инфекцией, она в большинстве случаев протекает бессимптомно. Особенностью манифестных форм ЭБВИ является полиморфизм клинических симптомов, начиная от инфекционного мононуклеоза до фульминантных тяжелейших форм, аутоиммунных и онкологических заболеваний, реализующихся спустя годы после диагностированной ЭБВИ. Доказано, что манифестация клинических проявлений развивается при первичном инфицировании и реактивации персистирующей инфекции 4.
В случае адекватного иммунологического ответа первичное инфицирование приводит к формированию латентной формы инфекции - персистирующей неактивной ЭВБИ. Приравниваясь к здоровому носительству, она является естественным завершением иммунологических изменений. При снижении иммунитета происходит реактивация инфекции с манифестными проявлениями -активация персистирующей инфекции. При тяжелом течении могут формироваться органные поражения: менингоэнцефалит, миокардит, гепатит, гломерулонефрит и другие с возможным летальным исходом 10.
Но чаще в клинической практике встречаются варианты повторной реактивации ЭБВИ с неспецифической симптоматикой, когда при отсутствии остро развившегося полного мононуклеозоподобного синдрома и появления атипичных мононуклеаров в периферической крови, характерных для инфекционного мононуклеоза, возникают утомляемость, слабость, артралгии, головная боль, снижение памяти и внимания, депрессия, субфебрилитет. При этом принято говорить о хронической инфекции, если симптоматика сохраняется в течение полугода. Дети с хронической ЭБВИ имеют, как правило, отягощенный преморбидный фон, страдают хроническим тонзиллитом, хроническим аденоидитом; у них формируются различные варианты лимфопролиферативного синдрома, умеренно выраженный интоксикационный синдром, астенизация, может быть субфебрилитет; у этой категории больных отмечаются частые рекуррентные заболевания, что объясняется иммуносупрессивным воздействием ВЭБ 13.
Изучение форм ЭБВИ стало быстро развиваться благодаря возможностям современной лабораторной диагностики, которая позволяет оценить время инфицирования и активность инфекционного процесса [15, 16]. Для острой первичной инфекции типично появление ДНК вируса в крови и иммуноглобулинов М к капсидному антигену (аVCAJgM) и (или) иммуноглобулинов к раннему ЕА-антигену (аЕАIgG), которые циркулируют с третьей недели инфицирования, а также низкоавидных иммуноглобулинов к капсидному антигену (аVCAIgG). Со временем низкоавидные аVCAIgG трансформируются в высокоавидные, сохраняясь пожизненно. Начиная со второго месяца с момента заражения появляются антитела к ядерному антигену (аEBNAIgG). У части пациентов они сохраняются всю жизнь, у части -элиминируются. Положительный результат исследования полимеразной цепной реакции (ПЦР) крови не позволяет судить о форме инфекции, так как может регистрироваться как при первичном инфицировании, так и при реактивации персистирующей инфекции. На фоне высокоавидных аVCAIgG и (или) аEBNAIgG при реактивации персистирующей инфекции появляются капсидные антитела класса М и (или) ранние антитела. Давность инфицирования вне обострения инфекционного процесса подтверждается обнаружением высокоавидных аVCAIgG и аEBNAIgG. Положительные результаты ПЦР слюны могут быть у 15-25% здоровых серопозитивных людей. Это происходит в силу пожизненной персистенции вируса в В-лимфоцитах, которые, находясь в лимфоидной ткани миндалин при латентной инфекции или ее активации, дают положительный результат исследования [17].
Иммунокорригирующая терапия Эпштейна - Барр вирусной инфекции
На сегодняшний день общепринятых принципов этиотропного лечения ЭБВИ не разработано, так как препараты с противовирусной активностью не позволяют элиминировать возбудитель из организма, и основой лечения является симптоматическая и патогенетическая терапия. Однако длительная персистенция ВЭБ, приводящая к угнетению клеточного иммунитета, факторов неспецифической защиты, интерферон-продуцирующей функции лейкоцитов, свидетельствует о необходимости использования иммунокорригирующих препаратов [18, 23-26].
В педиатрической практике хорошо зарекомендовали себя индукторы эндогенного интерферона, в частности меглюмина акридонацетат (Циклоферон®), которые имеют ряд преимуществ по сравнению с экзогенными интерферонами. При их назначении не вырабатываются аутоантитела на собственный интерферон, время выработки стимулированных эндогенных интерферонов контролируется макроорганизмом, что не приводит к его передозировке. Кроме того, индукторы эндогенного интерферона имеют высокую биодоступность 29. Циклоферон® является низкомолекулярным индуктором интерферона и, соответственно, оказывает противовирусное, иммуномодулирующее, противовоспалительное действия, стимулируя синтез а- и у-интерферона, что способствует усилению Т-клеточного иммунитета - нормализации субпопуляций СD3-лимфоцитов, СD4-лимфо-цитов, NK-клеток и иммунорегуляторного индекса. Прямое действие меглюмина акридонацетата реализуется через нарушение репликации вируса, блокирование вирусной ДНК или РНК, увеличение дефектных вирусных частиц и снижение вирус-индуцированного синтеза белка [32, 33]. Его клиническая эффективность доказана у детей при острой респираторной вирусной инфекции (ОРВИ) и гриппе, так как на ранней стадии инфицирования он подавляет репликацию вируса, стимулирует и поддерживает уровень всех видов интерферона. Из всех индукторов интерферона Циклоферон является самым быстрым, вызывая продукцию интерферона через 2-72 ч после введения, реализуя таким образом противовирусный и иммуномодулирующий эффекты уже через 2-3 ч после приема 36. Наибольшую эффективность у детей препарат имеет при низком интерфероновом статусе 36. Доказано прямое противовирусное действие Циклоферона с подавлением размножения вируса на стадии репликации и вирусного потомства, его способность индуцировать синтез эндогенного интерферона в отношении герпетических вирусов, и показана его клиническая эффективность у детей при различных герпесвирусных инфекциях, в том числе и ЭБВИ 40. В качестве примера успешного использования иммуно-тропной терапии при герпесвирусной инфекции приводим клинической случай течения и исхода хронической ЭБВИ у ребенка дошкольного возраста.
Anamnesis vitae: ребенок от третьей беременности (в семье есть двое детей 8 и 10 лет), протекавшей с угрозой прерывания (терапия дюфастоном) на фоне хронической фетоплацентарной недостаточности, третьих срочных родов путем кесарева сечения. Вес при рождении -3260 г, оценка по Апгар - 7-8 баллов. По поводу конъюгационной гипербилирубинемии была переведена на второй этап выхаживания. С рождения находилась на искусственном вскармливании в связи с гипогалактией у матери. До года наблюдалась неврологом по поводу перинатального поражения нервной системы, профилактические прививки с 12 мес. Из перенесенных заболеваний мама отмечала нетяжелые ОРИ в 1,5 года и острую кишечную инфекцию в 2 года 4 мес.
Предварительный диагноз - острая респираторновирусная инфекция, осложненная аденоидитом. Синусит (?).
Динамика и исходы. В гемограмме лейкоцитоза нет -9,5 х 10 9 /л, абсолютный лимфомоноцитоз (п4%, с28%, л56%, м12%), СОЭ - 18 мм/час. Биохимические тесты без патологических изменений, СРБ - 3 мг (норма - 0-10). При рентгенологическом исследовании придаточных пазух носа данных по синуситу не выявлено. Получен отрицательный результат ПЦР-исследования мазков из носоглотки (респираторный скрин). Лор-врачом диагностирован гнойный аденоидит. По данным ультразвукового исследования органов брюшной полости выявлялись умеренная гепатомегалия, мезентериальная лимфаденопатия.
Терапия в отделении включала антибиотики (цефтриаксон парентерально), Виферон-1 per rectum 2 раза в сутки, симптоматические средства, физиолечение. На фоне проводимого лечения в течение трех суток состояние ребенка оставалось без убедительной клинической динамики: продолжала лихорадить, сохранялись интоксикационный и лимфопролиферативный синдромы. На четвертый день пребывания в стационаре результаты лабораторного обследования: ПЦР+ крови на ВЭБ, аVCAJgM+ и аVCAIgG+ авидность 100%, аEAIgG–, аEBNAIgG+, что позволило диагностировать реактивацию хронической ЭБВИ. К лечению добавлен Циклоферон в таблетках по схеме на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23-е сутки. На третий день у девочки нормализовалась температура, восстановился аппетит, улучшилось самочувствие. Стал менее выраженным лимфопролиферативный синдром: носовое дыхание более свободное, уменьшился насморк. На 10-й день лечения ребенок жалоб не предъявлял. При объективном осмотре меньше выражены гипертрофия небных миндалин 1-й степени, шейная лимфаденопатия (размеры лимфоузлов уменьшились до 0,5 см), гепатомегалия 1,5 см. Выписана с клиническим улучшением с рекомендацией продолжить прием Циклоферона по схеме.
Клинический диагноз - хроническая Эпштейна - Барр вирусная инфекция, реактивация: лимфопролиферативный синдром, обострение хронического аденоидита, астеновегетативный синдром.
При объективном осмотре сохранялась умеренная гипертрофия небных миндалин, пальпировались мелкие, 0,3-0,5 см, безболезненные подчелюстные, передне-и заднешейные лимфоузлы, гепатомегалия отсутствовала, клинических проявлений астеновегетативного синдрома не отмечалось. Гемограмма соответствовала возрастной норме. В лабораторных тестах отсутствовали маркеры активной ЭБВИ: ПЦР крови - ДНК ВЭБ не обнаружено, аVCAJgM отрицательные, аEAIgG отрицательные, обнаружены аVCAIgG с авидностью 100% и аEBNAIgG.
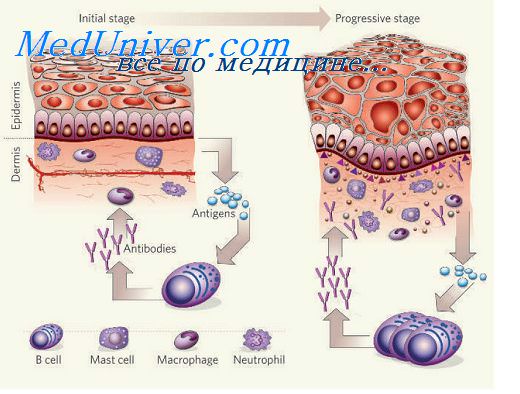
Рисунок. Этапы формирования у пациентки хронической Эпштейна - Барр вирусной инфекции
Figure. Stages of chronic Epstein - Barr virus infection development in a patient
Заключение
Описанный клинический пример демонстрирует течение хронической ЭБВИ у больной в возрасте 5 лет 8 мес. с развитием лимфопролиферативного и астено-вегетативного синдромов. При реактивации хронической ЭБВИ, протекавшей с клиническими проявлениями ОРИ, гнойного тонзиллита, применялись антибиотики, препараты интерферона, глюкокортикостероиды интраназально, физиотерапия с временным эффектом. Назначение Циклоферона в составе комплексного лечения позволило получить достаточно быструю положительную клиническую динамику купирования интоксикационно-лихорадочного и лимфопролиферативного синдромов в острый период, а в дальнейшем -и астеновегетативного синдрома и достигнуть перехода активной хронической ЭБВИ в латентную форму, что подтверждается отсутствием маркеров активности хронической инфекции в течение года после использования Циклоферона.
Информация об авторах:
Кокорева Светлана Петровна, д.м.н., доцент, заведующая кафедрой инфекционных болезней, Воронежский государственный медицинский университет имени Н.Н. Бурденко; 394036, Россия, Воронеж, ул. Студенческая, д. 10.
Котлова Вероника Борисовна, к.м.н., доцент кафедры инфекционных болезней, Воронежский государственный медицинский университет имени Н.Н. Бурденко; 394036, Россия, Воронеж, ул. Студенческая, д. 10.
Разуваев Олег Александрович, к.м.н., доцент кафедры инфекционных болезней, Воронежский государственный медицинский университет имени Н.Н. Бурденко; 394036, Россия, Воронеж, ул. Студенческая, д. 10.
Information about the authors:
Svetlana P. Kokoreva, Dr. Sci. (Med.), Associate Professor, Head of the Department of Infectious Diseases, Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia.
Veronika B. Kotlova, Cand. Sci. (Med.), Associate Professor of the Department of Infectious Diseases, Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia.
Oleg A. Razuvaev, Cand. Sci. (Med.), Associate Professor of the Department of Infectious Diseases, Voronezh State Medical University named after N.N. Burdenko; 10, Studencheskaya St., Voronezh, 394036, Russia.
Особенности течения и терапии респираторного микоплазмоза у детей в эпидемический сезон 2020-2021 гг.
Список литературы
References
Воспалительные изменения на уровне субклеточных структур при вирусной инфекции.
Вызываемое вирусами развитие клинических проявлений болезни и видимые признаки воспаления есть конечный результат множества событий. Большая часть процессов, связанных с репликацией вируса, а следовательно, с начальными воспалительными реакциями на микроструктурном уровне, недоступна для распознавания на клиническом уровне. Эта особенность, характерная для многих вирусных инфекций и впервые описанная С.А. Mims и А.Н. Sharpe], представляет собой важную концепцию для понимания вирусного воспаления. Зачастую привычные признаки: краснота, припухлость, инфильтрация составляют лишь видимую с большим опозданием и весьма незначительную часть того воспаления, которое захватывает многочисленные структуры пораженного организма.
Основные этапы взаимодействия вирусов и клеток чрезвычайно кратко представлены в модифицированной таблице.
В правом столбце таблицы перечислены события, происходящие внутри клетки, именно они определяют ее конечную судьбу: гибель, трансформацию, резервирование персистентного вируса и т.д. В левом столбце приведены события на уровне организма или ткани, ведущие к заражению клеток и развитию защитных иммунных реакций. Эта схема значительно упрощена, многое зависит от специфики вируса и хозяина.
Респираторные вирусы чаще проникают в организм через верхние дыхательные пути. Первичное прикрепление вируса к эпителиальным клеткам зависит от множества факторов: его устойчивости к неспецифическим защитным факторам (протеолитические ферменты, слизь, движение ресничек, соли желчных кислот), к секреторным антителам, а также от наличия специфических комплементарных рецепторов на поверхности клетки, способных к воссоединению с рецепторами вируса.
Как показали исследования последних лет, комплементарность вирусных и клеточных рецепторов зачастую обусловлена генетическими маркерами организма: группой крови и HLA-принадлежностью. Так, самые тяжелые осложненные формы гриппа чаще возникают у носителей антигенов А-Н и HLA-8, склонность к персистированию превалирует у лиц с группой крови ВШ и HLA-A9. Таким образом, развитие тех или иных форм воспаления отчасти предопределено генетически. Не исключено, что каждому из респираторных вирусов соответствует свой излюбленный генотип.
Вторым, не зависящим от специфических рецепторов, механизмом органотропности является протеолитическое расщепление гликопротеиновых оболочек парамиксовирусов (парагрипп, PC-вирус) в присутствии трипсиноподобных ферментов, содержащихся в инфицируемых клетках. Аналогичное свойство присуще вирусу гриппа, у которого ферментативному расщеплению подвергается гемагглютинин. При отсутствии в ткани необходимых ферментов многоцикловая инфекция не воспроизводится.
Прикрепление вируса к клетке является пусковым моментом для развития симптомокомплекса воспаления, который включает в себя альтерацию, экссудацию, трансформацию и пролиферацию в сочетании с нарушениями микроциркуляции и повреждениями функциональной активности. Краткая схема этого сложного и многообразного процесса не может отразить всех возможных вариантов и особенностей, но может облегчить восприятие основных моментов. Большая часть перечисленных в таблице 2 признаков воспаления, прежде всего деструкция и дистрофия, являются общими для всех респираторных вирусов и не могут служить надежными признаками дифференциации. Однако характер вирусных включений: их размеры, локализация, структура в сочетании с определенным типом поражения клеток (образование гигантских структур, пластов, скопления гроздевидных округлых клеток и т.д.) имеют определенное диагностическое значение при рассмотрении воспаления на субклеточном и клеточном уровне. Так, уже в начальной стадии воспаления, через 6-8 часов от момента заражения, при гриппе определяются базофильные включения, содержащие вирусные частицы. Чаще всего они локализуются в апикальной части эпителия; эозинофильные включения реже содержат вирус и чаще рассматриваются в качестве реактивных образований. При парагриппе и PC-инфекции выявляются цитоплазматические фуксинофильные включения, нередко группирующиеся вокруг ядра. При герпетической и цитомегаловирусной инфекции чаще регистрируются четко контурируемые внутриядерные включения, округлые, крупные, эозинофильные и оксифильные, нередко отгороженные от остальной цуклеплазмы светлой зоной. При аденовирусной инфекции также преобладают внутриядерные включения, на ранних стадиях инфекции (через 16 часов) - мелкие, округлые, базофильные или оксифильные; одни из них однородны, другие имеют форму колец с прозрачным центром. В дальнейшем число внутриядерных включений увеличивается, встречаются слоистые и ячеистые формы. На поздних этапах инфекции включения обнаруживаются и в цитоплазме клеток. Наиболее точная дифференцировка специфичности включений осуществляется с помощью прямого и непрямого иммунофлуоресцентного метода с использованием меченых антител.
Формирование вирусных включений интересно не только с точки зрения патогенных возможностей респираторных вирусов, но и с точки зрения анализа самого понятия воспаления. С одной стороны, это несомненный результат непосредственного воздействия вируса на клетку, вероятно это защитная реакция клетки, стремящейся локализовать патогенные частицы, а с другой стороны - это и возможность длительной резервации вируса. Таких двояких по целесообразности моментов в процессе вирусного воспаления достаточно. Так, под действием вирусов может происходить своеобразная активация фагоцитарной способности клеток, что проявляется в усилении цитофагоцитоза, когда инфицированные клетки активно фагоцитируют другие клетки, а также ферменты распавшихся структур. С одной стороны, это полезно с точки зрения утилизации и удаления дегенерировавших элементов, с другой стороны - нередко способствует большему распространению вирусной инфекции по клеточному пласту.
Большинство респираторных вирусов на ранних стадиях инфицирования вызывает ряд изменений клеточных структур, которые можно рассматривать как защитно-компенсаторные: набухание, гиперплазия ряда клеточных элементов, увеличение функционирующих локусов митохондрий, и лишь на более поздних стадиях возникают явления дистрофии, деструкции, либо необратимого перерождения.
Перечисляя изменения клеточных элементов, обусловленных вирусной репродукцией, было бы несправедливым забыть о главной их способности - нарушать синтез клеточных макромолекул. В случае развития вирусного инфицирования в клетке появляется два источника информации: клеточный и вирусный геномы. В подавляющем большинстве случаев ведущим оказывается вирусный геном, под руководством которого осуществляются процессы, направленные на воспроизводство вирусного потомства, в то время как синтез клеточных макромолекул (РНК, ДНК, белка) претерпевает значительное подавление. После длительных экспериментальных поисков было доказано, что в основе ингибирования синтеза клеточных РНК и ДНК в инфицированных клетках лежит феномен блокирования процесса транскрипции, т.е. "считывания" информации, закодированной в клеточном геноме, без нарушения целостности структур ДНК и РНК, а также РНК-полимераз. Ингибитором, ответственным за этот процесс, оказался аргининсодержащий белок - гистон. Большая часть исследователей полагает, что синтез белков-ингибиторов осуществляется самой клеткой в результате реализации информации, закодированной в ее геноме. Вирус лишь стимулирует синтез этих ингибиторов. Помимо подавления синтеза клеточных РНК, гистоны подавляют функцию и синтез ДНК, а также синтез АТФ и перенос аминокислот. Таким образом, появление индуцированных вирусом и воспроизведенных клеткой гистонов является одной из основных причин нарушения синтеза клеточных структур, а, следовательно, и дистрофии, являющейся одним из признаков воспаления.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Персистентные инфекции в легких. Латентная инфекция в легких.
В последнее десятилетие в центре внимания исследователей различного профиля находятся сложные формы воспаления, явно отступающие от общепринятых канонов острых защитных реакций и характеризуемые своеобразными дисбалансами иммуноглобулинов и цитокинов. Эти формы воспаления характерны, прежде всего, для вирусной персистенции. Персистенция (постоянство, упорство) - понятие достаточно широкое и неоднозначное, которое, по современным представлениям, включает в себя несколько подвариантов: персистентная, латентная, хроническая и медленная инфекции, а также бессимптомное вирусоносительство.
Персистентными называют инфекции, при которых вирус либо его антигены в течение продолжительного времени обнаруживаются в организме человека. Указанное пребывание сопровождается определенными специфическими иммунологическими сдвигами. Клинические проявления заболевания могут быть выраженными, слабыми либо маскироваться симптомами общего хронического заболевания (кашель, слабость, субфебрилитет, одышка и т.д.), что нередко наблюдается у больных с хронической обструктивной болезнью легких и бронхиолите с облитерацией при нерсистенции респираторно-синцитиального вируса.
Латентная инфекция - это практически пожизненная инфекция, при которой вирус (чаще герпес) находится в наиболее тесном взаимодействии с геномом клетки и пребывает преимущественно то в дефектной (ДНК-транскрипт), то в полной инфекционной форме, что соответствует ремиссии и обострению. Активация латентной инфекции происходит, как правило, под влиянии других инфекций (чаще грипп), переохлаждения, перегрева, солнечной радиации, психических травм и т.д.
Наиболее типичным примером хронической инфекции является инфекция, вызываемая аденовирусами. Для нее характерна частая смена клинических ремиссий и обострений, но относительно благоприятный прогноз при своевременном и правильном лечении.
Медленная инфекция - имеет неизбежно летальный исход, характеризуется многомесячным или даже многолетним инкубационным периодом с последующим медленным, но неуклонным развитием симптомов заболевания (вирусы СПИД и спонгиозных энцефалитов).
Классификация вирусной персистенции весьма условна. При наличии отличительных свойств многие ее формы имеют общие черты: при всех вариантах весьма распространено формирование дефектных форм вируса, их тесное взаимодействие с геномом клетки-хозяина, чередование фаз обострения и клинической ремиссии. Вероятны переходы одной разновидности персистенция в другую, например персистентной инфекции в латентную или хроническую.
Как показали исследования, проведенные в Государственном научном центре пульмонологии (МЗ РФ), персистенция достаточно широко распространена не только при хронической, но и острой бронхолегочной патологии. При тяжелых полисегментарных пневмониях и острых абсцессах нередко отмечается замедленная элиминация респираторных вирусов и их компонентов из организма больного, что подтверждается и более длительными сроками образования специфических противовирусных иммуноглобулинов класса М и G. Персистенция сопровождается низкими показателями клеточного иммунитета (прежде всего Т-активные клетки), натуральной киллерной активности, всех видов интерферона. Иммуносупрессия, обусловленная вирусами, способствует более выраженной активации бактериальной флоры как аэробного, так и анаэробного плана.
При затяжных и рецидивирующих бронхитах, особенно с явлениями бронхоспазма, вирусы и вирусные компоненты удается обнаружить до 1,5-2 месяцев от начала заболевания. Их элиминация прямо коррелирует с исчезновением признаков воспаления бронхов.
При хронической обструктивной болезни легких и бронхиолите с явлениями облитерации у детей респираторно-синцитиальный вирус чрезвычайно часто выявляется как в период обострения, так и относительной клинической ремиссии.
У больных с ЛОР-патологией: аденоидитами, хроническими тонзиллитами и отитами основным персистирующим агентом является аденовирус. При одновременном наличии аденоидитов и шейных лимфоденитов чаще всего наблюдается ассоциация хронических аденовирусных и микоплазменных инфекций.
Особенности воспалительных реакций организма при вирусной персистенции чрезвычайно разнообразны, весьма вариабельны и зависят от громадного количества факторов, определяемых как макро-, так и микроорганизмами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Повышение температуры тела - один из самых частых симптомов инфекционных заболеваний у детей и одна из самых частых причин обращения родителей за помощью к педиатру. Лихорадочные состояния представляют собой самый распространенный повод к применению медикаментозных средств [1, 5].
При измерении температуры тела в подмышечной ямке повышенной обычно считают температуру тела 37,0 °С и выше. Однако следует иметь в виду, что значения 36,0-37,5 °С могут быть признаны нормальными [3, 5]. Нормальная температура тела ребенка колеблется в течение суток в пределах 0,5-1,0 °C, повышаясь к вечеру. Аксиллярная температура ниже ректальной на 0,5-0,6 °C.
Лихорадка - неспецифическая защитно-приспособительная реакция организма, возникающая в ответ на воздействие различных патогенных раздражителей и характеризующаяся перестройкой процессов терморегуляции, которая приводит к повышению температуры тела.
Повышенная температура тела уменьшает жизнеспособность некоторых патогенных микроорганизмов, усиливает специфический и неспецифический компоненты иммунитета [11]. Однако повышение температуры может играть адаптивную роль только при ее подъеме до определенного предела. При высокой гипертермии (40-41 °С) наблюдается усиление интенсивности обменных процессов. Несмотря на усиление работы дыхательной и сердечнососудистой систем (при подъеме температуры тела на каждый градус выше 37 °С частота дыхания увеличивается на 4 в 1 мин, частота сердечных сокращений (ЧСС) - на 10-20 в 1 мин) возросшая доставка кислорода может не обеспечивать растущих потребностей в нем тканей, что приводит к развитию тканевой гипоксии и нарушению распределения сосудистого тонуса. В первую очередь страдают функции ЦНС, что нередко проявляется развитием судорожного синдрома - фебрильных судорог (особенно у детей раннего возраста, имеющих перинатальное повреждение ЦНС). При гипертермии возможно развитие отека головного мозга, когда состояние ребенка резко ухудшается, наступает угнетение центральной нервной системы [3, 9].
У детей с гипотрофией, дыхательной недостаточностью, а также при поражениях центральной нервной системы неблагоприятные для здоровья последствия могут развиться при сравнительно умеренной степени повышения температуры тела (38,5-39 °С).
Классификация лихорадки
Механизм лихорадки
Повышение температуры тела инфекционного генеза развивается в ответ на воздействие пирогенов вирусной или бактериальной природы и встречается наиболее часто.
В основе лихорадки лежит способность гранулоцитов и макрофагов синтезировать и выделять при активации эндогенные белковые пирогены, интерлейкины (ИЛ-1, ИЛ-6), фактор некроза опухоли (ФНО) и интерфероны. Мишенью для действия эндогенных пирогенов является терморегуляторный центр, осуществляющий регуляцию механизмов теплопродукции и теплоотдачи, обеспечивая тем самым нормальную температуру тела и ее суточные колебания.
ИЛ-1 считается основным инициирующим медиатором в механизме развития лихорадки. Он стимулирует секрецию простогландинов, амилоидов А и Р, С-реактивного белка, гаптоглобина, α1-антитрипсина и церулоплазмина. Под действием ИЛ-1 инициируется продукция Т-лимфоцитами ИЛ-2 и повышается экспрессия клеточных Ig-рецепторов, а также происходит усиление пролиферации В-лимфоцитов и стимуляция секреции антител. Нарушение иммунного гомеостаза при инфекционном воспалении обеспечивает проникновение ИЛ-1 через гематоэнцефалический барьер, где он взаимодействует с рецепторами нейронов центра терморегуляции. При этом активизируется циклооксигеназа (ЦОГ), что приводит к повышению внутриклеточного уровня циклического аденозин-3,5-монофосфата (цАМФ) и изменению внутриклеточного соотношения Na/Ca. Данные процессы лежат в основе изменения чувствительности нейронов и сдвига терморегуляторного баланса в сторону усиления теплопродукции и уменьшения теплоотдачи. Устанавливается новый, более высокий уровень температурного гомеостаза, что приводит к повышению температуры тела.
Клинические варианты лихорадки
Анализируя температурную реакцию, очень важно оценить не только величину ее подъема, продолжительность и суточные колебания, но и сопоставить эти данные с состоянием и самочувствием ребенка, клиническими проявлениями заболевания. Это необходимо для выбора правильной тактики лечебных мероприятий в отношении больного, а также для проведения дальнейшего диагностического поиска.
В первую очередь необходима оценка клинических признаков соответствия процессов теплоотдачи повышенному уровню теплопродукции, т. к. в зависимости от индивидуальных особенностей организма лихорадка даже при одинаковой степени повышения температуры тела у детей может протекать по-разному.
При адекватной реакции ребенка на повышение температуры тела теплоотдача соответствует повышенной теплопродукции, что клинически проявляется нормальным самочувствием, розовой или умеренно гиперемированной окраской кожи, влажной и теплой на ощупь (так называемая "розовая лихорадка"). Тахикардия и учащение дыхания соответствуют уровню температуры тела, ректально-дигитальный градиент не превышает 5-6 °С. Такой вариант лихорадки считается прогностически благоприятным.
Если реакция ребенка на повышение температуры тела неадекватна и теплоотдача существенно меньше теплопродукции, то клинически наблюдаются выраженное нарушение состояния и самочувствия ребенка, озноб, кожа бледная, мраморная, ногтевые ложе и губы с цианотичным оттенком, холодные стопы и ладони (так называемая "бледная лихорадка"). Наблюдается стойкое сохранение гипертермии, чрезмерная тахикардия, одышка, возможны бред, судороги, ректально-дигитальный градиент более 6 °С. Такое течение лихорадки является прогностически неблагоприятным и является прямым показанием для оказания неотложной помощи.
Среди клинических вариантов патологического течения лихорадки выделяют гипертермический синдром, при котором отмечается быстрое и неадекватное повышение температуры тела, сопровождающееся нарушением микроциркуляции, метаболическими расстройствами и прогрессивно нарастающей дисфункцией жизненно важных органов и систем [4]. Риск развития таких состояний особенно высок у детей раннего возраста, а также с отягощенным преморбидным фоном. Чем меньше возраст ребенка, тем опаснее для него быстрый и значительный подъем температуры тела в связи с возможным развитием прогрессирующих метаболических нарушений, отека мозга, нарушением витальных функций. При наличии у ребенка серьезных заболеваний сердечно-сосудистой, дыхательной систем лихорадка может привести к развитию их декомпенсации. У детей с патологией центральной нервной системы (перинатальные энцефалопатии, эпилепсия и др.) на фоне повышенной температуры тела возможно развитие судорог.
Тактика ведения и лечения детей с лихорадкой
Борьба с лихорадкой является одним из важнейших компонентов комплексной терапии основного заболевания. Проводится на фоне этиотропной (антимикробной, противовирусной, антипаразитарной) и посиндромной терапии.
При лихорадочных состояниях у детей проводимые мероприятия должны включать:
Снижение температуры тела не должно быть критическим, необязательно добиваться ее нормальных показателей, достаточно понизить температуру на 1-1,5 °C. Это приводит к улучшению самочувствия ребенка и позволяет лучше перенести лихорадочное состояние.
При "розовой лихорадке" необходимо раздеть ребенка с учетом температуры воздуха в помещении, положить "холод" на крупные сосуды (паховые, подмышечные области), при необходимости - обтереть водой комнатной температуры, что бывает достаточным для снижения температуры тела или значительно снижает объем фармакотерапии. Обтирание холодной водой или водкой не показано, так как может привести к спазму периферических сосудов и уменьшению теплоотдачи.
У детей из группы риска при неблагоприятном течении лихорадки с выраженной интоксикацией, нарушением периферического кровообращения ("бледная лихорадка") жаропонижающие препараты назначают даже при субфебрильной температуре (выше 37,5 °С), при "розовой лихорадке" - при температуре, превышающей 38,0 °С (табл. 1).
Таблица 1. Показания к назначению жаропонижающих средств
| Клинический вариант лихорадки | Факторы риска развития осложнений лихорадки | |
| Отсутствуют | Имеются | |
| "Розовая лихорадка" | 38,5 °С | 38,0 °С |
| "Бледная лихорадка" | 38,0 °С | 37,5 °С |
Жаропонижающие средства обязательны, наряду с другими мерами, при гипертермическом синдроме, когда происходит быстрое и неадекватное повышение температуры тела, сопровождающееся нарушением микроциркуляции, метаболическими расстройствами и прогрессивно нарастающей дисфункцией жизненно важных органов и систем [6, 9].
Необходимо отметить, что лекарственные средства для снижения температуры не должны назначаться курсом, т. к. при этом меняется температурная кривая и резко затрудняется диагностика инфекционных заболеваний. Очередной прием жаропонижающего препарата нужен только при повторном подъеме температуры тела до соответствующего уровня.
Принципы выбора жаропонижающих средств у детей.
Жаропонижающие средства по сравнению с другими лекарственными препаратами наиболее широко используются у детей, поэтому их выбор осуществляется исходя прежде всего из соображений безопасности, а не эффективности. Препаратами выбора при лихорадке у детей согласно рекомендациям ВОЗ [12] являются парацетамол и ибупрофен. Парацетамол и ибупрофен разрешены в Российской Федерации для безрецептурного отпуска и могут назначаться детям с первых месяцев жизни как в стационаре, так и в домашних условиях [8].
Необходимо отметить, что парацетамол обладает жаропонижающим, анальгезирующим и очень слабым противовоспалительным эффектом, т. к. реализует свой механизм преимущественно в центральной нервной системе и не обладает периферическим действием. Ибупрофен (Нурофен для детей, Нурофен) имеет более выраженные жаропонижающий, анальгетический и противовоспалительный эффекты, что определяется его периферическим и центральным механизмом. Кроме того, использование ибупрофена (Нурофен для детей, Нурофен) предпочтительно при наличии у ребенка наряду с лихорадкой болевого синдрома, например, лихорадка и боли в горле при ангине, лихорадка и боль в ушах при отите, лихорадка и боли в суставах при псевдотуберкулезе и др. [7]. Основной проблемой при использовании парацетамола является опасность передозировки и связанного с ней гепатотоксического действия у детей старше 10-12 лет. Это обусловлено особенностями метаболизма парацетамола в печени ребенка и возможностью образования токсических метаболитов препарата [2]. Ибупрофен редко может вызывать нежелательные явления со стороны желудочно-кишечного тракта, дыхательной системы, крайне редко - со стороны почек, изменения клеточного состава крови.
Таблица 2. Рекомендуемые разовые дозы НПВП для лечения лихорадки у детей
| Препарат | Разовые дозы |
| Парацетамол | 15 мг/кг не более 4 раз в сутки с интервалом не менее 4 часов |
| Ибупрофен (Нурофен для детей, Нурофен) | 5-10 мг/кг 3-4 раза в сутки |
| Анальгин | В составе литической смеси 50% р-р до 1 года: 0,1-0,2 мл/на 10 кг массы тела старше 1 года: 0,1 мл на год жизни* |
Назначение Анальгина (метамизола натрия) возможно только в случае непереносимости других жаропонижающих препаратов или при необходимости парентерального введения. Это связано с риском возникновения таких нежелательных реакций, как анафилактический шок, агранулоцитоз (с частотой 1:500 000), длительное коллаптоидное состояние с гипотермией [5].
Следует помнить, что препараты, обладающие сильным противовоспалительным эффектом, более токсичны. Нерационально для снижения температуры тела у детей использовать мощные противовоспалительные препараты - нимесулид, диклофенак, они разрешены только для рецептурного отпуска [5].
Не рекомендуется в качестве жаропонижающего средства для детей ацетилсалициловая кислота, способная при гриппе и других ОРВИ, ветряной оспе вызвать синдром Рея (тяжелую энцефалопатию с печеночной недостаточностью). Не следует использовать амидопирин и фенацетин, исключенные из списка жаропонижающих препаратов из-за высокой токсичности (развитие судорог, нефротоксичность).
При выборе лекарственных препаратов для снижения температуры у детей необходимо учитывать наряду с безопасностью удобство их применения, т. е. наличие детских лекарственных форм (сироп, суспензия), а также стоимость.
Лечебная тактика при различных клинических вариантах лихорадки у детей.
Выбор стартового жаропонижающего препарата, прежде всего, определяется клиническим вариантом лихорадки. Если ребенок хорошо переносит повышение температуры, его самочувствие страдает незначительно, кожа розовая или умеренно гиперемирована, теплая, влажная ("розовая лихорадка"), использование физических методов охлаждения позволяет снизить температуру тела и в ряде случаев избежать фармакотерапии. Когда эффект применения физических методов недостаточен, назначают парацетамол в разовой дозе 15 мг на кг массы тела или ибупрофен в дозе 5-10 мг на кг массы тела на прием внутрь в суспензии (Нурофен для детей) или таблетированной (Нурофен) форме в зависимости от возраста ребенка.
При "бледной лихорадке" жаропонижающие должны использоваться только в комплексе с сосудорасширяющими средствами. Возможно применение Папаверина, Но-шпы, Дибазола. При стойкой гипертермии с нарушением общего состояния, наличием симптомов токсикоза возникает необходимость парентерального введения сосудорасширяющих, жаропонижающих и антигистаминных средств [9]. В таких случаях используют литическую смесь:
Дети с некупирующейся "бледной лихорадкой" должны быть госпитализированы.
Гипертермический синдром, при котором отмечается быстрое и неадекватное повышение температуры тела, сопровождающееся нарушением микроциркуляции, метаболическими расстройствами и прогрессивно нарастающей дисфункцией жизненно важных органов и систем, требует незамедлительного парентерального введения жаропонижающих, сосудорасширяющих, антигистаминных препаратов с последующей госпитализацией и проведением неотложной посиндромной терапии [9, 10].
Таким образом, при лечении ребенка с лихорадкой педиатру следует помнить:
Читайте также:

