Что такое облигатные вирусы
Обновлено: 19.04.2024
Значение апоптоза в развитии вирусных инфекций и рака
• Вирусные инфекции и рак представляют собой такие патологические состояния, при которых может происходить блокирование апоптоза
Вирусы являются облигатными внутриклеточными паразитами, и поэтому гибель клетки-хозяина является одной из форм борьбы с вирусными инфекциями. Поэтому поддержание жизнеспособности клеток находится в интересах вируса. Многие вирусы обеспечивают это, блокируя клеточную гибель, и механизмы этой блокировки играют важную роль в понимании этапов апоптоза.
Как отмечалось, у насекомых апоптоз регулируется на уровне активации каспазы IAP. Бакуловирусы насекомых блокируют апоптоз точно таким же образом, экспрессируя IAP, который ингибирует DRONC и эффекторные каспазы. Вместе с тем, эти вирусы также экспрессируют другой белок, р35, который связывает и ингибирует активные каспазы. Блокируя активацию каспаз, эти вирусы поддерживают жизнеспособность клетки до тех пор, пока не образуется достаточное количество вирусных частиц и не произойдет лизис клетки.
Для вирусов позвоночных характерна другая стратегия, вероятно, поскольку ингибирование каспазы не блокирует повышение МОМР или независимую от каспаз гибель (и может способствовать развитию иммунного ответа на присутствие вируса). Поэтому некоторые вирусы позвоночных продуцируют антиапоптотические белки, относящиеся к семейству Вс1-2, например Е1В19К и белок BHRF вируса Эпштейна-Барра. Эти и другие вирусные Bcl-2 белки функционируют подобно Вс1-2, предотвращая повышение MOMP и апоптоз.
Вирусы позвоночных часто функционируют, предотвращая апоптоз, индуцируемый эффекторными клетками иммунной системы. Например, вирус ветряной оспы продуцирует ингибиторы протеаз, называемые серпины, которые способны блокировать гранзим В и каспазу-8 (но не каспазу-9 или эффекторные каспазы). Путем блокирования гранзима В вирус избегает эффекта цитотоксических лимфоцитов, которые ведут в организме поиск инфицированных клеток.
Аналогичным образом, ингибирование каспазы-8 приводит к блокированию апоптоза, индуцированному связыванием лигандов с рецепторами клеточной гибели; эти лиганды часто продуцируются цитотоксическими лимфоцитами и другими клетками в ответ на заражение вирусом. Еще один путь, посредством которого вирусы блокируют апоптоз с участием рецепторов клеточной гибели, связан с экспрессией молекул, близких к c-FLIP, например v-FLIP белка, продуцируемого вирусом герпеса.
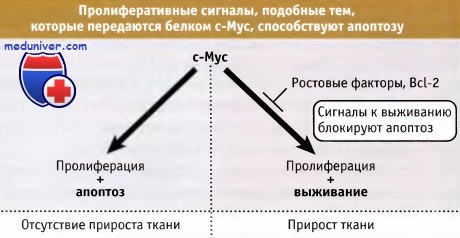
c-Myc и родственные белки не только направляют клетку в цикл, но также сенсибилизируют ее к гибели по пути апоптоза.
В результате, в отсутствие дополнительных сигналов, прироста ткани не наблюдается.
Когда апоптоз блокируется, например, ростовыми факторами, общее количество клеток начинает увеличиваться.
Способность c-Myc сенсибилизировать клетки к апоптозу является фундаментальным свойством этого белка,
а не побочным эффектом его влияния на клеточный цикл.
Подобные механизмы, вероятно, являются центральными в поддержании нормального тканевого гомеостаза и в предотвращении их злокачественного роста.
Другие патологические состояния, связанные с нарушениями механизмов апоптоза, представляют собой опухолевые заболевания. Как отмечалось в начале настоящего раздела, мощный супрессор опухолей, белок р53, который примерно в 30% случаев рака у человека представлен мутантной формой, частично оказывает свое супрессорное действие за счет индукции апоптоза в трансформированных клетках.
Аналогичным образом, антиапоптотический белок Bcl-2 впервые был обнаружен при исследовании хромосомной транслокации, происходящей при фолликулярной В-клеточной лимфоме. При раке происходят изменения в механизмах контроля апоптоза.
Однако взаимосвязь между апоптозом и раком имеет более фундаментальный характер, чем иллюстрируют эти простые примеры. Клетки позвоночных становятся чувствительными к запуску апоптоза за счет сигналов, которые обусловливают их вхождение в цикл, и принятие решения о жизни или смерти основывается на сигналах, переданных клетке от окружающих тканей (например, таких как ростовые факторы). При недостатке этих факторов, у клеток, находящихся в цикле, наступает апоптоз, и это ограничивает рост ткани. На рисунке ниже, например, показано, что белок c-Myc способствует не только пролиферации клеток, но также их апоптозу.
Поэтому экспрессия этого белка в ткани, в отсутствие других сигналов, необязательно способствует клеточной экспансии (или росту опухоли). Основные взаимоотношения между клеточным циклом и апоптозом, вероятно, имеют фундаментальное значение для выяснения вопроса о том, способны ли мы, являясь долгоживущим многоклеточным организмом, существовать без развития рака. Клеточный цикл не является причиной апоптоза; те же молекулы, которые обеспечивают вхождение клетки в цикл, также запускают и апоптоз, который подавляется антиапоптотическими сигналами.
Хотя c-Myc способствует пролиферации и апоптозу, Bcl-2 или Bcl-xL могут функционировать совместно с с-Мус и запускать процесс онкогенеза за счет блокирования апоптоза. Действительно, часто у человека при раке наблюдается активация антиапоптотических белков семейства Bcl-2. Такие кооперативные взаимоотношения между двумя типами онкогенов при раке (проапоптотические и пролиферативные, плюс антиапоптотические), вероятно, представляют собой общий принцип. В общем, можно сказать, что онкогены могут быть аналогичными c-Myc (способствующие как пролиферации, так и апоптозу), Bcl-2 (блокирующие апоптоз, не влияя на пролиферацию), или напоминать те и другие (способствующие пролиферации и блокирующие апоптоз вследствие множественности сигналов).
Белок Ras в активной форме может принимать участие в разных сигнальных путях, которые приводит к этим двум результатам. Так, в зависимости от условий, Ras может как промотировать, так и ингибировать апоптоз.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки — адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Об авторе
Вирусы являются чрезвычайно малыми объектами — их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора — ультратома — делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование — прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ — атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.
Принципиальная схема работы атомно-силового микроскопа (АСМ). Чувствительным элементом АСМ является упругая консоль (кантилевер), на конце которой закреплен острый зонд. Силы, возникающие между атомами острия зонда и исследуемой поверхностью приводят к деформации кантилевера, которая в свою очередь фиксируется при помощи оптической системы, реализованной в большинстве современных АСМ на основе полупроводникового лазера и четырехсекционного фотоприемника. Размер кантилевера — 100÷300 × 20÷40 мкм при толщине около 2 мкм. Высота зонда — около 10 мкм
С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимодействии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Метод атомно-силовой спектроскопии позволяет определить величину силы, действующей между исследуемыми объектами. Для этого один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке. Зонд подводится к поверхности подложки и затем поднимается обратно. Зависимость деформации кантилевера от расстояния между зондом и подложкой называется силовой кривой
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.
Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
Адекватным методом контроля геометрических параметров зонда атомно-силового микроскопа (а) при создании площадки для посадки вириона, является электронная микроскопия, как сканирующая, так и просвечивающая: б — площадка на острие зонда для посадки крупной вирусной частицы; в — вирусоподобная частица, закрепленная на острие зонда. Просвечивающая электронная микроскопия (JEM 1400, Jeol, Япония)
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень — от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований — наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
В публикации использованы фото автора
* Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения.

Но и Дженнер не имел представления о том, что является причиной заболевания оспой. В XIX веке все болезнетворные организмы и вещества без разбора называли вирусами. Лишь благодаря опытам отечественного биолога Дмитрия Иосифовича Ивановского прекратилась эта путаница! Он пропускал экстракт заражённых табачной мозаикой 1 растений через бактериальные фильтры, сквозь которые не проходят даже самые мелкие бактерии. Выяснилось, что экстракт оставался по-прежнему заразным для других растений. Значит, возбудителями табачной мозаики были организмы, меньшие по размеру, чем бактерии; их назвали фильтрующимися вирусами. Вскоре бактерии перестали называть вирусами, а сами вирусы выделили в отдельное царство живых организмов. Дмитрий Ивановский же во всём мире по праву считается основателем вирусологии — науки о вирусах.

Рис. 2. Дженнер прививает Джеймса Фиппса от оспы
Но что мы пока поняли про вирусы? Только то, что они меньше бактерий. Чем же вирусы так не похожи на другие организмы? И почему понадобилось вдруг их выделять в отдельное царство? А вот почему. В отличие от других живых организмов, вирусы не имеют клеточного строения, а значит, и всех характерных для клетки структур. А ещё они единственные, кто не умеет самостоятельно производить белок, главный строительный материал всего живого. Поэтому их размножение невозможно вне заражённой клетки. Из-за этого многие учёные не без оснований считают вирусы внутриклеточными паразитами.
Жертвами различных вирусов становятся представители всех без исключения существующих царств живых организмов! Так, есть вирусы растений — вирус табачной мозаики (рис. 3, слева), вирус мозаики костра (это растение изображено на рисунке 3, справа), вирус желтухи свёклы, вызывающий иногда даже эпидемии. Кстати, в растение вирус просто так не проникнет. Заражение происходит при травмах растительных тканей. Типичный пример: тля пьёт сок из стебля и для этого протыкает покровные ткани — а вирус тут как тут.

Рис 3. Слева: листья табака, поражённые вирусом табачной мозаики. Справа: костёр (лат. Brómus) — род многолетних травянистых растений семейства Злаки. Если посмотреть на заросли костра в ветреную погоду, его крупные метёлки, склоняясь под ветром то в одну, то в другую сторону, отсвечивают красноватым светом в солнечных лучах, очень напоминая языки пламени. Отсюда, вероятно, и произошло русское название этого растения
Грибы тоже поражаются вирусами, вызывающими, например, побурение плодовых тел у шампиньонов или изменение окраски у зимнего опёнка. Причиной многих опасных заболеваний животных и человека тоже служат вирусы: вирус гриппа, ВИЧ (вирус иммунодефицита человека), вирус Эбола, вирус бешенства, герпеса, клещевого энцефалита и т. д.
Есть даже вирусы, поражающие бактерии, их называют бактериофагами 2 . Так, в конце XIX века исследователи из Института Пастера заметили, что вода некоторых рек Индии обладает бактерицидным действием, то есть способствует снижению роста бактерий. И достигалось это благодаря присутствию в речной воде бактериофагов.

Рис. 4. Слева: вирус табачной мозаики. В центре: вирус мозаики костра похож на футбольный мяч (справа)

Рис. 5. Слева направо: вирус герпеса, аденовирус А человека, бактериофаг

Рис. 6. Маленькие вирусы-спутники внутри гигантского мимивируса
Но не стоит думать, что вирусы причиняют исключительно вред другим организмам! Так, исследователи из Пенсильванского университета показали, что безвредный для человека вирус AAV2, встречающийся почти у всех людей, убивает самые разные виды раковых клеток. При этом здоровые клетки организма вирус не заражает.
А совсем недавно стало известно, что вирусы тоже болеют. Мимивирус, поражающий амёбу Acanthamoeba polyphaga, сам страдает от другого вируса-спутника (рис. 6). Он, кстати, так и называется — Спутник. Этот вирус-спутник использует механизмы воспроизводства мимивируса для собственного размножения, мешая ему нормально развиваться в клетке амёбы. По аналогии с бактериофагами, он был назван вирофагом, то есть пожирающим вирусы. Можно сказать, что присутствие вируса-спутника в амёбе обеспечивает ей больше шансов на выживание в борьбе с мимивирусом.
Типы патогенных микроорганизмов. Токсины
В норме организм человека населён различными бактериями и простейшими, которые не вызывают инфекционных заболеваний. Инфекционный процесс возникает при поражении патогенной микрофлорой тканей и слизистых оболочек организма хозяина. Патоген — агент, способный вызвать инфекционный процесс.
Представителей нормальной микрофлоры считают условно-патогенными (комменсалами). Патогенность — способность микроорганизма вызывать заболевание макроорганизма. Вирулентность — степень патогенности (способность вызвать тяжёлое течение заболевания).
Например, основной фактор, определяющий патогенность Streptococcus pneumoniae, — капсула, без которой этот микроорганизм не может вызвать инфекцию. В роли возбудителей могут выступать простейшие и некоторые многоклеточные организмы. Они также могут быть патогенными и условно-патогенными.
Типы патогенных микроорганизмов
Облигатные патогены практически всегда вызывают заболевание (например, Treponema pallidum, ВИЧ). Условно-патогенные микроорганизмы вызывают заболевание только при определённых условиях.
Например, Bacteroides fragilis (комменсал) — представитель нормальной микрофлоры кишечника, но при попадании в брюшную полость (особенно вместе с Е. coli) он может стать причиной абсцесса; Staphylococcus aureus является комменсалом бактериальной флоры передних отделов носовых проходов, он может быть причиной заболевания только при попадании на раневую поверхность.
Другие микроорганизмы считают оппортунистическими патогенами. Они обычно поражают людей со слабой иммунной системой. Например, Pneumocystis jiroveci может быть причиной пневмонии только у пациентов со сниженным Т-клеточным иммунитетом.
Токсины патогенных микроорганизмов
Эндотоксины — стимуляторы выработки ИЛ-1 и ФНО-а макрофагами, вызывающие развитие лихорадки и шока.
Экзотоксины — вещества белковой структуры, оказывающие местное или системное повреждающее воздействие на макроорганизм. Большинство из них состоит из нескольких субъединиц, одна из которых способствует прикреплению или проникновению в клетки-мишени, а вторая обусловливает физиологический эффект.
Классический пример — холерный токсин, В-субъединица которого связывается с эпителиальными клетками, а А-субъединица активирует аденилатциклазу и усиливает отток ионов натрия и хлора из клетки, способствуя возникновению диареи.
Некоторые экзотоксины выступают в роли суперантигенов, вызывая неспецифическую активацию Т-клеток, усиливая выработку медиаторов воспаления — цитокинов, что приводит к развитию ярко выраженных физиологических эффектов (лихорадки, шока, желудочно-кишечных расстройств, сыпи).
Некоторые экзотоксины влияют на синтез белка (например, дифтерийный токсин и синегнойный экзотоксин А), в то время как другие нарушают нервно-мышечную передачу (столбнячный и ботулиновый токсины).
В большинстве случаев антитела к токсинам нейтрализуют их эффекты и обладают протективным действием.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

