Что такое противовирусные антитела их биологическая роль
Обновлено: 15.04.2024
Типы гуморального иммунного ответа при вирусной инфекции. Иммуноглобулин A.
Иммунная система организма на вирусные инфекции или иммунизацию вирусными вакцинами отвечает выработкой антител, обладающих специфичностью к различным вирусным компонентам и принадлежащих к разным классам иммуноглобулинов.
Важнейшая биологическая функция иммуноглобулинов - специфическое связывание с антигеном. Антитела против некоторых эпитопов на поверхности вирионов нейтрализуют инфекционность, они могут также действовать как опсонины, облегчая поглощение и разрушение макрофагами. Кроме того, антитела могут прикрепляться к вирусным антигенам на поверхности инфицированных клеток, вызывая их разрушение вследствие активации классического или альтернативного действия комплемента или с помощью активации Fc-рецепторсвязывающих клеток, таких как NK-клетки, полиморфноядерные лейкоциты и макрофаги (антителозависимая цитотоксичность).
Различают четыре основных класса антител: два мономера IgG и IgE и два полимера IgM и IgA. Все иммуноглобулины имеют подобную структуру, но широко варьируют по аминокислотной последовательности антигенсвязывающего сайта, который определяет их специфичность для данной антигенной детерминанты. N-концевая последовательность L- и Н-цепей образует антигенсвязывающий центр, то есть антидетерминанту. Чем больше антидетерминант на поверхности иммуноглобулина, тем выше его активность.
Авидность характеризует прочность связи антитела с соответствующим антигеном. Афинность - прочность связи между отдельными антидетерминантами и детерминантами.
IgG является основным классом антител в крови. Он состоит из двух Н- и L-цепей, каждая из которых содержит постоянные и вариабельные участки. Молекулы IgG содержат два идентичных антигенсвязывающих Fab-фрагмента и Fc-фрагмент, выполняющий эффекторные функции (связывание комплемента, прикрепление к фагоцитам и плацентарному или колостральному трансферу).
В результате системной вирусной инфекции IgG синтезируется в течение длительного периода и является главным фактором защиты от реинфекции. Субклассы IgG отличаются константной областью их V-цепей и, соответственно, биологическими свойствами, такими как фиксация комплемента и прикрепление к фагоцитам.
Первоначально антитела относятся к классу IgM, но соматические рекомбинации (транслокации) затем рождают класс, обусловленный связыванием V-генных сегментов различными постоянными участками Н-цепей. В изменении изотипов (переход изотипов на другой путь) важная роль принадлежит различным цитокинам. Таким образом, через несколько дней IgG , IgA и иногда IgE-антите-ла той же самой специфичности становятся доминантными в иммунном ответе.
Тц-клетки достигают своего пика обычно через неделю после инфекции, а антитела — через 2—3 недели. NK-клетки максимально активируются через два дня, а активность интерферона совпадает с пиком концентрации вируса.
Динамика гуморального иммунного ответа проявляется, в первую очередь, в смене синтеза антител различных классов. В начальной фазе иммунного ответа синтезируется преимущественно IgM с относительно слабым сродством к антигену (авидный класс антител). IgM является пентамером с 10 Fab-фрагментами. Синтез IgM сменяется синтезом IgG, а затем IgA. IgM-антитела находятся в большинстве случаев в плазме крови и лимфе, обладая способностью преципитировать, агглютинировать и лизировать антигены.
Устойчиво высокие титры антител могут отражать также персистенцию вирусной инфекции (например, вирусов герпеса, кори) или повторную стимуляцию вирусным антигеном, однако антитела к некоторым вирусам могут персистировать и без явных признаков заболевания. IgG -антитела содержатся в сыворотке крови в наиболее высокой концентрации (~12г/л), откуда они поступают в тканевую жидкость. В отличие от других иммуноглобулинов, у человека и приматов они способны проникать через плаценту и снабжать плод материнскими антителами. Период полураспада их равен 10-35 дням.
Иммуноглобулин A (IgA) является димером с 4 Fab-фрагментами. Проходя через эпителиальные клетки, IgA приобретает J-фрагмент (секреторный фрагмент), становясь секреторным slgA, который секретируется через эпителий респираторного, кишечного и урогенитального трактов. Секреторный IgA более устойчив к протеазам, чем другие иммуноглобулины, и является основным иммуноглобулином на слизистых поверхностях, в молозиве и молоке многих видов млекопитающих. Поэтому IgA-антитела играют важную роль в защите от инфекции респираторного, кишечного и урогенитального трактов. Иммунизация через слизистые при некоторых инфекциях является более эффективной, чем системное введение вакцины.
Секреторные антитела появляются на 4-7-й день после инфицирования и представлены в основном IgA, IgG и IgM. Они считаются менее специфичными, чем сывороточные. Динамика накопления антител в сыворотке крови и секретах практически одинакова.
В отличие от сывороточного IgA, большая часть которого является мономером, молекула секреторного IgA представляет собой димер. Мономерный IgA синтезируется плазматическими клетками костного мозга, периферических лимфатических узлов, селезенки и других органов. Димерные формы sIgA с соединительной j-цепью синтезируются лимфоидной тканью желудочно-кишечного, респираторного и урогенитального трактов.
Добавочный структурный компонент секреторного IgA, вероятно, функционирует как поверхностный рецептор клеток секреторного эпителия и придает устойчивость sIgA к действию протеаз. Биологическая функция sIgA состоит в основном в местной защите слизистых оболочек от инфекции. Формирование местных секреторных IgA на поверхности слизистых оболочек имеет особое значение для формирования устойчивости организма к вирусам, обычно проникающим через дыхательный, кишечный или урогенитальный эпителий. Для индукции секреторных IgA в кишечнике вирус должен вступить в контакт с лимфоидной тканью кишечника. После формирования местного ответа В-клетки памяти, образующие IgA, мигрируют в другие участки кишечника. Аналогичный механизм индукции IgA функционирует в респираторном тракте.
Система секреторного иммунитета функционирует и регулируется иначе, чем иммунная система в целом. Она может коррелировать с общей иммунной реакцией или быть независимой от нее. Кроме секреторного IgA, существенное значение для иммунитета слизистых оболочек имеют содержащиеся в секретах у человека IgM и IgG. IgM также представляет секреторный иммуноглобулин, однако он не так прочно, как sIgA, связывает секреторный компонент. В пищеварительном тракте IgM играет более важную роль, чем IgG, а в носоглотке - наоборот.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

МЕТОДЫ СЕРОЛОГИЧЕСКИХ РЕАКЦИЙ В ДИАГНОСТИКЕ ВИРУСНЫХ БОЛЕЗНЕЙ
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Для диагностики вирусных болезней людей и животных используют серологические реакции, которые основаны на взаимодействии вирусных антигенов со специфическими антителами.
Вирус – антиген, так как их белковая оболочка вызывает выработку специфических антител, которые накапливаются в сыворотке крови. Они способны соединятся в комплекс антиген + антитело только со своим антигеном. Если антиген – инфекционный агент (вирус), антитела его нейтрализуют: в этом состоит биологическая роль антитела.
Взаимодействие антител с антигенами возможно в пробирке, что является основой серологических реакций. Если взятая пара АГ (антиген) и АТ (антитело) гомологичны и соответствуют друг другу, то они образуют комплекс АГ + АТ. Это позволяет обнаружить по известному антителу неизвестный антиген [1].
1. Реакция нейтрализации (PH)
Это универсальная реакция служит эталоном при оценке других серологических реакций.
Принцип ее состоит в том, что при взаимодействии антигена (вируса) с гомологичными антителами образуется комплекс антиген + антитело, в результате нейтрализуется инфекционность вируса. Индикатором свободного (не связавшегося с антителами) вируса является чувствительная к вирусу живая система: животные, куриные эмбрионы или культура клеток.
При постановке реакции в пробирке смешивают равные объемы вируса и сыворотки, смесь выдерживают при соответствующей температуре (4, 22 или 37 °С) в течение одного часа или 16—18 ч (зависит от вируса и условий опыта). Затем этой смесью заражают чувствительную к вирусу живую систему, наблюдают за состоянием живых объектов и через соответствующий срок учитывают результат нейтрализации вируса по отсутствию:
1) гибели, развития клинической картины болезни и патологических изменений в органах и тканях лабораторных животных;
2) гибели, патологических изменений в оболочках, тканях зародыша и отсутствию гемагглютининов в жидкостях полостей куриных эмбрионах;
3) цитопатического действия (ЦПД) или бляшкообразования в культуре клеток. [2]
Так как для нейтрализации определенного количества вируса требуется определенное количество антител, а один из этих компонентов все еще неизвестен, то PH можно ставить в двух вариантах:
1) к разным дозам (разведениям) сыворотки (обычно в виде последовательных 2-кратных разведений) добавляют одинаковые дозы вируса (обычно 100—1000 ЕД50). В этом варианте определяют титр вируснейтрализующих антител в сыворотке, показателем которого служит разведение сыворотки, защищающее от действия вируса 50 % зараженных биологических систем;
2) к разным дозам (разведениям) вируса (обычно в виде последовательных 10-кратных разведений) добавляют одинаковые дозы сыворотки (обычно в разведениях 1 : 10 или 1 : 20). При постановке данного варианта PH кроме исследуемой (или специфической) сыворотки используют и нормальную (отрицательную) сыворотку. В этом случае определяют индекс нейтрализации (IN), который показывает, во сколько раз иммунная (специфическая) или исследуемая сыворотка снижает титр вируса по сравнению е нормальной сывороткой.
Достоинствами PH являются ее универсальность и высокая специфичность; недостатки — большая трудоемкость; необходимость строго соблюдать стерильность материалов, посуды и инструментов; высокая стоимость живых биологических систем; относительная длительность биопробы и необходимость проведения математических расчетов. [3]
2.Реакция торможения гемагглютинации (РТГА)
Широко используется при исследовании гемагглютинирующих вирусов.
Основана на том, что антитела при встрече с гомологичным вирусом (антигеном) нейтрализуют не только его инфекционную, но и гемагглютинирующую активность, так как блокируют рецепторы вирионов, ответственные за гемагглютинацию, образуя с ними комплекс антиген + антитело.
Принцип РТГА состоит в том, что в пробирке (лунке) смешивают равные объемы сыворотки крови и вируса и после экспозиции (30—40 мин) добавляют эритроциты соответствующего вида животного.
Эритроциты являются индикатором наличия вируса в смеси. Агглютинация эритроцитов указывает на наличие вируса в смеси, а отсутствие гемагглютинации — на его отсутствие, так как антитела полностью нейтрализовали гемагглютинирующую активность вируса. [4]
РТГА можно ставить в двух вариантах:
1) к разным разведениям сыворотки (обычно 2-кратным) добавляют одинаковые дозы вируса (4—8 ГАЕ);
2) к разным разведениям вируса (обычно 2-кратным) добавляют одинаковые дозы сыворотки.
Постановку РТГА по первому варианту проводят по следующим этапам:
• титруют вирус в РГА и определяют его гемагглютинирующий титр;
• приготовляют и контролируют рабочую дозу вируса (4 или 8 ГАЕ);
• ставят главный опыт РТГА;
Оценивают гемагглютинацию в каждой смеси в крестах и определяют титр антител. За титр антител в сыворотке принимается наивысшее разведение сыворотки, которое еще полностью тормозит гемагглютинацию. [5]
РГТА позволяет решить следующие диагностические задачи:
• обнаружить и определить титр антител в сыворотке крови с помощью известного вируса;
• идентифицировать неизвестный вирус путем исследования его с различными заведомо известными сыворотками (антителами).
Достоинства РТГА — простота техники постановки и быстрый результат. Однако эту реакцию можно использовать только для гемагглютинирующих вирусов. [4]
3.Реакция непрямой гемагглютинации (РНГА)
Основана на том, что эритроциты, на которых предварительно адсорбированы антигены, приобретают способность агглютинироваться в присутствии гомологичных сывороток (антител).
Эритроциты при этом выполняют роль носителей со специфическими детерминантами, агглютинация которых происходит в результате реакции антиген + антитело.
Эритроциты, к поверхности которых прочно присоединены антигены, называют эритроцитарным антигенным диагностикумом, или эритроцитами, сенсибилизированными антигеном.
Другой тип РНГА — на поверхности эритроцитов адсорбированы антитела и последующая их агглютинация происходит в присутствии гомологичного антигена. В этом случае такие эритроциты называют эритроцитарным антительным диагностикумом, или эритроцитами, сенсибилизированными антителами.
Приготовление эритроцитарных диагностикумов включает следующие этапы:
• фиксация эритроцитов формальдегидом или глютаровым, или акриловым альдегидами. Такие обработанные эритроциты длительно сохраняются. Чаще для этой цели используют эритроциты барана, человека, кур и др.;
• обработка фиксированных эритроцитов раствором танина. В результате эритроциты приобретают свойство необратимо адсорбировать на своей поверхности белки (вирусы и антитела);
• сенсибилизация танизированных эритроцитов вирусами или антителами.
Методика постановки РНГА для обнаружения и определения титра антител заключается в следующем:
• к последовательным 2-кратным разведениям сыворотки добавляют равные дозы эритроцитов, сенсибилизированных антигеном;
• смесь оставляют на 2—3 ч при комнатной температуре или на 16—18 ч при 4 °С;
• учитывают результаты. Если в сыворотке содержатся антитела к вирусу, которым были сенсибилизированы эритроциты, наблюдают гемагглютинацию, которую оценивают в крестах.
РНГА позволяет решать следующие диагностические задачи:
• обнаружить антитела и определить их титр в сыворотке крови с помощью известного эритроцитарного антигенного диагностикума;
• обнаружить и идентифицировать неизвестный вирус с помощью известного эритроцитарного антительного диагностикума.
Достоинства РНГА: высокая чувствительность, простота техники постановки и быстрота ответа. Однако важно отметить, что возникают большие трудности в приготовлении стабильных эритроцитарных диагностикумов (большая зависимость от чистоты используемых компонентов, необходимость подбора режима фиксации, танизации и сенсибилизации эритроцитов для каждого вида вируса). [6]
4.Реакция связывания комплемента (РСК)
Это — одна из традиционных серологических реакций, применяемых для диагностики многих вирусных болезней.
Само название в значительной мере отражает суть метода, состоящего из двух отдельных этапов. На первом этапе участвуют антиген и антитело (один из этих ингредиентов заранее известен), а также определенное количество предварительно оттитрованного комплемента. При соответствии антигена и антитела их комплекс связывает комплемент, что выявляют на втором этапе с помощью индикаторной системы (смесь бараньих эритроцитов и антисыворотки к ним — гемолизина). Если комплемент связался при взаимодействии антигена и антитела, то лизиса эритроцитов не происходит (положительная РСК). При отрицательной РСК несвязанный комплемент способствует гемолизу эритроцитов. РСК часто используют в диагностической практике для обнаружения и идентификации вирусов, обнаружения и титрования антител в сыворотках крови.
Основными компонентами РСК служат антигены (известные или выявляемые), антитела (известные антисыворотки или исследуемые сыворотки), комплемент (сыворотка крови морской свинки), гемолитическая сыворотка и эритроциты барана; в качестве разбавителя используют изотонический раствор натрия хлорида (pH 7,2—7,4) или различные буферные растворы. [2]
5.Реакция диффузионной преципитации в геле (РДП)
Основана на способности к диффузии в гелях антител и растворимых антигенов.
Для создания условий диффузии в слое агара делают лунки, в которые заливают компоненты. Количество и взаимное расположение лунок зависит от решаемой задачи.
РДП позволяет решить следующие диагностические задачи:
обнаружить и идентифицировать неизвестный выделенный вирус путем исследования его с различными заведомо известными сыворотками (антителами);
обнаружить и определить титр антител в сыворотках с помощью известного антигена.
РДП может быть поставлена в чашках Петри (макрометод) и на предметных стеклах (микрометод).
Методика постановки макрометода по технике принципиально не отличается от постановки микрометода, только в этом случае в чашку Петри наливают 20—25 мл расплавленного агара и в застывшем геле делают лунки диаметром 5—6 мм по специальной схеме (расстояние между лунками 4—5 мм ) и вносят соответствующие компоненты.
При постановке РДП на предметных стеклах препарат можно через 48—72 ч высушить и окрасить раствором амидного черного, что позволит его сохранить и сфотографировать.
Достоинства РДП: простота техники постановки; быстрота получения ответа; не требует стерильной работы, особой чистоты компонентов; возможность документирования результата путем фотографирования. Недостаток РДП — низкая чувствительность. [7]
6.Реакция торможения гемадсорбции (РТГАд)
Эту реакцию используют в том случае, если вирус обладает гемадсорбирующими свойствами. Гемадсорбцией называется адсорбция (прилипание) эритроцитов к поверхности клеток, зараженных вирусом.
Чтобы наблюдать гемадсорбцию, из пробирки с зараженной вирусом культурой клеток удаляют культуральную жидкость и вносят 0,5%-ную взвесь эритроцитов, оставляют на 5—10 мин, затем слой клеток споласкивают физиологическим раствором (чтобы смыть эритроциты). Если в зараженной культуре клеток идет репродукция вируса, то на таких клетках под малым увеличением микроскопа можно видеть адсорбировавшие эритроциты, в контрольных (незараженных) культурах клеток таковые отсутствуют.
РТГАд основана на торможении гемадсорбции, если зараженную вирусом культуру клеток предварительно обработать специфической сывороткой (содержащей антитела к этому вирусу).
Методика постановки РТГАд заключается в следующем: на 3—7-й день после заражения культур клеток из них удаляют питательную среду, промывают клетки раствором Хенкса и вносят в каждые 4 пробирки по 0,5 мл специфической к вирусу ПГ-3 сыворотки в разведении 1:10;
пробирки в наклонном положении оставляют при комнатной температуре на 30 мин (для контакта клеток с антителами);
во все пробирки вносят по 1 мл 0,5%-ной взвеси эритроцитов морской свинки;
через 30 мин — учет результатов. Отсутствие гемадсорбции в пробирках со специфической сывороткой и проявление ее в пробирках с зараженной культурой клеток, но не обработанной специфической сывороткой, свидетельствует о наличии вируса ПГ-3 в культуре клеток.
Чаще всего РТГАд применяют для идентификации вируса и редко для обнаружения и титрования антител. [4]
7.Реакция иммунофлуоресценции (РИФ)
При данном методе используют явление люминесценции.
В РИФ люминесценция проявляется в виде флуоресценции — это свечение, возникающее в момент облучения возбуждающим светом и прекращающееся сразу после его окончания.
Для возбуждения флуоресценции при люминесцентной микроскопии чаще всего используют ультрафиолетовую или сине-фиолетовую часть спектра (длина волны 300—460 нм).
Метод РИФ заключается в том, что антитела, соединенные с флуорохромом, сохраняют способность вступать в специфическую связь с гомологичным антигеном. Образующийся комплекс антиген + антитело в связи с присутствием в нем флуорохрома обнаруживают под люминесцентным микроскопом по характерному свечению.
Для получения антител используют высокоактивные гипериммунные сыворотки, из которых выделяют антитела и метят их флуорохромом. В качестве флуорохрома наиболее часто используют ФИТЦ-флуоресцеин изотиоционат (зеленое свечение) и РСХ-родамин сульфохлорид (красное свечение). Антитела, меченные флуорохромом, называют конъюгатом. [3]
Методика приготовления и окрашивания препаратов заключается в следующем:
• готовят на предметных стеклах мазки, отпечатки из органов или на покровных стеклах — инфицированную культуру клеток; можно использовать и гистосрезы;
• препараты подсушивают на воздухе и фиксируют в охлажденном ацетоне при комнатной температуре или при минус 15 °С (от 15 мин до 4—16 ч);
• окрашивают по прямому или непрямому методу; ведут учет под люминесцентным микроскопом по интенсивности свечения, оцениваемому в крестах.
Параллельно готовят и окрашивают препараты от здорового животного — контроль.
Различают два основных метода применения флуоресцирующих антител: прямой и непрямой.
Прямой метод (одноступенчатый). На фиксированный препарат наносят конъюгат (флуоресцирующую сыворотку к предполагаемому вирусу), выдерживают 30 мин при температуре 37 °С во влажной камере. Затем препарат отмывают от несвязанного конъюгата физиологическим раствором (pH 7,2 — 7,5), подсушивают на воздухе, наносят нефлуоресцирующее масло и исследуют под микроскопом.
Прямой метод позволяет обнаружить и идентифицировать антиген. Для этого нужно иметь на каждый вирус флуоресцирующую сыворотку.
Непрямой метод (двухступенчатый). На фиксированный препарат наносят немеченую сыворотку, содержащую антитела к предполагаемому вирусу, выдерживают 30 мин при 37 °С, отмывают несвязанные антитела. На препарат наносят флуоресцирующую антивидовую сыворотку, соответствующую виду животного — продуцента гомологичных противовирусных антител, выдерживают 30 мин при 37 °С. Затем препарат отмывают от несвязанных меченых антител, подсушивают на воздухе, наносят нефлуоресцирующее масло и исследуют под люминесцентным микроскопом.
Непрямой метод позволяет не только обнаружить и идентифицировать антиген, но и выявить и определить титр антител. Кроме того, этим методом можно обнаруживать одной меченой сывороткой антигены различных вирусов.
Разработаны несколько модификаций непрямого метода. Наибольшего внимания заслуживает метод с использованием комплемента. Метод заключается в том, что на фиксированный препарат наносят инактивированную нефлуоресцирующую специфическую сыворотку и комплемент морской свинки, выдерживают 30 мин при 37 °С, промывают, и для выявления комплекса антиген + антитело + комплемент наносят флуоресцирующую антикомплементарную сыворотку, выдерживают 30 мин при 37 °С, промывают, подсушивают на воздухе и исследуют под люминесцентным микроскопом.
Достоинства РИФ: высокая специфичность и чувствительность; простота техники постановки; требуется минимальное количество компонентов. Это экспресс-метод диагностики, так как в течение нескольких часов можно получить ответ. К недостаткам можно отнести субъективизм в оценке интенсивности свечения и, к сожалению, иногда флуоресцирующие сыворотки бывают плохого качества. В настоящее время РИФ широко применяют в диагностике вирусных болезней животных. [5]
Библиографический список
1. Госманов, Р. Г. Ветеринарная вирусология [Текст] : учебник для студ. вузов, обуч. по спец. 111201 "Ветеринария" / Р. Г. Госманов, Н. М. Колычев. - 2-е изд., перераб. и доп. - М. : КолосС, 2006. – 93c.
2. Широбоков В. П. Медицинская микробиология, вирусология и иммунология [Текст] : учебник для студ. высш. мед. учеб. заведений. – М. : Винница Нова Книга, 2015. – 262 с.
4. В. А. Подколзина, А. А. Седов Медицинская микробиология[Текст]: конспект лекций для вузов. – М.: Приор-издат, 2007. – 14с.
5. Павлович С. А. Микробиология с вирусологией и иммунологией [Текст] : учеб. пособие / Павлович С. А. – 3-е изд., испр. – Минск: Выш. шк., 2013. – 388 с.
6. Донецкая Э.Г.-А. Клиническая микробиология [Текст] : Руководство для специалистов клинической лабораторной диагностики. — М. : ГЭОТАРМедиа, 2011. — 57 с.
7. Кишкун А. А. Клиническая лабораторная диагностика [Текст]: учеб. пособие. – М.: ГЭОТАР-Медиа, 2010. – 807 с.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Определение
Новая коронавирусная инфекция COVID-19 – это острое инфекционное заболевание, относящееся к группе ОРВИ (острых респираторных вирусных инфекций). Его вызывает новый коронавирус SARS-CoV-2.
Основным источником инфекции является больной человек, в том числе находящийся в инкубационном периоде заболевания (между моментом заражения и появлением первых жалоб).
Наибольшую опасность для окружающих человек представляет в последние два дня инкубационного периода (больной еще не знает, что болен, но уже выделяет вирус) и в первые дни болезни (поскольку выделяет максимальное количество вируса).
Пути передачи вируса
Передача инфекции осуществляется воздушно-капельным и контактным путями. Воздушно-капельный путь считается основным и реализуется при кашле, чихании и разговоре на близком (менее 2 метров) расстоянии. Контактным путем можно заразиться через рукопожатия, объятия и поцелуи, а также через поверхности и предметы, пищевые продукты, обсемененные вирусом.
Жалобы при COVID-19 неспецифичны и встречаются при других ОРВИ. В большинстве случаев болезнь протекает нетяжело. Нередко отмечается и вовсе бессимптомное течение: человек чувствует себя хорошо, не предъявляет никаких жалоб, а о перенесенной болезни узнает случайно, сдав анализы.
- Легкое течение (около 80% заболевших).
- Температура тела до 38°C, кашель (чаще сухой, но может быть и с мокротой), общая слабость, боли в горле; возможно, снижение обоняния и вкуса, расстройство стула, различные кожные высыпания.
- Среднетяжелое течение.
- Температура тела выше 38°C.
- Частота дыхания более 22/мин.
- Одышка – ощущение нехватки воздуха, сопровождающееся изменением частоты, глубины и ритма дыхания при обычных физических нагрузках.
- Изменения на КТ (компьютерной томографии) органов грудной клетки, типичные для вирусного поражения (объем поражения минимальный или средний; КТ 1-2).
- Сатурация кислорода (SpO2) – насыщение крови кислородом менее 95%.
- СРБ (С-реактивный белок) сыворотки крови более 10 мг/л.
- Тяжелое течение.
- Частота дыхания более 30/мин.
- SpO2 менее 93%.
- Снижение уровня сознания или возбуждение.
- Нестабильная гемодинамика (снижение артериального давления менее 90/60 мм рт. ст., уменьшение объема выделяемой мочи).
- Изменения в легких на КТ органов грудной клетки, типичные для вирусного поражения (объем поражения значительный или субтотальный; КТ 3-4).
- Изменения ряда лабораторных показателей, определяемых в условиях отделения интенсивной терапии.
- Крайне тяжелое течение – множественные тяжелейшие поражения органов и систем с необходимостью респираторной поддержки (инвазивной вентиляции легких).
- Изменения в легких при КТ, типичные для вирусного поражения критической степени (объем поражения значительный или субтотальный; КТ 4).
Наличие вируса в организме можно выявить путем взятия мазков из носоглотки (носа) и ротоглотки (зева).
- Обнаружение РНК SARS-CoV-2 методом ПЦР;
- Обнаружение вирусных антигенов (экспресс-диагностика).
- Обнаружение антител IgG и IgM к коронавирусу – качественный (есть или нет антитела) и количественный (сколько антител) методы.
- Обнаружение антител IgG и IgM к коронавирусу (экспресс-диагностика).
Их достоинства – быстрое (в течение 20-30 минут) получение результата, возможность использования в домашних условиях. Недостаток – не слишком высокая точность: из-за невысокой чувствительности тесты не всегда могут определить пациентов с новой коронавирусной болезнью (не определяют примерно каждого четвертого). Если тест положительный, то это практически всегда верно. Отрицательный тест не исключает наличие болезни. Экспресс-методы могут использоваться в первичной диагностике для определения дальнейшей тактики обследования.
-
Клинический (общий) анализ крови, С-реактивный белок, прокальцитонин – для исключения присоединения бактериальной инфекции.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
С-реактивный белок – белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме. Синонимы: Анализ крови на СРБ; С-реактивный белок сыворотки крови. C-reactive Protein (CRP), quantitative; C-reactive protein test; CRP test. Краткое описание опред.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Синонимы: Фрагмент расщепления фибрина. D-dimer, Fragment D-dimer, Fibrin degradation fragment. Краткая характеристика определяемого вещества D-димер D-димер представляет собой растворимый продукт расщепления поперечно-сшитого фибрина. Генерация D-димера требует последовательной активност.
Для проведения исследования в медицинских офисах необходимо предъявить СНИЛС и документ удостоверяющий личность. Запись на исследование В случае получения положительного или сомнительного результата на COVID-19 и при необходимости проведения подтверждающего тестирования обра.
Срок выполнения исследования на выявление РНК SARS-CoV-2 в лабораториях медицинских организаций не должен превышать 48 часов с момента получения биологического материала. Если отбор проводится не в лабораторном центре, необходимо учитывать время доставки проб до лаборатории. Срок выполнения исследований в референтной лаборатории – не более 48 часов с момента доставки образца.
Взятие мазка методом ПЦР для обнаружения РНК SARS-CoV-2 проводится:
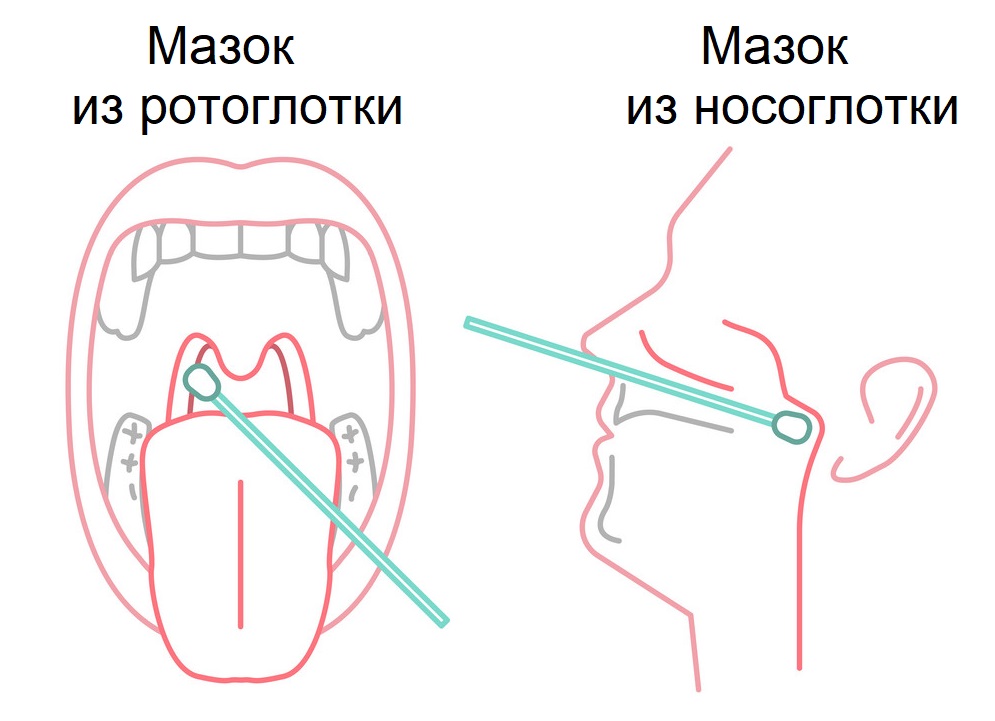
Пациенту за 3-4 часа до взятия мазка нельзя есть, пить, чистить зубы, полоскать рот и горло, использовать спрей-освежитель для ротовой полости, жевать жевательную резинку, курить. Кроме того, нельзя промывать нос, использовать спреи, капли, мази для носа. Это позволит сохранить для исследования максимально возможное число пораженных вирусом клеток эпителия (наружного слоя) верхних дыхательных путей.
Интерпретация результатов
К сожалению, ПЦР-диагностика иногда может давать ошибочные результаты. Причины ложноотрицательных результатов (человек болен COVID-19, а результат теста отрицательный):
- количество вируса в образце меньше порога чувствительности тест-системы из-за некорректной подготовки пациента к исследованию или из-за небольшого количества вируса в организме (низкая вирусная нагрузка), например, при бессимптомном течении или в период выздоровления;
- некорректное взятие мазка – например, только из зева или только из носа, погрешности в технике забора материала;
- нарушение рекомендованного срока хранения взятого образца;
- ненадежная система идентификации образцов, что ведет к получению чужого результата.
Антитела класса М (IgМ) к SARS-CoV-2 появляются, как правило, на 7-10 день болезни. Они могут сохраняться в организме человека до 2-3 месяцев. Поэтому их обнаружение говорит о текущей или недавно перенесенной инфекции.
Антитела класса G (IgG) к SARS-CoV-2 обнаруживают обычно через 10-14 дней после начала болезни. Выявление IgG-антител к возбудителю COVID-19 свидетельствует, что человек выздоравливает или уже переболел коронавирусной инфекцией. Длительность их сохранения в организме на сегодняшний день точно неизвестна.
Тестирование на антитела к вирусу SARS-Cov-2 рекомендуется использовать в следующих случаях:
- в качестве дополнительного метода диагностики острой инфекции (не ранее 7-го дня болезни для IgM, не ранее 10-14-го дня болезни для IgG) или при невозможности по какой-либо причине исследования мазков;
- для выявления лиц с бессимптомной формой инфекции;
- для установления факта перенесенной ранее инфекции при обследовании групп риска и проведении массового обследования населения для оценки уровня популяционного иммунитета;
- для отбора потенциальных доноров иммунокомпетентной (антиковидной) плазмы.
Донорами антиковидной плазмы могут стать лица в возрасте от 18 до 55 лет, с отсутствием противопоказаний к донорству (ряд хронических заболеваний, беременность), которые болели коронавирусной инфекцией и выздоровели, при условии, что с начала болезни прошло не менее 5 недель.
Для оценки иммунитета после вакцинации имеет значение только выявление определенных IgG – антител к спайковому (S) белку SARS-CoV-2 (качественный).
Для проведения исследования в медицинских офисах необходимо предъявить СНИЛС и документ удостоверяющий личность. Синонимы: Выявление IgG к спайковому (S) белку SARS-CoV-2 (качественный анализ) после COVID-19 и для оценки эффективности вакцинации (вакцинным препаратом на основе RBD-домена.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.
Определение
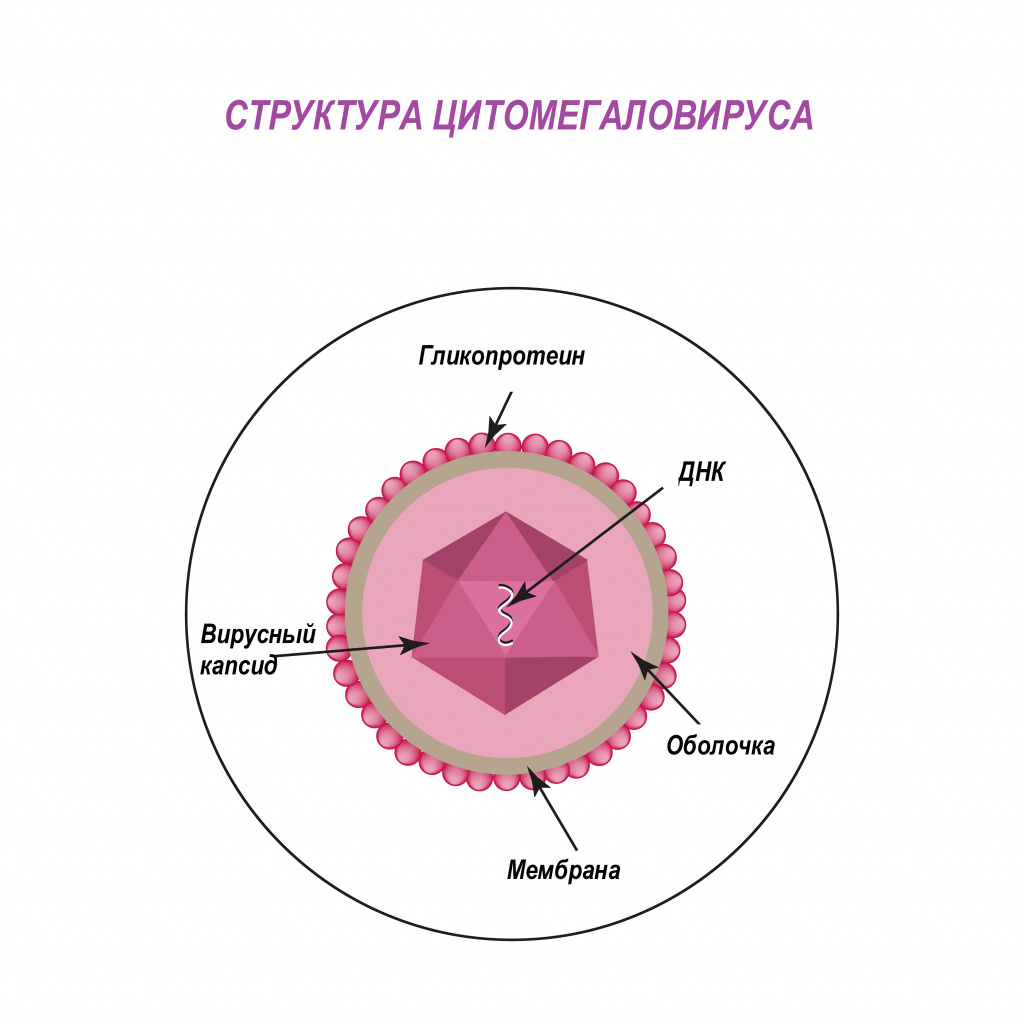
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений - от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Попадая в клетки организма, цитомегаловирус способен оставаться в них пожизненно. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. При угнетении иммунитета вирус активизируется, вызывая клинические симптомы болезни.
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% - то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
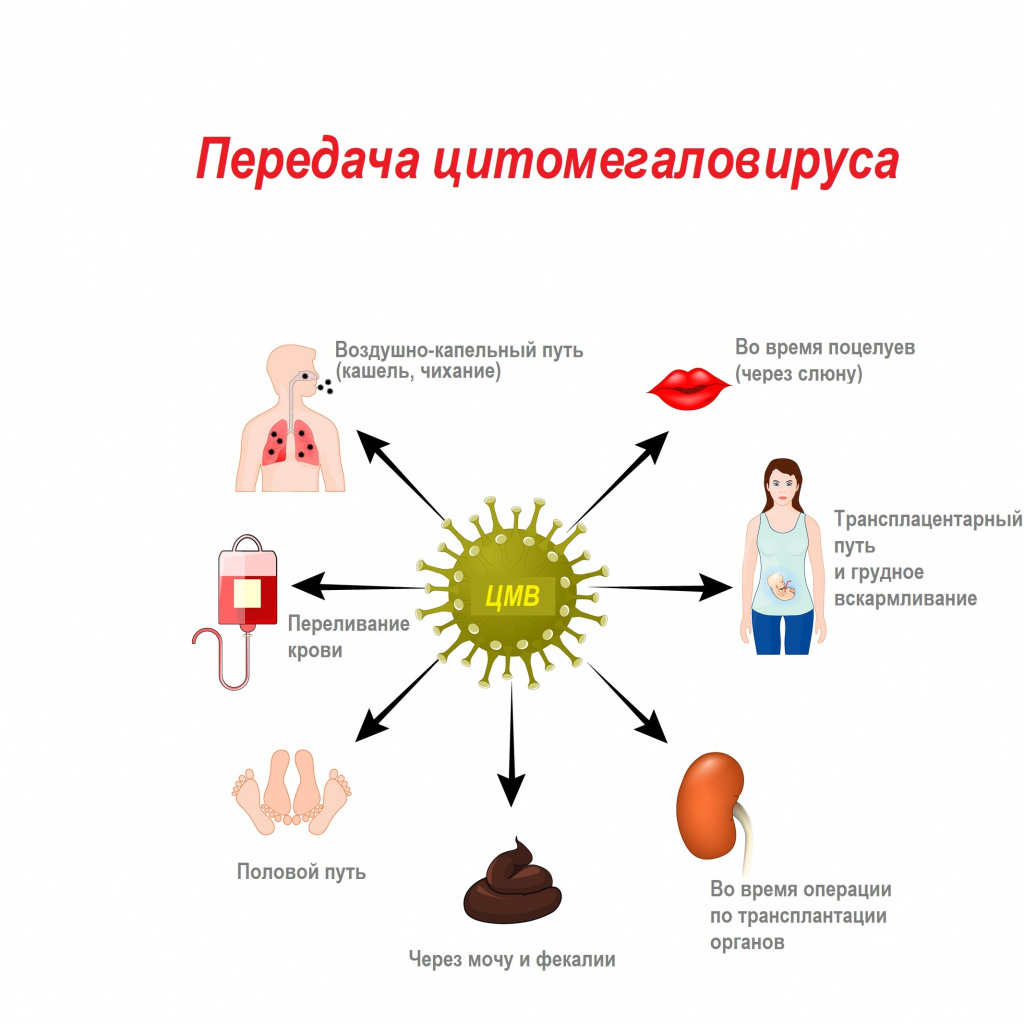
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.
- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело - вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования - общие и специфические:
-
общий анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу. Cytomegalovirus; CMV Antibody, IgG; CMV infection; CMV-specific IgG. Краткое описание исследования Anti-CMV-IgG .
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирусная инфекция входит в группу репродуктивно значимых инфекций, обозначаемых как TORCH-комплекс (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes); первичное инфицирование данными возбудителями, либо обострение .
К каким врачам обращаться
С первичными жалобами пациенты обращаются к врачу-терапевту или врачу общей практики (семейному врачу), детей ведет врач-педиатр . Могут потребоваться консультации инфекциониста - для верификации диагноза, стоматолога - при поражениях слизистой оболочки рта, кардиолога - при наличии врожденного порока сердца, нейрохирурга - при пороках центральной нервной системы, невропатолога - для оценки неврологической патологии, гематолога - при выраженных гематологических изменениях и геморрагическом синдроме, окулиста - для исследования глазного дна, отоларинголога - для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию - для восстановления обмена веществ в организме;
- симптоматическую терапию - для купирования воспалительных и токсических проявлений заболевания.
Проблема клинически выраженной инфекции актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих кортикостероидную, туберкулостатическую терапию, а также перенесших ожоговую травму.
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Читайте также:

