Что такое реассортантный вирус а
Обновлено: 22.04.2024
В статье представлены методы профилактики и лечения гриппа. Описаны механизмы действия противовирусных препаратов. представлена сравнительная характеристика противовирусных средств Особое внимание уделено Эрюферону - новому препарату с комплексным действием, созданному на основе аффинно очищенных ангител к интерферону у человека, гистамину и CD4 Трехкомпонентный состав Эргоферона воздействует на различные механизмы воспалительной реакции с формированием адекватного противовирусного ответа, что позволяет рекомендовать Эргоферон как средство выбора лечения острых респираторных вирусных заболеваний, включая грипп, в амбулаторных условиях.
Ключевые слова: вирусные инфекции, грипп, иммунитет, интерферон, противовирусные препараты, Эргоферон
Грипп - острое заболевание с коротким инкубационным периодом, внезапным началом и циклическим течением, которое характеризуется выраженным токсикозом. поражением верхних дыхательных путей и легких. Грипп и другие респираторные вирусные инфекции являются наиболее массовыми заболеваниями.
Вирусы гриппа относятся к ортомиксовирусам, имеют сферическую форму, Внутренняя часть вируса состоит из полимеразного комплекса (PA, PBI, РВ2), рибонуклеопротеида и матриксного протеина. Снаружи вирус покрыт оболочкой с двумя вилами поверхностных антигенов — гемагглютинином (НА) и нейраминидазой (NA), За счет этих образовании происходит прикрепление и внедрение вируса внутрь клетки хозяина. Вирусы гриппа Л содержат два типа нейраминидазы и три типа гемагглютинина, вирус В — I тин нейраминидазы и I тип гемагглютинина, вирус С содержит только гемагглютинин. Поверхностные антигены обладают значительной способностью к изменчивости, что обусловливает появление новых вирусов финна и в конечном счете приводит к эпидемиям. В период эпидемии болеют от 5 до 20 % населения. При пандемиях, котла происходят резкие изменения свойств вируса, заболевает каждый второй человек. Самая большая пандемия гриппа, унесшая около 40 млн жизней, возникла в 1918—1919 гг. [15] В 2009-2010 гг. мир перенес первую в новом тысячелетии пандемию гриппа, вызванную новым (реассортантным) вариантом вируса гриппа А(Н1N1)/California/04/2009. Она возникла в условиях достаточно продолжительной одномоментной циркуляции вирусов гриппа разных серотипов - A(H3N2), A(Н1N1), В - и разных штаммов вирусов гриппа одного и того же серотипа (когда новые штаммы не вытесняли из циркуляции предыдущие, уже существующие и актуальные в плане развития инфекции) на фоне снижения частоты напряженных эпидемий гриппа с нарастанием активности прочих респираторных вирусов, микоплазм, хламидий и бактерий. За короткое время новый пандемический штамм вытеснил из активной циркуляции актуальные в прежние годы штаммы вирусов гриппа [A(H3N2), А(Н1N1), В ] и не только явился доминантой в этиологии заболеваемости гриппом во время пандемии, но и сохранил ведущие ПОЗИЦИИ в последующие годы [15, 16].
На сезон 2012—2013 п. для стран северного полушария Всемирная организация здравоохранения (ВОЗ) прогнозирует. что актуальными будут следующие штаммы: A/California/7/2009 (H1N1) pclm 09: A/Victoria/361/2011 (H3N2): B/Wiseonsin/I/2010 (линия Ямагата). Таким образом, ожидается имени двух штаммов вируса гриппа. в связи с чем возможно предположить более интенсивный характер течения эпидемическою процесса в предстоящем эпидемическом сезоне [12].
Эпидемии возникают, как правило. осенью или зимой. Основным источником инфекции при этом является собственно больной гриппом человек. Быстрое распространение заболевания в короткие сроки обусловлено коротким инкубационным периодом, воздушно-капельным механизмом передачи, высокой восприимчивостью людей к гриппу, а также отсутствием иммунитета у населения к новым антигенным вариантам вируса. Для того чтобы произошло инфицирование, вирус должен преодолеть факторы неспецифической резистентности дыхательных путей. Первая линия неспецифической защиты - вязкость слизи, постоянное движение ресничек цилиндрического эпителия, неспецифические ингибиторы репликации вируса, которые содержатся в секрете дыхательных путей: макрофаги, захватывающие вирус, секреторный IgA Вторая линия специфической зашиты -интерферон, циркулирующие антитела классов IgM, IgG, IgЕ, температурная реакция.
От момента заражения до клинических проявлений гриппа проходит короткий промежуток времени - от нескольких часов до 2-3 дней. Заболевание всеми начинается остро. Основные проявления - интоксиация, т. е. высокая температура, озноб, сильная головная боль, слезотечение, боль при движении глазных яблок, ломота в мышцах и суставах. На 2-3-й день присоединяются катаральные симптомы: першение в горле, насморк, сухой надсадный кашель. Грипп может проявляться и симптомами со стороны желудочно-кишечного тракта: тошнотой, рвотой, жидким учащенным стулом. Выраженная интоксикация, бред, галлюцинации, потери сознания, судороги, повторная рвота являются симптомами тяжелою течения гриппа и требуют немедленною обращения за медицинской помощью [3,7].
В межэпидемический период диагноз гриппа должен быть подтвержден лаборатории - с помощью специфических диагностических тестов, в т. ч. полимеразной цепной реакцией (ПЦР), выделением вирусной культуры, увеличением в 4 раза титров вирус-нейтрализующих антител [13]. Дифференциальная диагностика гриппа проводится прежде всего с другими острыми респираторными вирусными инфекциями (ОРВИ) (табл. 1).
Таблица 1.
Дифференциальная диагностика ОРВИ
| Основные симптомы | Этиология |
|---|---|
| Ринит, ринофарингит | Риновирусы Коронавирусы Энтеровирусы |
| Фарингит, конъюнктивит | Аденовирусы |
| Ларингит | Парагрипп |
| Трахеит | Грипп А, В |
| Бронхит, бронхиовит | Респираторно-синцитиальный вирус Метапневмовирус Бокавирус |
Наиболее опасен грипп своими осложнениями. Грипп оказывает непосредственный вред здоровью человека. Он снижает защитные силы организма и может быть причиной разнообразных заболеваний верхних и нижних отделов дыхательных путей, центральной нервной системы, почек и др. [2]. Кроме того, грипп способен обострять течение других сопутствующих заболеваний, что чрезвычайно опасно для людей с хронической патологией сердечно-сосудистой системы, органов дыхания, поджелудочной железы, центральной нервной системы и др. Особенно опасен грипп для людей пожилого возраста, новорожденных и беременных.
Осложнения гриппа
- Респираторные: острый бронхит (20-30 %), круп (5-15 % среди госпитализированных).
- Острый средний отит (35 % среди госпитализированных детей).
- Пневмонии: первичная (2—5 %), вторичная бактериальная (4% среди госпитализированных пожилых людей).
- Сердечно-сосудистые: сердечная недостаточность, миокардит и перикардит, кровоизлияние в сердечную мышцу и другие органы.
- Неврологические: вирусный энцефалит. энцефаломиелит,
- Синдром Рейе: энцефалопатия + жировая дистрофия печени (чаще у детей 5- 14 лет; данное осложнение снизывают c приемом салицилатов, частота - от 0.2 до 4.0 на 100 тыс. инфекционных Больных).
- Почечные (нефрит).
- Гастроинтестинальные.
- Офтальмологические.
- Инфекционно-токсический шок.
- Геморрагический шок.
- Рабдомиолиз.
Проведение Профилактической вакцинации рекомендовано ежегодно всему населению [8]. В то же время существуют группы людей с повышенным риском осложнений и смертности после гриппа, которые в первую очередь подлежат вакцинации: люди старше 65-летнего возраста, беременные женщины, дети до 3 лет, лица, страдающие хроническими заболеваниями (сахарный диабет, артериальная гипертония, сердечная недостаточность и др.), а также люди, которые могут заразить гриппом лиц, относящихся к группам повышенного риска (медицинские работники, члены семьи) [6].
Остановимся на мерах профилактики при уже начавшейся эпидемии (подъеме заболеваемости гриппом и другими ОРВИ). Заражение вирусом может происходить, как правило, воздушно-капельным путем, инфекция может передаваться и контактным путем. Инфекционные свойства вируса гриппа сохраняются в воздухе помещений в течение 2-9 часов, на бумаге, картоне, тканях - 8 -12 часов, на металлических предметах и пластмассе - 24-48 часов. Соответственно, меры профилактики гриппа включают следующие мероприятия: проветривание помещений, ношение защитных марлевых повязок, соблюдение гигиенических мероприятий (мытье рук, промывание слизистых глаз и носа).
Люди, больные гриппом, должны быть по возможности изолированы. Многие препараты, которые используются в лечении гриппа, могут применяться и для его профилактики, в т. ч. интерферон и индукторы интерферона [4].
В случае развившеюся заболевания необходим ряд мер. Терапия гриппа и ОРВИ должна быть комплексной, адекватной этиологии и тяжести течения (заболевания, направленной на все звенья патогенеза этою широко распространенного и нередко тяжелого заболевания. Особые требовании должны предъявляться к этиотропным и патогенетическим средствам лечения гриппа и ОРВИ.
Все противогриппозные препараты условно можно разделить на противовирусные и симптоматические средства. Лечение обязательно должно проводиться противовирусными препаратами (табл.2)
Таблица 2.
Механизмы действия противовирсных препаратов
| Препараты | Класс препаратов по механизму действия |
|---|---|
| Римантадин, амантадин | Блокаторы М2-канала |
| Арбидол | Ингибитор гемагглютинина, индуктор интерферона |
| Озельтамивир, Занамивир, Перамивир | Ингибиторы нейраминидазы |
| Кагоцел | Индуктор интерферона |
| Ингавирин | Ингибитор тримеризации NP |
Блокаторы М2-каналов - ремантадин и амантадин - являются препаратами первого поколения. В настоящее время к данному классу препаратов у большинства штаммов вируса гриппа выработалась резистентность. Поэтому данная группа противовирусных препаратов не рекомендована к использованию для лечения гриппа. Препараты нового поколения - ингибиторы нейраминидазы [11]. Основное действие препаратов направлено на торможение репликации вируса путем воздействия на нейраминицазу. В России широкое применение получил препарат озельтамивир.
Препарат эффективен в отношении большинства вирусом фиша, включая пандемический. На фойе применения озельтамавира снижалось число осложненных форм гриппа, уменьшалась продолжительность заболевания. Занамивир применяется в порошковой форме, что несколько ограничивает его использование. Среди нежелательных реакций занамивира следует отметить развитие бронхоспазма, особенно у больных бронхиальной астмой и ХОБЛ, и также невозможность применения больными, находящимися на ИВЛ. В качестве противовирусного препарата в России с успехом применяется Арбидол, Кроме прямого противовирусного действия Арбидол является интерферон-индуцируюшим и иммуномодулируюшим препаратом.
Российский препарат Ингавирин зарекомендовал себя эффективным в отношении вирусов не только гриппа, но и других ОРВИ. Эффективность всех противовирусных препаратов напрямую зависит от их более раннего назначения. Однако из недостатков этого класса препаратов следует отметить развитие резистентности. Данные последних лет свидетельствуют о развитии резистентности на препараты группы нейраминидазы в 2—4 % случаев. Поэтому в комплексной терапии гриппа нашли применение препараты с двойным механизмом действия — интерфероны и индукторы интерферонов. Назначение интерферонов оправданно развивающейся иммуносупрессией под воздействием вирусов Гриппа. Интерфероны активизируют синтез внутриклеточных ферментов, препятствующие размножению вирусов. Индукторы интерферона повышают способность клеток к синтезу эндогенного интерферона. Таким образом, индукторы интерферона обладают противовирусным и иммуномолулируюишм эффектами. Одно из достоинств данной группы препаратов при лечении гриппа -отсутствие резистентности (табл. 3).
Таблица 3.
Сравнительная характеристика противовирусных препаратов
| Тип препарата | Достоинства | Недостатки |
|---|---|---|
| Ингибиторы репликации вируса | Высокая терапевтическая эффективность | Формирование резистентности |
| Эффективное подавление репликации вируса | ||
| Хорошая комплаентность | ||
| Интерфероны и индукторы интерферонов | Отсутствие резистентности | Более низкая лечебная эффективность |
Согласно современным взглядам. препараты, применяемые в терапии респираторных вирусных инфекции. должны способствовать элиминации возбудителя, стимулировать защитные силы организма и корректировать возникающие в процессе болезни функциональные нарушения [17]. Таким требованиям отвечает новый комбинированный препарат Эргоферон (РУ№ЛСР-007362/10-290710), созданный на основе аффинно очищенных антител к гамма-интерферону человека (анти-ИФН-γ), СD4 (анти-CD4) и гистамину (анти-Н). Трехкомпонентный состав Эргоферона позволяет воздействовать на различные механизмы воспалительною ответа и формировать адекватный противовирусный ответ широкого спектра. Так, экспериментально доказано, что антн-ИФН-γ повышают экспрессию ИФН-γ, ИФН-α, рецепцию ИФH-γ и нормализуют цитокиновый статус [18]. Анти-СD4 - второй компонент Эргоферона - регулирует активность СD4-рецептора, представленного на антиген-презентируюших клетках (макрофагах, дендритных метках), Т-хелперных лимфоцитах 1-го и 2-го типов. В эксперименте показано, что модулирующее влияние анти-СD4 на CD4+ клетки системы иммунитета сопровождается повышением их функциональной активности, нормализацией соотношения CD4/CD8 и субпопуляиионного состава CD3, CD4, CD8, CD16, CD20), а также усилением противовирусной эффективности компонентов, входящих и состав Эргоферона [19, 20]. Третий компонент препарата -анти-Н - уменьшает проницаемость сосудов и снижает агрегацию тромбоцитов, подавляет высвобождение гистамина из тучных клеток и базофилов, оптимизирует продукцию лейкотриенов [19, 20].
За прошедший год в рамках изучения терапевтической активности Эргоферона в лечении ОРВИ и гриппа было проведено несколько рандомизированных исследований, в т. ч. многоцентровые двойные плацебо-контролируемые [1, 5, 6, 21—23]. Так, согласно полученным данным, в т. ч. в Научно-исследовательском институте вакцин и сывороток им. И.И. Мечникова РАМП (профессор М.П. Костинов) и Научно-исследовательском институте эпидемиологии и микробиологии им. Г.Н. Габричевского (профессор Е.П. Селькова), все участники, рандомизированные в группу терапии Эргофероном, заканчивали участие в исследовании выздоровлением от ОРВИ либо значительным улучшением. В то же время в группе плацебо у единичных больных было зафиксировано раЗВЯТИв бактериальных осложнении. что привело к необходимости назначения им антибактериальных препаратов [5,6].
Исследование, проведенное на базе аллергологического отделения ГКБ №57 Москвы (допет Н.П. Княжеская), продемонстрировало высокую эффективность препарата Эргоферон у пациентов с хроническими заболеваниями легких, включая аллергические [22]. У таких пациентов вирусная инфекция в большинстве случаев провоцирует обострение основного бронхо-легочного заболевания. Воздействие Эргоферона на гистамин-зависимую активацию Н1-гистаминовых рецепторов приводило к снижению проницаемости микрососудов бронхиального дерева, уменьшая отечность слизистой и воспаление бронхов. Основные симптомы заболевания, включая лихорадку. были купированы за 2 суток, в 78 % случаев не потребовалось назначения антибактериальной терапии. В рамках исследования, проведенного на базе клиники инфекционных болезней Уральской государственной медицинской академии (доцент В.К. Веревщиков, Екатеринбург), были продемонстрированы терапевтическая эффективность препарата в отношении верифицированных с помощью ПЦР гриппозной, парагриппозной, других вирусных респираторных инфекций, способность Эргоферона оптимизировать интерфероновый и клеточный ответы на вирусную инфекцию, а также приводить к нормальному уровню содержание гистамина в крови больных Сотрудники кафедр терапии Челябинской государственной медицинской академии (профессор Л.А. Степанищева) и Владивостокского государственного медицинского университета (доцент Н.В. Шестакова) подтвердили высокую эффективность Эргоферона. проявляющуюся в уменьшении продолжительности заболеваний, сокращении частоты развития бактериальных осложнений, уменьшении длительности периода нетрудоспособности [21], Кроме того. показано, что лечение Эргофероном оказывает значимые противовоспалительные эффекты, проявляющиеся в достоверном снижении таких показателей воспаления, как фибриноген и С-реактивный протеин [23]. Следует подчеркнуть, что все исследователи. имеющие опыт применения Эргоферона, отмечают его хорошую переносимость и сочетаемость с другими препаратами, применяющимися для лечения ОРВИ На основании приведенных данных можно сделать следующее заключение: препарат Эргоферон может быть рекомендован как средство выбора лечения острых респираторных вирусных инфекций, включая грипп, в амбулаторных условиях.
Проведенный нами мониторинг ведения пациентов с ОРВИ в ЮВАО г. Москвы (Н.В. Орлова - окружной терапевт ЮВАО) подтверждает, что врачи амбулаторного звена при лечении гриппа широко используют этиотропную противовирусную терапию. В последние годы назначаются главным образом Ингавирин и Арбидол. При ОРВИ, обусловленных другими вирусами, также активно используются индукторы интерферона, включая Эргоферон. При этом, согласно данным анализа, оценка эргоферона врачами амбулаторных лечебных учреждений ЮВАО совпадает с таковой исследователей данного препарата [21].
Как свидетельствуют результаты мониторинга, применение противовирусных препаратов позволяет сократить сроки клинических симптомов заболевания (интоксикации, лихорадки и др.), а также снизить число осложнений ОРВИ и гриппа.
C полным списком литературы можно ознакомиться в редакции журнала.
Аренавирусы. Свойства аренавирусов. Геморрагическая лихорадка Ласса.
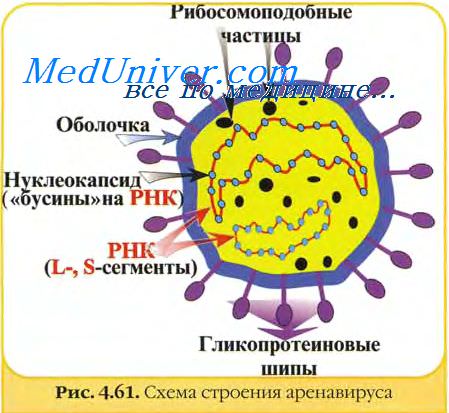
Характерный морфологический признак представителей семейства Arenaviridae — наличие внутри вирусных частиц электронно-плотных зернистых структур, напоминающих песчаные вкрапления, наличие которых обусловило название семейства [от лат. arena, песок].
Семейство включает один род Arenavirus, представленный округлыми вирионами диаметром 110-130 нм. Геном аренавирусов образует однонитевая молекула - РНК, содержащая пять сегментов.
Вирионы ареновирусов содержат транскриптазу, ответственную за синтез комплементарной нити +РНК, исполняющей роль матрицы.
Нуклеокапсид ареновирусов окружён суперкапсидом, на котором расположены многочисленные, плотно прилегающие друг к другу гликопротеиновые булавовидные шипы.
Все аренавирусы относят к экологической группе робовирусов, и все виды патогенны для человека; наиболее типичны тяжёлые геморрагические лихорадки с высокой летальностью, гриппоподобные поражения, реже, серозные менингиты.
По наличию внутреннего растворимого Аг (выявляемого в РСК или РНИФ) аренавирусы разделяют на группы Старого и Нового Света (исключая вирус лимфоцитарного хориоменингита, широко распространённый в Евразии и Америке).
Первую группу образует ареновирус Ласса; вторую — вирусы Хунин (возбудитель аргентинской геморрагической лихорадки), Мачупо (возбудитель боливийской геморрагической лихорадки) и Гуанарито (возбудитель венесуэльской геморрагической лихорадки).
Основной резервуар аренавирусов — различные грызуны, у которых вирусы длительно персистируют и активно выделяются с мочой. Человек — тупиковый хозяин инфекционного цикла.
Человек заражается ареновирусами при укусах клещей-переносчиков, а также алиментарным и воздушно-пылевым путём (при употреблении инфицированных воды и продуктов).
Геморрагическая лихорадка Ласса
Аренавирусы впервые выделен в миссионерском гocпитале городка Ласса (Северо-Запад Нигерии).
Длительность инкубационного периода гемморагической лихорадки Ласса 7-10 сут; клиническая картина поражений варьирует от бессимптомных форм до молниеносных летальных форм (составляют 35-50% всех случаев).
Геморрагическая лихорадка Ласса развивается бурно: характерны высокая температура тела, головная боль, мышечные боли.
При тяжёлых формах гемморагической лихорадки Ласса присоединяются явления интоксикации, поражений ЦНС, геморрагического диатеза с дальнейшим развитием шока. Смерть наступает через 2 нед после начала болезни; летальность может достигать 70%.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Реассортантные вакцины. Особенности реассортантных вакцин.
Вирусы, имеющие сегментированный геном, могут быть аттенуированы путем генной реассортации. Реассортация является формой генетической рекомбинации, наблюдаемой у РНК-вирусов с сегментатированным геномом. Реассортация обнаружена у семейств с 2 (арена- и бирнавирусы), 3 (буньявирусы) 6, 7 или 8 (ортомиксовирусы) или 10, 11 или 12 (реовирусы) геномными сегментами. В клетках инфицированных двумя родственными вирусами внутри каждого семейства может происходить обмен сегментами с образованием жизнеспособных стабильных реассортивов. Они встречаются в природе и являются важным источником генетической вариабельности. Цель получения аттенуированных реассортантов, пригодных для использования в качестве живой вакцины, состоит в том, чтобы заранее полученным и охарактеризованным аттенуированным штаммам придать необходимую антигенность в соответствии с антигенностью актуальных полевых изолятов вируса.
От доноров аттенуации берут гены, кодирующие внутренние белки и ограничивающие репликацию, от актуальных эпидемических (эпизоотических) штаммов заимствуют гены, кодирующие поверхностные белки (гликопротеины). Эту технологию используют длительный период, хотя до сих пор удачной вакцины не было создано. Вирусные реассортанты были получены при рекомбинации вирулентных штаммов вируса гриппа А человека с различными генетически модифицированными штаммами этого вируса. Существует несколько способов для достижения аттенуации вируса гриппа путем реассортации генов. Первый заключается в аттенуации вируса донора генов последовательным пасссированием вируса в куриных эмбрионах. Аттенуированные для человека штаммы могут быть использованы для рекомбинации с эпидемическими штаммами. Этот способ применяли в СССР, Великобритании, Бельгии.
Второй способ принципиально сходен с первым и отличается тем, что аттенуацию осуществляют пассированием вируса при пониженной температуре (25—30°С). Свойство аттенуации передается от холодо-адаптированного донорского штамма полевым изолятам вируса при рекомбинации. Этот метод впервые применили в нашей стране (Г.И. Александрова), затем он получил развитие в США. Полученные таким образом реассортанты при испытаниях на добровольцах оказались стабильными и сохраняли признаки аттенуации и иммуногенность. Третий способ заключается в том, что для реассортации генов в качестве донора аттенуации используют штаммы вируса гриппа птиц, не вирулентные для человека.
Ограниченную репродукцию вируса гриппа птиц в нижнем отделе респираторного тракта обезьян контролировали шесть генов, кодирующих внутренние белки вируса. Аттенуированный фенотип реассортанта вируса гриппа А птица — человек оказался стабильным в течение пяти пассажей на обезьянах. Однако инфекция реассортантом индуцировала незначительную резистентность обезьян к последующему их контрольному заражению вирулентным вирусом гриппа А человека.
Четвертый способ основан на получении температурочувствительных (ts) мутантов вируса с помощью химических агентов. Реассортантные аттенуированные штаммы вируса гриппа получены на основе таких доноров (ts-мутантов). Но осталась нерешенной проблема усиления их вирулентности для человека. Наиболее распространенным в настоящее время остается второй метод аттенуации. Считается, что для обеспечения достаточного уровня аттенуации и ее стабильности необходимо, чтобы реассортантные штаммы получили от донора шесть генов. Молекулярно-генетическим анализом установлено наличие множественных мутаций во всех восьми генах, что свидетельствует о невозможности реверсии ts-признака к дикому типу.
В результате использования таких методов были сконструированы живые реассортантные вакцины против гриппа, включающие два гена, кодирующие поверхностные гликопротеины (НА и NA) современного вирулентного штамма, и шесть генов, кодирующие внутренние белки донора аттенуации.
В условиях широкого эпидемиологически контролируемого наблюдения на группе из 30 000 детей установлена безвредность, высокая иммунологическая и профилактическая эффективность этой вакцины, а также генетическая стабильность холодоадаптированных рекомбинантов.
Живые (реассортантные) вакцины против ротавирусной инфекции человека были созданы на базе культуральных аттенуированных ротавирусов крупного рогатого скота и обезьян. В случае с реассортантным вирусом, приготовленном на базе вируса обезьян, от ротавируса человека был взят только один ген, кодирующий главный протективный белок VP7. Для реассортации брали гены ротавируса человека 1-, 2-й 4-серотипов. Вакцинация реассортантным вирусом вызывала сероконверсию у 70% привитых индивидуумов.
Термочувствительные реассортанты вирусов гриппа человек/лошадь (H3N8) создавали защиту у вакцинированных лошадей независимо от антител к ГА. Реассортация является феноменом, редко встречеющимся в природных условиях. Она ответственна, например, за антигенный шифт вируса гриппа. У КРС найдены реассортанты вируса катаральной лихорадки овец. В опытах in vitro установлено, что реассортация двух штаммов с пониженной вирулентностью приводила к появлению высоковирулентного вируса.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусы гриппа - РНК-содержащие вирусы - относятся к сем. Orthomyxoviridae и разделяются на вирусы А, В и С (табл. 1).
Сравнительная характеристика вирусов гриппа
| Критерии | Тип А | Тип В | Тип С |
| Тяжесть заболевания | ++++ | ++ | + |
| Природный резервуар | Есть | Нет | Нет |
| Пандемии человека | Вызывает | Не вызывает | Не вызывает |
| Эпидемии человека | Вызывает | Вызывает | Не вызывает (лишь спорадические заболевания) |
| Антигенные изменения | Шифт, дрейф | Дрейф | Дрейф |
| Сегментированный геном | Да | Да | Да |
| Чувствительность к ремантадину | Чувствительны | Не чувствительны | Не чувствительны |
| Чувствительность к занамивиру | Чувствительны | Чувствительны | - |
| Поверхностные гликопротеины | 2 (HA, NA) | 2 (HA, NA) | 1(HA) |
Вирус гриппа имеет сферическую форму и размер 80-120 нм. Сердцевина представлена одноцепочечной отрицательной цепью РНК, состоящей из 8 фрагментов, которые кодируют 11 вирусных белков.
Вирусы гриппа А широко распространены в природе и поражают как людей, так и целый ряд млекопитающих и птиц. Вирусы гриппа типов В и С выделены только от человека.
Эпидемически значимыми являются 2 подтипа вируса гриппа А — H3N2 и H1N1 и вирус гриппа типа В (А.А. Соминова с соавт, 1997; О.М. Литвинова с соавт., 2001). Итогом такой ко-циркуляции явилось развитие в один и тот же эпидсезон в различных странах эпидемий гриппа различной этиологии. Гетерогенность популяции эпидемических вирусов возрастает также за счет дивергентного характера изменчивости вирусов гриппа, что приводит к одновременной циркуляции вирусов, относящихся к различным эволюционным ветвям (О.М. Литвинова с соавт., 2001). В этих условиях создаются предпосылки для одновременного инфицирования человека различными возбудителями, что приводит к формированию смешанных популяций и реассортации как между вирусами ко-циркулирующих подтипов, так и среди штаммов в пределах одного подтипа (О.И. Киселев с соавт., 2000).
Классификация типов вирусов гриппа основана на антигенных различиях двух поверхностных гликопротеинов — гемагглютинина (НА) и нейраминидазы (NА). Согласно этой классификации вирусы гриппа и подразделяют на 3 типа — вирусы гриппа типа А, типа В и типа С. Различаются 16 подтипов НА и 9 подтипов NА.
Рис. 1. Классификация вирусов гриппа А и виды животных и птиц - промежуточные и конечные хозяева в цепи передачи инфекции к человеку.
Недавно открыт 16 подтип (Н16) гемагглютинина
Примечание: ∗ НА 7 и NА 7-NА8 выявили и у лошадей
На рис. 1 представлены подтипы вирусов гриппа типа А и их промежуточные хозяева и природные резервуары (перелетные птицы). К основным хозяевам вирусов гриппа А относятся те виды, которым свойственна заболеваемость гриппом.
В популяции человека до настоящего времени выявлены вирусы гриппа А только трех подтипов с НА1, НА2 и НА3. При этом вирусы содержат только два типа нейраминидазы - NА1 и NА2 (рис.1). Доказана их стабильная циркуляция в течении прошлого столетия, начиная с пандемии 1918 г (R.G. Webster et al., 1978; K.G. Nicholson et al., 2003).
Вирусы гриппа А (в меньшей степени В) обладает способностью к изменению структуры НА и NА. Для вируса гриппа А характерны два типа изменчивости:
- точечные мутации в вирусном геноме с соответствующим изменением в НА и NА (антигенный дрейф);
- полная замена одного или обоих поверхностных гликопротеинов (НА и NА) вируса путем реассортации/рекомбинации (антигенный шифт), в результате которого появляется принципиально новый вариант вируса, способный вызвать гриппозные пандемии.
Для вируса гриппа В антигенная изменчивость ограничивается только дрейфом, т.к. он, по-видимому, не имеет природного резервуара среди птиц и животных. Для вируса гриппа С характерна большая стабильность антигенной структуры и с ним связаны лишь локальные вспышки и спорадические случаи заболевания.
Представляет определенный интерес появление новых штаммов вируса гриппа в человеческой популяции и связанные с ними пандемии (рис. 2). На рис. 2 представлены основные антигенные шифты, ассоциированные с панедмиями ХХ века, вызванные вирусами гриппа А:
- в 1918 г пандемия была вызвана вирусом типа H1N1;
- в 1957 г - H2N2 штаммом А/Singapore/1/57;
- в 1968 г - H3N2 штаммом A/Hong Kong/1/68;
- в 1977 г - H1N1 штаммом A/USSR/1/77 (многие ученые не рассматривали это как пандемию, но с появлением этого штамма сложилась ситуация с одновременной ко-циркуляцией 2 штаммов вируса гриппа А - H3N2 и H1N1).
Рис. 2. Возникновение новых штаммов вируса гриппа в человеческой популяции и связанные с ними пандемии
Каковы же механизмы происхождения пандемических штаммов и какие биологические характеристики необходимы для появления высокопатогенного вируса с пандемическим потенциалом?
Для вирусов гриппа А характерна высокая частота возникновения реассортантов в результате смешанного заражения, что обусловлено сегментированностью вирусного генома. Преобладание реассортанта определенного генного состава считается результатом селекции, при которой из обширного набора разных реассортантов отбирается именно такой, который наиболее приспособлен к репродукции в данных условиях (Н.Л. Варич с соавт., 2009). Штаммоспецифические свойства геномных сегментов могут оказать сильное влияние на генный состав реассортантов в неселективных условиях. Другими словами, отличительной особенностью вирусов гриппа является то, что в восьми из генных сегментов, особенно в гене НА, происходят частые и непредсказуемые мутации. Реассортация играет важную роль в появлении новых вариантов вирусов, в частности в происхождении пандемических штаммов. И иногда нельзя исключить возможность появления на протяжении пандемии вируса с более высокой вирулентностью.
Современные исследования показали, что генная структура нового вируса А/H1N1 является сложной и в его состав, как мы уже отмечали во введении, входят гены свиного гриппа, поражающего свиней Северной Америки; гены свиного гриппа, поражающего свиней Европы и Азии; гены птичьего гриппа; гены человеческого гриппа. По сути, гены нового вируса получены из четырех различных источников. Микрофотография вируса гриппа А/H1N1 представлена на рис. 4.
Рис. 4. Микрофотография вируса гриппа А/H1N1
- реассортации между вирусами гриппа животных/птиц и человека;
- непосредственной адаптации вируса животных/птиц к человеку.
Для понимания происхождения пандемических вирусов гриппа важное значение имеет изучение свойств природного резервуара инфекции и путях эволюции этого семейства вирусов при смене хозяина. Уже хорошо известно и это можно утверждать, что водоплавающие птицы являются природным резервуаром вирусов гриппа А (адаптированные к этим промежуточным хозяевам в течение многих столетий), о чем свидетельствует носительство всех 16 подтипов НА этого вируса. Через фекалии птиц, которые в воде могут сохраняться более 400 дней (Грипп птиц…, 2005), вирусы могут передаваться другим видам животных при употреблении воды из водоема. (K.G. Nicholson et al., 2003). Это подтверждается филогенетическим анализом последовательностей нуклеиновых кислот разных подтипов вирусов гриппа А от различных хозяев и из различных географических регионов.
Читайте также:

