Что такое тера для вич инфицированных
Обновлено: 24.04.2024
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препара
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препарата. Препарат относится к ингибиторам обратной траскриптазы.
Препаратами второго поколения являются дидеоксииназин (ДДИ), дидеоксицитидин (ДДС). В настоящее время спектр препаратов этой группы значительно расширился (ставудин-ДДТ, хивид, фосфозид и другие).
Эта группа лекарственных средств (ЛС) имеет ряд существенных недостатков. Указанные ЛС не подавляют полностью репликацию вируса, который может быть выделен у большинства больных во время терапии.
Как показали исследования, к ЗДВ достаточно быстро развивается устойчивость, в особенности на поздних стадиях болезни с усиленной репликацией ВИЧ, когда, по-видимому, возникает резистентность и к другим аналогам нуклеозидов.
Обычный фактор, существенно ограничивающий применение ЛС этой группы, — их токсичность. Для ЗДВ характерно главным образом токсическое действие на костный мозг, тогда как ДДИ и ДДС обладают нейротоксическим действием. Кроме того, ДДИ может вызывать тяжелый острый геморрагический панкреатит.
Установлена тесная связь между клинической неэффективностью ЗДВ и резистентностью к нему in vitro.
Вторая группа препаратов, открытая сравнительно недавно и уже широко используемая, — это ингибиторы протеаз: индиновир (криксиван), инвираза (саквиновир), вирасепт (нельфиновир) и другие.
В настоящее время речь не идет уже о монотерапии антиретровирусными средствами, а только о ди-, три- и даже тетратерапии. Такие методики позволяют снижать концентрацию вируса до величин, не определяемых с помощью современных тест-систем (< 200 копий/1 мл).
Предпочтительность комбинированной терапии обосновывается следующими положениями (В. В. Покровский).
- Использование многих этиотропных агентов более эффективно подавляет жизнедеятельность вируса, воздействуя на различные болевые точки или синергически воздействуя на одну из них.
- Это позволяет снизить дозы препаратов, что уменьшает частоту и выраженность побочных эффектов.
- Различные лекарства имеют различную способность проникать в ткани (головной мозг и т. д.).
- Комбинация лекарств затрудняет формирование устойчивости, или она появляется позднее.
Все описанные выше подходы к терапии ВИЧ-инфекции предполагали непосредственное воздействие на репликацию вируса. Другая возможная методика лечения ВИЧ-инфекции состоит в усилении защитных сил макроорганизма. Некоторые варианты такого подхода в большинстве случаев неспецифические, изредка специфические и могут воздействовать на защитные свойства клетки-хозяина.
Интерфероны, как природные, так и рекомбинантные, имеют ряд недостатков: антигенность, необходимость многократного введения для поддержания достаточной концентрации в организме, большое количество побочных эффектов и т. д.
Этих недостатков лишены многие индукторы эндогенного интерферона, некоторые из них способны включаться в синтез ИФН в некоторых популяциях клеток, что в ряде случаев имеет определенное преимущество перед поликлональной стимуляцией иммуноцитов интерфероном.
Специфическая активность циклоферона при ВИЧ-инфекции изучена в 1997 году в Институте гриппа РАМН
- Выявлена выраженная ингибирующая активность циклоферона на репродукцию ВИЧ в культуре клеток моноцитов.
- По показателям ингибирующей активности циклоферон значительно превосходит азидотимидин.
- Представленные экспериментальные данные обосновывают клиническое использование циклоферона для лечения больных ВИЧ-инфекцией.
Пятилетний опыт применения циклоферона у ВИЧ-инфицированных позволяет оценить результаты этой работы.
В период 1992 – 1997 годы в Санкт-петербургском городском центре по профилактике и борьбе со СПИД циклоферон получили 40 пациентов с разными стадиями ВИЧ-инфекции. Следует отметить, что 11 больных прошли два курса терапии циклофероном, в связи с чем общее число лиц, получивших один курс лечения циклофероном, составило 29 человек. В основном это были молодые люди в возрасте до 40 лет (20 человек), в том числе трое детей до 14 лет.
Все больные отмечали хорошую переносимость циклоферона, отсутствие пирогенных реакций после его введения.
Пациенты также констатировали улучшение общего состояния, сна и аппетита, повышение жизненного тонуса, работоспособности. 30% из числа получавших препарат и перенесших в осенне-зимний период грипп или ОРВИ отметили, что заболевание протекало непривычно легко и выздоровление наступило быстрее обычного.
Из клинической практики
После курса циклоферона отмечалось существенное снижение вирусной нагрузки (в 3,6 раза). Число CD4+ возросло на 62%. Монотерапия циклофероном оказала положительное стабильное влияние на изученные показатели у пациентов.
Определенный интерес представляют результаты многолетнего наблюдения больных ВИЧ-инфекцией, которые получали длительно циклоферон в своеобразном профилактическом режиме с целью стабилизации процесса и профилактики прогрессирования заболеваний.
В 1998 году на базе Российского научно-методического Центра по профилактике и борьбе со СПИД (руководитель член-корр. АМН В. В. Покровский) была изучена динамика суррогатных маркеров ВИЧ-инфекций (уровень CD4+) и вирусная нагрузка у больных ВИЧ-инфекцией при лечении циклофероном.
Оценка достоверности полученных результатов проводилась с помощью непараметрических критериев (критерий знаков, максимум-критерий, критерий Вилкоксона для сопряженных совокупностей).
В испытуемую группу вошли 10 взрослых больных ВИЧ-инфекцией в стадии первичных проявлений по Российской классификации ВИЧ-инфекции (В. И. Покровский, 1989 г.). Результаты исследования уровня CD4-лимфоцитов представлены в таблице и на рисунке, из которых видно, что после первых четырех недель исследования наметилась тенденция к повышению среднего уровня CD4-лимфоцитов, которое к 12-й неделе стало статистически достоверным. Это повышение сохранилось до конца исследования, несмотря на
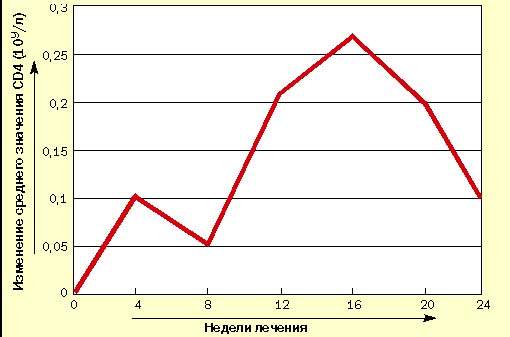 |
| Рисунок 1. Изменение уровня CD4-лимфоцитов у больных ВИЧ-инфекцией при лечении циклофероном (в сравнении с исходным уровнем) |
 |
| Рисунок 2. Средние значения изменения концентрации РНК ВИЧ (log10/мл) |
Таким образом, применение циклоферона в терапии ВИЧ-инфекций сопровождается стабилизацией клинических проявлений заболевания, улучшением состояния, а также гематологических и иммунологических показателей больных.
Циклоферон как монопрепарат оказывает иммуномодулирующее и противовирусное действие при лечении ВИЧ-инфицированных (стадии А1 3Б) в тех случаях, когда нет значительного снижения числа CD4+ клеток (<200). Хорошо зарекомендовало себя назначение циклоферона по следующей схеме.
- По 4 мл препарата в 1, 2, 4, 6, 8, 10, 13, 16, 19 и 22-й дни лечения (у детей по 2 мл). Первые две инъекции могут вводиться внутривенно, остальные внутримышечно. Повторные курсы циклоферона рекомендуется проводить через 6 месяцев под иммунологическим контролем.
- Циклоферон хорошо сочетается со всеми основными лекарственными средствами, его рекомендуется использовать в случае, когда имеются признаки активной репликации ВИЧ (высокие показатели вирусной нагрузки), у больных с обострениями различных оппортунистических заболеваний.
Исчезновение у некоторых больных иммунологических и вирусологических показаний для проведения противоретровирусной терапии может иметь важное значение для разработки новых подходов к проведению лечения больных ВИЧ-инфекцией, для снижения стоимости терапии и отсрочки развития резистентности к ней или преодолению последней.
Циклоферон может оказаться перспективным профилактическим средством при сомнительных контактах и контактах с заведомо ВИЧ-инфицированными партнерами.
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
С самого зарождения эпидемии ВИЧ медицинское научное сообщество было занято поиском эффективного способа предотвращения передачи ВИЧ-инфекции.
Кроме использования средств барьерной контрацепции (презервативов) существуют и иные способы обезопасить себя от ВИЧ-инфекции. Самый главный из них — PrEP, или так называемая доконтактная профилактика (ДКП).
Препараты PrEP — это те же вещества, которыми лечат ВИЧ, но принимаются они по усеченной, неполной схеме. Механизм действия ДКП прост: если лекарство успело попасть в организм заранее, то при попадании в него вируса оно способно убить ВИЧ еще до того, как тот успеет закрепиться в нем.
Защита, которую предлагает PrEP, достаточно надежна и приближается к 100 %, если принимать таблетки правильно.
Что это за таблетки?
Сразу стоит дать названия, существуют две схемы ДКП, которые рекомендованы для использования:
(в одной таблетке — тогда они называются Трувада, либо по отдельности);
Почему именно эти препараты? Для того чтобы ответить на вопрос, можно или нет использовать конкретное лекарство для ДКП, надо провести клиническое исследование. Без клинических исследований подтвердить такой тезис невозможно. Поэтому придерживаться стоит тех схем, которые уже были испытаны и утверждены в качестве PrEP.
Именно поэтому, когда мы говорим о доконтактной профилактике, как правило, речь идет о двух препаратах, как это уже было сказано: тенофовире и эмтрицитабине. Если вы обратитесь в аптеку, то их комбинация в одной таблетке будет стоить порядка 14 000 рублей. Однако допустимо применение и других апробированных для ДКП лекарств. Например, тенофовира и ламивудина. Эта схема также одобрена Всемирной организацией здравоохранения (ВОЗ), они, купленные по отдельности, будут стоить не 14 000, а порядка 1000 рублей.
Какой схемой воспользоваться — решать вам. В целом ДКП сейчас доступна в разных формах для пациентов с разным достатком, и самые дешевые ее схемы могут стоить не более двух тысяч рублей в месяц.
А можно подробнее про механизм действия?
Можно. Итак, доконтактная профилактика заключается в приеме двух препаратов, относящихся к классу ингибиторов обратной транскриптазы, ВИЧ-отрицательными людьми. То есть людьми, в чьем организме вируса пока еще нет.
Что делают эти препараты? На картинке ниже вы можете увидеть жизненный цикл вируса иммунодефицита, как он прикрепляется к клетке и вбрасывает внутрь нее свой генетический материал.
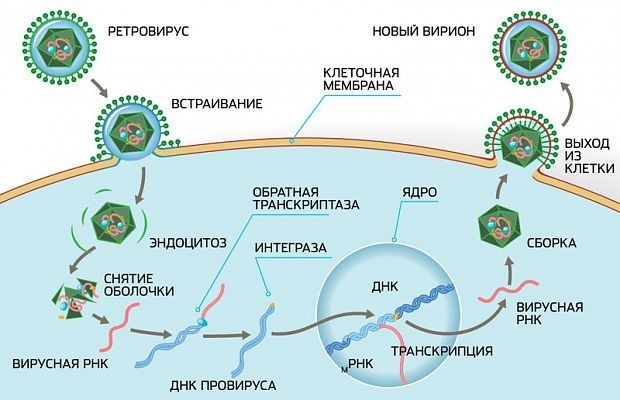
Этот генетический материал под воздействием особого фермента — обратной транскриптазы — запускает процесс репликации новых вирусов.
Два исследования — iPrEx и Partners (оба они проводились в США и Западной Европе) — продемонстрировали крайне высокую эффективность защиты PrEP, в отдельных случаях приближающуюся к 99 %.
В обоих лекарство тенофовир + эмтрицитабин, известное как Трувада, тестировалось на людях, относящихся к ключевым, то есть наиболее уязвимым для эпидемии, группам, — на мужчинах, практикующих секс с мужчинами, и трансгендерных женщинах (mtf). И именно у них этот метод профилактики показал свою наибольшую эффективность.
(Противо)показания к началу ДКП
В настоящее время в России ДКП одобрена Министерством здравоохранения в качестве дополнительного метода профилактики ВИЧ-инфекции и даже попала в клинические рекомендации, так что врач, пусть пока и не имеет возможности выдавать ее бесплатно, как выдаются препараты АРВТ, все же может легально рассказать своим пациентам, где можно приобрести необходимые таблетки, что для этого нужно сделать и как их принимать.
Главным противопоказанием к началу ДКП, конечно, является наличие у пациента ВИЧ-инфекции или симптомов, указывающих на так называемую острую фазу ВИЧ, которая имеет место примерно через две недели после проникновения вируса в организм.
Побочные эффекты
Безопасна ли ДКП? Да. Она безопасна. Оба режима одинаково эффективны. Всего в настоящий момент мы знаем лишь о семи случаях получения вируса на PrEP. А учитывая, что во всем мире примерно полмиллиона человек принимают доконтактную профилактику, семь случаев — это весьма немного.
Два из них были связаны с низкой приверженностью (пропуском приема профилактического препарата), два — с наличием резистентного к эмтрицитабину штамма ВИЧ. Два человека были инфицированы еще до начала доконтактной профилактики. Буквально недавно мировые СМИ сообщили о еще одном случае инфицирования ВИЧ на доконтактной профилактике. На этот раз вирус получил активист в Австралии, который более пяти лет принимал PrEP именно в разовом режиме.
Сейчас идет расследование этого инцидента, и мы пока не знаем точно, в чем была его причина. Что же касается побочных эффектов, они встречаются крайне редко и при должном внимании врача легко контролируются.
Долгосрочные эффекты, например деминерализация костной ткани, появляются не сразу, и, по большому счету, слишком бояться их не стоит. Деминерализация костной ткани, связанная с тенофовиром, проходит в течение, как правило, месяца после остановки приема и не является необратимой. То же самое касается снижения функции почек.
Когда он появится на наших прилавках — сказать сложно. Но в любом случае стоит помнить: даже если это лекарство и появится в России, ДКП — это не витамины, которые можно принимать самостоятельно. Любые побочные эффекты должен отслеживать врач, равно как и назначать сам препарат. Кому стоит обратиться к ДКП, а кому повременить? В идеале такое решение должен принимать не сам пациент в режиме самолечения, а специалист, обладающий достаточной квалификацией.
Как правильно приостановить прием ДКП?
Если вы мужчина или трансгендерная женщина и хотите безопасно прекратить прием доконтактной профилактики, вам необходимо принимать ДКП как минимум еще два дня после последнего рискованного полового контакта. И только через два дня в случае отсутствия в течение этого времени опасных контактов перестать пить таблетки.
Для женщин на ДКП необходимо как минимум семь дней приема ДКП после последнего рискованного контакта. Это связано с особенностями женского организма и того, как ведут себя препараты PrEP в нем.
Чтобы возобновить прием доконтактной профилактики, вы должны быть уверены в отсутствии рисков в период без ДКП. Если риски все же были, то необходимо сделать тест на ВИЧ. Но помните про период серонегативного окна — 4-6 недель с момента последнего риска.
Чтобы начать пить доконтактную профилактику на постоянной основе, необходимо непрерывно принимать ДКП на протяжении семи дней до первого рискованного контакта. Либо (только для мужчин) можно принять двойную дозировку, а затем каждые 24 часа принимать по одной дозе ДКП.
Постконтактная профилактика ВИЧ (ПКП)
Если опасный контакт все-таки случился, а вы не успели обезопасить себя ни с помощью презерватива, ни с помощью препаратов ДКП, и со времени контакта прошло не более 72 часов, избежать инфицирования вам может помочь так называемая постконтактная профилактика.
Заключается она в том, что в указанный срок вам необходимо начать прием препаратов, которыми обычно лечат ВИЧ-инфекцию, но, в отличие от PrEP, тут принимать лекарства придется в полной дозировке, такой, какую принимают люди, у которых уже диагностирована инфекция.
Многочисленными исследованиями доказано: если начать такой прием вовремя, есть большой шанс, что вирус не успеет закрепиться в организме и заболевания удастся избежать. Идеально начать прием лекарств в первые два часа или хотя бы в первые сутки после контакта. Чем позже будет начат такой прием, тем меньше вероятность, что терапия сработает.
Курс профилактики длится 28 дней, и по завершении его необходимо сделать тест, чтобы удостовериться в его эффективности.
Важно! Лекарства, которые вам придется принимать, по факту продаются БЕЗ РЕЦЕПТА, но найти их можно не в каждой аптеке. Поэтому времени на раздумья у вас немного. Возможно, на то, чтобы собрать необходимую комбинацию таблеток, у вас может уйти более суток, так что поиск стоит начать прямо сейчас.
Всего вам придется купить три препарата и принимать нужно будет все три. По отдельности они не работают.
Читайте также:

