Что такое вгс спектр при гепатите с
Обновлено: 25.04.2024
Изучение хронических вирусных поражений печени выявило широкий спектр внепеченочных проявлений хронического гепатита В (ХГВ), а впоследствии, при открытии вируса гепатита С, и хронического гепатита С (ХГС). В России ведущая роль в изучении системности поражения при вирусных заболеваниях печени принадлежит исследованиям, проведенным в клинике им. Е.М.Тареева: изучение хронического активного гепатита как системного заболевания (Апросина З.Г., 1974, 1981 гг.), внепеченочных поражений при ХГС (Игнатова Т.М., 2000 г., Русских А.В., 2004 г., Милованова С.Ю., 2005 г., Карпов С.Ю., 2005 г.); при ХГВ (Ильянкова А.А., 2001 г., Абдурахманов Д.Т., 2003 г., Ибрагимова М.М., 2004 г., Крель П.Е., 1995 г., Тэгай С.В., 2003 г., Русских А.В., 2004 г.), поражения системы крови (Гусейнова Л.А., 1981 г.), легких (Дроздова А.С., 1989 г.), почек (Потапова А.В., 1989 г., Косминкова Е.Н., 1992 г.), синдрома Шегрена (Лопаткина Т.Н., 1980 г., Чернецова О.В., 2004 г.), системных васкулитов при вирусных гепатитах (Семенкова Е.Н., 1994).
В развитии внепеченочных поражений основное значение имеют иммунные реакции, возникающие в ответ на репликацию вирусов гепатита В или С в печени, в тканях лимфоидного и нелимфоидного происхождения. Предположения о наличии внепеченочных сайтов репликации вирусов гепатита В и С возникли в связи с наблюдением случаев быстро развивающегося острого гепатита у пациентов с вирусным циррозом печени после пересадки здоровой донорской печени. Инфицирование донорского органа у больных после ортотопической трансплантации печени объяснялось внепеченочной локализацией вирусов [1]. Помимо иммунных нарушений в возникновении системных поражений имеет значение прямое цитопатическое действие вирусов гепатита. Нередко внепеченочные поражения (ВПП) являются единственным проявлением вирусной инфекции и могут определять прогноз и тактику лечения заболевания.
Особенности хронического гепатита В с внепеченочными проявления гепатита
Внепеченочные проявления гепатита встречаются у 10-20% больных хроническим гепатитом В и включают широкий спектр поражений различных органов и систем [2]. Поражения кожи, наблюдаемые при острых и хронических болезнях печени, обусловленных HBV, весьма вариабельны и включают макулярные, макулопапулярные, папуловезикулярные высыпания, рецидивирующую крапивницу, петехии, пурпуру, узловатую эритему, скарлатиноподобную сыпь, гангренозную пиодермию, витилиго, гиперпигментацию и изъязвления в области нижних конечностей, аллергический капиллярит, пурпуру Шенлейна-Геноха 5.
Смешанная криоглобулинемия (СКГ) встречается среди больных ХГВ в 3-17% случаев, может проявляться кожной пурпурой, артритами и/или артралгиями, поражением почек, синдромом Рейно [5, 6, 8, 9]. Поражение почек при ХГВ протекает в трех формах – хронический гломерулонефрит (ХГН), тубулоинтерстициальный нефрит (ТИН), в рамках васкулита при узелковом полиартериите, ассоциированном с HBVинфекцией 15. Частота поражения почек при ХГВ составляет 14%, в том числе ХГН – 12,6%, ТИН – 1,4% [11]. В клубочках выявляются депозиты различных антигенов HBV, включая HBsAg, HBeAg, HBcAg; у части больных в ткани почки была обнаружена HBV ДНК [13]. ИК могут активировать комплемент и вызывать поражение клубочков путем формирования мембраноатакующих комплексов и дальнейшего каскада реакций, таких как индукция протеаз, оксидативное повреждение и разрушение цитоскелета нефрона [14]. Узелковый полиартериит (УП) является системным васкулитом с поражением средних и мелких артерий. Циркулирующие ИК, содержащие вирусные белки, вовлекаются в патогенез УП, ассоциированного с HBV инфекцией [15]. По данным Е.Н. Семенковой, инфицирование вирусом гепатита В выявляется в 56,9% случаев УП. [16] Отмечено, что почти все случаи HBV-ассоциированного УП связаны с инфекцией вируса гепатита В дикого типа, характеризующейся HBe-антигенемией и высокой репликацией HBV. Предположительно повреждение почек происходят в результате отложения вирусных HBeAg-HBeAb ИК [15]. В целом, хроническая HBV-инфекция демонстрирует широкий спектр внепеченочных поражений, в генезе которых имеют значение как иммунокомплексные реакции, так и реакции гиперчувствительности замедленного типа.
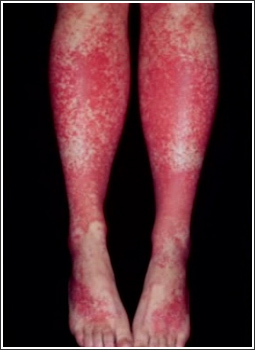
Рис.1. Пурпура на коже нижних конечностей у больного хроническим гепатитом С
Внепеченочные проявления гепатита В могут длительно маскировать поражение печени, являясь ведущими клиническими проявления гепатита болезни и нередко определяющими прогноз заболевания. Однако, с введением программ массовой вакцинации против вируса гепатита В инфицированность населения начала снижаться. А после открытия в 1989 году вируса гепатита С все большее значение стало придаваться изучению обширного спектра поражений при этой инфекции.
Особенности хронического гепатита С с внепеченочными проявления гепатита
Согласно различным исследованиям, от 40 до 74% пациентов, инфицированных вирусом гепатита С, могут иметь хотя бы одно внепеченочное проявление (ВПП) за время течения болезни [17, 18, 19]. Более того, ВПП могут являться первым признаком HCV инфекции в отсутствии у ряда больных признаков поражения печени. Основной особенностью ХГС является частое развитие внепеченочных поражений преимущественно иммунокомплексного генеза, в первую очередь обусловленных смешанной криоглобулинемией (СКГ), выявляемой у 19-56% больных [18, 20, 21]. Только небольшая группа больных ХГС с СКГ (менее 15%) имеет симптомное течение – криоглобулинемический синдром [21, 22].
Распространенность смешанной криоглобулинемии увеличивается с длительностью HCV-инфекции в организме и продолжительностью заболевания и чаще наблюдается у женщин на 2-м-3-м десятилетии болезни. В некоторых исследованиях показано, что длительность HCV инфекции у больных ХГС со СКГ почти в 2 раза выше, чем у пациентов без СКГ, у 40% больных со СКГ выявляют признаки цирроза печени [20]. В настоящее время установлено, что вирус гепатита С имеет высокий тропизм к мононуклеарам периферической крови, которые могут служить его резервуаром и местом репликации. Вирус гепатита С связывается с лигандом CD81 на поверхности В-лимфоцитов через Е2-белок, что приводит к активации этих лимфоцитов. На первом этапе продуцируются только поликлональные криоглобулины, затем доминирующий клон В-клеток начинает продуцировать моноклональные иммуноглобулины. Смешанная криоглобулинемия является причиной системного васкулита с поражением сосудов мелкого и среднего калибра с возможным вовлечением в патологический процесс различных органов и систем [18, 23, 24]. Известно, что при ХГС васкулиты могут быть обусловлены не только СКГ, но и (со значительно меньшей частотой) – иммунными комплексами, не обладающими свойствами преципитировать на холоде, то есть не содержащими IgM РФ [18, 25, 26]. Поражение кожи чаще всего (95% случаев) представлено кожным васкулитом от пурпуры (лейкоцитокластический васкулит) и петехий на нижних конечностях (рис. 1) до выраженных некротических язв. Биопсия кожи в местах повреждений выявляет иммунокомплексный васкулит мелких сосудов с мононуклеарной инфильтрацией. HCV-антитела выявляются в кожных повреждениях в 40% случаев [19]. Пурпура у больных ХГС без СКГ характеризуется меньшей распространенностью и отсутствием язвенно-некротических изменений кожи по сравнению с больным со СКГ [27]. Синдром Рейно при ХГС часто является ранним клиническим проявлением КГ-синдрома, как правило, протекает без дигитальных некрозов. Однако, при высоком криокрите частота дигитальных некрозов увеличивается [10, 27]. Поражение мышц. Миалгии часто наблюдаются при ХГС, особенно в рамках КГ-синдрома в сочетании с артралгиями, кожным васкулитом.
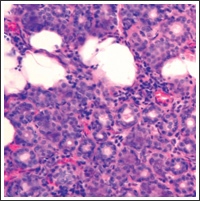
Рис. 2. Очаговая лимфоцитарная инфильтрация слюнной железы, характерная для синдрома Шегрена
По данным клиники им. Е.М.Тареева частота поражения легких была выше у больных без СКГ (11,3%), чем с КГ (6,3%). В группе пациентов без КГ поражение легких характеризовалось развитием фиброзирующего альвеолита, у больных с КГ наблюдалась картина легочного васкулита [27]. Поражение сердца. Имеются наблюдения миокардита хронического течения на фоне HCV-инфекции. Поражение миокарда, ассоциированное с HCV-инфекцией, может быть обусловлено: прямым (вирусным) воздействием на миокард; непрямым (иммунологическим) механизмом поражения и апоптозом клеток, обусловленным внутренними и внешними сигналами [34]. Имеются данные о прямом повреждающем действии на миокард core-белка вируса. Иммуноопосредованный путь повреждения миокарда осуществляется при участии В-клеток, Т-клеток и макрофагов. Обнаружение (+) и (-)-цепей HCV РНК в ткани миокарда у больных миокардитом, дилатационной миокардиопатией и (+)-цепи HCV РНК в миокарде больных гипертрофической кардиомиопатией, сочетающихся с HCV-инфекцией, позволяют обсуждать возможность репликации HCV в ткани миокарда. Обсуждается также роль реакций клеточного иммунитета на тканевые антигены вируса и индуцированные им аутоантигены, роль иммунных комплексов в патогенезе поражения миокарда. Кроме того, не исключается роль цитокинов (продуцируемых активированными вирусом иммуноцитами), которые через механизм повышения продукции оксида азота вызывают отрицательный инотропизм и повреждение сердечной мышцы [35].
Поражение суставов. Артралгии и/или артриты встречаются у 21-74% больных ХГС [19, 24]. Артриты при хронической HCV-инфекции могут рассматриваться как часть аутоиммунного процесса (например, в связи с криоглобулинемией) или как независимый процесс. Описано два вида поражения суставов: полиартрит мелких суставов, подобный ревматоидному артриту, который встречается очень редко и имеет мягкое течение; и неэрозивный олигоартрит с вовлечением средних и крупных суставов, часто интермиттирующего течения, как правило, связанный с криоглобулинемией. Ревматоидный фактор в сыворотке крови выявляется в 50-80% случаев. Антитела к циклическому цитруллиновому пептиду (АЦЦП) обнаруживаются менее, чем у 6% больных с HCV-ассоциированным артритом, что можно использовать для дифференциального диагноза ревматоидного артрита и поражения суставов в рамках HCV-инфекции [19]. Синдром Шегрена (СШ). У больных ХГС с высокой частотой (14-77%) выявляются морфологические признаки лимфоцитарного сиалоаденита и поражение слезных желез (у 26-50%).
Морфологические изменения малых слюнных желез характеризовались небольшой воспалительной инфильтрацией (рис. 2) и распространенным фиброзом ацинарной ткани [36, 37]. Клинически ксерофтальмия и ксеростомия имеют субклиническое течение у 73,8% больных, клинически очевидный СШ отмечается у больных ХГС с КГ [37]. Синдром Шегрена у больных является фактором риска развития злокачественной В-клеточной лимфомы, особенно при сочетании со СКГ [38]. Поражение щитовидной железы. Прямая связь между HCV-инфекцией и заболеванием щитовидной железы до конца не установлена, однако, поражение щитовидной железы (особенно гипотиреоз) чаще встречается среди больных ХГС, чем в общей популяции. У 13% больных, инфицированных HCV, выявляется гипотиреоз и у 25% обнаруживаются антитиреоидные антитела. В 30% случаев поражение щитовидной железы выявляется в ходе ПВТ. В связи с этим остается открытым вопрос, является ли нарушение функции щитовидной железы вирус-индуцированным или нежелательным эффектом противовирусной терапии. ПВТ, возможно, вызывает развитие нарушения функции щитовидной железы de novo или вызывает обострение уже существующего субклинического поражения щитовидной железы [39, 40].
Как и при ХГВ, внепеченочные проявления гепатита ХГС создают определенные трудности в дифференциальном диагнозе ХГС, определяя у части больных неблагоприятный прогноз криоглобулинемического васкулита, поражения почек, В-клеточной лимфомы. Особенности лечения хронических гепатитов В и С с системными проявления гепатита. Адекватный подход к лечению хронических вирусных гепатитов с внепеченочными проявлениями гепатита включает в себя две независимые, но тесно связанные цели. Первая – эрадикация вируса или снижение вирусной нагрузки с помощью этиотропной противовирусной терапии. Вторая – патогенетическое лечение аутоиммунных нарушений с использованием иммуносупрессивной терапии и/или плазмафереза с целью контроля образования иммунных комплексов. По мнению большинства исследователей, для лечения хронической HBV-инфекции оптимальна комбинированная терапия: использование препаратов, различающихся по механизму действия, – сочетание ИФН-? с аналогами нуклеоз(т)идов, сочетание нескольких аналогов нуклеоз(т)идов. Преимуществом интерферона-? является более низкая частота рецидивов после отмены препарата, а аналогов нуклеоз(т)идов – отсутствие нежелательных эффектов, в том числе иммуностимулирующего действия, что обусловливает его применение у больных с внепеченочными проявлениями гепатита и декомпенсированным циррозом печени. В ряде случаев при наличии миокардита, тубулоинтерстициального нефрита, полимиозита оправдано применение иммуносупрессивной терапии, несмотря на усиление репликации вируса гепатита В под влиянием стероидов [6,43-46]. Лечение ХГС со СКГ направлено на подавление вирусной репликации и угнетение В-клеточной пролиферации. Эрадикация HCV при противовирусной терапии приводит к исчезновению СКГ и регрессу клинических проявлений, но часть больных ХГС не отвечает на ПВТ, у ряда пациентов отмечаются выраженные нежелательные эффекты лечения. Применение кортикостероидов при хроническом вирусном гепатите с аутоиммунными нарушениями может приводить к увеличению вирусной нагрузки. В то же время, известно, что интерферонотерапия может вызывать ухудшение таких внепеченочных проявлений HCV-инфекции, как периферическая нейропатия, миокардит, тубуло-интерстициальный нефрит, полимиозит. Недавно было предложено использовать ритуксимаб (химерные моноклональные антитела к CD20) в качестве анти-В-клеточной терапии у больных ХГС с криоглобулинемией, не отвечающих на ПВТ [47, 48]. Его действие связано с быстрым, но обратимым, угнетением CD20+ В-клеток в периферической крови [49, 50]. Ряд исследований свидетельствуют об эффекте ритуксимаба у больных ХГС с периферической нейропатией и комбинации ритуксимаба и плазмафереза у больных ХГС с криоглобулинемическим васкулитом [47, 51], а также эффективность ритуксимаба и ПВТ у больных ХГС с КГ-гломерулонефритом и сосудистой пурпурой [23, 52]. Таким образом, лечение больных хроническими вирусными гепатитами с внепеченочными проявления гепатита не разработано, представляет серьезные проблемы и нуждается в дальнейшем изучении и выработке тактики.
Вирусный гепатит С является одной из главных причин хронических заболеваний печени. Первичная диагностика гепатита С осуществляется путем определения антител к белкам вируса гепатита С (ВГС) в сыворотках с использованием широко представленных на рынке тест-систем для иммуноферментного анализа (ИФА). Положительные результаты, полученные при скрининге сывороток, несут информацию о самом факте инфицирования, однако серологические методы не позволяют разграничить разрешившуюся острую инфекцию от хронического заболевания, а также оценить эффективность антивирусной терапии. В связи с этим для установления диагноза и характеристики активности хронического гепатита наряду с комплексным клиническим обследованием пациентов проводятся вирусологические исследования, направленные на определение прямых маркеров ВГС - РНК и вирусспецифических белков.
Патогенез гепатита С остается во многом неясным. До сих пор не существует однозначного ответа на вопрос, как присутствие вируса в организме влияет на развитие заболевания. Во многом это обусловлено тем, что исследователи этой проблемы получают противоречивые результаты. В этом обзоре мы постарались коротко изложить существующие в настоящее время опубликованные данные и результаты собственных исследований, касающиеся связи между присутствием РНК и белков ВГС в организме больных и активностью хронического гепатита С.
Для изучения распределения РНК вируса гепатита С в различных органах и тканях инфицированного организма применяют методы полимеразной цепной реакции с этапом обратной транскрипции (ОТ-ПЦР), гибридизации in situ, ПЦР in situ. Вирусные белки выявляют либо с помощью поликлональных сывороток, либо с помощью моноклональных антител.
Для оценки влияния вирусной нагрузки на активность хронического гепатита С, которая может варьировать от минимальных гистологических изменений в печени до случаев цирроза и гепатокарциномы, используют различные варианты количественного и полуколичественного методов ОТПЦР. Активность патологического процесса в печени оценивают по уровню активности фермента аланинаминотрансферазы (АЛТ), индексу гистологической активности (ИГА). Стадию заболевания характеризуют, используя гистологический индекс склероза (ГИС). Гистологический диагноз (ИГА и ГИС) ставится на основании морфологического изучения биопсийного материала печени и выражается в баллах в соответствии с международной классификацией (DesmetV.J. et al., 1994).
По данным ряда исследователей, репликация вируса возрастает по мере прогрессирования болезни (Cho S.W. et al., 1996), и более высокий уровень виремии коррелирует с более серьезным повреждением печени (Gretch D. et al., 1994). При исследовании парафиновых срезов печени Dries V. с соавт. (1999) отмечали более частое выявление РНК В ГС в печени пациентов с высоким уровнем воспалительной активности по сравнению со случаями, при которых повреждения печени были минимальны. По мнению авторов, это связано с тем, что вирусная нагрузка клеток печени может определять воспалительно-некротическую реакцию (Dries V. et al., 1999). По данным Jamal M.M. с соавт. (1999), у пациентов с постоянно нормальным уровнем АЛТ наблюдается значительно более низкий уровень РНК ВГС в печени, чем у больных с повышенным уровнем АЛТ. Adinolfi L.E. с соавт. (1998) указывают, что у пациентов с циррозом печени уровень РНК в печени превышает таковой у пациентов с низким уровнем ИГА (1-4). Наиболее высокий уровень РНК ВГС в печени наблюдается у больных с ИГА>8 (Adinolfi L.E.etal., 1998).
В противоположность этому большинство исследователей сходятся на том, что прямая связь между количеством РНК ВГС в организме (как в печени, так и в периферической крови) и степенью активности патологического процесса отсутствует (BallardiniG.etal., 1997, McGuinnesP.H. et al., 1996, Negro F. et al., 1998, 1999, Rodriguez-Inigo E.et al., 1999, Sugano M. et al., 1995). Поданным этих авторов, присутствие вируса в организме и уровень вирусной РНК не коррелируют со значениями ИГА, ГИС или АЛТ. Есть данные об уменьшении уровня вирусной РНК в печени при прогрессировании хронического гепатита С (Di MartinoetaL, 1997).
Результаты, полученные в нашей лаборатории, согласуются с последней концепцией: при исследовании материалов (ткани печени, сыворотки и лимфоцитов периферической крови) от 75 пациентов с хроническим гепатитом С не было обнаружено достоверных отличий между частотой выявления РНК ВГС у больных с различной активностью заболевания (Лакина Е.И. и др., 2000). При проведении нами количественного анализа уровня РНК ВГС в сыворотке крови больных ХГС (Amplicor Monitor Test, v.2.0., "Roche Diagnostics") также не выявлено значимой корреляции между показателями ИГА, ГИС, АЛТ и уровнем виремии.
В настоящее время в литературе активно обсуждается вопрос о роли лимфоцитов в развитии ВГС-инфекции. Результаты выявления РНК ВГС в мононуклеарах периферической крови больных гепатитом С, полученные разными исследователями, варьируют в широких пределах. Так, по данным одних авторов, РНК ВГС в мононуклеарах периферической крови встречается у 24% больных (Young K.S. et al., 1993), по данным других - у всех (100%) обследованных (MellorG. et al., 1998, OkumuraA. et al., 1998). Согласно нашим данным, РНК ВГС в лимфоцитах периферической крови выявляется в 64% случаев. Связи между наличием ВГС в лимфоцитах и активностью гепатита С не обнаружено.
Zignego A.L. с соавт. (1995) показали, что РНК вируса чаще встречается в клетках крови пациентов с более серьезными повреждениями печени. Для объяснения существования этой связи авторы предположили, что активная инфекция различных субпопуляций клеток, вовлеченных в иммунный ответ хозяина, может нарушать их функцию, приводя к персистенции ВГС и развитию хронических повреждений печени. Частое обнаружение РНК ВГС в периферических мононуклеарах больных с хроническими повреждениями печени может объясняться тем, что при длительной ВГС-инфекции клеток печени происходит увеличение пула инфицированных лимфоидных клеток путем передачи от клетки к клетке (Zignego et al., 1995). Показано, что инфицированные лимфоидные клетки могут быть причиной заражения здоровой печени, пересаженной в организм ВГС-инфицированного пациента (Feray С. et al., 1992). Внепеченочный резервуар инфекции может также служить источником реактивации болезни после прекращения интерферонотерапии (Gil В. et al., 1993).
При изучении вопроса о том, насколько уровень вируса в сыворотке отражает его количество в печени, данные исследователей расходятся. Тогда как одни авторы выявляют корреляцию между присутствием геномной РНК в печени и уровнем виремии (De Moliner L. et al., 1998, Mc Guinnes P.H. et al., 1996, Negro F. et al., 1999), другие (Ballardini G. et al., 1997) подобную связь отрицают. Martin с соавт. (1998) указывают на существование корреляции между количеством РНК ВГС в печени и в сыворотке крови, но не в периферических мононуклеарах. В работе Sugano M. с соавт. (1995) сообщается о положительной корреляции между уровнем РНК ВГС в печени и сыворотке крови до лечения интерфероном. После интерферонотерапии корреляция между количеством РНК в печени и в сыворотке не была обнаружена. Подсчет инфицированных клеток в печени после проведения гибридизации in situ показал, что число клеток, содержащих РНК ВГС, может колебаться от 4,8% до 87,6% у разных больных, и уровень виремии прямо зависит от числа инфицированных клеток в печени (Gosalvez J. et al., 1998, Lau G.K.K. et al., 1994, Rodriguez-Inigo E. et al., 1999). При сопоставлении частоты выявления РНК ВГС в печени и в сыворотке крови нами были получены результаты, согласно которым примерно в трети случаев возникает ситуация, когда при наличии вируса в печени РНК ВГС в сыворотке не выявляется: частота выявления РНК ВГС в печени составляет 86%, в сыворотке крови -51%. Эти результаты согласуются с данными других авторов (Haydon G.H. et al.„ 1998, Seidi S. et al., 1999). Например, в работе Haydon G.H. с соавт. (1998) геномная РНК ВГС выявлена в клетках печени 10 из 12 пациентов, негативных по этому показателю в сыворотке.
Жизненный цикл ВГС включает образование репликативных (минус-) цепей РНК, которые служат матрицей для образования геномных молекул. Частота выявления репликативной формы РНК ВГС по данным одних исследователей составляет 35% случаев (Gastaldi M. et al., 1995), тогда как по данным других до 100% (Okabe M. et al., 1997, Sansonno D. et al., 1997, Chang M. et al., 2000). Существенное расхождение данных может объясняться трудностями, возникающими при определении минус-РНК, так как количество негативных цепей РНК на один (lanford R.E. et al., 1995) - три (Mellor J. et al., 1998) порядка ниже, чем +РНК. Это объясняется тем, что одна молекула -РНК может служить матрицей для синтеза нескольких геномных молекул.
Среди исследователей нет единого мнения о том, насколько репликация вируса связана с процессами повреждения печени и выходом вирусных частиц в периферическую кровь (De Moliner L. et al., 1998. Negro F. et al., 1999). По данным Negro F. с соавт. (1998, 1999), использовавших полуколичественный метод PCR, нет строгой связи между вирусной репликацией и уровнем виремии. Согласно полученным нами данным, репликация вируса в печени сопровождается большей частотой выявления РНК ВГС в сыворотке крови, однако достоверной корреляции между этими параметрами не обнаружено. Несоответствие между количеством выявленных геномной и репликативной форм РНК ВГС в печени и уровнем виремии может быть следствием ряда причин: 1 - элиминации вируса из сыворотки с помощью специфических антител; 2 - поступления ВГС в периферическую кровь не только из печени, но и из других органов и тканей; 3 - нарушения процесса высвобождения вируса из клеток печени под действием лекарственных средств или других факторов (Negro F. et al., 1998). Опыты, проведенные в нашей лаборатории, не выявили достоверной корреляции между частотой встречаемости минус-РНК ВГС в печени и степенью поражения печеночной ткани (Лакина Е.И. и др., 2000). Это согласуется с предположением, что вирус может реплицироваться, не вызывая серьезных повреждений в ткани печени (Negro F. et al., 1998). Однако есть данные о возможном участии вирусной репликации в развитии цитопатического эффекта (Chang M. et al., 2000, Tsutsumi M. et al., 1994). С помощью метода гибридизации in situ показано, что клетки, содержащие репликативную форму РНК вируса, локализованы преимущественно в очагах поражения печени (Tsutsumi M. et al., 1994). Обнаружена достоверная корреляция между количеством гепатоцитов, содержащих репликативную форму РНК ВГС, и степенью воспаления печени. Следует отметить, что для геномной РНК ВГС авторы такой связи не выявили (Chang M. et al., 2000).
Согласно мнению большинства исследователей, хотя печень и является главным органом, где происходит вирусная репликация, ВГС может реплицироваться в периферических мононуклеарах, лимфатических узлах, поджелудочной железе, в меньшей степени - в костном мозге, селезенке, щитовидной железе и надпочечниках (Lerat Н. et al., 1996, Okumura A. et al., 1998, Gowans E.J., 2000, Grovatto M. et al., 2000, Radkoowski M. et al., 2000).
Наряду с определением РНК, перспективным методом изучения активности вирусной репродукции является выявление вирусных белков непосредственно в тканях с помощью иммуногистохимических методов (ИГХ). В качестве иммунных реагентов для детекции антигенов ВГС используются как моноклональные антитела (Ballardini G. et al., 1995, Gonzalez-Peralta R.P. et al., 1994, Noun-Aria K.T et al., 1995, Sansonno D. et al., 1995, Nayak N.C., SatharS.A., 1999), так и поликлональные антисыворотки, полученные от экспериментально иммунизированных животных (Gonzalez-Peralta R.P. et al., 1994, Tsutsumi M. et al., 1994) или больных хроническим гепатитом С людей (Ballardini G. et al., 1995, Nouri-Aria K.T. et al., 1995).
Большой интерес представляет вопрос о связи экспрессии вирусных белков с активностью патологических процессов в печени. Согласно большинству исследований, число гепатоцитов, содержащих вирусные антигены, не коррелирует ни со степенью гистологических изменений в печени, ни с показателями биохимической активности (Gonzalez-Peralta R.P. et al., 1994, Nayak N.C., Sathar S.A., 1999, Gowans E.J., 2000). С другой стороны, Hiramatsu N. с соавт. (1992) показали, что экспрессия антигенов ВГС в печени возрастала с увеличением степени поражения органа. Sansonno D., Damacco F. (1993), изучая печень больных острым гепатитом С, обнаружили топографическую связь между очагами воспаления и некроза с одной стороны и гепатоцитами, экспрессирующими антигены ВГС, - с другой. Однако при переходе болезни в хроническое состояние эта связь не обнаруживалась.
Мы изучали распределение антигенов нуклеокапсида, неструктурных белков NS3, NS4A и NS4B с помощью полученных нами МКА в клетках печени больных хроническим гепатитом С на криостатных срезах печени. Были использованы биопсийные материалы от больных с различной активностью гепатита С и на разных стадиях заболевания. Параллельно ткань печени анализировали методом RT-PCR на наличие геномной и репликативной цепей РНК ВГС. В целом, антигены ВГС обнаружены в печени 33 из 34 (97%) пациентов, имеющих геномную РНК в ткани печени. Уровень детекции белка нуклеокапсида составлял 53%, NS3 - 76%, NS4 - 81%. Репликативная форма РНК ВГС значительно чаще ассоциировалась с выявлением соrе-белка. При этом доля антиген-позитивных гепатоцитов варьировала в широких пределах от 1 до 90% у разных пациентов, составляя в среднем около 32%. У больных с ХГС обнаружены качественные и количественные различия в соотношении структурных и неструктурных белков ВГС в клетках печени. В целом, все исследованные белки накапливались в печени пациентов с более тяжелыми формами ХГС (Абдулмеджидова АГ. и др., 2000). Между антиген-содержащими клетками и очагами воспаления и некроза ткани печени топографической связи выявлено не было, что подтверждает ранее полученные данные (Sansonno D., Damacco F., 1993). Эти результаты свидетельствуют в пользу гипотезы об отсутствии прямого цитопатического действия ВГС.
Анализ внутриклеточной локализации вирусных белков методом ИГХ показал, что специфическое окрашивание наблюдается только в цитоплазме гепатоцитов, что согласуется с большинством опубликованных работ (Ballardini G. et al., 1997, Blight К. et al., 1994, Brody R.I. et al., 1998, Gonzalez-Peralta et al., 1994, 1995, Nouri-Aria K.T. et al., 1995, Sansonno D. et al., 1995 (a,b), 1997).
Большой интерес представляет использование моноклональных антител для выявления белка нуклеокапсида ВГС в сыворотках крови больных гепатитом С и доноров (Onto E. et al., 1996, Jolivet-Reynaud С. et al., 1998, Masalova O.V. et al., 1998). Подобные исследования наталкиваются на две основные трудности: низкая концентрация вируса и блокирование антигенов ВГС антителами в составе иммунных комплексов (Onto E. et al., 1996, Shiratori Y. et al., 1997). В нашей лаборатории разработан метод для количественного определения соге-белка, входящего в состав циркулирующих в плазме "свободных" вирионов и иммунных комплексов. При исследовании плазм от 80 антиВГС-позитивных доноров оказалось, что вирусная РНК выявляется только в половине образцов. В 94,4% РНК-позитивных плазм выявлен и белок нуклеокапсида ВГС. Концентрация белка core в разных образцах варьировала в широких пределах и составляла 5-850 пг/мл (Масалова О.В. и др., 2000). В сыворотках пациентов с ХГС (n=71) белок нуклеокапсида был обнаружен у 74% больных. Концентрация соге-белка не коррелировала с тяжестью заболевания Показано, что циркуляция ВГС в виде иммунных комплексов ассоциирована с более продвинутой стадией ХГС (согласно значениям ГИС) (Masalova O.V. et al., 2000). Тест-системы для ИФА на основе моноклональных антител, позволяющие определять белок нуклеокапсида не только на качественном, но и на количественном уровне, являются более простым и дешевым, чем ПЦР, методом выявления ВГС. Их внедрение в практику здравоохранения может существенно обогатить возможности современной диагностики и контроля за течением гепатита С.
Таким образом, несмотря на десятилетнее изучение вопроса о связи между присутствием вируса гепатита С в организме и прогрессированием хронического гепатита, многое по-прежнему остается неясным. Данные о роли вирусного генома и вирусных белков в патогенезе инфекции противоречивы. Необходимы дальнейшие исследования по комплексному анализу обоих компонентов иммунного распознавания: вируса (РНК, структурных и неструктурных белков) и иммунной системы хозяина (антител к ВГС, Т-клеток, цитокинов и иммунных комплексов). Эти знания необходимы для разработки эффективных средств профилактики и специфических препаратов для лечения гепатита С, что позволит контролировать это широко распространенное тяжелое заболевание человека.
* Работа поддержана РФФИ, проект № 01-04-48890
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!

Вирусный гепатит С является одной из важнейших проблем мирового здравоохранения. Инфекция, вызванная вирусом гепатита С, часто протекает латентно, характеризуется минимальными клиническими проявлениями, а также высокой частотой хронизации. Гепатит С нередко диагностируется случайно, и во многих случаях пациенты остаются недообследованными. Доступные в настоящее время современные методы серологической (определение спектра антител к вирусу гепатита С) и молекулярной диагностики (качественный и количественный анализ выявления РНК вируса гепатита С, генотипирование) гепатита С позволяют выявить инфекцию на ранних сроках, определить необходимость назначения противовирусной терапии, оценить ее эффективность и вероятность достижения устойчивого ответа на лечение. Рассматривается проблема диагностики скрытого гепатита С.
Вирусный гепатит С (ГС) является одной из важнейших проблем мирового здравоохранения. Инфекция, вызванная вирусом ГС, часто протекает латентно, характеризуется минимальными клиническими проявлениями, а также высокой частотой хронизации. Предполагается, что в мире вирусом гепатита С (ВГС) инфицировано около 170 млн человек, при этом у них значительно повышен риск формирования цирроза печени и гепатоцеллюлярной карциномы.
Общие симптомы ГС: усталость, боль в мышцах, потеря аппетита или тошнота – являются неспецифическими и во многих случаях выражены слабо или совсем не проявляются. ГС нередко диагностируется случайно, и во многих случаях пациенты остаются недообследованными. Подсчитано, что только 30–50% лиц, инфицированных ВГС, осознают свою болезнь, получают противовирусную терапию (ПВТ) и могут избежать дальнейшей передачи вируса [1]. ГС у пациентов, не получающих терапии, переходит в хроническое состояние в 80% случаях, что приводит к развитию цирроза печени у 20–40% лиц с высоким риском печеночной декомпенсации, гепатоцеллюлярной карциномы и смерти [2].
В свете этих фактов диагностика ГС должна быть выполнена тщательно у всех пациентов с высоким уровнем активности печеночных ферментов, с хроническими заболеваниями печени неясной этиологии и наличием отягощенного эпидемиологического анамнеза (введение внутривенно или назально психоактивных препаратов, переливание крови или ее компонентов, хирургические вмешательства (до 1990 г.), частые инъекции, выполнение татуировок или пирсинга, передача инфекции половым путем). Для диагностики ГС доступны как серологические, так и молекулярно-генетические методы исследования [3].
Серологические маркеры инфицирования ВГС
Врач при первичной лабораторной диагностике ГС начинает свое обследование с определения в сыворотке крови пациента основного маркера инфицирования ВГС – антиВГС. Их обнаружение может свидетельствовать о встрече организма с ВГС в прошлом или о наличии текущей инфекции (вместе с положительным результатом выявления рибонуклеиновой кислоты вируса гепатита С [РНК ВГС]) [4].
В современной клинической практике антитела против множественных эпитопов ВГС обнаруживаются с помощью коммерчески доступных иммуноферментных (ИФА) тест-систем 2-го и 3-го поколения. В этих наборах реагентов ВГС-специфические антитела из сыворотки захватываются рекомбинантными белками ВГС, а затем определяются вторичными антителами против иммуноглобулинов классов G и M (IgG или IgM), меченные ферментами, которые катализируют развитие цветной реакции.
Первый ИФА для обнаружения ВГС-специфических антител был основан на эпитопах ВГС, полученных из NS4 региона (С-100), имел низкую специфичность и чувствительность (70-80%) [3]. C-100-антитела появляются через 16 недель после инфицирования ВГС. Регионы генома ВГС представлены на рисунке 1.
ИФА тест-системы 2-го поколения дополнительно обнаруживают антитела против эпитопов, полученных из core (C-22), NS3 (C-33) и NS4 (С-100) регионов, имеют более высокую чувствительность (примерно 95%) и низкий риск получения ложноположительных результатов. С помощью этих наборов реагентов ВГС-специфические антитела могут быть обнаружены уже через 10 недель после инфицирования ВГС [5].
Специфичность серологической диагностики ГС трудно определить, поскольку отсутствует золотой стандарт. Ложноположительные результаты определения антиВГС наиболее часто встречаются у пациентов с наличием ревматоидного фактора в крови, среди беременных, у пациентов с аутоиммунными заболеваниями и др. Ложноположительные результаты определения антиВГС в популяциях с низкой распространенностью ГС, в частности среди доноров крови и органов, требуют проведения подтверждающих тестов. Несмотря на то что иммуноблоттинг для подтверждения положительных результатов выявления антиВГС методом ИФА доступен, эти тесты потеряли свое клиническое значение, т. к. разработаны высокочувствительные методы определения РНК ВГС.
Ложноотрицательные результаты выявления антиВГС могут наблюдаться у пациентов, находящихся на гемодиализе или у лиц с тяжелой иммуносупрессией, например у ВИЧ-инфицированных или больных с гематологическими злокачественными новообразованиями.
ИФА тест-системы 3-го поколения, доступные с 1993 г., дополнены рекомбинантными NS5-белками. Специфичность современных наборов реагентов при определении антиВГС составляет 99,95% (вне зависимости от наличия в материале γ-глобулинов, ревматоидного фактора, С-реактивного белка и т. д.), чувствительность – 98,9%, и они способны обнаруживать антиВГС через 4–6 недель после инфицирования.
Считается, что при остром ГС один только серологический скрининг является недостаточным, т. к. антиВГС могут появляться позднее от момента инфицирования вирусом. Напротив, РНК ВГС может обнаруживаться в течение нескольких дней после заражения, что делает данный анализ обязательным в диагностике острого ГС. Кроме того, количественное определение РНК ВГС играет важную роль в выборе тактики, длительности и эффективности ПВТ [7].
Молекулярные маркеры инфицирования ВГС
В настоящее время доступны как качественные, так и количественные методы определения РНК ВГС.
Для скрининга донорской крови и для подтверждения активной формы инфекции у лиц с антиВГС должен проводиться качественный анализ на РНК ВГС методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
Количественный анализ определения РНК ВГС предлагает возможность точного измерения вирусной нагрузки и играет важную роль в проведении мониторинга ПВТ [9–12]. Качественные и количественные методы обнаружения РНК ВГС в настоящее время широко заменены методом ПЦР в реальном времени, который может обнаруживать РНК ВГС в очень широком диапазоне – от 10 до 10 млн МЕ/мл (рис. 2, табл. 1.).
Поскольку интерферонотерапия является дорогостоящей и связана с частыми неблагоприятными побочными эффектами, важна ранняя оценка прогноза ПВТ, что позволит своевременно отменить неэффективную терапию, избежать ее нежелательных явлений и снизить стоимость лечения.
Отрицательный результат выявления РНК ВГС в чувствительном тесте через 24 недели после окончания терапии является целью противовирусного лечения и указывает на достижение УВО [8].
В последнее время количественный анализ РНК ВГС стал широко применяться для выбора персонализированной продолжительности ПВТ при использовании новых противовирусных препаратов прямого действия для лечения хронического ГС [16, 17].
После базовой диагностики ГС у каждого пациента, для которого рассматривается проведение ПВТ, должен быть определен генотип ВГС, т. к. рекомендуемые в настоящее время схемы и длительность лечения, а также конкретный выбор доз препаратов (в частности, рибавирина) различаются в зависимости от генотипа вируса.
Показано, что независимо от типа терапии (пегилированные, или короткие, интерфероны в сочетани с рибавирином) пациенты лучше отвечают на лечение, если они инфицированы ВГС генотипа 2. Лица, инфицированные генотипами 1, 3, 4 ВГС, хуже отвечают на проводимую ПВТ [18]. В связи с этим для пациентов с хроническим ГС установлена различная длительность ПВТ (при генотипах 2 и 3 – 24 недели, генотипах 1 и 4 – 48 недель) [19].
Золотым стандартом определения генотипа ВГС является анализ нуклеотидной последовательности участка NS5B вирусного генома (рис. 1). В рутинной диагностике ГС применять данный подход весьма затруднительно, поскольку многие коммерческие тест-системы основаны на высокотехнологичной ПЦР с генотип-специфичными праймерами, а также на методе обратной гибридизации. В основе работы таких наборов лежит использование в качестве матрицы 5’-нетранслируемой области генома ВГС. Однако указанные тест-системы не могут точно дифференцировать новые, редко встречающиеся генотипы ВГС – 7, 8 и 9, а также во многих случаях – субтипы 1a и 1b [8]. Последнее особенно важно, поскольку показано, что субтипы 1а и 1b по-разному отвечают на новые антивирусные препараты прямого действия [8].
В настоящее время вопрос об использовании наиболее адекватного метода генотипирования ВГС в рутинной клинической практике по-прежнему остается открытым.
Морфологические методы, такие как иммуногистохимия, in situ гибридизация или ПЦР образцов ткани печени, не играют значительной роли в диагностике ГС из-за их малой доступности, технической сложности, связанной с проведением (биопсия печени), и нередко низкой чувствительности, специфичности и эффективности (в связи с ограниченным объемом получаемого материала) в сравнении с серологическими и молекулярно-генетическими подходами.
Итоги описания современных методов диагностики ГС отражены в таблице интерпретации результатов исследования, суммированы в виде алгоритма и могут служить памяткой для врача любой специальности (рис. 3, табл. 2).
В настоящее время врач может столкнуть с проблемой, когда, обследуя пациента с хронической патологией печени (при исключении аутоиммунных процессов и лекарственного поражения) на фоне длительно сохраняющейся минимальной активности печеночного воспаления, в сыворотке крови не находит маркеров инфицирования вирусами гепатитов. В таких случаях считают, что инфекция протекает скрыто (латентная инфекция).
Скрытый гепатит С
Первое определение скрытого (латентного) ГС включало обнаружение РНК ВГС в сыворотке крови в отсутствие серологических маркеров инфицирования ВГС. В дальнейшем при интенсивном изучении данной формы инфекции представление о скрытом ГС изменилось.
В 2004 г. I. Castillo и соавт. была описана скрытая форма ВГС-инфекции, когда у лиц с гепатитом неустановленной этиологии в ткани печени и мононуклеарах периферической крови при помощи ОТ-ПЦР с последующим подтверждением гибридизацией in situ была обнаружена РНК ВГС. При этом в сыворотках крови пациентов отсутствовали как антиВГС (подтверждено двумя независимыми исследованиями ИФА), так и РНК ВГС [19].
С момента начала изучения показатели частоты распространения срытого ГС в группах риска не были определены. Опубликованные данные о выявлении латентной инфекции свидетельствуют об относительно высокой частоте ее выявления. Так, среди 76 пациентов с гепатитом неясной этиологии у 35 установлен острый ГС, т. е. выявлена РНК ВГС на фоне отсутствия антиВГС [20].
В работе P. Jain было показано присутствие среди 27 обследованных пациентов программного гемодиализа скрытого ГС в 90% случаев [21].
Среди 58 ВИЧ-инфицированных пациентов с доказанным половым путем передачи ВИЧ скрытый ГС определен у 6 (10,3%) пациентов.
Данные исследования продемонстрировали, что результаты выявления только серологических маркеров инфицирования ВГС не дают полного представления об истинном распространении этого вируса [22].
T. Pham и соавт. получили доказательства гипотезы о том, что скрытый ГС является следствием разрешения симптоматического ГС, что указывает на необходимость исследования клеток иммунной системы для эффективной диагностики ВГС-инфекции [23].
Для диагностики латентной ВГС-инфекции необходимо применение высокочувствительных методов ПЦР и специальных методик обработки материала, в первую очередь ультрацентрифугирования сыворотки для концентрации вирусных частиц. В настоящее время золотым стандартом диагностики скрытой ВГС-инфекции является определение РНК ВГС в ткани печени пациентов. Учитывая высокую травматичность процедуры биопсии печени, активно проводится поиск других надежных методов диагностики.
В 70% случаев скрытого ГС РНК ВГС обнаруживают в мононуклеарах периферической крови. V. Carreno и соавт. было показано, что при исследовании РНК ВГС в мононуклеарах периферической крови пациентов с подтвержденной скрытой ВГС-инфекцией (наличие РНК ВГС в ткани печени и ее отсутствие в сыворотке крови) результат был положительным в 57% (12/21) случаев [24].
Латентная инфекция без серологических маркеров ВГС встречается при хроническом гепатите неуточненной этиологии (криптогенном гепатите), у больных, получающих программный гемодиализ, и у пациентов с гепатоцеллюлярной карциномой. Важность выявления скрытого ГС определяется возможностью передачи вируса при гемотрансфузиях от доноров с недиагностированной ВГС-инфекцией.
Выделяют две формы латентной HCV-инфекции:
• 1-й тип – выявление РНК ВГС в ткани печени у больных хроническим заболеванием печени неуточненной этиологии в отсутствие антиВГС и РНК ВГС в сыворотке;
• 2-й тип – определение РНК ВГС в ткани печени у больных со спонтанным разрешением острой инфекции или с элиминацией РНК ВГС из сыворотки крови в результате ПВТ при сохраняющихся в сыворотке крови антиВГС.
Исследования с использованием гибридизации in situ показали, что в сравнении со случаями гистологически подтвержденного ХГС в ткани печени пациентов со скрытой ВГС-инфекцией количество инфицированных гепатоцитов значительно ниже. Кроме этого, у таких пациентов показатели аланиновой аминотрансферазы, гамма-глобулинов и альфа-фетопротеина значительно ближе к норме. Тем не менее при скрытой ВГС-инфекции в ткани печени пациентов наблюдались выраженные признаки стеатоза [24].
Было показано, что в сравнении с пациентами с ХГС или гепатитом неуточненной этиологии у лиц со скрытой ВГС-инфекцией наблюдается усиленная пролиферация CD 8+ Т-лимфоцитов и выработка гамма-интерферона в ответ на антигенную стимуляцию белками NS3 и NS4 ВГС.
Таким образом, можно предположить, что формирование скрытой ВГС-инфекции у таких пациентов связано с перестройкой функционирования иммунной системы, проявившейся в контроле над ГС.
Второй немаловажный вопрос в данной проблеме для клинициста: нужно ли и как лечить таких пациентов?
Группой исследователей под руководством М. Pardo в 2006 г. был проведен 6-месячный курс лечения (пегилированный интерферон в сочетании с рибавирином) 10 пациентов со скрытой ВГС-инфекцией с последующим наблюдением в течение 24 недель. Несмотря на то что у 8 пациентов к окончанию ПВТ в мононуклеарах периферической крови не обнаруживалась РНК ВГС, достигнутый результат (УВО) сохранился лишь у 3 больных [25].
Скрытая ВГС-инфекция в настоящее время является хорошо описанным явлением, особенно имеющим значение для службы переливания крови и трансплантологии. Кроме того, дальнейшее ее изучение позволит лучше понять механизмы хронизации ВГС инфекции, а также разработать новые рекомендации в отношении терапии пациентов с ХГС.
Антитела к вирусу гепатита С в сыворотке в норме отсутствуют
Суммарные антитела к вирусу гепатита С представляют собой антитела классов IgM и IgG, направленные к комплексу структурных и неструктурных белков вируса гепатита С.
Это исследование является скрининговым для выявления пациентов с ВСГ. Суммарные антитела к вирусу гепатита С можно выявить в первые 2 недели заболевания, и их присутствие свидетельствует о возможной инфицированности вирусом или перенесенной инфекции.
Однозначный ответ на основании результатов данного теста получить невозможно, так как тест определяет суммарные антитела IgM и IgG. Если это ранний период острого вирусного гепатита С, то об этом свидетельствуют антитела IgM, а если это период реконвалесценции или состояние после перенесенного ВГС, то на это указывают антитела IgG.
Оценка результатов исследования
Результат исследования выражается качественно – положительный или отрицательный. Отрицательный результат исследования указывает на отсутствие суммарных антител (JgM и JgG) к ВГС в сыворотке крови. Положительный результат – выявление суммарных антител (JgM и JgG) к ВГС свидетельствует о начальной стадии острого вирусного гепатита С, остром периоде инфекции, ранней стадии реконвалесценции, перенесенном вирусном гепатите С или хроническом вирусном гепатите С.
Однако обнаружение суммарных антител к ВГС недостаточно для постановки диагноза ВГС и требует подтверждения для исключения ложноположительного результата исследования. Поэтому при получении положительного результата скринингового исследования на суммарные антитела к ВГС в лаборатории проводится подтверждающий тест. Окончательный результат определения суммарных антител к ВГС выдается совместно с результатом подтверждающего теста.
Антитела к вирусу гепатита С JgM
Антитела к вирусу гепатита С JgM в сыворотке в норме отсутствуют. Наличие антител класса JgM к ВГС в крови пациента позволяет верифицировать активную инфекцию. Антитела класса JgM могут выявляться не только при остром ВГС, но и при хроническом гепатите С.
Антитела класса JgM к ВГС появляются в крови пациента спустя 2 недели после развития клинической картины острого вирусного гепатита С или обострения хронического гепатита и обычно исчезают спустя 4-6 месяцев. Снижение их уровня может свидетельствовать об эффективности лекарственной терапии.
Оценка результатов исследования
Результат исследования выражается качественно – положительный или отрицательный. Отрицательный результат исследования указывает на отсутствие антител JgM к ВГС в сыворотке крови. Положительный результат – выявление антител JgM к ВГС свидетельствует о начальной стадии острого вирусного гепатита С, остром периоде инфекции, ранней стадии реконвалесценции или активном хроническом вирусном гепатите С.
Обнаружение вируса гепатита С методом ПЦР (качественно)
Вирус гепатита С в крови в норме отсутствует.
В отличие от серологических методов диагностики ВГС, где обнаруживают антитела к ВГС, ПЦР позволяет выявить наличие непосредственно РНК ВГС в крови как качественно, так и количественно. Определяемым фрагментом в обоих служит консервативный участок генома гепатита С.
Обнаружение только антител к ВГС подтверждает лишь факт инфицирования пациента, но не позволяет судить об активности инфекционного процесса (о репликации вируса), о прогнозе заболевания. Кроме того, антитела к вирусу ГС обнаруживают как в крови больных острым и хроническим гепатитом,так и у тех пациентов, кто болел и выздоровел, а нередко антитела в крови появляются только спустя несколько месяцев после появления клинической картины заболевания, что затрудняет диагностику. Обнаружение вируса в крови методом ПЦР – более информативный метод диагностики.
Качественное выявление ВГС методом ПЦР в крови свидетельствует о виремии, позволяет судить о размножении вируса в организме и является одним из критериев эффективности противовирусной терапии.
Аналитическая чувствительность метода ПЦР составляет не менее 50-100 вирусных частиц в 5 мкл, прошедшей выделение ДНК-пробы, специфичность – 98%. Обнаружение РНК вируса гепатита С с помощью ПЦР на ранних этапах развития вирусной инфекции (возможно уже через 1-2 недели после заражения) на фоне полного отсутствия каких-либо серологических маркеров может служить самым ранним свидетельством инфицирования.
Однако изолированное выявление РНК вируса гепатита С на фоне полного отсутствия каких-либо других серологических маркеров не может полностью исключить ложноположительный результат ПЦР. В таких случаях требуется всесторонняя оценка клинических, биохимических и морфологических исследований и повторное неоднократное подтверждение наличия инфекции ПЦР.
Согласно рекомендациям ВОЗ для подтверждения диагноза вирусного гепатита С необходимо троекратное выявление РНК вируса гепатита С в крови пациента.
Обнаружение РНК вируса гепатита С методом ПЦР используется в целях:
Обнаружение вируса гепатита С методом ПЦР (количественно)
Количественный метод определения содержания РНК вируса гепатита С в крови дает важную информацию об интенсивности развития заболевания, об эффективности лечения и о развитии резистентности к антивирусным препаратам. Аналитическая чувствительность метода составляет от 5.102 копий/мл вирусных частиц в сыворотке крови, специфичность – 98%.
Уровень виремии оценивают следующим образом: при содержании РНК ВГС от 10^2 до 10^4 копий/мл – низкий; от 10^5 до 10^7 копий/мл – средний и выше 10^8 копий /мл – высокий.
Количественное определение содержания РНК ВГС в сыворотке крови методом ПЦР имеет важное значение для прогноза эффективности лечения интерфероном-альфа. Показано, что наиболее благоприятный прогноз заболевания и наибольшую вероятность положительного ответа на противовирусную терапию имеют лица с низким уровнем виремии. При эффективном лечении уровень виремии снижается.
Генотипирование вируса гепатита С - определение генотипа
Метод ПЦР позволяет не только выявить РНК ВГС в крови, но и установить его генотип. Наиболее важное значение для клинической практики имеют 5 субтипов ВГС – 1а, 1b, 2а, 2b и 3а. В нашей стране наиболее часто встречается субтип 1b, далее идут 3а, 1а, 2а.
Определение генотипа (субтипа) вируса имеет важное значение для прогноза течения ВГС и подбора пациентов с хроническим ВГС к проведению лечения интерфероном-альфа и рибавирином.
При инфицировании пациента субтипом 1b хронический ВГС развивается примерно в 90% случаев, при наличии субтипов 2а и 3а – в 33-50%. У пациентов с субтипом 1b заболевание протекает в более тяжелой форме и часто заканчивается развитием цирроза печени и гепатоцеллюлярной карциномы. При инфицировании субтипом 3а у больных более выражен стеатоз, поражение желчевыводящих путей, активность АЛТ и менее выражены фиброзные изменения в печени, чем у пациентов с субтипом 1b.
Показаниями к лечению хронического ВГС интерфероном–альфа являются:
При лечении интерфероном-альфа больных вирусным гепатитом С с субтипом 1b эффективность терапии отмечается в среднем в 18% случаев, у инфицированных другими субтипами – в 55%. Использование комбинированной схемы лечения (интерферон-альфа + рибавирин) повышает эффективность терапии. Стойкий ответ наблюдается у 28% больных с субтипом 1b и у 66% - с другими субтипами ВГС.
Читайте также:

