Что такое вирус менго
Обновлено: 23.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.
Определение
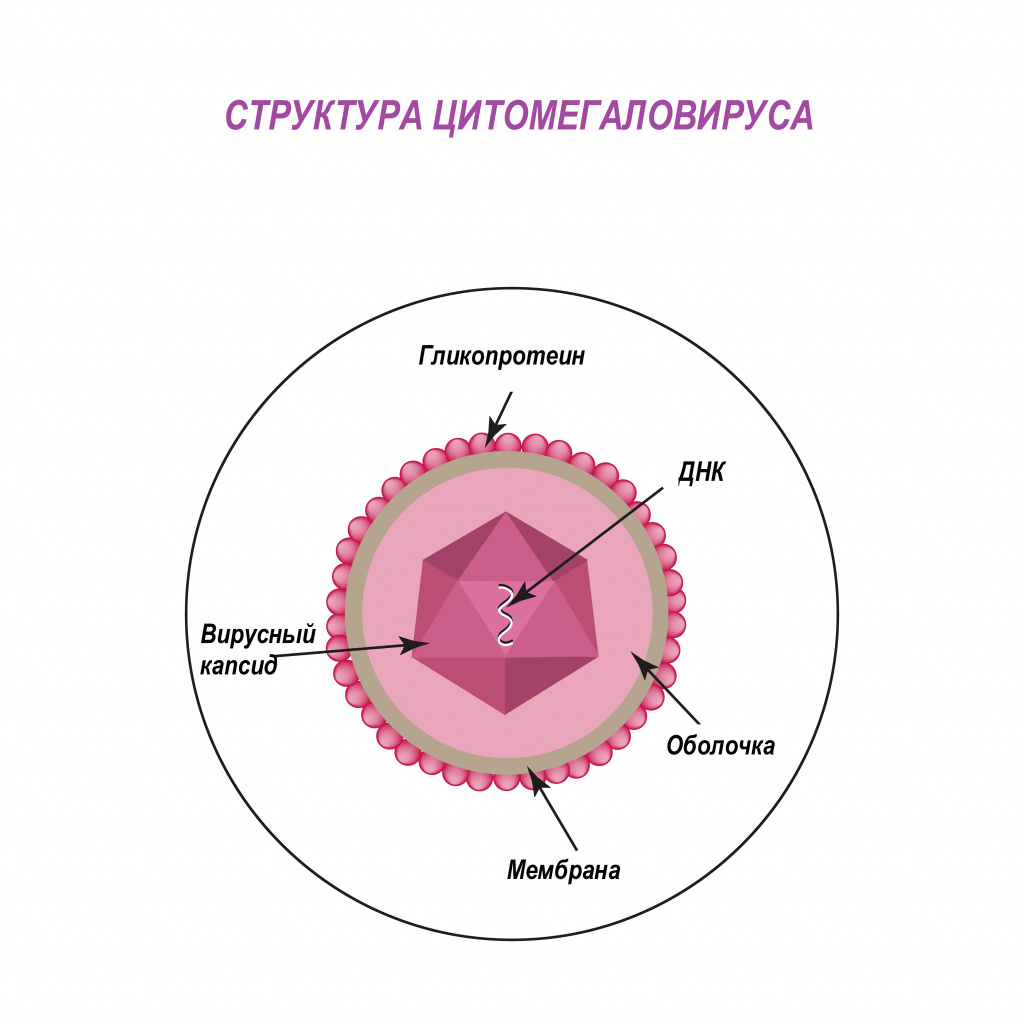
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений - от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Попадая в клетки организма, цитомегаловирус способен оставаться в них пожизненно. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. При угнетении иммунитета вирус активизируется, вызывая клинические симптомы болезни.
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% - то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
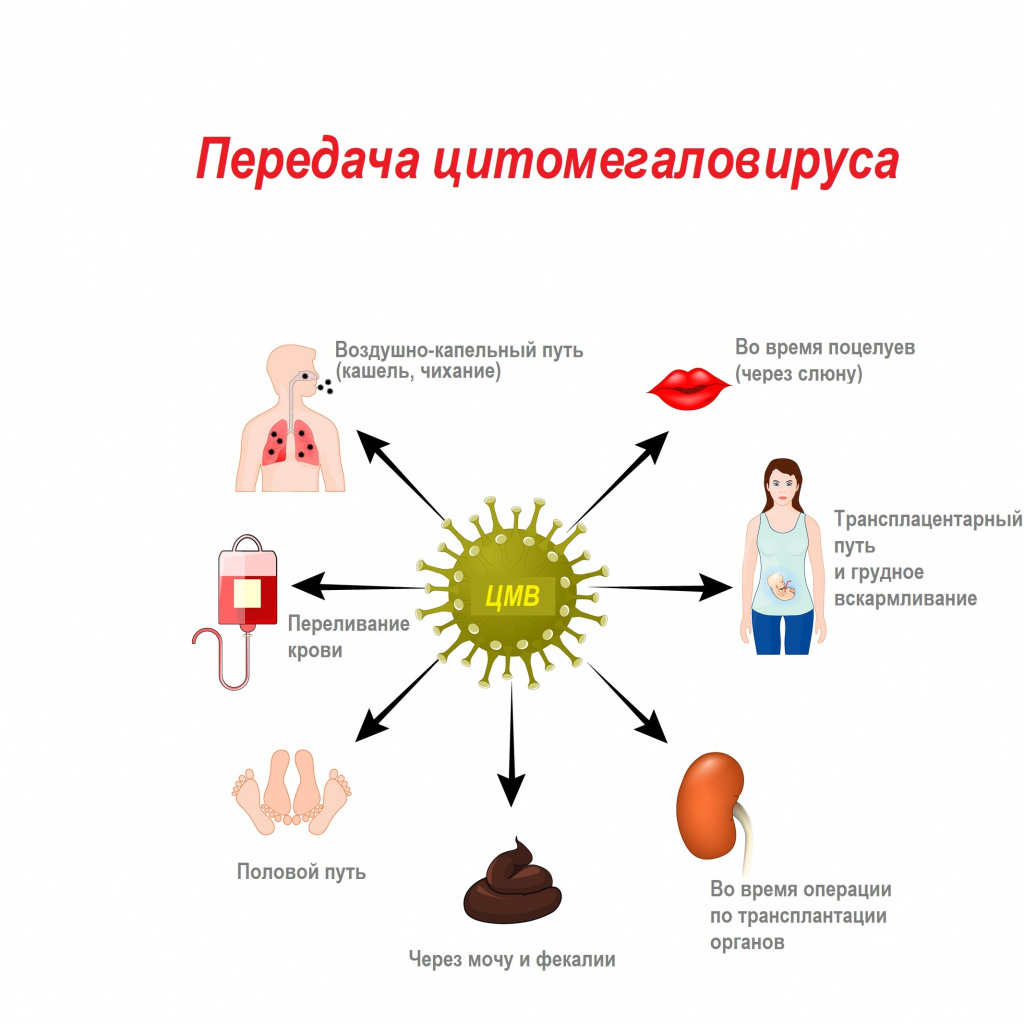
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.
- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело - вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования - общие и специфические:
-
общий анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу. Cytomegalovirus; CMV Antibody, IgG; CMV infection; CMV-specific IgG. Краткое описание исследования Anti-CMV-IgG .
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирусная инфекция входит в группу репродуктивно значимых инфекций, обозначаемых как TORCH-комплекс (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes); первичное инфицирование данными возбудителями, либо обострение .
К каким врачам обращаться
С первичными жалобами пациенты обращаются к врачу-терапевту или врачу общей практики (семейному врачу), детей ведет врач-педиатр . Могут потребоваться консультации инфекциониста - для верификации диагноза, стоматолога - при поражениях слизистой оболочки рта, кардиолога - при наличии врожденного порока сердца, нейрохирурга - при пороках центральной нервной системы, невропатолога - для оценки неврологической патологии, гематолога - при выраженных гематологических изменениях и геморрагическом синдроме, окулиста - для исследования глазного дна, отоларинголога - для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию - для восстановления обмена веществ в организме;
- симптоматическую терапию - для купирования воспалительных и токсических проявлений заболевания.
Проблема клинически выраженной инфекции актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих кортикостероидную, туберкулостатическую терапию, а также перенесших ожоговую травму.
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.

Новость
Автор
Редактор

Рисунок 1. Классификация пикорнавирусов.
Структура пикорнавирусов

Рисунок 2. Структура энтеровируса крупного рогатого скота. Белок VP1 обозначен синим цветом, VP2 — зеленым, VP3 — красным и VP4 — желтым. Рисунок из [3].
Сверчок и HAV: связь раскрыта!

Рисунок 3. Поверхность HAV. Синим цветом обозначен белок VP1, зеленым — VP2, красным — VP3. Черными линиями обозначены границы частицы. Рисунок из [6].
Новые факты о HAV
Было обнаружено, что вирусные частицы HAV более устойчивы к физическим и химическим воздействиям, чем частицы других Picornaviridae [6]. Они остаются стабильными при температуре до 80 °С и значениях pH около 2. Можно было бы предположить, что такая устойчивость вызвана изменениями домена VP2 на границе пентамеров, что описывалось выше. Однако, стабильность паралитического вируса сверчка, организованного подобно HAV, ничем не отличается от таковой прочих пикорнавирусов. Дальнейшие исследования показали, что устойчивости частицы HAV способствует состыковка небольших аминокислотных остатков и тирозиновых боковых цепей, прижатых вокруг оси двойной симметрии.

HAV — переходная эволюционная форма

Рисунок 5. Филогения. a — дендрограмма представителей пикорнавирусов и крипавирусов: EV71 — энтеровирус 71, 1BEV — энтеровирус крупного рогатого скота, 4HRV — человеческий риновирус 14, 1HXS — полиовирус 1 типа, 1COV — вирус Коксаки B3, 1TME — вирус Тейлера, 2MEV — вирус менго, 3CJI — Seneca valley virus, 1ZBA — вирус ящура A10, 2WFF — вирус конского ринита А, 3NAP — вирус клопов Triatoma и 1B35 — вирус CrPV, паралитический вирус сверчка; b — суперпозиция (наложение) белков VP1 (синий), VP2 (зеленый) и VP3 (красный) вируса гепатита А. Рисунок из [6].
Таким образом, можно сделать вывод, что HAV обладает тонкими, но глубокими структурными различиями с другими пикорнавирусами. Филогенетический анализ показывает, что HAV связан как с классическими пикорнавирусами, так и с пикорнаподобными вирусами насекомых (рис. 5а). Кроме того, замена N-концевого домена в белке VP2 повышает уровень его гомологии с белками VP1 и VP3 (рис. 5b). Это подтверждает идею о том, что HAV сохранил структурные и функциональные особенности первичных пикорнавирусов, которые были родственны пикорнаподобным вирусам насекомых. Та же замена в белке VP2 позволила вирусу гепатита А приобрести эффективные механизмы внедрения своего генома в клетку, что стимулировало взрывное появление разнообразных форм современных пикорнавирусов млекопитающих.
Полученные знания о кристаллической структуре и происхождении HAV раскрывают широкие перспективы в борьбе с этим вирусом. Например, можно синтезировать препараты, направленные на разрушение структуры вируса. Или, зная, что HAV, как и его предки, попадает в клетки путем трансцитоза, пытаться блокировать этот процесс. Можно сделать лекарства, направленные на разрушение комплекса HAV-ESCRT, и таким образом предотвращать активную репликацию вируса в клетках. Думаю, что исследования в этой области не заставят себя ждать, и скоро мы узнаем о появлении на рынке новых препаратов, способных эффективно бороться с вирусом гепатита А.

Обзор
Реконструкция оболочки вируса Зика. Карта поверхности вириона (разрешение — 3,8 Å), полученная с помощью программной обработки криоэлектронных микрофотографий, позволяет предположить, как именно вирус поражает те или иные клетки, и вычислить потенциальные мишени для терапии или компоненты для вакцины. Симметрически неэквивалентные мономеры вирусного гликопротеина Е окрашены разными цветами.
Автор
Редакторы
В эпоху глобализации из-за свободного перемещения людей по миру проникновение ZIKV в новые регионы становится неизбежным. Там он может длительно сохраняться, передаваясь от животных к животным и изредка вызывая мелкие вспышки болезни у людей, либо циркулировать в человеческой популяции. Угроза, исходящая от любого нового заболевания, зависит от его эпидемиологии, клинических особенностей и способности медицинского сообщества эффективно его контролировать (рис. 1). И сейчас огромные усилия брошены на изучение особенностей вируса Зика и механизмов его воздействия на человеческое здоровье, в особенности — на здоровье беременных [1].

Рисунок 1. Сотрудник муниципальной службы города Ресифи (Бразилия) во время операции по уничтожению комаров Aedes aegypti, переносящих вирус Зика.
Хронология событий в Зика-эпопее

Рисунок 2. Микрофотография вируса Зика, полученная с помощью трансмиссионного электронного микроскопа (ТЭМ). Вирусные частицы размером 40 нм окрашены синим цветом.
В Энтеббе расположен Угандийский исследовательский институт вирусологии (Uganda Virus Research Institute, UVRI), чьи сотрудники в 1947 году при изучении желтой лихорадки в лесу Зика выделили из крови макаки до тех пор неизвестный флавивирус. Ученые описали его как вирус Зика (рис. 2). А на следующий год обнаружили вирус в комарах Aedes africanus [3].
В 1952 году вирус выявили уже у людей — в Уганде и Танзании, а в 1954 году — в Нигерии. ZIKV четко ассоциировался с лихорадкой и кожной сыпью, в связи с чем его окончательно объявили патогенным для человека. Тогда же, в 50-е, экспериментальным путем с участием добровольцев установили основного переносчика вируса — комара Aedes aegypti, обычного переносчика желтой лихорадки, лихорадки денге и чикунгуньи. Позже компанию ему составили и другие виды, в том числе Aedes albopictus [1].
В 60–80-е годы легкие формы инфекции выявляли в странах Африки, Азии и в Индии. Длительное присутствие ZIKV в этих регионах подтверждалось обнаружением вируса в комарах и нечеловекообразных обезьянах. У людей до 2007 года фиксировали не так много клинических случаев, и потому система здравоохранения не спешила бить тревогу [4].
Первую крупную вспышку лихорадки Зика зарегистрировали в 2007 году на острове Яп в тихоокеанских Федеративных штатах Микронезии, где инфицированными оказались 73% населения, однако симптомы у подавляющего большинства были умеренными и недолгими. Следующая вспышка охватила в 2013–2014 годах Французскую Полинезию, где заразились 66% жителей. Одновременная волна заболеваемости синдромом Гийена-Барре подняла вопрос о его ассоциации с вирусом Зика: тогда зафиксировали 42 случая — а это на порядок больше, чем в 2012 году, когда синдром диагностировали у троих [1].
К 27 июля ZIKV циркулировал уже в 67 странах и территориях (рис. 3). Крупная вспышка заболевания произошла в Колумбии — там заразились 65 000 человек. У многих из них выявлялись неврологические синдромы, отмечались и случаи микроцефалии [1].
В июле 2016 зафиксировали две смерти, связанные с заражением ZIKV: в США и Пуэрто-Рико. Предполагают, что смерти вызвал не сам вирус, а обострившиеся во время лихорадки симптомы хронических заболеваний.
В середине августа 2016 года в Пуэрто-Рико ввели режим чрезвычайной ситуации, поскольку распространение вируса набирало обороты слишком быстро: за полгода (с декабря 2015 по 12 августа 2016) число заразившихся возросло с одного до 10 000 человек.
К 1 сентября в американской Флориде зарегистрировали 47 случаев заболевания, а в Майами-Бич впервые в США обнаружили трех комаров — переносчиков вируса Зика.

Рисунок 3. История распространения вируса Зика по миру.
В Россию впервые вирус завезли в феврале 2016 года из Доминиканской республики. За прошедшие месяцы отмечены еще 7 случаев. Все — у туристов, вернувшихся из стран, где распространяется ZIKV: большинство — из Доминиканской республики, один — с Карибских островов. Все пациенты благополучно перенесли лихорадку.
Патогенез лихорадки Зика
Передача вируса и развитие болезни
Какие-то симптомы появляются у меньшинства инфицированных: на острове Яп лишь 19% заразившихся сообщили о симптомах, а во Французской Полинезии — 26%. Если признаки лихорадки развиваются, то в 95% случаев это происходит через 6–11 суток после заражения (рис. 4). Симптомы сходны с проявлениями других подобных инфекций [1], [4]:
- повышенная температура тела;
- кожная сыпь;
- боль в суставах и мышцах;
- головная боль;
- конъюнктивит;
- отеки;
- иногда рвота;
- общее недомогание.

Рисунок 4. Схема протекания инфекции у человека и комара. В среднем признаки развиваются на шестой день после инфицирования. Примерно на девятый день начинается выработка иммуноглобулинов (антител): первым обнаруживают IgM, количество которого позже снижается одновременно с ростом концентрации IgG. Последний сохраняется в крови неопределенное время. Виремия, вероятно, возникает до появления симптомов, и ее продолжительность сказывается на риске инфицирования восприимчивых комаров, кусающих зараженного человека. После определенного инкубационного периода комар приобретает способность передавать возбудителя другим людям. Tg — интервал между эпизодами инфицирования первого и второго человека.
Виремия, или вирусемия — медицинское состояние, когда вирусы попадают в кровоток и могут распространяться по всему телу, — аналогично бактериемии, при которой в кровь попадают бактерии [9]. — Ред.
В клетку вирус Зика проникает, взаимодействуя с определенными рецепторами на ее поверхности. Основной из них — AXL. А посредником выступает рецептор TIM-1, который связывает вирусные частицы и транспортирует их к AXL, способствующему проникновению вируса в клетку. Однако TIM-1 не необходимое звено, он лишь повышает концентрацию вирионов на поверхности клетки и ускоряет их взаимодействие с AXL [10].
Когда вирус оказывается внутри клетки, она отвечает повышенной продукцией интерферонов IFN-α и IFN-β, а также хемокинов CXCL10 и CXCL11, которые играют важную роль во врожденном и адаптивном иммунитете. Эти хемокины привлекают Т-клетки и другие лейкоциты к месту воспаления и даже оказывают прямое антимикробное действие, когда их концентрация в кожных фибробластах сильно повышается [10].
Антитела к вирусу обнаруживают в крови уже на девятый день после заражения. Продолжительность иммунитета против ZIKV пока не известна, но, судя по другим флавивирусам, можно предположить, что он пожизненный [1].
Вирус Зика и беременность
Однако установить связь между ZIKV и микроцефалией оказалось достаточно сложно из-за нескольких обстоятельств:
- остается неясным, сколько беременностей затронул вирус — инфекция ведь часто бессимптомна;
- до сих пор нет четкого определения микроцефалии;
- существуют другие инфекционные агенты, вызывающие микроцефалию: цитомегаловирус и Rubella virus (вирус краснухи).
Симптомы инфекции у беременных женщин такие же, как и у остальных, но пока не известно, влияет ли на частоту их проявления иммунодефицит, характерный для этого периода. Результаты исследований, касающихся неблагоприятных последствий заболевания для эмбриона, очень разнородны: где-то у 29% беременных с симптомами болезни развивался эмбрион с микроцефалией, а где-то и у 74%. Возможно, такие расхождения возникли потому, что в исследованиях участвовало недостаточное количество пациентов — меньше 50 человек. С определенной уверенностью можно утверждать лишь то, что ZIKV-ассоциированная микроцефалия разовьется у плода одной из ста инфицированных в первый триместр женщин независимо от наличия симптомов, и этот риск становится незначительным во второй и третий триместры [1].
Помимо микроцефалии с вирусом Зика сейчас связывают и другие эмбриональные патологии [1]:
- внутричерепной кальциноз; ;
- дефекты органа зрения;
- гипоплазию ствола мозга; ; .
Устройство вируса Зика
Организация генома
К концу августа 2016 года в GenBank хранилось 67 полных последовательностей генома ZIKV. Вирус Зика содержит кодирующую молекулу РНК длиной 10,8 т.н. с одной ORF (открытой рамкой считывания), фланкированной нетранслируемыми участками (UTR) — 5′-UTR длиной 106 н. и 3′-UTR длиной 428 н. (рис. 5). ORF кодирует полипротеиновый предшественник, который впоследствии разделяется на три структурных белка (капсидный [С], премембранный [prM] и оболочечный [E]) и семь неструктурных (NS1, NS2A, NS2B, NS3, NS4A, NS4B и NS5). Вирусный полипротеин во время трансляции и/или после нее расщепляется вирусной протеазой, сигнальной пептидазой и неизвестной протеазой клетки-хозяина. Фрагмент pr затем, при производстве зрелых вирионов, обычно отсекается в аппарате Гольджи фурином [17].

Рисунок 5. Геном вируса (представлен в виде последовательности кодируемых РНК белковых продуктов). Структурные белки окрашены серым цветом, неструктурные синим. Цифрами обозначены длины белков (число аминокислотных остатков). Стрелки указывают на места расщепления полипротеина.
Основные белки
Белок E — главный поверхностный гликопротеин флавивирусов, а неструктурные белки NS3 и NS5 — основные ферменты вирусной репродукции [17]. Структура этих белков показана на рисунке 6.

Рисунок 6. Структура главных белков ZIKV.
Белок Е разделен на два структурных региона — стволовой и трансмембранный (на рис. 6 — stem и ТМ) — и три функциональных домена: домен I участвует в организации оболочки (рис. 7), домен II отвечает за взаимодействие мономеров, а домен III связывает клеточный рецептор.
NS3 состоит из протеазного и хеликазо-НТФазного доменов, которые осуществляют процессинг вирусного полипротеина и раскручивание структурированных участков во время синтеза вирусной РНК.
NS5 содержит метилтрансферазный домен, который метилирует 5’-CAP-участок геномной РНК, и домен РНК-зависимой-РНК-полимеразы (RNA dependent RNA polymerase, RdRp).

Рисунок 7. Трехмерная модель вируса Зика в атомном разрешении, созданная в студии биомедицинской визуализации Visual Science. Модель построена по данным научных публикаций об организации вируса Зика и родственных вирусов и считается наиболее достоверной на текущий момент.
Известно, что гликозилирование играет важную роль в инфекционности, созревании и вирулентности флавивирусов [18], [19]. Для вируса Зика предсказаны потенциальные участки для N- и O-гликозилирования в белках prM, E, NS1 и NS4B, которые гликозилируются и в других флавивирусах. Исследования, посвященные роли этих сайтов в жизненном цикле вируса Зика, еще только планируются [17]. Правда, уже обнаружено одно структурное отличие белка Е ZIKV от подобных белков других флавивирусов — выставленная на поверхность вирусной частицы аминокислотная петля, с которой в позиции Asn154 связывается гликан (см. видео). Предполагают, что именно эта петля вместе с прикрепленным сахаром может отвечать за тропизм вируса (взаимодействие с рецепторами определенной группы клеток) и патогенез болезни [20].
Отличие в структуре белка Е ZIKV от гомологичных белков других флавивирусов.
исследовательская группа Университета Пердью, США
Борьба с вирусом Зика
Диагностика
Основные проблемы диагностики ZIKV-инфекции — это значительное количество бессимптомных случаев и неспецифичность симптомов: лихорадка денге и чикунгунья, которые тоже переносятся комарами рода Aedes, проявляются подобным образом. Предположить заражение вирусом Зика можно, если симптомы появляются у человека, который недавно побывал или длительно проживал в районе циркуляции ZIKV [1], [4].
Лучшим решением был бы высокоспецифичный тест на антитела, который можно использовать не только для подтверждения инфицированности, но и для проверки иммунитета против вируса Зика в самом начале беременности, что позволило бы женщинам понять степень риска. Однако такое тестирование осложняется кросс-реактивностью с другими флавивирусами. Определенные надежды дает тест ELISA. Например, IgG-ELISA, применяемый во Французской Полинезии, где циркулирует вирус денге, еще до основной вспышки лихорадки Зика выявлял ZIKV-позитивных доноров крови (тогда их было <1%) [1].
Профилактика
Основной способ — это защита от укусов комаров, в том числе и с помощью контроля их распространения.
В регионах циркуляции вируса Зика и потенциально опасных зонах людям рекомендуют носить светлую одежду, закрывающую как можно больше поверхности тела, устанавливать на окна и двери домов противомоскитные сетки, использовать сетку во время сна, а также применять репелленты с ДЭТА, IR3535 или икаридином [4].
Самки комаров Aedes после насыщения кровью откладывают яйца, которые в безводной среде могут сохраняться до года. Даже в минимальном количестве воды из яиц выходят личинки и дальше развиваются во взрослых особей. Потому для контроля численности и распространения комаров необходимо постоянно отслеживать и ликвидировать места их размножения: ведра, бочки, горшки с водой, сточные канавы, использованные автомобильные покрышки. В особых случаях прибегают к распылению инсектицидов [4].
Пример эффективного контроля численности переносчика вирусов — действия Уильяма Горгаса по ликвидации эпидемии желтой лихорадки в Гаване и регионе Панамского канала в начале XX века. Этот американский военврач и его команда устроили жестокую борьбу с антисанитарией и обработали все здания и улицы инсектицидами (от которых, к слову, пострадало и немало жителей). В результате желтая лихорадка была полностью побеждена [21].
В 50-х и 60-х годах в государствах Америки применяли интенсивные меры по контролю переноса возбудителя желтой лихорадки, включая повсеместное распыление ДДТ. Это привело к устранению Aedes aegypti из 18 стран и значительно сократило область распространения заболевания. Позже подобные программы успешно осуществили Сингапур и Куба. Конечно, через некоторое время лихорадка вернулась, но даже краткосрочный период без инфекции имел большое значение для населения [1].
Чтобы сократить риск передачи ZIKV половым путем (особенно во время беременности), мужчинам, проживающим в зонах циркуляции вируса или недавно побывавшим там, ВОЗ рекомендует пользоваться презервативами или воздерживаться от половой активности на всём протяжении беременности партнерши [4].
Лечение
Обычно заболевание протекает в легкой форме и не требует специального лечения. Во время лихорадки необходим отдых и обильное питье, иногда — прием препаратов для устранения боли и других неприятных симптомов [4].
Тем не менее существуют вещества, которые оказывают воздействие и на сам вирус Зика. Например, эффективно подавляет репродукцию вируса in vitro 2′-C-метиладенозин, а 7-деаза-2′-C-метиладенозин (МК-608) ингибирует репликацию ZIKV in vitro и затормаживает развитие болезни в экспериментах на мышах. Препараты 2′-C-метилцитидин, рибавирин, фавипиравир и T-1105 ослабляют цитопатическое действие вируса и снижают его урожай [22], [23].
Разумеется, вакцина решила бы проблему кардинально, но она до сих пор не разработана. Сейчас исследованиями занимаются 18 коммерческих компаний и исследовательских институтов [24–26]. Однако первая фаза клинических испытаний стартует не раньше конца 2016 года, а значит, готовая вакцина появится еще не скоро, и распространение инфекции по миру продолжится [1].
Заключение
Хотя всевозможные случайности в эволюции вирусов делают точный прогноз пандемий практически невозможным, научный мир пытается повышать скорость реакции на новые угрозы. В ближайшее время усилия биологов и медиков сосредоточатся на разработке единой стратегии, которую в любой момент можно было бы применить к той или иной вспышке заболевания. Такая стратегия позволит быстро разобраться в путях передачи, патогенезе и способах контроля инфекции, чтобы предотвратить ее глобальное распространение.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);
Читайте также:

