Что такое внутриутробная инфекция и герпес
Обновлено: 26.04.2024
Внутриутробная герпетическая инфекция. Заражение плода вирусом герпеса
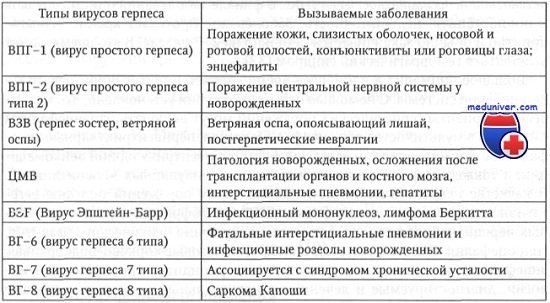
Вероятность перинатальной передачи герпетической, наиболее распространенной и практически неконтролируемой инфекции, очень высока. По данным Т. В. Голосовой, И. К. Никитина, известно более 80 представителей вирусов герпеса, из которых 8 типов патогенны для человека.
В паравертебральных сенсорных ганглиях ВПГ и ЦМВ находятся в латентном состоянии в виде L-prep-частиц. Персистенция вирусов связана с иммунокомпетентностью организма. В ситуациях, сопровождающихся иммуносупрессией, вирусы поражают различные ткани и вызывают разнообразные клинические формы заболевания. Одна из таких ситуаций обусловлена беременностью и взаимоотношением мать — плод.
Вероятно, это обусловлено тем, что вирус простого герпеса содержит детерминанты, подобные одному из фрагментов ФНР. Повышение уровня этих аутоантител в крови новорожденных коррелирует с появлением ЭКГ-признаков, свидетельствующих о снижении активности синусового узла и электрической активности миокарда.
У детей, рожденных женщинами с обострением герпетической инфекции, относительно чаще выявляются нарушения ритма сердца, связанные с угнетением симпатического звена регуляции, а также значительное удлинение интервала QT, что является маркером высокого риска формирования электрической нестабильности миокарда.
По данным Е. М. Малковой с соавторами, у новорожденных (n=62) с обнаруженной ДНК семейства герпесвирусов летальность составила 26,9%, у 7 новорожденных при патолого-анатомическом исследовании обнаружены врожденные пороки развития (гипоплазия легких, ангиоматоз сосудов легкого и генерализованная форма бронхоэктазий).
По результатам анализа у этих детей была выявлена ДНК вируса герпеса человека типа 6, что подтвердило тератогенное действие этого вируса.
Лечение перинатальной герпетической инфекции. К противогерпетическим относят противовирусные (химиопрепараты, интерфероны) и иммунокорригирующие препараты. Рекомендуются для использования в педиатрической практике иммуноглобулин человеческий нормальный, в том числе цитотект внутривенно, иммуноглобулин человеческий нормальный для внутримышечного введения. Однако препараты крови не исключают риск передачи гемотрансмиссивных инфекций. Установлено, что платные и первичные доноры крови являются источниками высокого уровня риска для гемотрансмиссивной передачи ВИЧ-инфекции и гепатитов.
Представляется обоснованным пересмотр показаний к переливанию компонентов и препаратов крови в сторону их сокращения.
Приорететное значение имеет раннее назначение противовирусной терапии. По данным О. Е. Озеровой с соавторами, основной метод диагностики — иммунологический — не всем доступен в связи с трудоемкостью и значительным временем для постановки окончательного диагноза. Поэтому в настоящее время основным диагностическим методом на 1 этапе, помимо клинических методов исследований, является эхография, дающая возможность оценить структуру головного мозга, других органов и установить степень их вовлечения в патологический процесс.
Врожденный герпес – герпетическая инфекция, встречающаяся у новорожденных при антенатальном или интранатальном заражении от инфицированной матери. Характеризуется специфическими кожными проявлениями в виде везикулярной сыпи, которая может также располагаться на слизистых оболочках глаз, рта, внутренних органов. Часто развивается герпетический энцефалит с очаговой симптоматикой и судорогами. Патологические изменения отмечаются в печени, селезенке, легких, почках и других органах. Врожденный герпес диагностируется на основании результатов серологических, гистологических исследований, а также выявления частиц вируса. Лечение – противовирусные препараты, иммуномодуляторы, иммуноглобулины, витаминотерапия.
Общие сведения
Врожденный герпес является одним из множества вариантов герпетической инфекции, к которой также относятся цитомегалия, ветряная оспа, внезапная экзантема детей и другие нозологии. Частота встречаемости заболевания – 1 случай на 2,5-60 тыс. новорожденных. Предположительно, такой разброс статистических данных связан с низкой выявляемостью в развивающихся странах. Врожденный герпес имеет высокую значимость в педиатрии в связи с ростом заболеваемости, а также увеличением случаев рецидивирующего течения. Это обусловлено тем, что вирусом простого герпеса инфицировано практически все население планеты, а сам вирус постоянно претерпевает значительные мутации. Кроме того, низкая специфичность симптомов часто является причиной запоздалой диагностики, что, в свою очередь, представляет опасность для жизни ребенка.

Причины и классификация врожденного герпеса
Возбудитель заболевания – вирус простого герпеса человека. Известно множество типов данного вируса, однако врожденный герпес в 80% случаев вызывается вирусом 2 типа, который также известен как генитальный герпес. Оставшиеся 20% в структуре заболеваемости приходятся на долю вируса простого герпеса 1 типа. Заражение чаще всего происходит интранатально, при прохождении плода по инфицированным родовым путям. Реже врожденный герпес развивается еще в утробе, попадая в организм малыша через плаценту. В этом случае речь идет о наиболее тяжелом течении заболевания, результатом чего обычно является выкидыш или рождение ребенка с разной степенью недоношенности и тяжелыми пороками развития.
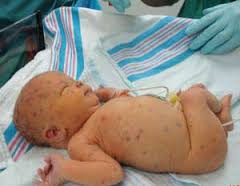
Заболевание может протекать в нескольких формах, которые отражают доминирующие клинические проявления. Выделяют 3 формы врожденного герпеса: локализованную, церебральную и генерализованную. Первая из них представлена характерными кожными высыпаниями, и именно этот симптом является ведущим. Церебральная форма, как правило, проявляется менингитом и энцефалитом герпетической природы. Генерализованный врожденный герпес у новорожденных достаточно часто развивается вследствие несовершенства иммунного ответа и сопровождается симптомами со стороны внутренних органов. Мозговые нарушения и кожные элементы также присутствуют.
Симптомы врожденного герпеса
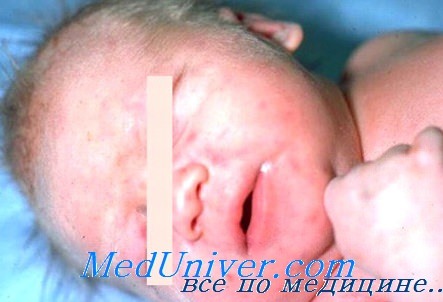
Как уже было сказано выше, симптоматика различается в зависимости от формы заболевания. Чаще всего врожденный герпес дебютирует на 7-14 день жизни. Время появления первых клинических признаков зависит от многих факторов: сроки гестации, срока инфицирования, сопутствующей патологии и т. д. Примерно в половине случаев врожденный герпес проявляется специфической для данной нозологии везикулярной сыпью. Мелкие пузырьки с серозным содержимым могут локализоваться на любой части тела, при этом элементы располагаются группами, образуя скопления и иногда сливаясь. Везикулы окружены кольцом гиперемии и отека, за счет чего они слегка приподнимаются над кожей. Характерно поражение слизистой оболочки глаз в виде кератитов и конъюнктивитов.
Часто содержимое кожных элементов в короткие сроки становится геморрагическим или гнойным. После вскрытия на месте пузырьков остаются эрозии, заживающие путем образования корочки. Общее состояние малыша может ухудшаться незначительно, температура повышается до субфебрильных значений. Исключение составляют случаи так называемого первичного врожденного герпеса, представляющего собой локализованную форму заболевания и проявляющегося обильной сыпью, элементы которой часто сливаются, оставляя после вскрытия обширные эрозии. Температура высокая, высыпания присутствуют не только на коже, но и на слизистых. В отсутствие своевременной терапии генерализация происходит в 50% случаев.
Церебральная форма врожденного герпеса проявляется менингеальной симптоматикой при отсутствии поражения кожи. Иногда везикулярная сыпь возникает позже, спустя примерно неделю после дебюта мозговых нарушений, но элементов сыпи в этом случае всегда немного. На первый план выходят симптомы менингита и энцефалита: нарушения сознания, эпилептиформные, тонические и тонико-клонические судороги. Симптомы неспецифичны, поэтому герпетический энцефалит легко спутать с энцефалитом любой другой природы. Значительная интоксикация ухудшает состояние, однако у новорожденных лихорадка может быть не выражена. Также присутствуют признаки отека мозга, что проявляется стволовыми нарушениями: дисфагией, расстройствами дыхания и пр.
Генерализованная форма врожденного герпеса является самой опасной. Она включает в себя и элементы сыпи, и церебральную симптоматику, описанную выше. Помимо этого, заболевание проявляется поражением внутренних органов: гепатоспленомегалией, пневмонией, специфическими изменениями в почках и надпочечниках. Явления токсикоза выражены в значительной степени. Смертность при генерализованной форме врожденного герпеса составляет более 50%, а по некоторым данным достигает 80-90% случаев, при этом половина выживших детей остаются глубокими инвалидами. Медленный регресс общемозговых и очаговых расстройств и их частая необратимость являются особенностью герпетической инфекции.
Диагностика врожденного герпеса
Выявление заболевания сопряжено для педиатра со значительными трудностями. Во-первых, если отсутствуют кожные проявления, то врожденный герпес можно заподозрить с той же вероятностью, что и многие другие патологии неонатального периода, в частности, внутриутробные инфекции, гипоксическую травму и т. д. Кроме того, часто выявление возбудителя не является доказательством герпетической инфекции, поскольку основная масса населения в мире имела контакт с данным вирусом. Тем не менее, основой диагностики является обнаружение самого вируса или его антигенов в разных средах, например, в содержимом везикул, крови, мазках из носо- и ротоглотки, цереброспинальной жидкости и др.
Метод высокоспецифичен, но занимает много времени. По этой причине проводятся серологические исследования с целью определения специфических антител класса IgM, что является подтверждением острой фазы врожденного герпеса. Подтверждение диагноза возможно также на основании обнаружения антител класса IgG, при этом решающую роль играет не сам факт их наличия, а нарастание титра в динамике не менее чем в 4 раза (при отсутствии нарастания антитела являются материнскими). В диагностике герпетического энцефалита врачи опираются именно на данные серологического исследования. Врожденный герпес также подтверждается, исходя из анамнеза матери и результатов гистологического обследования последа.
Лечение и прогноз врожденного герпеса
Проводится этиотропная терапия заболевания, от сроков ее начала во многом зависит прогноз для жизни и здоровья ребенка. Применяются противовирусные препараты, высокотропные именно к вирусу простого герпеса. Используется парентеральный путь введения. Также назначаются средства наружного действия для лечения везикулярной сыпи. Кроме того, к терапии врожденного герпеса всегда подключаются иммуноглобулины и иммуномодуляторы, проводится курс витаминотерапии. По показаниям осуществляется кислородная поддержка и ИВЛ, вводятся противосудорожные препараты, проводится дегидратация.
Прогноз неблагоприятный. Врожденный герпес часто протекает в генерализованной форме, последствия герпетического энцефалита необратимы. Выжившие дети очень редко не отстают в развитии от сверстников. Большинство из них остаются инвалидами или погибают в период разгара клинических проявлений. Даже если терапия начата своевременно, заболевание может неоднократно рецидивировать с той же симптоматикой. Для профилактики рецидивов возможно использование герпетической вакцины. В настоящее время существует несколько ее видов, но вследствие частых мутаций вируса эффективность вакцинации остается под вопросом.
Каковы возможные последствия инфицирования ВПГ во время беременности? Какие формы герпетической инфекции у беременной женщины наиболее опасны для плода и новорожденного? Каковы возможные варианты клинических проявлений герпетической инфекции у н
Каковы возможные последствия инфицирования ВПГ во время беременности?
Какие формы герпетической инфекции у беременной женщины наиболее опасны для плода и новорожденного?
Каковы возможные варианты клинических проявлений герпетической инфекции у новорожденных?
Частота распространенности вируса простого герпеса (ВПГ) среди беременных в США составляет 22-36%, в Европе — 14-19%. За период с 1966 по 1993 год частота случаев герпеса у новорожденных также возросла с 2,4 до 28,2 случаев на 100 тыс. новорожденных [19]. В России распространенность ВПГ среди популяции увеличилась в период с 1993 по 1997 год с 8,5 до 14,1 случаев на 100 тыс. населения [5]. Однако истинная частота врожденного герпеса и герпеса новорожденных остается неустановленной, так как в большинстве стран мира отсутствуют правила обязательной регистрации герпетической инфекции [17].
Герпетическая инфекция может протекать атипично, латентно, что представляет большие трудности для своевременного ее распознавания и является причиной диагностических ошибок.
Общепринятые бактериологические и микробиологические исследования не всегда позволяют выявить возбудителя в острой фазе заболевания, и нередко болезнь принимает хроническое течение, а женщины становятся носителями вирусной инфекции. Специфическая локализация ВПГ приводит к хроническим воспалительным процессам (эндометриту, цервициту, вульвовагиниту), а во время беременности – к поражению плаценты, плода и невынашиванию [2, 3, 7].
-
Установлено, что внутриутробное инфицирование плода ВПГ может происходить:
- трансплацентарно, трансцервикально или восходящим путем из инфицированного родового канала и гениталий;
- трансовариально — из полости малого таза по маточным трубам. Инфицирование новорожденного может происходить:
- в процессе родов — при прохождении плода через родовые пути;
- после родов (аэрогенно или при контакте с инфицированным медицинским персоналом, инструментарием, при нарушении санитарно-противоэпидемического режима, через молоко) [1, 9].
Внутриутробная герпетическая инфекция в ранний период беременности обычно заканчивается развитием уродства плода и самопроизвольным выкидышем. Инфицирование плода во II-III триместрах беременности может привести к развитию клинически манифестирующего герпеса у новорожденного в виде генерализованных или локальных проявлений (поражение ЦНС, глаз, кожи, ротовой полости) и латентного носительства [2, 4, 7, 10].
Влияние герпетической инфекции на течение беременности и состояние плода обусловлено двумя основными механизмами.
Во-первых, возможно инфицирование плаценты, околоплодных вод и оболочек, а также самого плода. Это может привести к повреждению плаценты, оболочек, тератогенным изменениям в тканях эмбриона и плода, к развитию локальных или генерализованных поражений, а также к латентной инфекции плода, с последующими клиническими проявлениями в постнатальном периоде.
Во-вторых, возможно влияние ГИ с развитием у беременной лихорадки, нарушений функции фетоплацентарной системы, гомеостаза, гормонального баланса. Указанные причины могут приводить к ранним и поздним выкидышам, задержке развития беременности, преждевременным родам, антенатальной гипотрофии, гипоксии, уродствам и гибели плода, развитию врожденных форм инфекции у новорожденных [6, 8, 11].
Многообразие клинических проявлений обусловлено длительностью и формой манифестации инфекции у беременной, свойствами и вирулентностью вируса, состоянием плацентарного барьера и защитных сил как матери, так и плода [6].
Изучение влияния герпетической инфекции на течение беременности, развитие плода и новорожденного показало, что наиболее серьезную опасность в любом триместре беременности представляют генерализованные формы ГИ у женщин и первичная инфекция во время родов.
Частота инфицирования новорожденного при наличии у беременной первичной герпетической инфекции достигает 40-50%, тогда как при рецидивирующей – 5% [12, 15, 20]. Такое различие обусловлено тем, что при рецидивирующей форме инфекции интенсивность и продолжительность выделения вируса меньше, чем при первичной. Кроме того, защитное действие оказывают специфические антитела, пассивно передающиеся новорожденному от матери, страдающей рецидивирующей формой герпетической инфекции. Следует иметь в виду, что внутриутробное инфицирование плода может происходить как при первичной, так и при рецидивирующей герпетической инфекции. При массивной вирусемии создаются благоприятные условия для трансплацентарного проникновения ВПГ в плод.
| Герпетические инфекции у беременных относятся к числу самых распространенных заболеваний, определяющих внутриутробное инфицирование, эмбрио- и фетопатии, акушерскую патологию. В последние годы отмечена тенденция к увеличению инфицирования беременных вирусом простого герпеса и способностью ГИ, при определенных условиях, к эндемическому распространению |
Поскольку беременность сопровождается иммуносупрессией, она может быть одним из естественных предрасполагающих факторов реактивации латентной герпетической инфекции и способствовать более частому рецидивированию, диссеминации ВПГ в организме, развитию генерализованной инфекции. Основные функциональные системы оказываются в “режиме предельной загруженности” и не могут адекватно и надежно реагировать на развитие инфекции. Решающее значение в этом сложном патологическом процессе, по-видимому, принадлежит состоянию иммунологической реактивности организма беременной.
По особенностям клинической картины течения заболевания выделяют: первичный (острый) и рецидивирующий (хронический) герпес [1].
Первичный генитальный герпес в типичных случаях начинается с локальных симптомов: болей, высыпаний на коже больших и малых половых губ, промежности, слизистой влагалища и шейке матки, дизурии, уретральных и вагинальных выделений, болезненности в паху. Инкубационный период, как правило, колеблется от трех до семи суток. Очень высок процент (до 60%) атипичного течения, когда единственным симптомом инфекции являются вагинальные выделения. Изменения могут проявляться в виде зуда, жжения, эритемы, отечности, единичных или сгруппированных везикул и папул, эрозии и язв, которые разрешаются к 6–12 дню. После отторжения корочек происходит эпителизация пораженных участков без существенных изменений кожи и слизистых оболочек. Иногда в области пузырьков некоторое время сохраняется гиперемия и пигментация [1, 6].
Больные с генитальным герпесом нередко жалуются на плохое общее самочувствие, быструю утомляемость, головные боли, бессонницу, субфебрильную температуру. Эти симптомы максимально выражены в продроме и в первые два дня после появления элементов поражений, и постепенно ослабевают в течение первой недели заболевания.
Средняя продолжительность активного выделения ВПГ из шейки матки и уретры — 5–6 дней от момента появления элементов поражения. В то же время следует иметь в виду, что выделение вируса может происходить достаточно длительно и при отсутствии видимых изменений слизистой оболочки.
Рецидивирующий герпес характеризуется длительным и упорным течением. Постоянные обострения процесса чередуются с периодами ремиссии различной продолжительности. Обострение рецидивирующего герпеса происходит после различного рода внешних воздействий или снижения защитных сил организма.
Частота рецидивов и продолжительность ремиссий весьма вариабельна: от одного раза в два-три года до ежемесячных обострений.
Клиническая картина при рецидивирующем генитальном герпесе напоминает вариант острого его течения. При рецидивах обычно слабее, чем при первичной острой инфекции, выражены экссудативные процессы, более длительно протекает заживление [1, 5, 6].
Многолетнее течение генитального герпеса может обусловить возникновение стойких локальных изменений в виде гиперпигментации кожи и слизистых оболочек. Частые рецидивы генитального герпеса, сопровождающиеся зудом, чувством жжения, болями, наиболее тяжело переносятся больными и нередко приводят к развитию невротических состояний. В зависимости от локализации генитальной герпетической инфекции выделяют следующие уровни герпетического поражения органов малого таза:
- поражение наружных половых органов;
- герпетические кольпиты, цервициты, уретриты, циститы;
- герпетические эндометриты, сальпингоофориты.
Клинические проявления герпетических поражений внутренних половых органов не имеют специфических особенностей по сравнению с воспалительными процессами невирусной этиологии. Больные отмечают боль и чувство тяжести внизу живота и в крестце, умеренные серозные выделения из половых путей. Как первичный, так и рецидивирующий генитальный герпес могут сочетаться с другими видами герпетической инфекции. Однако первичная инфекция во время беременности представляет большую угрозу для жизни самой женщины и плода, поскольку возрастает риск диссеминации ВПГ и развития герпетического энцефалита, гепатита.
Наиболее тяжело протекает генерализованная форма герпетической инфекции, характеризующаяся множественным поражением органов и систем организма.
Анализ наблюдений свидетельствует о том, что генерализованная герпетическая инфекция у женщин развивается преимущественно в III триместре беременности и почти всегда ассоциируется с первичным заражением вирусом простого герпеса. Генерализация инфекции происходит постепенно. Первыми вовлекаются в патологический процесс половые органы, влагалище и шейка матки, являющиеся входными воротами инфекции. В 1/3 случаев первичный очаг локализуется на губах, в полости рта, гортани, иногда на коже [1, 3].
От момента первичного заражения или peaктивации латентной герпетической инфекции до генерализации проходит от одного-двух дней до недели и более. Такая вариабельность сопоставима с основными этапами патогенеза ВПГ-инфекции: миграцией вируса, вирусемией различной продолжительности и интенсивности, поражением кожи или слизистой оболочки. Клиническая картина генерализованного герпеса характеризуется бурным и полиморфным течением. Однако четко можно выделить выраженные симптомы общей интоксикации: лихорадку, озноб, мышечные боли, общую слабость.
Почти всегда первой поражается печень. Развивающийся гепатит (в 80–90% случаев), по-видимому, характеризует классическое течение генерализованного герпеса и требует внимательного отношения при проведении дифференциального диагноза с вирусными гепатитами, холециститом и поражением печени на фоне нефропатии. Редко выявляются клинические признаки миокардита, панкреатита, энцефалита, нефрита [13, 18, 21].
Часто генерализованная герпетическая инфекция во время беременности сопровождается умеренной лейкопенией на фоне нейтрофилеза, тромбоцитопенией, повышением уровня ферментов печени. При отсутствии специфической терапии летальность очень высока (до 70 – 85%).
Герпетическая инфекция у новорожденного может быть проявлением как внутриутробного (врожденная), так и перинатального (интра- и постнатального) инфицирования. В результате анте-, интра- или постнатального инфицирования может развиться генерализованная или локальная форма заболевания, проявляющиеся симптомами поражения ЦНС, глаз, кожи, ротовой полости. Врожденная герпетическая инфекция характеризуется широким полиморфизмом и выявляется при рождении либо в первые 24 – 48 ч жизни новорожденного.
Инкубационный период герпетической инфекции, приобретенной новорожденным во время или после родов, колеблется от 2 до 30 дней [1, 12].
-
Клиническая картина в основном характеризуется синдромными патогномоничными поражениями:
- кожи и слизистых оболочек;
- центральной нервной системы (повышение внутричерепного давления, гипотония, гипорефлексия, апноэ, нарушение терморегуляции, двигательная гиперреактивность, судорожный синдром);
- органов дыхания (цианоз, одышка, пневмония);
- печени (гепатоспленомегалия, желтуха, повышение уровня трансаминаз, прогрессирующая гипербилирубинемия, врожденные пороки развития печени и желчевыводящих путей);
- ДВС-синдромом (кровотечения).
Локализованные поражения кожи, слизистой оболочки глаз или полости рта обычно проявляются на 10 – 11-е сутки после рождения и составляют 20 – 30% всех форм манифестации герпетической инфекции у новорожденных. При локализованной форме болезни имеются единичные или сгруппированные везикулярные высыпания, располагающиеся чаще на коже лица и конечностей. Везикулы быстро вскрываются, и образуются мелкие эрозии. Кроме везикулярных повреждений, может быть пятнистая эритема. Иногда наблюдается повторное появление свежих высыпаний.
Кожные проявления герпетической инфекции у новорожденных обычно протекают благоприятно, однако в ряде случаев (до 20%) наблюдаются неврологические нарушения. При этом клинические признаки поражения ЦНС отчетливо выявляются в более поздние сроки. Поражения глаз проявляются кератоконъюнктивитом и хориоретинитом. Герпетические проявления инфекции в полости рта у недоношенных наблюдаются в три раза чаще, чем у новорожденных, родившихся в срок. При этом в большинстве случаев характерным является поражение слизистой оболочки неба в виде участков поверхностного некроза эпителия, которые преимущественно локализуются на границе твердого и мягкого неба, симметрично с обеих сторон, реже – на небных дужках. Инкубационный период заболевания колеблется от 2 до 12 дней. У некоторых детей герпес в полости рта может проявляться в более поздние сроки — от 10 до 30 дней [8, 19, 22].
Локализованные поражения ЦНС встречаются у 30 – 35% новорожденных, проявляются в основном в 15 – 17-дневном возрасте и характеризуются более высокой летальностью – до 50 – 70%. Сочетание симптомов поражения герпетической инфекцией ЦНС с локализованными формами является неблагоприятным прогностическим признаком.
Особенно тяжело протекает генерализованная герпетическая инфекция у недоношенных детей. Летальность достигает 80 – 95%. При этой форме заболевания выявляются повреждения практически в каждом органе ребенка, однако наиболее выражены они в головном мозге, печени, легких, надпочечниках. Примерно у 60 – 70% детей генерализованная инфекция характеризуется поражением ЦНС.
При анализе клинической картины генерализованной герпетической инфекции и локализованного поражения ЦНС у новорожденных необходимо учитывать тот факт, что 20% из них могут не иметь никаких признаков поражения кожи, а это в значительной степени затрудняет диагностику заболевания.
Таким образом, у беременных с герпетической инфекцией должен быть предусмотрен комплекс диагностических, профилактических и лечебных мероприятий, направленных на исключение или уменьшение случаев возникновения врожденной внутриутробной инфекции, что должно быть обязательным условием создания эффективной системы профилактики и охраны здоровья матери и ребенка.
Рассмотрена проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода, факторы риска внутриутробных инфекций, патогенетические механизмы возникновения, развития и воздействия ВУИ, подходы к диагностике и лечению.
The issue of fetal intrauterine infecting and intrauterine infection (IUI) was considered, as well as the risk factors of intrauterine infections, pathogenic mechanisms of their occurrence, development and effect of IUI, and approaches to the diagnostics and treatment.
Проблема внутриутробной инфекции особо актуальна в современных условиях в связи с распространенностью и тяжестью воспалительных процессов. Проблема внутриутробного инфицирования и внутриутробной инфекции (ВУИ) плода является одной из ведущих в акушерской практике и в перинатологии в связи с высоким уровнем инфицирования беременных, рожениц и родильниц, опасностью нарушения развития плода и рождения больного ребенка. Наличие инфекции у матери является фактором риска ВУИ плода, но не всегда означает его заболевание [1, 5–7, 13].
Внутриутробная инфекция — группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые вызываются различными возбудителями, но характеризуются сходными эпидемиологическими параметрами и нередко имеют однотипные клинические проявления. Заболевания развиваются в результате внутриутробного (анте- и/или интранатального) инфицирования плода. При этом в подавляющем большинстве случаев источником инфекции для плода является мать. Истинная частота врожденных инфекций до настоящего времени не установлена, но, по данным ряда авторов, распространенность данной патологии в человеческой популяции может достигать 10%. В структуре перинатальной смертности ВУИ составляет более 30% [1, 5–7].
Кроме этого, ВУИ относятся к тяжелым заболеваниям и во многом определяют уровень младенческой смертности.
Согласно данным многих авторов, причиной внезапной смерти грудных детей является инфекционное заболевание, протекающее без ясной симптоматики. В числе причин или фоновых состояний скоропостижной смерти могут быть ВУИ [2].
Под внутриутробным инфицированием понимают процесс внутриутробного проникновения микроорганизмов к плоду, при котором отсутствуют признаки инфекционной болезни плода. Как правило, инфекционный процесс затрагивает плаценту, в которой развивается плацентит, хориоамнионит и т. д. Диагноз внутриутробного инфицирования у новорожденного устанавливается на основании выделения возбудителя из клеток крови, ликвора и других источников, выявления IgM и низкоавидных IgG в пуповинной крови, а также при морфологическом исследовании плаценты [1, 5–7].
Внутриутробное инфицирование не означает неизбежного развития инфекционного заболевания. Для выявления ВУИ необходимо наличие данных лабораторного исследования в сочетании с клинической картиной инфекционного заболевания. Под ВУИ подразумевают не только процесс распространения инфекционных агентов в организме плода, но и вызванные ими морфофункциональные нарушения различных органов и систем, характерные для инфекционной болезни (сепсис, пневмония, менингит, гепатит и т. д.), возникшей анте- или интранатально и выявляемой пренатально или после рождения [10, 11].
Инфекционно-воспалительные заболевания во время беременности имеют особенности: инфицирование плода и новорожденного может быть вызвано как острой инфекцией матери, так и активацией хронической, персистирующей инфекции во время беременности; большая часть заболеваний беременных, приводящих к внутриматочной инфекции, протекает в латентной или субклинической форме; активация персистирующей инфекции возможна при любом нарушении гомеостаза в организме беременной (стресс, острые респираторные вирусные инфекции, переохлаждение и др.) [1, 2].
Возможный спектр возбудителей внутриутробной инфекции весьма разнообразен и широк. Это бактерии (грамположительные и грамотрицательные; аэробные и анаэробные), грибы, простейшие, внутриклеточные микроорганизмы (микоплазмы, хламидии), вирусы. Чаще всего наблюдается сочетание возбудителей — бактериально-вирусная смешанная инфекция [3, 4, 10, 11].
Зачастую ВУИ ассоциируются с наличием инфекций TORCH — то есть синдромом комплекса. Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых врожденных инфекций: T — токсоплазмоз (Тoxoplasmоsis), R — краснуха (Rubella), С — цитомегалия (Cytomegalia), Н — герпес (Herpes) и О — другие инфекции (Оther). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекцию, микоплазмоз и др. [9, 11].
Принимая во внимание, что источником инфекции для плода всегда является его мать, особое значение приобретают следующие факторы риска внутриутробных инфекций:
- хронические очаги инфекции в организме матери (в том числе наличие воспалительных заболеваний органов малого таза, урогенитальные инфекции);
- первичное инфицирование во время беременности, активация инфекционного процесса;
- патологическое снижение общего и местного иммунитета;
- наличие экстрагенитальной патологии (анемия, тромбофилии, аутоиммунные заболевания);
- повышение проницаемости плацентарного барьера во II и III триместрах беременности при невынашивании беременности и плацентарной недостаточности;
- отягощенный акушерско-гинекологический диагноз;
- неблагоприятные социально-бытовые факторы [1, 9, 11].
Патогенетические механизмы возникновения, развития и воздействия ВУИ разнообразны и зависят от многих факторов:
- срока беременности, при котором происходит инфицирование (чем раньше, тем прогноз будет более неблагоприятным);
- вида возбудителя, его вирулентности, массивности обсеменения;
- первичности или вторичности инфекционного процесса у беременной;
- путей проникновения инфекции к плоду (восходящий, нисходящий, гематогенный);
- степени распространенности и интенсивности воспалительного процесса;
- состояния организма матери, его иммунологической толерантности.
Влияние инфекции на эмбрион и плод заключается в воздействии комплекса следующих факторов:
- патологическое воздействие микроорганизмов и их токсинов (инфекционное заболевание, гипоксия плода, задержка развития плода);
- нарушение процесса имплантации и плацентации (низкая плацентация, предлежание плаценты);
- снижение метаболических процессов и иммунологической защиты плода [1, 9, 11].
Таким образом, реализуется ли внутриутробное инфицирование в ВУИ или нет, зависит от ряда факторов, которые мы представили выше.
Учитывая неспецифичность клинических проявлений ВУИ во время беременности, диагностика данной патологии в большинстве случаев затруднена и возможна лишь в результате сочетания клинических и лабораторно-диагностических методов обследования.
Клинический метод исследования позволяет выявить различные осложнения гестационного периода, такие как невынашивание беременности и синдром задержки роста плода (СЗРП). Кроме этого, немаловажное значение имеет наличие проявлений инфекции у матери (отит, гайморит, пиелонефрит, цистит и т. д.).
Методы, позволяющие оценить состояние фетоплацентарной системы:
- эхография (плацентометрия, поведенческая активность плода, его тонус, количество околоплодных вод, степень зрелости плаценты);
- допплерография (МПК, ФПК);
- кардиотокография (КТГ).
Микробиологические и серологические исследования:
- микроскопия влагалищных мазков (повышенное содержание лейкоцитов, кокковая флора, признаки дисбиоза, грибковая флора);
- бактериальный посев (наличие анаэробных и аэробных бактерий, грибковой флоры);
- ПЦР-диагностика (геномы ВПГ-1, ВПГ-2, ЦМВ, микоплазмы, уреаплазмы, хламидии);
- иммуноферментный анализ (ИФА): обнаружение в сыворотке специфических антител к возбудителям (IgM, IgG, IgA) в диагностически значимых титрах.
Исследование хориона (биопсия хориона): бактериологический метод, ПЦР-диагностика.
Исследование околоплодных вод (амниоцентез): бактериологический метод, ПЦР-диагностика.
Исследование пуповинной крови плода (кордоцентез): бактериологический метод, ПЦР-диагностика и специфический иммунный ответ (IgM) плода.
Морфологическое исследование плаценты, данные аутопсии.
Предположительный диагноз внутриутробного инфицирования и ВУИ помогают поставить косвенные методы:
- наличие у матери клиники инфекционного заболевания;
- наличие специфического иммунного ответа;
- результаты УЗИ, допплерометрии, КТГ.
К прямым методам диагностики внутриутробного инфицирования и ВУИ относятся: выявление возбудителя в материале, полученном при биопсии хориона, амниоцентезе (ПЦР, бактериологический метод), кордоцентезе (ПЦР, бактериологический метод и определение уровня специфических IgM).
Характер течения беременности при внутриутробной инфекции зависит от срока воздействия возбудителя.
На ранних этапах зародыша (1–3 недели беременности) из-за отсутствия механизмов взаимодействия инфекционного агента и плодного яйца реализации воспалительной реакции чаще всего не происходит. Контакт с инфекцией может закончиться альтернативным процессом и гибелью плодного яйца. Повреждение эмбриона инфекцией на 4–12 неделях беременности связано с вирусной инфекцией, проникновением микроорганизмов через хорион. Плод еще не имеет защитных механизмов. Нарушение закладки органов и систем вызывает тератогенный и эмбриотоксический эффект [13, 15].
В I триместре беременности специфических клинических признаков наличия ВУИ нет, косвенно о ней свидетельствуют некоторые эхографические признаки:
- повышенный локальный тонус матки;
- отслойка хориона;
- изменение формы плодного яйца (деформация);
- прогрессирование истмико-цервикальной недостаточности (функционального характера);
- гипоплазия хориона;
- увеличение или персистенция желточного мешка;
- несоответствие размеров эмбриона размерам полости плодного яйца (увеличение, уменьшение);
- отсутствие редукции хорионической полости.
Инфекционные фетопатии возникают с 16-й недели, когда происходит генерализация инфекции у плода. Могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [12–15].
В III триместре плод реагирует на внедрение возбудителя локальной реакцией. Могут возникнуть энцефалит, гепатит, пневмония, интерстициальный нефрит. Влияние вирусов чаще всего проявляется признаками незрелости, дисэмбриогенетическими стигмами, затяжным адаптационным периодом, значительной потерей массы тела в раннем постнатальном периоде. Данные эхографии во II и III триместрах беременности, указывающие на развитие инфекции у плода:
- СЗРП;
- гипоксия плода;
- фетоплацентарная недостаточность;
- многоводие или маловодие;
- неиммунная водянка плода;
- увеличение или уменьшение толщины плаценты, наличие патологических включений;
- контрастирование базальной мембраны;
- наличие взвеси в околоплодных водах;
- кальцификаты в печени и селезенке и головном мозге плода;
- поликистоз легких, почек плода;
- эхогенные фиброзные включения на папиллярных мышцах и створках клапанов сердца плода;
- расширение петель кишечника плода (гипоксия, энтерит) [12–15].
После верификации диагноза ВУИ лечебные мероприятии проводят с помощью этиотропной, антимикробной терапии: препараты пенициллинового ряда и макролиды. Целесообразность назначения антимикробных препаратов не вызывает сомнения, если ВУИ обусловлено наличием патогенных возбудителей (бледная спирохета, токсоплазма, хламидии, гонококк и т. д.) [8, 14].
В настоящее время одним из наиболее дискутабельных вопросов в акушерстве является выяснение истинной этиологической роли генитальных микоплазм (Mycoplasma hominis, Mycoplasma genitalis, Ureaplasma urealyticum) в развитии патологии матери и плода. Инфицирование плода генитальными микоплазмами происходит преимущественно интранатально: в 18–55% — у доношенных новорожденных и в 29–55% — у недоношенных [3, 16, 20].
Актуальность проблемы урогенитального микоплазмоза обусловлена не только значительным распространением этой инфекции в популяции, но и неоднозначностью ее оценки как эпидемиологами, так и клиницистами [16].
По данным различных исследователей, микоплазмы являются возможной причиной развития конъюнктивитов, врожденных пневмоний, респираторного дистресс-синдрома, хронических заболеваний легких, менингита и неонатального сепсиса. Вопрос о терапии микоплазменной инфекции до настоящего времени остается открытым. В схемах терапии предусматривается 7–10-дневные курсы макролидов [1, 3, 21, 22].
Во время беременности противовирусная терапия при генитальном герпесе, цитомегаловирусной инфекции, вирусе ветряной оспы проводится с помощью этиотропных препаратов (ацикловир) начиная со II триместра гестационного периода. Целью лечения является профилактика рецидивирования и антенатального инфицирования [14, 17, 19].
Трихомонадная инфекция относится к группе негонококковых воспалительных заболеваний мочеполовых органов. Лечение трихомониаза во время беременности осуществляется с помощью метронидазол-содержащих препаратов начиная со II триместра гестационного периода [8].
Появление новых методов диагностики, разработка и внедрение новых лекарственных средств не изменяют ситуацию с внутриутробными инфекциями, оставляя это по-прежнему актуальной проблемой в акушерстве. Все это обуславливает неуклонный рост инфекции в человеческой популяции, высокий процент рецидивов инфекции даже у пациентов, получавших курс антибиотикотерапии в соответствии с действующими инструкциями и схемами лечения. Проблема осложняется тем, что в настоящее время отсутствует единая концепция механизма рецидивирования, недостаточно изучена роль микст-инфекции в возникновении, течении и персистировании инфекции, не учитываются особенности гормонального и иммунного статуса больного, не сформированы диагностические критерии контроля излеченности патологического процесса. Это все вместе взятое является стимулом для продолжения исследований, направленных на решение данных проблем. Несмотря на то что роль вирусных и бактериальных инфекций в этиологии и патогенезе многих патологических процессов не вызывает сомнений, вопрос о значении инфекций в качестве моновозбудителя на сегодняшний день окончательно не решен. Актуальным по-прежнему остается вопрос разработки алгоритма лабораторной диагностики заболеваний.
Только совершенствование диагностических подходов, разработка оптимальных алгоритмов и методов обследования и предупреждение распространения резистентных штаммов путем адекватного отношения к каждому пациенту индивидуально (обязательное проведение посевов на определение чувствительности к антибиотикам до назначения терапии) может изменить данную ситуацию.
Исследование выполнено за счет гранта Российского научного фонда (проект № 15-15-00109).
Литература
В. Н. Кузьмин 1 , доктор медицинских наук, профессор
К. Н. Арсланян, кандидат медицинских наук
Э. И. Харченко, кандидат медицинских наук
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Читайте также:

