Что за вирус прион
Обновлено: 22.04.2024
С появлением Интернета и свободных СМИ, люди стали узнавать всё больше о смертельных заболеваниях — инфекционных, вирусных, онкологических и наследственных. Но мало кто слышал о фатальных прионных болезнях. Несмотря на клинические испытания, на данный момент не существует ни одного доказанного универсального лечения этой группы заболеваний. Невролог Ричард Джонсон из Университета Джона Хопкинса говорит, что если прионы пациента превратились в патологические, он умирает, и мы не можем этого избежать.
Что такое прионная болезнь
Прионные заболевания — они же называются трансмиссивными губчатыми энцефалопатиями — представляют собой семейство редких прогрессирующих нейродегенеративных заболеваний, которые поражают как людей, так и животных. Их отличают:
- длительный инкубационный период;
- характерные губчатые разрыхления мозговой ткани, связанные с потерей нейронов;
- неспособность иммунной системы отреагировать на заражение, инициируя воспалительный процесс.
Прионные болезни поражают как людей, так и животных, быстро прогрессируют и всегда приводят к летальному исходу.
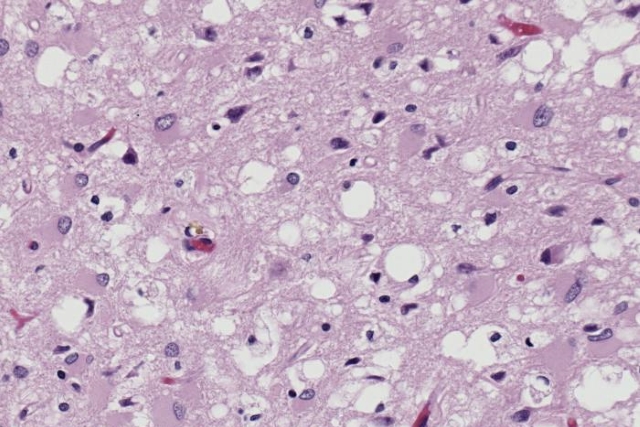
Возбудитель болезни — прионы — тип белков с аномальной третичной структурой, не содержащий нуклеиновых кислот. Сам термин относится к патологическим патогенным агентам, которые способны вызывать аномальное сворачивание специфических нормальных клеточных белков, которые называются как раз прионными белками, встречающихся чаще всего в мозге. Функции этих нормальных прионных белков до сих пор полностью не изучены.
Болезнь Крейтцфельдта – Якоба — БКЯ, псевдосклероз спастический, синдром кортико-стриоспинальной дегенерации, трансмиссивная спонгиоформная энцефалопатия, коровье бешенство.
Это прогрессирующее дистрофическое заболевание коры большого мозга, базальных ганглиев и спинного мозга. Считается основным проявлением губчатой энцефалопатии (прионной болезни). Излечение невозможно. БКЯ поражает людей всех национальностей и рас, мужчин и женщин, взрослых и детей.
Прионные белки — нормальные белки, которые присутствуют у каждого человека. Но есть определённые группы людей, у которых присутствует генетическая мутация, предрасполагающая их к синтезу патогенного прионного белка. Прионные болезни также могут передаваться путём прямого заражения, передача может произойти и в ходе хирургических манипуляций, использования человеческого гормона роста или употреблении заражённого мяса. Такой вид заражения называется ятрогенным и он остаётся в процентном меньшинстве относительно иных форм БКЯ.
Процентное соотношение ятрогенных случаев болезни Крейтцфельдта – Якоба в исследовании National CJD Research & Surveillance Unit у 177 пациентов.
- Гормон роста (соматотропин) — 53,1% (94 случая).
- Твердая мозговая оболочка (в том числе поедание) — 38,9% (69 случаев).
- Гонадотропный гормон — 2,25% (4 случая).
- Нейрохирургический инструментарий — 2,25% (4 случая).
- Пересадка роговицы — 1,69% (3 случая).
- Электроды для стереоэлектроэнцефалографии — 1,12% (2 случая).
- Пересадка печени — 0,56% (1 случай).
Есть случаи заражения, которые не классифицируются ни по одной из двух вышеупомянутых причин, в таком случае они считаются спорадическими, то есть возникшими спонтанно и самостийно, по независящим от генетики или внешних факторов обстоятельствам.
Доктор Ойбек Тургунхужаев, руководитель направления нейрореабилитации Междисциплинарного центра реабилитации (Москва), говорит, что окончательный диагноз человеку с подозрением на какое-либо прионное заболевание основывается на оценке клинических признаков и симптомов и ряде вспомогательных исследований. Долгое время единственным методом подтверждения диагноза была электроэнцефалография. Но поскольку общая чувствительность этого метода ограничена, полезность этого исследования была поставлена под сомнение.
Почему в России не ставят этот диагноз
Прионные заболевания неизлечимы, они неизбежно фатальны. Кроме этого, проблема заключается в том, что для постановки достоверного диагноза необходимо проводить вскрытие. Любое вскрытие — это риск для патологоанатома, так как были случаи ятрогенного заражения специалистов от умерших пациентов.
По приказу Роспотребнадзора, о том, что человек заболел прионной болезнью необходимо извещать в течение двух часов. При этом установление такого диагноза ведет за собой, по российским инструкциям, утилизацию всего оборудования, с которым пациент был в контакте. Именно поэтому, когда Медуза рассказывала случай одной из больных БКЯ, все клиники говорили о том, что у них нет оборудования для наблюдениях таких пациентов. На самом деле — это просто способ не потерять миллионы рублей, утилизируя даже аппарат МРТ. Если бы речь шла о сотнях поставленных диагнозов прионной болезни (например, в США регистрируется 300 случаев ежегодно, возможно, их больше), тогда речь шла бы о потери миллиардов рублей для российских больниц и бюджета. Именно поэтому официально диагноз не ставится, врачи не хотят об этом говорить, так как никакого официального распоряжения не существует, что диагноз ставить нельзя. В итоге выходит, что заболевание есть, смерти есть, а причины для родственников и умирающих людей — нет.
Им никто не скажет, что скорее всего родственники уже заразились. Никто не скажет, что нельзя пробовать сырой фарш или есть сырое мясо, тем более мозги. Также как из-за того, что диагноз не ставится, можно случайно пересадить орган больного прионной болезнью, тем самым заразив другого человека. Также это может произойти через хирургический инструмент (такие случае были, об этом ниже).
Когда мы просили хоть кого-то рассказать нам о прионных болезнях, практически никто не готов был говорить открыто. Так мы анонимно поговорили с врачом-неврологом одной из крупнейших московских больниц. «С прионами две проблемы. Во-первых, для постановки достоверного диагноза необходимо проводить вскрытие. Хотя формально (по российским руководствам, например) проводить вскрытие можно, хотя и в особенных условиях. Любое вскрытие — это, естественно, дополнительный риск для патологоанатомов, потому что были описаны случаи заражения патологоанатомов от умерших пациентов. никто не хочет переводить на них риск.
Во-вторых, так как прионные инфекции — это тяжело протекающие, неизлечимые заболевания (хотя и с довольно сложным путем передачи), в нашей стране чертовски сложные законы для регистрации и ведения таких пациентов; о случаях обязаны сообщать в случае выявления чуть ли не в течение двух часов, после постановки диагноза необходимо проводить уничтожение части в том числе дорогостоящего оборудования, которое, как может оказаться по факту, даже рядом не лежало с пациентом, нужно переоформлять документы и так далее.
Болезнь Крейтцфельда – Якоба
Болезнь Крейтцфельда – Якоба (БКЯ) является одной из разновидностей прионных болезней. Это быстро прогрессирующее, фатальное нейродегенеративное заболевание, которое, как полагают, вызвано аномальной изоформой прионного белка. БКЯ встречается во всем мире, и согласно статистике, во всем мире заболевает 1 из миллиона человек.
Прионные болезни не идут по одному и тому же сценарию, у людей, страдающих одним и тем же прионным поражением могут разниться эпидемиология и патогенез. Болезнь Крейтцфельда-Якоба делят на несколько типов.
Спорадическая форма — заболеть от мутации, кашляя, испытывая головную боль и провалы в памяти
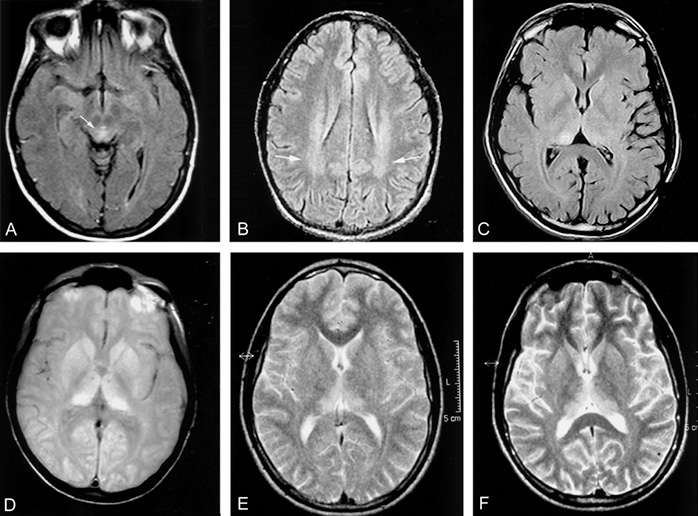
Первые симптомы сБКЯ обычно неспецифические: головная боль, недомогание, кашель, головокружение и изменение поведения, настроения или провалы в памяти. Для подтверждения диагноза должно пройти время, чтобы появились и иные основания полагать прионную природу. Классическими клиническими признаками с БКЯ являются:
- быстрое снижение когнитивных способностей;
- атаксия (нарушение согласованности движения различных мышц);
- миоклонус (быстрые внезапные сокращения отдельных мышц), оканчивающиеся акинетическим мутизмом (торможение всех двигательных функций, кроме фиксирующих движений глазных яблок).
Окончательный диагноз зависит от оценки клинических проявлений и результатов лабораторных тестов.
Акинетический мутизм — состояние при котором пациенты перестают двигаться и следить глазами за целью, за исключением реакции глаз на раздражители или длительной фиксации взгляда, их мышцы самостоятельно или под воздействием внешних факторов периодически быстро сокращаются. Пациенты страдают недержанием, не издают никаких звуков или только нечленораздельные шумы. Если глотание сохраняется, пациенты могут прожить в этом состоянии в течение нескольких недель, даже годы при иных благоприятных факторов, получая питание внутривенно или через трубку. При спорадической форме БКЯ, пациенты доходят до этого состояния в течение первых недель заболевания. Всамых стремительных сценариях, 10% пациентов доходят до этого состояния за год.
Долгое время самым информативным способом постановки диагноза было проведение диффузионно-тензорной МРТ. Этот способ является наиболее доступным, относительно неинвазивным и действенен при ранних изменениях в коре головного мозга. СБКЯ можно обнаружить через маркеры в назальных слизистых оболочках, спинномозговой жидкости, моче или крови, но эти тесты часто дают ложноположительные результаты — белок 14.3.3 не является специфичным без появления сопутствующей клинической картины. Протеинограмма является новым оптимальным методом диагностирования сБКЯ, так как она самая чувствительная из всех вышеназванных.
Белки 14-3-3 — семейство регуляторных молекул, встречающихся у всех эукариот. Они связываются со множеством других белков, регулируя их функции и тем самым влияя на множество процессов, в том числе регулировку клеточного цикла, контроль метаболизма, апоптоз, контроль транскрипции генов. Они были обнаружены более 40 лет назад при систематической классификации белков нервной ткани, где их содержание превышает 1% от всех белков. К настоящему времени описано более 300 различных белков-мишеней, способных взаимодействовать с 14-3-3.
Протеинограмма — исследование, изучающее количественное соотношение разновидностей белка в крови. В понятие общего белка входят все возможные белки, несмотря на их различия в строении и функциях.
Наследственная форма болезни Крейтцфельда – Якоба и также связанная с генетическими мутациями фатальная семейная бессонница составляют всего 10% от всех случаев прионных болезней. Множество исследований указывает на то, что общий путь в патогенезе заболевания может быть общим как для спорадических, так и для наследственных форм прионного заболевания, за исключением того, что в первом случае превращение белка происходит без участия каких-либо факторов, а не предопределено наличием мутации в генах.
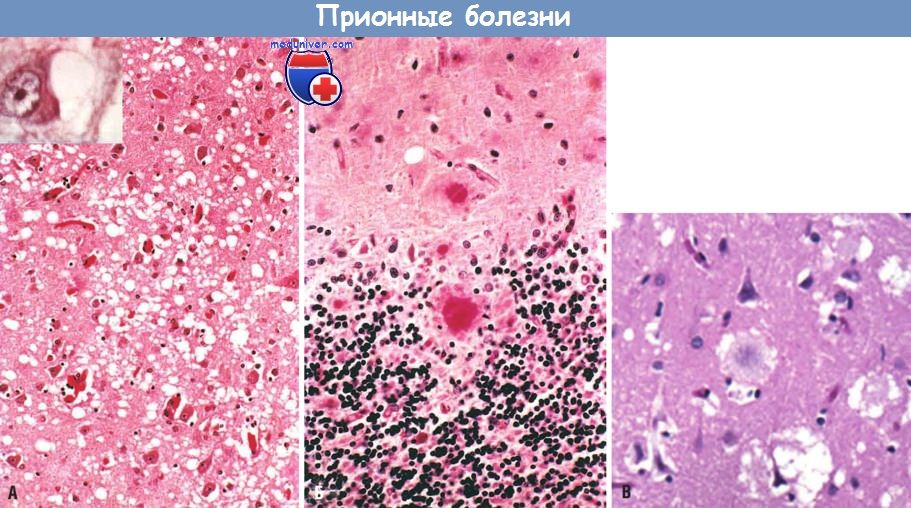
(А) Губкообразная дегенерация в коре больших полушарий. Врезка: нейроны, содержащие вакуоли. (Б) Кора мозжечка с бляшками куру (PAS-реакция), которые состоят из агрегатов PrPsc. ( В) Бляшки в корковом веществе, окруженные зоной губкообразной дегенерации, при новом варианте болезни Крейтцфельда-Якоба.
Фенотип — совокупность характеристик, присущих на определённой стадии развития болезни. Фенотип формируется на основе генотипа.
Полиморфизм — способность некоторых организмов существовать в состояниях с различной внутренней структурой или в разных внешних формах.
При наследственном прионном заболевании, фенотип заболевания будет определяться комбинированным эффектом патогенных мутаций, полиморфизма кодонов 129 и типа PrPSc. Полиморфизм кодона 129 играет двойную роль в прогнозировании исхода заболевания. Главным в понимании патогенеза прионной болезни является детальное и точное знание процессов и условий in vivo для образования PrPSc, которые неизбежно приводят к развитию и выражению заболевания. Эти знания позволят разработать рациональную и эффективную стратегию терапевтического вмешательства.
Новый вариант БКЯ — заразиться, съев кусок мяса
Новый вариант болезни Крейтцфельда – Якоба (nvCJD) был впервые идентифицирован в 1996 году. Последующие исследования подтвердили гипотезу, что эта форма связана с бычьей губчатой энцефалопатией. Скорее всего, пациенты употребляли в пищу мясо, содержащее патологические прионы мозга коров.
В отличии от спорадической формы, болезнь не имеет четкого возраста заражения. У пациентов с нБКЯ часто выявляют и психиатрические симптомы, потому порой она ошибочно диагностируется как психическое, а не неврологическое расстройство. Истинная причина психиатрических симптомов кроется в когнитивных нарушениях, постоянных болях в конечностях, нарушениях адекватности ощущений (парестезия или дизестезия), расстройствах речи или зрения.
В течение 6–8 месяцев развиваются пороки управления мышечной системой, но в некоторых случаях развитие болезни может длиться и более 18 месяцев. Потому этот диагноз достаточно трудно поставить при появлении первых признаков заболевания. Если у пациента возникают неконтролируемые движения, возрастает вероятность грамотного диагностирования нБКЯ. В отличие от спорадической формы, где характерны внезапные мышечные спазмы при напряжении (миоклонус), в случае с новой формой возможны и дистония (синдром, при котором происходит постоянное спазматическое сокращение мышц), и хорея (синдром, характеризующийся беспорядочными, отрывистыми, нерегулярными движениями).
Летальная стадия новой формы похожа на летальную стадию спорадической формы болезни Крейтцфельда-Якоба, она проходит с прогрессирующей потерей контроля над мышцами, часто приводящей к состоянию акинетического мутизма.
Деменция и БКЯ: кто-то болен и даже не знает об этом
Как правило, спорадическая форма БКЯ представлена совокупностью деменции и нейродегенеративных или психиатрические симптомов. У таких больных распространены пирамидная, мозжечковая и фокальная кортикальная дисфункция. У трети пациентов деменции предшествуют жалобы на усталость, головную боль, нарушение сна, недомогание, потерю веса, боль, депрессию или изменения в поведении.
Неврологические симптомы, включая атаксию, дизестезию, слабоумие или мышечные расстройства (хорея, миоклонус или дистония) появляются позже. Большинство случаев быстро прогрессирующей деменции без других сопутствующих симптомов случается у пожилых людей из-за метаболических нарушений или острых инфекций (пневмонии или инфекции мочевыводящих путей). Потому перед прохождением лабораторных тестов врачи первостепенно указывают быстро прогрессирующую деменцию без явного диагноза. Окончательный вердикт будет зависеть от полученных результатов анализов и обследований, заболевания будут отличаться в зависимости от клинической картины. ЭЭГ может помочь исключить судорожную активность головного мозга и обратиться к диагностике других состояний, таких как БКЯ.
Быстро прогрессирующая деменция представляют собой одну из самых сложных неврологических проблем. Дифференциальная диагностика широко используется для подтверждения окончательных диагнозов, которые могут относиться к нейродегенеративным, аутоиммунным, инфекционным и опухолевым заболеваниям. Даже при таком тщательном подходе к обследованию пациентов, небольшой процент случаев диагностируются уже после смерти.
Фатальная семейная бессоница
Фатальная семейная бессонница — это редкое прионное заболевание, которое в буквальном смысле лишает сна и приводит к снижению всех нейро-двигательных и психических функций. Можно выделить две формы этой болезни: генетическую и спорадическую.
Генетическая форма связана с мутацией, приводящей к превращению белка PrP в прионный белок. Спорадическая же появляется спонтанно, без каких-либо предпосылок. Это заболевание отличается от других прионных заболеваний областью поражения — превращение прионных белков в патологические преимущественно происходит в одном отделе головного мозга — таламусе, который, в том числе, отвечает и за сон.
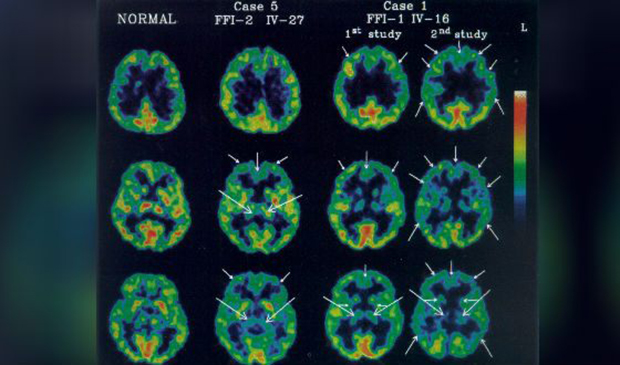
Диагноз фатальной семейной бессонницы в генетической форме подтверждается генетическим тестированием. В случае со спорадическими случаями, могут обнаружить нарушения в структуре сна и аномалии в таламусе полисомнография и позитронно-эмиссионная томография (ПЭТ). Средняя продолжительность жизни с начала первых симптомов заболевания — 3 года, лечения не существует.
Медленно прогрессирующая деменция: симптомы в течение нескольких лет
Синдром Герстманна-Штраусслера-Шейнкера — это редкая генетическая форма трансмиссивной губчатой энцефалопатии, которая впервые была описана австрийскими неврологами в 1936 году. Синдром чаще всего проявляется в возрасте 40–50 лет, и вызван мутациями генов прионного белка PRNP на 20 хромосоме.
Клиническая картина синдром схожа со спорадической формой БКЯ, но он отличается продолжительностью и медленно прогрессирующей деменцией наряду с иными симптомами. Синдром Герстманна-Штраусслера-Шейнкера может длиться как нескольких месяцев так и несколько лет, средняя продолжительность жизни — 5 лет. Диагностировать заболевание можно даже на ранних стадиях посредством проведения магнитно-резонансной томографии. На МРТ будут наблюдаться губчатые изменения в коре и разрастание глиальных клеток.
Глиальные клетки или нейроглия — совокупность вспомогательных клеток нервной ткани. Составляет около 40 % объёма ЦНС. Количество глиальных клеток в мозге примерно равно количеству нейронов.
Глиальные клетки имеют общие функции и, частично, происхождение (исключение — микроглия). Они составляют специфическое микроокружение для нейронов, обеспечивая условия для генерации и передачи нервных импульсов, а также осуществляя часть метаболических процессов самого нейрона.
Обнаруживать прионную болезнь достаточно трудозатратно, учитывая то, что если диагноз подтвержден, пациенту уже ничем не помочь, а больницы теряют миллионы рублей. И самое жуткое, что все люди на Земле в группе риска. Прионы не пощадят никого. Поэтому не пробуйте фарш, после того, как его посолили. Не ешьте потроха и мозги коров и свиней, и посещайте врача вовремя. В конце концов, МРТ врать не будет.
Прионы составляют отдельный класс инфекционных агентов; они имеют белковую основу и не содержат генома, состоящего из нуклеиновых кислот. Концепция существования прионов включает в себя идею о новой, белковой наследственности — измененных формах белков в организме-хозяине, которые при переносе в новый организм могут вызвать в получателе изменение фенотипа. Большинство прионов являются патогенами, но по сравнению с другими классами патогенов (например, вирусами, бактериями, грибами, паразитами) они уникальны тем, что распространяются внутри и между хозяевами без переноса или репликации собственных ДНК или РНК.
История исследований
Прототипом прионной болезни было трансмиссивное нейродегенеративное заболевание овец — таинственная смертоносная скрейпи (или почесуха овец). Ранние исследования показали, что агент скрейпи необычайно устойчив к лечению, которое нейтрализует другие патогены, и может годами оставаться на пастбищах. То, что агент скрейпи проявляет устойчивость, в частности, к радиации, привело к тому, что в 1960-х годах Дж. С. Гриффит и Тиквах Альпер предположили, что он представляет собой новый класс патогенов, который не имеет собственного нуклеинового генома и может быть аномальной самовоспроизводящейся формой белка или мембраны. Между тем описания патологии мозга, вызванной человеческой болезнью куру в Папуа — Новой Гвинее, которые выполнил Карлтон Гайдушек, привели Уильяма Хэдлоу к мысли, что куру похожа на скрейпи овец, и Хэдлоу порекомендовал, чтобы куру испытали на передаваемость от людей к другим приматам. Гайдушек успешно проделал эту работу и показал, что люди племени форе заболевали куру во время ритуальных каннибалистских праздников. Яркой особенностью куру и других прионных заболеваний, часто скрывавшей их причины, является длительный инкубационный период между заражением и появлением клинических признаков, который у людей может превышать четыре десятилетия.
Моя лаборатория в сотрудничестве с Питером Лэнсбери показала, что связанные с заболеваниями формы PrP сами могут вызвать трансформацию нормальных молекул PrP в аномальные формы. В этих реакциях превращения мы выявили поразительные биохимические особенности, которые помогли объяснить характеристики известных штаммов прионов и барьеры их передачи между разными видами. Однако, чтобы однозначно доказать, что прионы состоят из повторно свернутых агрегатов PrP и им не нужны специфически-прионные нуклеиновые кислоты, потребовалось разработать методы непрерывной бесклеточной амплификации прионов или реакции образования прионов de novo. Они первоначально были созданы лабораториями Сото, Супаттапоне и Прузинера в 2000-х годах; до того времени было трудно полностью исключить вероятность того, что эти заболевания вызваны неопознанными вирусами.
Методы исследования
К сожалению, многие из стандартных методов, на которых долгое время базировались исследования обычных патогенов, — генетика патогенов, серология, рентгеноструктурный анализ, спектроскопия ядерного магнитного резонанса (ЯМР) — чрезвычайно трудно применить к прионам. Без каких-либо специфических патогенных генов, которые можно было бы секвенировать или подвергнуть мутации, многие стандартные генетические и обратные генетические подходы к выявлению структуры и функции патогенов не работают. Поскольку прионы состоят из белков организма-хозяина, иммунный ответ хозяина на патоген очень мал; таким образом, провести простое серологическое обнаружение прионных инфекций, основанное на взаимодействии с антителами, очень сложно. Кроме того, прионы млекопитающих, как правило, плотно упакованы, сильно гликозилированы и связаны с другими молекулами организма-хозяина, и поэтому даже специфические прионные конформационные эпитопы (поверхности, распознаваемые антителами) на агрегатах PrP трудно обнаружить и использовать. Все попытки определить трехмерные структуры прионов на протяжении уже долгого времени заходят в тупик, так как очищенные прионы имеют агрегированный, но некристаллический характер.
В течение многих лет единственным способом обнаружения и анализа прионов млекопитающих был биоанализ животных, который даже на самых быстрых моделях — грызунах — длился от нескольких месяцев до одного года. В конкретном организме разные штаммы обычно можно различить по периодам инкубации, невропатологическим паттернам и биохимическим признакам связанных с болезнью отложений PrP или прионов.
К счастью, в последнее время были разработаны мощные бесклеточные амплификационные анализы прионов, такие как циклическая амплификация прионной формы белка (PMCA), вибрационно-индуцированный конверсионный анализ в режиме реального времени (RT-QuIC) и анализ клеток скрейпи. Эти методы основаны на присущем прионам механизме репликации. И PMCA, и RT-QuIC чрезвычайно чувствительны: они могут усилить присутствие прионов в триллион раз, почти до точки обнаружения нескольких прионных частиц. Реакции PMCA распространяют инфекцию прионов, тем самым отражая и освещая многие аспекты прионной биологии, в то время как анализы RT-QuIC, как правило, не распространяют полностью инфекционные прионы, но обеспечивают более быстрые, более практичные и более высокопроизводительные методы их обнаружения, и, таким образом, они стали самыми современными инструментами в диагностике прионных заболеваний. Как PMCA, так и RT-QuIC в некоторых случаях помогают различать важные штаммы прионов у определенных видов организмов-хозяев.
В выявлении базовой структуры прионов наблюдается медленный прогресс. При помощи полупроводниковых ЯМР-исследований была обнаружена молекулярная архитектура некоторых прионов грибов и прионоподобных фибриллярных структур PrP млекопитающих. Электронная кристаллография, дифракция волокон и криоэлектронные микроскопические исследования помогли описать ключевые структурные ограничения прионов млекопитающих, но применение этих и, возможно, других структурных биологических методов еще нужно улучшить.
Структура и воспроизведение прионов
Разобраться в структуре и механизмах репликации прионов млекопитающих, по крайней мере на молекулярном уровне, крайне сложно. Сначала нужно объяснить, как неправильно свернутые белки могут распространяться в роли патогенов, не перенося своего собственного нуклеинового генома. Затем следует также объяснить, как белки с единой последовательностью аминокислот, такие как PrP того или иного животного-хозяина, могут образовывать разные штаммы прионов, которые исправно распространяются и вызывают различные фенотипы болезни без генетических мутаций, объясняющих вариации штаммов в обычных патогенах.
Множество исследований указывает на то, что прионы млекопитающих — это упорядоченные скопления нескольких молекул PrP, плотно упакованных и часто фибриллярных или нитевидных. Молекулы PrP (мономеры) в прионах по сравнению с нормальными свободными молекулами PrP пересвернуты практически полностью. Когда правильные молекулы PrP включаются в растущие прионные агрегаты, эти агрегаты вызывают их рефолдинг, причем прионы действуют как штамм-специфические шаблоны или затравки, которые каким-то образом придают свои собственные аберрантные формы каждой входящей молекуле, контролируя стабильную репликацию своего штамма.
За рамками этого грубого описания детали структуры и распространения прионов на молекулярном уровне остаются неясными. Также нерешенным остается вопрос о том, как прионы распространяются за пределы исходного места заражения в организме-хозяине. Существующие данные свидетельствуют о том, что наиболее эффективная межклеточная передача прионов связана с мембранозными структурами, такими как экзосомы или туннелирующие нанотрубки, — скорее всего, потому, что прионы обычно связаны с мембранами липидными якорями; однако возможность этих мембранных структур способствовать распространению прионов in vivo еще предстоит определить. Очень важно понять механизмы распространения прионов, поскольку способности различных неправильно свернутых белковых агрегатов распространяться внутри и между клетками, тканями и индивидами определяют то, действуют ли они как инфекционные патогены или являются относительно безобидными сбоями белкового метаболизма.
Прионные болезни
Многие виды млекопитающих, включая людей, низших приматов, крупный рогатый скот, овец, коз, оленей, лосей, кошек, норок, грызунов и различных экзотических копытных, восприимчивы к прионным заболеваниям PrP. Но такими являются не все виды: собаки и лошади, судя по всему, представляют собой заметные исключения. Разные виды обычно экспрессируют несколько разные нормальные молекулы PrP, и различия в аминокислотной последовательности PrP могут сильно влиять на восприимчивость хозяина к входящим прионным инфекциям. Например, люди, как известно, до некоторой степени восприимчивы к губчатой энцефалопатии крупного рогатого скота (ГЭКРС), но, по-видимому, устойчивы к скрейпи овец и, насколько нам известно, хронической изнуряющей болезни оленей. По какой-то причине лесные полевки и беличьи обезьяны необычайно восприимчивы к широкому спектру прионных инфекций других видов.
Механизмы, с помощью которых прионные инфекции вызывают нейродегенеративные заболевания, нам пока неизвестны. Агрегаты различных прионных штаммов в организмах-хозяевах разных видов могут накапливаться преимущественно в разных областях центральной нервной системы и вызывают ряд невропатологических расстройств. Очевидно, что конечным эффектом по крайней мере частичного повреждения является сбой в работе нейронов и их потеря, что вызывает множество клинических симптомов и приводит к летальному исходу. Известно, что ряд нейрофизиологических процессов и путей нарушается, но многое еще предстоит определить относительно того, связаны ли такие нарушения с прямой или косвенной токсичностью прионов и в какой степени та или иная недостаточность или комбинация недостаточностей наиболее ответственна за кончину больного.
У людей причины прионных заболеваний могут быть генетическими (из-за специфических мутаций гена PrP), приобретенными (вызванными заражением — например, воздействием куру, ГЭКРС или другим содержащим прионы материалом) или спорадическими (неизвестного происхождения; обычно предполагается, что они обусловлены спонтанным образованием прионов у конкретного индивидуума). Подавляющее большинство прионных заболеваний человека являются спорадическими, и среди них наиболее распространена спорадическая болезнь Крейтцфельдта — Якоба (sCJD), заболеваемость которой в год во всем мире составляет примерно один случай на миллион населения. Ряд различных мутаций в гене PrP может вызывать множество семейных прионных заболеваний, при этом некоторые мутации являются полностью пенетрантными (всегда вызывающими болезнь у носителей мутации), а другие — менее пенетрантными. Клинические симптомы и прогрессирование болезни могут заметно различаться в разных организмах-хозяевах и при разных типах прионных заболеваний, но могут включать деменцию, расстройство координации, бессонницу, галлюцинации, жесткость мышц, спутанность сознания, усталость и затрудненность речи.
Диагностика и лечение прионных болезней
В последнее время были достигнуты значительные успехи в том, чтобы точно и относительно неинвазивно диагностировать прионные заболевания человека у живых пациентов на основе новых прион-специфических тестов мазков из носа, спинномозговой жидкости, крови, мочи или кожи. Например, RT-QuIC-тестирование спинномозговой жидкости и/или материалов назальной щеточной биопсии может достигать 100% точности при диагностике спорадической болезни Крейтцфельдта — Якоба. Эти тесты выгодны потому, что измеряют возбудителей прионной болезни, но они еще не полностью проверены и не рекомендованы официально такими организациями, как ВОЗ. В остальном диагностика спорадических прионных заболеваний у людей зависит в первую очередь от совокупности клинических признаков, результатов сканирования мозга, электроэнцефалограмм и других биомаркеров, которые вместе могут иметь высокую диагностическую чувствительность, но не полностью специфичны для прионных болезней.
Несмотря на описанные выше недавние успехи в разработке новых прионных тестов, действующие руководящие принципы таковы: для окончательной диагностики спорадического или приобретенного прионного заболевания необходимо невропатологическое исследование тканей головного мозга, полученных в результате биопсии (что редко) или аутопсии. Полагаю, в скором времени эти рекомендации будут изменены, в них будут включены новые, менее инвазивные прижизненные тесты для выявления прионов. К сожалению, несмотря на то, что этот прогресс в раннем диагностировании прионных болезней должен улучшить перспективы разработки и применения терапевтических средств, в настоящее время доступных методов лечения, которые доказали бы свою эффективность в клинических испытаниях, не существует.
Открытые вопросы и будущие направления исследований
Действительно, последний вопрос представляет собой важный рубеж в изучении многих заболеваний, связанных с неправильным образованием белков, особенно тех, которые связаны с патогенным накоплением аномальных фибриллярных белковых отложений (например, амилоидных фибрилл и бляшек). Эти болезни включают в себя болезни Альцгеймера, Паркинсона и Гентингтона, а также боковой амиотрофический склероз, лобно-височные деменции, хроническую травматическую энцефалопатию и диабет второго типа. Различные белки организма-хозяина образуют скопления при этих и многих других заболеваниях, но, как и прионы, такие скопления обычно растут за счет включения в затравку нормальных растворимых молекул белка. Таким образом, потенциал для прионоподобного распространения белков существует на молекулярном уровне. Также растет количество доказательств того, что множество различных связанных с болезнями белковых отложений может расти и распространяться так же, как и прионы, вызывая патологии после инокуляции в локализованные участки у подопытных животных.
Результаты этих исследований поднимают насущные вопросы о том, могут ли многочисленные заболевания, основанные на повторном фолдинге белка, — а они зачастую гораздо более распространены, чем прионные заболевания, основанные на PrP, — быть переданы людям или животным в реальных условиях. Болезнь Крейтцфельдта — Якоба передается между людьми через трансплантацию тканей, инъекции гормонов, полученных от трупов, переливание крови и зараженные медицинские инструменты. Вторым фактором в таких ятрогенных передачах является тот факт, что прионы часто не полностью инактивируются стандартными процедурами клинической дезинфекции.
Еще предстоит установить, могут ли быть определены другие типы потенциально прионоподобных, ассоциированных с болезнями агрегатов белка, которые также могут быть устойчивы к инактивации и при этом способны инициировать или ускорять патогенные процессы у людей. Я не знаю никаких эпидемиологических указаний на то, что это так, но дальнейшее тщательное изучение этого вопроса кажется оправданным.

Новость
Путь прионов
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Биологическая сущность прионов
Рисунок 1. Метафора нейродегенеративного поражения мозга — это губка, в которую превращается нервная ткань в результате массовой гибели нейронов.
И тогда происходит удивительное событие: нормальные молекулы белка, контактируя с патологическими, сами превращаются в них, изменяя свою пространственную структуру (механизм трансформации остаётся загадкой и по сей день) [1]. Таким образом прион, как самый настоящий инфекционный агент, заражает нормальные молекулы, запуская цепную реакцию, разрушительную для клетки.
Некоторые сведения о прионах
Условия возникновения заболеваний
Условия возникновения прионовых болезней уникальны. Они могут формироваться по трём сценариям: как инфекционные, спорадические и наследственные поражения. В последнем варианте главную роль играет генетическая предрасположенность [2].
В последнее десятилетие интерес к этой теме возобновился в связи с возможностью развития диагностики и эффективной терапии [5]. Появилось множество различных объяснений для возрастных нейродегенеративных болезней, — например, окислительная модификация ДНК, липидов и/или белков; соматические мутации; измененный врождённый иммунитет; экзогенные токсины; несоответствия ДНК—РНК; нарушение работы шаперонов; отсутствие одного из аллелей гена [5]. Альтернативным комплексным разъяснением служит то, что различные группы белков могут формировать прионы. Несмотря на то, что небольшое количество прионов может быть удалено посредством путей белковой деградации, их чрезмерное накопление с течением времени позволяет прионам самостоятельно распространяться в организме (рис. 2), что приводит к нарушению деятельности центральной нервной системы [5].

Группы риска прионных заболеваний
Вот кого прионные заболевания могут настичь с наибольшей вероятностью:
- работники пищевой промышленности;
- ветеринары;
- патологоанатомы;
- хирурги;
- пациенты трансплантолога;
- каннибалы;
- лица, в семье которых были замечены синдромы Герстманна—Штрейслера—Шейнклера или фатальной инсомнии.
Лабораторная диагностика и лечение
Диагностика базируется на внутримозговом заражении мышат или хомяков, у которых медленно (до 150 дней) развивается соответствующее заболевание, если пациент был болен [2]. Часто проводится гистологическое исследование головного мозга погибших животных [2].
К сожалению, до настоящего времени еще не разработаны эффективные методы лечения прионовых болезней, хотя попытки предотвратить конформационный переход нормального белка в аномальный производятся. Поэтому самым надёжным способом предупреждения развития инфекционных форм является профилактика [2].
Перспективы
По-видимому, интерес к прионам не угаснет до тех пор, пока предположения на их счёт полностью не подтвердятся и не будут найдены эффективные способы лечения прионных заболеваний. В статье [6] говорится о необходимости современного исследования, которое требует тщательного рассмотрения чужеродных прионов в экстраневрональных тканях.
В качестве модельных объектов авторы использовали мышей: две линии, которые трансгенно экспрессировали овечий прионный белок, и одну линию, которая экспрессировала человеческий прионный белок (рис. 3). Задачей было сравнить эффективность межвидовой передачи инфекции посредством тканей мозга и селезёнки. Внутримозговое заражение чужеродным прионным белком выражалось в отсутствии или небольшом количестве инфекционного агента в мозгах этих мышей. Однако инфекционные чужеродные прионы обнаруживались в селезёнке на более ранних этапах заражения в сравнении с моментом, когда были использованы нейротропные прионы, тем самым определяя, что лимфатическая ткань может быть более пермиссивной к распространению чужеродных прионов по сравнению с мозгом.

Рисунок 3. Способность приона хомяков Sc237 заражать и передаваться при введении в мозг или селезенку трансгенным мышам, имеющим прионный белок PrP овцы (tg338; белые мыши) или человека (tg7; серые мыши). Число заболевших/инъецированных мышей показано в скобках; ниже приведено среднее время жизни (в днях).
Чем вызвана эта предпочтительная репликация прионов в лимфатических тканях, пока неизвестно. Однако полученные данные показывают, что человек может быть более чувствительным к чужеродным прионам, чем предполагалось ранее на основании присутствия прионов в мозгу, и по этой причине бессимптомный переносчик прионной болезни может быть не распознан. Это ещё раз подтверждает, что такая могущественная биомолекула как прион таит в себе немало загадок, раскрытие которых, возможно, поможет в понимании ряда неразрешимых проблем человечества.

Обзор
Автор
Редакторы

Мы постарались опереться на корпус уже известного знания о прионах, учтя последние результаты экспериментов и аналитической работы в этой области.
Чтобы увидеть рисунок в полном размере, нажмите на него.





















Литература
Комментарии
Использование материалов сайта разрешено только при наличии активной ссылки на источник. Все права на изображения и тексты принадлежат их авторам.

Инфекционные болезни могут развиваться не только из-за бактерий, вирусов и других хорошо известных врачам микроорганизмов - это ошеломляющее заявление в медицинской среде было сделано после того, как в 1982 году профессор неврологии и биохимии Стэнли Прузинер (США) обнаружил белковые соединения, способные вызывать заболевания. Открытие белков-прионов было настоящим прорывом в медицине, доказательством чему стало получение учёным Нобелевской премии в 1997 году.
Прионы: биологическая сущность, свойства, среда обитания таинственных молекул
Как можно заразиться прионами?
На сегодняшний день выделяют следующие основные пути заражения инфекционным белком-прионом:
1. Трансмиссивный. В этом случае молекулы белка передаются от одного вида млекопитающего к другому - например, от инфицированной коровы или овцы человеку. Заражение происходит при употреблении в пищу мяса или молока заражённого животного, либо использовании его тканей (роговицы, препаратов крови и т.п.), применении во время оперативных вмешательств биологического шовного материала.
2. Наследственный. Заболевание развивается на фоне генетической мутации, затрагивающей область 20-й хромосомы. Несмотря на слабую изученность функционирования этого участка генома, достоверно известно его участие в синтезе нормального прионного белка. В случае генных мутаций вместо здорового приона образуется патологический, а это приводит к развитию болезней.
3. Спорадический. При этом аномальный белок появляется в организме спонтанно, без видимых причин.
Вне зависимости от способа появления аномальный белок может стать причиной заражения других людей.
Прионные заболевания: особенности течения, лечения, прогноз
Отличительной особенностью болезней, вызываемых прионами, является длительный инкубационный период - от 2-3 месяцев до нескольких десятилетий. Подавляющее большинство прионных заболеваний человека являются спорадическими и имеют семейный характер наследования.
Куру, синдром Герстманна-Штреусслера-Шейнкера, болезнь Крейтцфельдта-Якоба, скрэпи – прионы вызывают заболевания, сопровождаемые поражением центральной нервной системы. Для них характерны такие признаки как деменция (слабоумие), зрительные и мозжечковые нарушения. При этом у больного могут отмечаться двигательные расстройства, бессонница, галлюцинации, нарушение речи.
К сожалению, эффективных методов лечения прионных болезней на сегодняшний день нет, хотя учёные пытаются предотвращать переход нормального белка в аномальный. Пациентам назначается симптоматическая терапия с использованием противосудорожных средств для облегчения страданий. Прогноз пока неутешителен, так как все вышеперечисленные заболевания завершаются летальным исходом.
Перспективы
Раскрытие загадочных явлений, которыми окутаны прионы, возможно, поможет в понимании ряда серьёзных биомедицинских проблем человечества.
Читайте также:

