Чумная палочка это вирус или бактерия
Обновлено: 25.04.2024
К 120-летию открытия А. Йерсеном и Ш. Китазато микроба чумы Yersinia pestis
Об авторе
Виктор Васильевич Сунцов — доктор биологических наук, ведущий научный сотрудник Института проблем экологии и эволюции им. А. Н. Северцова РАН. Занимается изучением происхождения и эволюции возбудителей природноочаговых инфекций, в частности чумы.
Диаграмма публикаций по проблеме чумы, фиксирующая скачок их числа с 2003 г.
Немного истории
Карта распространения чумы в Европе. Пандемия, начавшаяся в центральных районах Азии, достигла берегов Черного моря в 1347 г.
Когда появился микроб чумы?
Доказанное в 1980 г. молекулярными методами непосредственное родство псевдотуберкулезного (Y. pseudotuberculosis) и чумного (Y. pestis) микробов привело к выводу об их недавней дивергенции, правда, без указания времени и места, когда именно и где это случилось [5]. Высокое сходство их геномов позволяло некоторым авторам даже объединить их в один вид в качестве отдельных подвидов, хотя вызывают они совершенно разные болезни. И псевдотуберкулезного, и чумного микробов относят к семейству Enterobacteriaceae — возбудителям кишечных инфекций, но последний, будучи паразитом крови, не имеет к ним никакого отношения. У него иная адаптивная среда, и в принципе его нужно отнести к другому семейству [3].
Микрофотография чумной палочки. Увел. ×200. Фото с сайта cdc.gov
Идея недавнего отделения чумного микроба от псевдотуберкулезного была неожиданной, но отнюдь не новой. В 1950–1970-х годах такие мысли высказывали В. Н. Беклемишев, В. А. Бибикова, А. И. Дятлов, Л. Н. Классовский, В. С. Петров, Н. М. Хрусцелевская. Но тогда подобные интуитивные ощущения эволюционной молодости возбудителя чумы выглядели теоретически чуждыми, паранаучными и деструктивными, поэтому они не нашли поддержки у ортодоксов.
Головокружение от успехов
В современных исторических реконструкциях в биологии доминирует новая филогенетика (молекулярная филогенетика, генофилетика). Отчасти это лидерство оправдано широкими возможностями, которые предоставляют молекулярные структуры и компьютерные технологии филогенетических построений, позволяющие сравнивать и обрабатывать миллионы признаков, — таких, как последовательности нуклеотидов. Все составляющие новой филогенетики полезны, они необходимы для создания естественных филогенетических схем, но недостаточны, особенно в отношении прокариот. Молекулярная генетика — молодая наука, и закономерности молекулярной эволюции пока не вполне ясны. Филогении можно выстраивать только по гомологичным признакам, а их выявление, в том числе и на молекулярном уровне, представляет немалую проблему. Выводы на основе применения разных молекулярно-генетических методов далеко не однозначны, порой не согласуются между собой и с данными других наук: экологии, биогеографии, микробиологии и др. Такая обескураживающая разноголосица свойственна и заключениям в отношении микроба чумы.
Происхождение Yersinia pestis: взгляд натуралиста
Знание экологии монгольского сурка и его блох позволяет понять селективные (адаптационные) процессы, проходившие в микробных популяциях в природе, и причинно-следственные связи в эволюционных филумах. Появление возбудителя чумы в Центральной Азии предопределили два природных фактора: аридность горно-степных ландшафтов, постепенно увеличивающаяся с олигоцена-миоцена, и максимальное похолодание в сартанское время последнего оледенения. Проще говоря, индуктором видообразования микроба чумы был сухой и холодный климат Центральной Азии в конце ледниковой эпохи. Кроме того, в возникновении чумного микроба важную роль играет физиология, точнее поведение монгольского сурка, связанное с устройством зимовочной пробки, а также особенности сурочьей блохи O. silantiewi.
В Центральной Азии, в горно-степных поселениях сурка тарбагана влажность почвы очень низкая, всего 2–7% [3], а грунт в зимовочной норе зверька сухой и щебнистый. Изготовить из него земляную пробку внутри норы, в вертикальном лазе диаметром 15–20 см, все равно, что замазать сухим песком отверстие в потолке размером с футбольный мяч. Из-за дефицита почвенной влаги у монгольского сурка выработалось специфичное поведение. При залегании в спячку он устраивает зимовочную пробку из специально подготавливаемой смеси мелкозема, щебня и влажных каловых масс, которые летом собираются в отнорках (уборных). Для перетаскивания камней, обвалянных в фекалиях, сурки используют зубы, при этом частицы фекалий, а с ними и возбудитель псевдотуберкулеза, попадают в ротовую полость. Итак, во рту спящих тарбаганов — экскременты, а в них — кишечный паразит, микроб псевдотуберкулеза!
Монгольский сурок тарбаган и его зимовочная (постоянная) нора. Вверху: зимовочная пробка, состоящая из смеси мелкозема, щебня и цементирующих их экскрементов (1); гнездовая камера (2); отнорки-уборные, в которых в летние месяцы сурки накапливают строительную смесь (3). Внизу: слой мелкозема и щебня (а); и коренные породы (б), приведены температуры грунта и спящих сурков во время раскопки (февраль 1979 г.)
Сурки — типичные семейно-колониальные животные. Группировки из 2–22 разновозрастных и разнополых зверьков совместно зимуют в одной постоянной, или зимовочной, норе. У каждого зверька в течение зимней спячки более длительные периоды глубокого сна (торпора) чередуются с короткими периодами бодрствования (эутермии). В торпорной фазе температура тела снижается до 2–5°C, в эутермной может достигать нормальной, у активных сурков — около 37°С. За осенне-зимне-весеннее время сурки не вполне синхронно просыпаются до 15 раз, примерно дважды в месяц. Таким образом, каждый зверек в течение периода подземной жизни имеет два гомеостатических состояния, между которыми лежит промежуток физиологической гетеротермии. Отсюда следствие: блохи в холодное время года питаются на сурках, температура тела которых лежит в диапазоне 5–37°C. Обратим внимание на непрерывность температур!
В 1970-х годах в тувинском очаге чумы, расположенном в Центральной Азии, мы изучали зимнюю спячку тарбагана. В феврале-марте, во время максимального зимнего промерзания грунта (до глубины более 2 м), раскопали три зимовочных норы. Из них изъяли восемь глубоко спящих и девять проснувшихся активных зверьков, среди которых были молодые, полувзрослые и взрослые особи. Из их шерсти собрали 230 личинок O. silantiewi, 60 живых и 452 пустых коконов, а из ротовой полости торпидных зверьков — дополнительно 20 личинок. Пустые коконы (от 4 до 87) обнаружили также на 22 зверьках, отловленных в первые две недели после весеннего пробуждения.
Тувинский природный очаг чумы, Монгун-Тайгинский мезоочаг. Снеговое покрытие в зимне-весенние месяцы не превышает 30–40%, грунт промерзает на глубину более 2 м к началу января, а оттаивает в июле
Отметим распределение коконов на шерсти: большая часть прикреплена на голове, у основания хвоста и на наружной стороне задних ног. Все личинки, извлеченные из ротовой полости, оказались с кровью и увеличенными в размерах за счет развития жирового тела, что свидетельствовало о полноценности пищи и об их готовности к окукливанию. У спящих зверьков поврежденная личинками слизистая ротовой полости и язык обильно кровоточили, изо рта заметно выступала кровяная пена, а рот, зубы, лапы были обильно испачканы экскрементами (следами устройства зимовочной пробки осенью). Незарубцевавшиеся раны в ротовой полости мы наблюдали у всех сурков, отловленных после выхода из нор в конце марта и начале апреля, что говорит о массовости описываемого явления, его общепопуляционном характере.
Отсюда понятна причина концентрации пустых коконов на голове, хвосте и наружной стороне задних ног у спящих и недавно пробудившихся сурков тарбаганов. Зимой грунт промерзает глубже гнездовых камер, и личинки переходят из гнездовой выстилки на более теплые тела спящих зверьков. При этом некоторые личинки, произвольно перемещаясь в шерсти, попадают в ротовую полость сурка, где, питаясь на слизистой, травмируют ее. Перед окукливанием личинки покидают ротовую полость и прикрепляются к шерсти близ рта. Зная позу свернувшегося в шар спящего сурка, у которого нос уткнулся в анус, а задние ноги прижаты к щекам, легко предсказать места прикрепления коконов.
На основе новых эколого-географических, палеоклиматических и генетических данных можно сформулировать основные постулаты теории происхождения и мировой экспансии микроба чумы.
Происхождение, естественное распространение в Евразии и антропогенная мировая экспансия микроба Y. pestis во время первой (I), второй (II) и третьей (III) пандемий. 1 — южная граница зоны многолетнемерзлых грунтов; 2 — граница доминантного распространения в природе микроба Y. pseudotuberculosis O:1b; 3 — ареал сурка-тарбагана, район происхождения микроба чумы; 4 — первичные природные очаги; 5 — вторичные природные очаги; gly + (gly − ) — способность (неспособность) штаммов ферментировать глицерин
Предковая форма возбудителя чумы — микроб псевдотуберкулеза 1-го серотипа (Y. pseudotuberculosis O:1b), который доминирует в северо-центрально-азиатских и дальневосточных районах с суровым климатом.
Метаморфоза микроба псевдотуберкулеза в чумную бактерию произошла в конце позднего плейстоцена. За весь четвертичный период глубокое промерзание грунта (2 м и более) в Центральной Азии отмечено только в сартанское время позднего плейстоцена и в голоцене, т. е. не ранее 22 тыс. лет назад [10].
В ультраконтинентальном районе зимнего антициклона в Центральной Азии личинки блох, паразитирующие на монгольском сурке тарбагане, зимой переходят к факультативной гематофагии, что приводит к устойчивому контакту крови сурков с псевдотуберкулезным микробом [3].
Теперь уже можно легко представить, как сапрозоонозный кишечный псевдотуберкулезный микроб постепенно эволюционировал в облигатный паразит крови незимоспящих грызунов: экскременты тарбагана → спящий сурок → активный сурок → незимоспящий грызун.
Знание молекулярно-генетических, популяционных и биоценотических факторов, а также их многообразных связей позволяет выделить в эволюционной истории возбудителя чумы основные вехи.
IV. Во время третьей пандемии с корабельными крысами микроб уже другого подвида (orientalis) из Азии вновь проник в Африку и впервые на быстроходных морских судах добрался до Нового Света, где закрепился в виде вторичных природных очагов в популяциях земляных белок, луговых собачек, полевок, морских свинок.
В поисках согласия
Экологический сценарий происхождения, эволюции и мировой экспансии возбудителя чумы весьма заметно расходится с гипотезами, построенными на основе генетических данных. Где же истина? Какой из них достоин большего одобрения?
В пользу экологического сценария говорит следующее:
Такие аргументы делают этот экологический сценарий наиболее правдоподобным в сравнении с другими, позволяют принять его за исходную гипотезу и наполнять его генетическими признаками. Биологическое содержание сценария, понятное широкому кругу исследователей, дает существенные гносеологические преимущества перед слишком редуцированными историческими реконструкциями. К примеру, некоторые авторы из-за сходства отдельных генетических признаков у кавказского подвида Y. pestis caucasica и псевдотуберкулезного микроба считают Кавказ родиной чумы и выстраивают соответствующую филограмму [11, 12]. Но на Кавказе, в относительно теплом климатическом регионе, нет псевдотуберкулезного микроба 1-го серотипа или он встречается крайне редко! Истоки чумы следует искать в холодных, суровых краях — как в предложенном сценарии.
Несмотря на разительное несходство экологической и генетической филогений, между ними нет непреодолимой пропасти, более того, есть безусловные точки соприкосновения. Экологический сценарий для молекулярных и генетических признаков очерчивает диапазон генетической изменчивости микробной популяции, вступившей на путь видообразования, выделяет рамки экологической достоверности генетических фактов, привлекаемых для филогенетических выводов [3, 13].

В Средние века от чумы вымирали целые города, поэтому её считали Божьей карой. Долгое время эта болезнь считалась самой страшной и смертоносной. Известные истории эпидемии оспы, холеры, испанки и других болезней убивали не больше 30% заражённых. Но при чуме смертность была стопроцентной. Эта болезнь не исчезла до сих пор, но появилось эффективное лечение, и заразившиеся полностью выздоравливают.
Что такое чума
В последнее время люди постоянно слышат обо опасности вирусов, поэтому у многих возник вопрос: чума — это вирус или бактерия? Вирус имеет примитивную структуру: ДНК или РНК, покрытая оболочкой. Бактерия — это микроорганизм, который устроен гораздо сложнее, чем вирус. Несмотря на то, что вирусы вызывают опасные заболевания, большую угрозу здоровью представляют бактериальные инфекции, которые успешно лечатся антибиотиками. Именно с появлением антибиотиков смертность снизилась в десятки раз. Важно помнить, что в отличие от оспы, вызванной вирусом, чума — это бактериальная инфекция.
Возбудитель чумы — Yersinia pestis, чумная палочка, которая является грамотрицательной бактерий. Её переносчиками являются некоторые грызуны. Чумная палочка была открыта в 1894 году, когда в Гонконге бушевала эпидемия. Открытие сделали независимо друг от друга швейцарско-французский врач-бактериолог Александр Йерсен и японский медик Китасато Сибасабуро.
Получивший образование в Берлине Китасато Сибасабуро работал над исследованиями в соответствии с методом Роберта Коха. А. Йерсен был последователем школы Луи Пастера. Именно он доказал, что возбудителем средневековой чумы была именно Yersinia pestis. Прежде предполагали, что болезнь вызывается неизвестной бактерией из рода Bacterium или Pasteurella. В честь А. Йерсена был назван род бактерий, к которому принадлежит чумная палочка.
Особенности чумной палочки
Предполагается, что предком чумной палочки является псевдотуберкулезная — Yersinia pseudotuberculosis, которая обитает в почве и вызывает неопасные болезни ЖКТ. Учёные проводили многочисленные сравнения этих бактерий и узнали, что примерно 10 тыс. лет назад произошла мутация, в результате которой у псевдотуберкулёзной палочки возникли новые гены, позволяющие ей проникать в дыхательные пути человека и поражать лёгкие, а также стремительно проникать во все ткани организма и размножаться в них. Так образовалась чумная палочка.
Эта бактерия вновь мутировала в конце II или в начале III тысячелетий до н.э., и тогда появилась бубонная форма чумы. Учёные выделяют три исторических разновидности чумного возбудителя:
antiqua — вызвала Юстинианову чуму (около 541–683 годы н.э.);
medievalis — вызвала Чёрную смерть XIV веке;
orientalis — вызвала Третью пандемию (примерно 1855–1912 годы), а также современные случаи заражения.
Сейчас известно несколько сотен штаммов чумной палочки, но все заражённые получают эффективное лечение.
Чумная палочка способна сохраняться в мокроте из лёгких до 10 дней. На различных поверхностях она живёт неделями, а на трупах погибших — даже месяцами. Она хорошо переносит низкие температуры, но погибает при кипячении за считанные минуты. При нагревании до 60ºС она погибнет за час. Её легко убивают дезинфицирующие средства.
История и современность
Эпидемии чумы уносили миллионы жизни. Жители средневековых городов жили в тесноте, из-за этого риск заражения возрастал многократно. Это сыграло свою роль в том, что вспышки чумы в Европе были обыденностью в XIV–XVIII веках.
Чума существовала всегда с тех пор, как 10 тыс. лет назад появился её возбудитель. Во многих древних письменных источниках говорится о случаях бубонной чумы в Древнем Риме. В истории человечества известны три масштабные вспышки мора:
Юстинианова чума — продолжалась в 541–683 годах и вплоть до VIII века. Она возникла в египетском городе Пелусий (542 г.) и быстро проникла в Константинополь (544 г.), охватила Византию и все страны Средиземноморья, а позднее — всю Европу, Англию и Северную Африку. Вспышка случилась во времена Юстиниана I, бывшего императором Византии. Чума протекала в септической и бубонной формах. По приблизительным подсчётам жертвами стали 100 млн человек. Погибла почти половина жителей Византии.
Чёрная смерть — первоначально зародилась в пустыне Гоби примерно в 1320 году, позже пришла в области возле озера Иссык-Куль в 1338–1339 годах. За следующие несколько лет она поразила жителей Центральной Азии, Золотой Орды, Крыма и в 1347 году пришла в Константинополь, а затем в Сицилию. Оттуда чума распространилась на всю Европу. Пик пандемии пришёлся на 1346–1353 годы, но болезнь продолжала периодически бушевать вплоть до XVIII века. Погибло около 200 млн человек, некоторые поселения обезлюдели.
Третья пандемия — вспыхнула в середине XIX века (около 1855 года) и завершилась в 1920-е годы. Она началась в Китае и стремительно охватила всю Юго-Восточную Азию. Умерли 12 млн человек.
Первая вакцина была создана в 1896 году российским бактериологом, эпидемиологом и иммунологом Владимиром Хавкиным, который приехал из Франции в Бомбей во время бушевавшей там эпидемии.
В 1947 году обнаружено лечебное влияние стрептомицина, этим средством начали лечить заражённых. Сейчас каждый год заболевает примерно 2500 человек по всему миру. В настоящее время есть несколько вакцин и антибиотики. Смертность составляет около 5–10%. Важнейшую роль играет рано начатое лечение.
Формы болезни
Известно несколько форм заболевания, которые отличаются друг от друга по симптомам и степени заразности:
Бубонная — после проникновения инфекции через рану на коже воспаляется лимфатический узел.
Лёгочная — пневмония, возникающая при попадании чумной палочки в дыхательные пути.
Кожная — инфекция проникает через рану или царапину, но не вызывает воспаление лимфоузла (бубон).
Кишечная — осложнение любой из форм.
Все эти разновидности одинаково опасны для здоровья и прежде всегда приводили к неминуемой гибели.
Симптомы
Важно понимать, как происходит заражение. Бактерия попадает в организм через слизистые оболочки, конъюнктиву или через рану на коже. Лихорадка начинается через 1–7 дней после заражения.

Исследование эволюционного происхождения возбудителя опасной болезни человека – чумы – оказалось чрезвычайно интересным не только для эпидемиологии и медицины, но и для теоретической биологии. На примере бактерии ученым открылся детальный и пошаговый сценарий перехода вида в новую экологическую нишу и адаптивную зону. Последнее и есть собственно тот гигантский шаг, что в теоретической биологии обозначает начальные этапы макроэволюции. Представляется, что чумная палочка ( Yersinia pestis ) произошла от бактерии Y. pseudotuberculosis из семейства энтеробактерий, вызывающей кишечные заболевания у животных и человека. Это холодолюбивая энтеробактерия способна обитать в свободном состоянии в окружающей среде. Чумная палочка преодолела барьеры адаптивной зоны предка и проникла в кровь теплокровных животных, став облигатным (постоянным) паразитом.
Считается, что все крупные таксоны живых существ являются результатами макроэволюционных преобразований. Ученые - палеонтологи, морфологи, эмбриологи – могут продемонстрировать признаки и функции, позволившие таксонам шагнуть в новую для предкового организма нишу (экологическую, сменить адаптивную зону). В то же самое время показать непосредственно пошаговый сценарий возникновения нового таксона и его приспособлений удается довольно редко. В.В. Сунцову из Института проблем экологии и эволюции им. А.Н. Северцова удалось детализировать ход макроэволюционных событий. В представленной статье исследователь предлагает на примере возникновения чумной палочки перекинуть мост через пропасть двух понятий макро- и микроэволюции, напротив, провести границу между видообразованием (необратимые процессы) и микроэволюционными процессами (внутривидовыми, обратимыми). Тем самым автор считает, что реабилитирует позиции СТЭ: все механизмы эволюции (от молекулярно-генетических до экологических) действуют на видовом уровне. Пересмотр старой концепции разделения макро- и микроэволюции, несомненно, назрел и в данный момент в эволюционной теоретической литературе идет интересная и продуктивная дискуссия на эту тему, что делает рассуждения автора исключительно важной, интересной и самоценной составляющей данной статьи.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
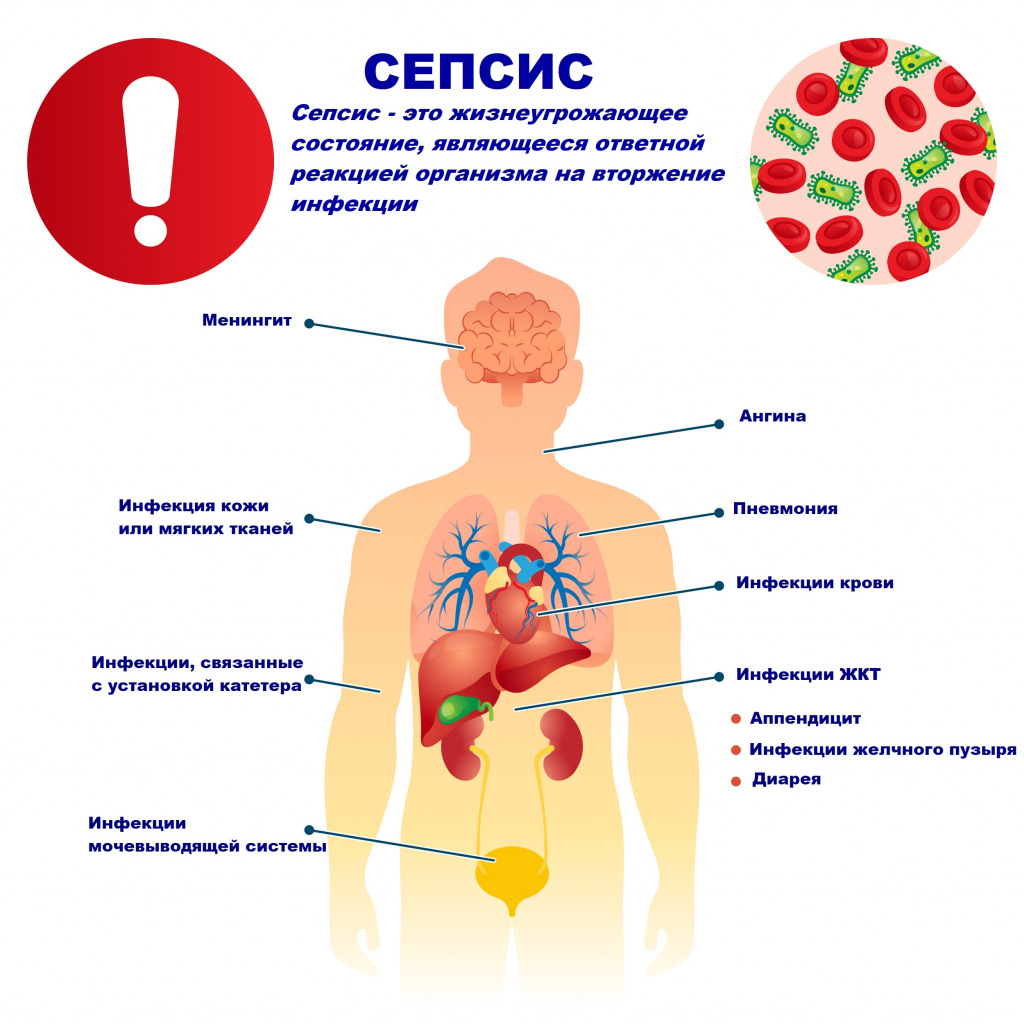
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.
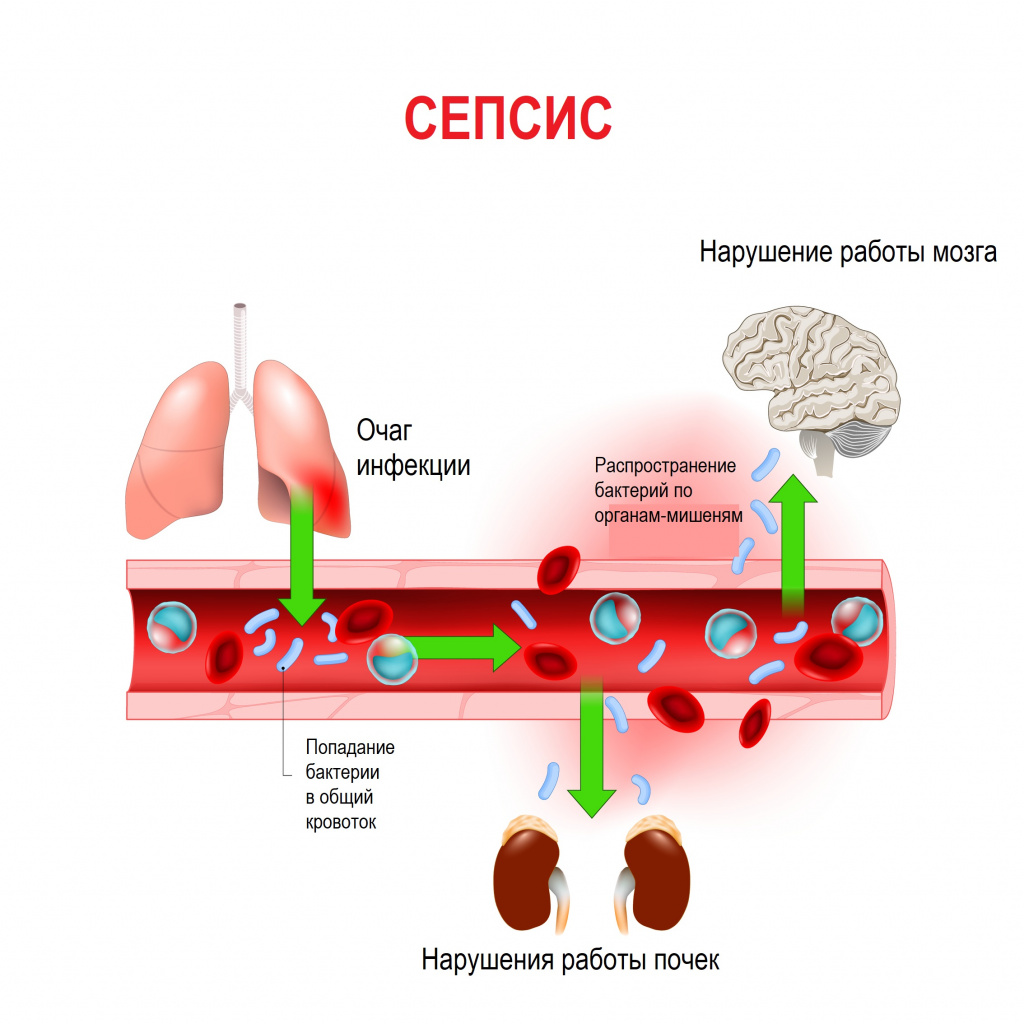
Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.
Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.

В 1894 году на борьбу с третьей пандемией чумы, начавшейся в Китае, были брошены лучшие врачебные силы многих стран мира. Японское правительство направило в Китай врача Шибасабуро Китадзато, а французское — Александра Иерсена. К этому времени уже были открыты возбудители холеры, туберкулеза, сибирской язвы и некоторых других инфекций, но микроорганизм, вызывающий чуму, оставался неизвестным. Китадзато выделил из тканей умершего больного микроорганизмы, которые посчитал возбудителями чумы. Независимо от японского врача Иерсен, получив культуру микроорганизмов из погибших от чумы, одновременно обнаружил чумную палочку в трупах павших крыс. Долгое время в медицинских кругах считалось, что микроорганизмы, обнаруженные исследователями, идентичны. Но через два года японские бактериологи К. Накамура и М. Огата с патологом М. Ямагава установили, что истинным возбудителем чумы все же является микроб, выделенный А. Иерсеном, а микроорганизм, изолированный Ш. Китадзато, относится к сопутствующей микрофлоре. Об этом Огата сделал доклад на Международном конгрессе в Москве в 1896 году.
Микроорганизм, вызывающий заболевание чумой, — чумная палочка — несколько раз менял свою таксономическую номенклатуру: Bacterium pestis — до 1900 года, Bacillus pestis — до 1923-го, Pasteurella pestis — до 1970-го и, наконец, Yersinia pestis как признание приоритета французского ученого.
Итак, возбудитель чумы был найден, но оставалось непонятным, какими путями происходит распространение болезни.

Первое объективное подтверждение того, что чумный микроб может передаваться от грызунов к человеку, получено в 1912 году. Тогда в северо-западном Прикаспии начали работу передвижные лаборатории под началом Д.К. Заболотного и И.И. Мечникова. Участник экспедиции врач И.А. Деминский выделил чумного микроба из органов суслика. Работая с полученным штаммом, И.А. Деминский заразился чумой и умер.

Читайте также:

