Циклоферон при вирусной ангине
Обновлено: 24.04.2024
Установлена профилактическая эффективность препарата циклоферон (снижение заболеваемости ОРЗ и гриппом в 2,9–7,2 раза для микст-инфекций респираторного тракта) в группе часто болеющих детей. Индекс эффективности колебался от 2,4 до 3,4, колебания показателя защиты от 58,5 до 67,1 %, снижение заболеваемости более чем в 2,9 раза. Отмечено и снижение кратности (в 4,1 раза) и длительности острых (в 1,7 раза) эпизодов ОРЗ/ОРВИ, частоты развития аллергии в 4,6 раза, уменьшение проявлений синдрома лимфоаденопатии, астенического синдрома, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. Во вновь организованных коллективах, как у детей, так и у подростков выявлено снижение заболеваемости ОРЗ и гриппом (в 2,4–4,4 раза). Цитопротекторное действие проявлялось усилением активности факторов (лизоцим, секреторный иммуноглобулин А) местной неспецифической резистентности. Прием препарата снижал видовое разнообразие микрофлоры поверхности миндалин, уменьшал обсеменённость поверхности миндалин микрофлорой, в том числе золотистым стафилококком, что обеспечило снижение штаммов золотистого стафилококка, устойчивых к бензилпенициллинам. Отмечена минимизация симптомов интоксикации, выраженности и продолжительности катаральных явлений, отсутствие нежелательных реакций на препарат.

1. Маркова Т.П. Длительно и часто болеющие дети / Т.П. Маркова, Д.Г. Чувиров // Ремедиум. – 2010. – № 6. – С. 26–28.
2. Василевский И.В. Часто болеющие дети: практические подходы к иммунокорригирующей терапии. – М.: Медицина, 2008. – № 2. – С. 93–99.
3. Альбицкий В.Ю. Часто болеющие дети. Клинико-социальные аспекты. Пути оздоровления / В.Ю. Альбицкий, А.А. Баранов. – Саратов, 1986. – 165 с.
5. Самсыгина Г.А. Проблемы диагностики и лечения часто болеющих детей на современном этапе / Г.А. Самсыгина, Г.С. Коваль // Педиатрия им. Г.Н. Сперанского. – 2010. – Т. 89, № 2. – С. 137–145.
6. Василевский И.В. Реабилитация часто болеющих детей: учеб-метод пособие. – Минск: БелМАПО, 2006. – 44 с.
8. Микробиологические методы исследования биологического материала: инструкция по применению: утв. М-вом здравоохранения Республики Беларусь 19.03.2010. – Минск, 2010. – 129 с.
9. Введение в клиническую микробиологию / А.Г. Бойцов [и др.]. – СПб.: Изд-во СПбГМА им. И.И. Мечникова, 1999. – 115 с.
10. Влияние интерферона I типа на персистенцию стафилококка и некоторые показатели иммунореактивности организма / И.Я. Спивак [и др.] // Журнал микробиологии, эпидемиологии и иммунобиологии. – 1984. – № 11. – С. 74–77.
11. Лутовина, О.В. Состояние микробиоценозов кишечника и ротоглотки у часто и длительно болеющихреспираторнымизаболеваниями детей раннего возраста // Вестник новых медицинских технологий. – 2008. – Т. 15, № 3. – С. 56–60.
12. Микробиоценоз ротоглотки и кишечника у детей, посещающих дошкольные учреждения / Л.В. Феклисова [и др.] // Эпидемиология и инфекционные болезни. – 2007. – № 4. – С. 14–18.
Уменьшение количества устойчивых к антибиотикам штаммов на фоне приема циклоферона, несомненно, представляется весьма интересным и важным эффектом ввиду всеобщей тенденции к развитию резистентности к используемым в повседневной практике антибактериальным препаратам.
В группу часто болеющих детей (ЧБД) входят на том или ином возрастном этапе от 15 до 75 % детской популяции, в связи с чем,частые респираторные заболевания является актуальной проблемой педиатрии. К категории ЧБД относят детей, страдающих повторными острыми респираторными заболеваниями (ОРЗ) свыше 4–6 раз в год, имеющих инфекционный индекс от 1,1 до 3,5. Среди всей популяции ЧБД выделяют категорию ложно болеющих с индексом резистентности от 0,3 до 0,49, а к категории истинно часто болеющих детей, относят часто болеющих детей при индексе резистентности 0,5 и выше 4.
Система иммунитета в детском возрасте характеризуется относительно пониженным уровнем нейтрофилов основных эффекторных клеток естественного (врожденного) звена иммунного ответа и низкой продукцией иммуноглобулинов на фоне повышенного числа Т- и В-лимфоцитов, что свидетельствует о неполноценности адаптивного (приобретенного) звена, а в совокупности с анатомо-физиологическими особенностями органов дыхания, недостаточными гигиеническими навыками и значительным контактом с окружающим миром делает детей дошкольного возраста особенно уязвимыми для инфекций [5, 6].
После перенесенного эпизода ОРЗ дисбиотические изменения микрофлоры зева сохраняются до 1,5 месяцев. Вирусы являются этиологическими агентами более чем в 80 % случаев ОРЗ для их лечения даже при неосложнённом течении, используются антибактериальные (АБ) препараты, что способствует усугублению дисбиоза. 35 % детей, относящихся к группе ЧБД, имеют хроническую ЛОР патологию. Не менее, чем в 30 % случаев, ЧБД являются носителями β-гемолитического стрептококка группы А, а 50 % детей являются носителями золотистого стафилококка [11, 12].
Введение интерферона 1 типа в экспериментальных исследованиях сокращало сроки персистенции золотистого стафилококка и количество персистирующих бактерий, способствуя нормализации показателей иммунного статуса, повышая выживаемость животных при стафилококковой инфекции. Иммуномодулирующий эффект интерферона II типа ещё более выражен,γ-интерферон активно стимулирует макрофаги, усиливает экспрессию молекул МНС I и II, стимулирует дифференцировку Т-хелперов нулевого типа в Т-хелперы первого типа.
В связи с этим, нами выбран метилглюкаминакридоноацетат- ранний индуктор смешанного (Th1/Th2) типа иммунного ответа, увеличивающий функциональную активность фагоцитирующих клеток и обеспечивающий их бактерицидность[2, 4, 5].
Напомним механизм действия препарата, описанный нами ранее[1].
Циклоферон как индуктор интерферонов. Продукция эндогенного интерферона под воздействием циклоферона обусловлена наличием чувствительных клеточных систем, способных синтезировать интерферон в ответ на индуктор.Иммунокомпетентные клетки (моноциты, лимфоциты, макрофаги, купферовские клетки печени) способны индуцировать интерферон. Циклоферон индуцирует ранний интерферон.
Одним из важных направлений формирования полноценного иммунного ответа является регуляция синтеза ИФН-g. Продукция ИФН-γTh1 осуществляется благодаря стимуляции ИЛ-12, ИЛ-2 и ФНО-a, а ИЛ-18, являясь потенциальным индуктором синтеза ИФН-g, выступает в роли синергиста ИЛ-12 и оба этих цитокина лидируют в быстрой активации моноцит/макрофагальной системы посредством стимуляции выработки ИФН-g, который также стимулируется при действии циклоферона.
Иммунотропная активность циклоферона. В основе развития иммунного дисбаланса лежат функциональная клеточная блокада (блокада рецепторов и механизмов передачи сигналов); дисбаланс клеточных субпопуляций – хелперов Th1/Th2, супрессоров/цитотоксических лимфоцитов, хелперов/эффекторов и другие. В экспериментальных исследованиях циклоферон индуцировал в линии клеток К562 иммунного происхождения синтез мРНКинтерферона-гамма и IL-2, а также IL-1 и IL-6 (представители гуморального Th-2 типа иммунитета). При этом, циклоферон не индуцирует мРНК цитокинов в линиях клеток неиммунного происхождения (MG-63), что свидетельствует о высокой тропности циклоферона к клеткам иммунной системы.Введение циклоферона приводит к существенным изменениям в составе субпопуляций лимфоцитов (повышается относительное и абсолютное число исходно сниженных общих Т-лимфоцитов (СD3 +), Т-хелперов (СD4 +), иммунорегуляторного индекса и естественных киллеров (СD16 +); снижение СD8 + и СD72 + – лимфоцитов). Повышается уровень иммуноглобулина А (IgA) при одновременном снижении концентрации иммуноглобулина Е (IgE). Циклоферон увеличивает провоспалительный потенциал нейтрофилов периферической крови, а также функциональную активность фагоцитирующих клеток за счет генерации активных форм кислорода, обеспечивая бактерицидность клеток.
Циклоферон как стимулятор образования дефект-интерферирующих вирусных частиц. В ряде случаев размножение вирусов подавляется дефектными частицами, которые известны как дефект-интерферирующие частицы (ДИ-частицы). ДИ-частицы препятствуют нормальной репродукции вируса, что ведет к подавлению его цитоцидного действия. Накопление достаточного количества ДИ-частиц в инфицированном организме приводит к самоограничению инфекции, при этом, дефектные частицы сохраняют цитокин- и интерферон (ИФН)-индуцирующие свойства, стимулируя неспецифический иммунитет.
Противовирусная активность циклоферона. Циклоферон оказывает непосредственное противовирусное действие, восстанавливает способность лейкоцитов крови к синтезу интерферона, подавляет проникновение вирусной частицы в клетку путем ингибирования синтеза мРНК и трансляции вирусных белков, а также через блокирование процессов сборки вирусной частицы и ее выхода из инфицированной клетки. В результате связывания молекулы интерферона с интерфероновыми рецепторами на поверхности клеток происходит активация генов, локализованных в 21 хромосоме у человека. Этот процесс сопровождается формированием более 20 новых внутриклеточных белков, способствующих возникновению резистентности к вирусам. Данные белки отсутствуют в клетках, не подвергшихся воздействию интерферона. К этим белкам относят фермент А-синтетазу, осуществляет расщепление мРНК путем подавления удлинения полипептидных цепей. Также под действием данного фермента продуцируются олигомеры адениловой кислоты, которые блокируют синтез вирусных белков, что приводит к нарушению трансляции с вирусной РНК.
Вышесказанное, определило цель исследования – установить способность меглюминакридонацетата (циклоферона) индуктора раннего эндогенного интерферона смешанного типа влиять на микробиологический пейзаж поверхности миндалин часто болеющих детей.
Материалы и методы исследования
Под наблюдением находилось 16151 детей дошкольного и школьного возраста, которым в период повышенного сезонного подъема респираторной заболеваемости была проведена экстренная неспецифическая профилактика повторных ОРЗ (эпидемиологическое исследование).Препарат назначался детям в соответствии с указаниями инструкции по медицинскому применению.
Также в сезон 2010/11 года наблюдали 68 детей (32 девочки и 36 мальчиков) в возрасте от 4 до 7 лет, медиана (Ме) – 5,1 лет, нижняя квартиль (Q25) – 4,5 года, верхняя квартиль (Q75) – 5,8 лет, посещающих специализированные детские сады (№ 94 и № 95) для часто болеющих детей.
При получении информированного согласия от законных представителей ребенка, отсутствии острых инфекционных заболеваний, наличии в анамнезе 6-и и более эпизодов ОРЗ за последний год, ребенок включался в протокол врачебного наблюдения.
Препарат циклоферон (таблетки по 150 мг) назначали двумя курсами (с перерывом в 1 месяц) 10 мг/кг массы тела, согласно инструкции по медицинскому применению препарата. Двукратно, до начала приема препарата и через 2 недели после окончания приема, выполнили посев микрофлоры с поверхности миндалин. Материал – слизь с поверхности миндалин – брали стерильными ватными тампонами натощак и помещали в универсальную гелевую транспортную среду Стюарта фирмы Copan (Италия). В течение 2 часов полученный материал доставлялся в лабораторию. Для идентификации микрофлоры и определения её чувствительности к антибактериальным препаратам была использована автоматизированная система VITEC-2 фирмы Bio Merieux (Франция).Тестирование чувствительности к антибактериальным препаратам осуществлялось методом минимальных ингибирующих концентраций [8, 9].
Статистический анализ проводился с использованием стандартного пакета прикладных программ Statistica версия 6.0. При сравнении двух независимых групп изучаемой переменной использовали тест Манна-Уитни (U), в случае зависимости групп – тест Вилкоксона (Z). При сравнении долей (процентов) использовался метод Фишера. Нулевая гипотеза об отсутствии различий между переменными отвергалась на уровне значимости α = 0,05 (p £ 0,05) для каждого из использованных тестов. Для представления результатов статистической обработки использовали величины медианы (Me), верхней (Q75) и нижней квартилей (Q25) в формате Me (Q25-Q75).
Результаты исследования и их обсуждение
В раннее проведенных исследованиях[2] нами показано, что циклоферон используется как средство неспецифической профилактики ОРЗ/ОРВИ и гриппа у детей во время эпидемического подъема заболеваемости. Под наблюдением находилось 16151 человек, из них 9299 получали препарат, а 6852 – плацебо (дети в возрасте от 10 до 16 лет). Кроме этого выборка в 1255 детей включала возраст от 7 до 10 лет. Препарат получали 524 ребенка, а 731 человек получали активное плацебо. 114 детей в возрасте от 4 до 7 лет получали циклоферон, в сравнении с ревитом. Индекс эффективности составил 2,9 (колебания от 2,4 до 3,4), показатель защиты 62,8 % (колебания от 58,5 до 67,1 %), снижение заболеваемости более чем в 2,9 раза. Установлена профилактическая эффективность препарата (снижение заболеваемости ОРЗ и гриппом наблюдалось в 2,9–7,2 раза для микст-инфекций респираторного тракта). Отмечена минимизация симптомов интоксикации, выраженности и продолжительности катаральных явлений, отсутствие нежелательных реакций на препарат. Цитопротекторное действие, проявлялось снижением степени деструкции клеток эпителия, усилением в 4,5 раза активности факторов (лизоцим, секреторный иммуноглобулин А) местной неспецифической резистентности. Показано снижение кратности (в 4,1 раза) и длительности острых (в 1,7 раза) эпизодов ОРЗ/ОРВИ, частоты развития аллергии в 4,6 раза, уменьшение проявлений синдрома лимфоаденопатии, астенического синдрома, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. Выявлено снижение заболеваемости ОРЗ и гриппом (в 2,4–4,4 раза) во вновь организованных коллективах, как у детей, так и у подростков. При проведении курса циклоферона наблюдалась смена структуры ОРЗ среди заболевших. Увеличивались легкие (в 4,3 и более раза), уменьшались тяжелые и осложненные формы заболеваний, число заболевших, получавших циклоферон составило 6 %. Наблюдалось легкое течение ОРЗ, число пропущенных дней по болезни (в пересчете на 1 ребенка) составило 4,8 дня. Среди детей, не получавших средств неспецифической профилактики, уровень заболеваемости составил 58 %, при заболеваемости в 19 % у детей, получавших гриппол. Наблюдая 116 детей в возрасте до 14 лет с неосложненным и осложненным (со стороны ЛОР-органов) течением ОРВИ, установлено, что в 95,7 % случаев заболевание начиналось с лихорадки, симптомов интоксикации, проявляющихся вялостью, адинамичностью, бледностью кожных покровов, головной болью, судорожным синдромом, рвотой. У 17 детей выявлен бронхит, а при отоларингологическом осмотре выделены наблюдавшиеся группы детей: 1-я – ОРВИ с превалированием клиники ринофарингита; 2-я – с наличием острого катарального среднего отита (ОКСО); 3-я – острого гнойного среднего отита (ОГСО); 4-я – острого катарального синусита (ОКС) и 5-я – острого гнойного синусита (ОГС). Вирусная этиология ОРВИ из 116 обследованных детей, была подтверждена в 74,1 % случаев.
Оценка неспецифической резистентности слизистой оболочки, изучена по показателям фагоцитарной активности, фагоцитарного числа, степени завершенности фагоцитоза (на слизистой ротоглотки и в крови), также оценивался уровень SigА. Выявлено снижение фагоцитарной активности нейтрофилов (ФА) и фагоцитарного числа (ФЧ) относительно нормы в начале заболевания, но степень снижения была различна. В группе больных гриппом А показатели достоверно ниже, чем в группе сравнения. Активность фагоцитов падает более чем в 2 раза от нормы как в крови, так и на слизистых оболочках. При выявлении катарального отита или синусита на фоне гриппа А, ФА и ФЧ на слизистых выше, чем в крови. При парагриппозной инфекции эти процессы активированы в крови. ОГСО сопровождается теми же изменениями, но в меньшей степени выраженности. ОГС при парагриппе протекает с высокой активностью фагоцитоза в крови.
В мазках из зева, полученных до лечения, у наблюдаемых нами 68 детей, относящихся к часто болеющим, выделены представители 25 семейств, родов и видов микроорганизмов, но наиболее частой находкой явился золотистый стафилококк, обнаруживаемый в титрах 1∙104–1∙106 у половины обследованных детей. У 44 детей (64,71 %) идентифицирована 1 культура, у 14 (20,58 %) – 2, у 9 (13,24 %) – 3, у 1 (1,47 %) – 4 культуры бактерий. При повторном обследовании спектр микроорганизмов значительно сузился, обнаружены представители только 16 семейств, родов и видов микроорганизмов, как и при первом исследовании, золотистый стафилококк выявлялся у половины обследованных, но в более низких титрах (рисунок). У 11 детей (25,58 %) рост бактерий отсутствовал, у 24 детей (55,81 %) идентифицирована 1 культура, у 6 (13,96 %) – 2, у 2 (13,96 %) – 3 культуры бактерий.
При анализе чувствительности к антибиотикам золотистого стафилококка, высеянного с поверхности миндалин, при повторном исследовании установлено уменьшение доли метициллин-, рифампицин-, эритромицин-, тетрациклин резистентных штаммов и достоверное снижение процента штаммов устойчивых к бензилпенициллинам, по сравнению с исходными показателями.
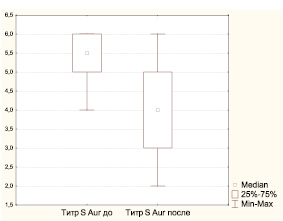
Динамика титра S. аureus у ЧБД, принимавших циклоферон
Ингибирование циклофероном персистентного потенциала внутриклеточных патогенов способствует их элиминации при острых и хронических инфекционных процессах [7].
Уменьшение количества устойчивых к антибиотикам штаммов на фоне приема циклоферона, несомненно, представляется весьма интересным и важным эффектом ввиду всеобщей тенденции к развитию резистентности к используемым в повседневной практике антибактериальным препаратам.
Таким образом, препарат циклоферон можно рекомендовать к применению в составе комплексной терапии и для реабилитации часто и длительно болеющих детей.
Установлена профилактическая эффективность препарата (снижение заболеваемости ОРЗ и гриппом наблюдалось в 2,9–7,2 раза для микст-инфекций респираторного тракта). Индекс эффективности составил 2,9 (колебания от 2,4 до 3,4), показатель защиты 62,8 % (колебания от 58,5 до 67,1 %), снижение заболеваемости более чем в 2,9 раза.
Отмечена минимизация симптомов интоксикации, выраженности и продолжительности катаральных явлений, отсутствие нежелательных реакций на препарат. Цитопротекторное действие, проявлялось снижением степени деструкции клеток эпителия, усилением в 4,5 раза активности факторов (лизоцим, секреторный иммуноглобулин А) местной неспецифической резистентности. Показано снижение кратности (в 4,1 раза) и длительности острых (в 1,7 раза) эпизодов ОРЗ/ОРВИ, частоты развития аллергии в 4,6 раза, уменьшение проявлений синдрома лимфоаденопатии, астенического синдрома, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. Выявлено снижение заболеваемости ОРЗ и гриппом (в 2,4–4,4 раза) во вновь организованных коллективах, как у детей, так и у подростков.
Прием препарата снижает видовое разнообразие микрофлоры поверхности миндалин, уменьшает обсеменённость поверхности миндалин микрофлорой, в том числе золотистым стафилококком, приводит к значимому снижениюштаммов золотистого стафилококка, устойчивых к бензилпенициллинам.
Резюме. Для оценки способности препарата циклоферон влиять на микробиологический пейзаж поверхности миндалин у часто болеющих детей (ЧБД) была изучена микрофлора миндалин до и после стандартного курса этого препарата у 68 дошкольников, относящихся к категории ЧБД. Установлено, что микробный пейзаж поверхности миндалин детей после курса циклоферона характеризовался уменьшением разнообразия микрофлоры и снижением титра бактерий, в том числе и золотистого стафилококка, а также уменьшением количества штаммов, резистентных к бензилпенициллину, клиндамицину и ванкомицину. Таким образом, препарат циклоферон можно рекомендовать для реабилитации ЧБД.
Ключевые слова: часто болеющие дети, циклоферон, микрофлора миндалин.
Введение.
По современным литературным данным в группу часто болеющих детей (ЧБД) входят на том или ином возрастном этапе от 15 до 65% детской популяции [10], в связи с этим частые респираторные заболевания является актуальной проблемой педиатрии [4, 9]. В 1986 году В.Ю. Альбицким и А.А. Барановым была предложены критерии включения детей в группу часто болеющих. К (ЧБД) относят детей, страдающих острыми респираторными заболеваниями (ОРЗ) свыше 4-х раз в год в возрасте до 1 года, 6-и раз – в 1-3 года, 5-и раз – в 4-5 лет и 4-х раз – после 5 лет [1].
Система иммунитета в детском возрасте характеризуется относительно пониженным уровнем нейтрофилов – основных эффекторных клеток врожденного звена иммунного ответа, а также низкой продукцией иммуноглобулинов на фоне повышенного числа Т- и В-лимфоцитов, что свидетельствует о неполноценности адаптивного звена [8]. Это в совокупности с анатомо-физиологическими особенностями органов дыхания [6], недостаточными гигиеническими навыками и расширением контактов с окружающим миром делает детей дошкольного возраста особенно уязвимыми для инфекций.
Несмотря на то, что вирусы являются этиологическими агентами более чем в 80% случаев ОРЗ [2], по данным литературы в практической медицине для их лечения в большинстве случаев, даже при неосложнённом течении, используются антибактериальные (АБ) препараты [13, 14], что способствует развитию дисбиоза. Показано, что после перенесенного эпизода ОРЗ дисбиотические изменения микрофлоры зева сохраняются до 1,5 месяцев [11]. Гибель резидентной микрофлоры приводит к заселению биотопа условно-патогенными микроорганизмами. Существуют данные, что 35% детей, относящихся к группе ЧБД, имеют хроническую ЛОР патологию [10]. Не менее, чем в 30% случаев, ЧБД являются носителями β-гемолитического стрептококка группы А [3, 7]. Не менее 50% детей являются носителями золотистого стафилококка [7, 9].
В эксперименте на мышах было продемонстрировано, что введение интерферона 1 типа сокращало сроки персистенции золотистого стафилококка и количество персистирующих бактерий, способствовало нормализации показателей иммунного статуса и повышению выживаемости при стафилококковой инфекции [5]. Иммуномодулирующий эффект интерферона II типа ещё более выражен. Установлено, что ?-интерферон активно стимулирует макрофаги, усиливает экспрессию молекул МНС I и II, стимулирует дифференцировку Т-хелперов нулевого типа в Т-хелперы первого типа [12].
Приведенное выше факты определили цель нашего исследования: оценить способность индуктора эндогенного интерферона – препарата циклоферон влиять на микробиологический пейзаж поверхности миндалин у часто болеющих детей.
Материалы и методы.
Было обследовано 68 детей (32 девочки и 36 мальчиков) в возрасте от 4 до 7 лет, медиана (Ме) – 5,1 лет, нижняя квартиль (Q25) – 4,5 года, верхняя квартиль (Q75) – 5,8 лет. Все дети посещали специализированные детские сады (№94 и №95) г. Гродно для ЧБД. Критериями включения в исследование были добровольное информированное согласие законных представителей детей, возраст 4-7 лет, отсутствие острых инфекционных заболеваний на момент обследования, наличие в анамнезе 6-и и более эпизодов ОРЗ за предшествующие 12 месяцев. Обследование включало клинический осмотр детей, анкетирование родителей и выкопировку данных из амбулаторной карты (форма №112-у).
Двукратно, до начала приема препарата циклоферон и через 2 недели после окончания приема детям выполнили посев микрофлоры с поверхности миндалин. Материал – слизь с поверхности миндалин – брали стерильными ватными тампонами натощак и помещали в универсальную гелевую транспортную среду Стюарта фирмы Copan (Италия). В течение 2 часов полученный материал доставлялся в лабораторию. Для идентификации микрофлоры и определения её чувствительности к антибактериальным препаратам была использована автоматизированная система VITEC-2 фирмы BioMerieux (Франция). Тестирование чувствительности к антибактериальным препаратам осуществлялось методом минимальных ингибирующих концентраций.
Препарат циклоферон (таблетки по 0,15) назначался двумя курсами (с перерывом в 1 месяц) по схеме, указанной в аннотации: на курс по 1 таблетке 1 раз в день за полчаса до еды в 1, 2, 4, 6, 8, 11, 14, 17, 20 и 23 дни.
Статистический анализ проводился с использованием стандартного пакета прикладных программ Statistica версия 6.0. При сравнении двух независимых групп изучаемой переменной использовали тест Манна-Уитни (U), в случае зависимости групп – тест Вилкоксона (Z). При сравнении долей (процентов) использовался метод Фишера (Fisher exact test). Нулевая гипотеза об отсутствии различий между переменными отвергалась на уровне значимости α=0,05 (p ≤0,05) для каждого из использованных тестов. Для представления результатов статистической обработки использовали величины медианы (Me), верхней (Q75) и нижней квартилей (Q25) в формате Me (Q25-Q75).
Результаты и обсуждение.
В мазках из зева, полученных до лечения, были выделены представители 25 семейств, родов и видов микроорганизмов (таблица 1). Наиболее частой находкой был золотистый стафилококк. В титрах 1*104 - 1*106 он обнаруживался практически у половины обследованных. У 44 детей (64,71%) была идентифицирована 1 культура, у 14 (20,58%) – 2, у 9 (13,24%) – 3, у 1 (1,47%) – 4 культуры бактерий.
Таблица 1.
Микрофлора с поверхности миндалин ЧБД, выделенная при первом обследовании
| Название | Количество культур | % носителей |
|---|---|---|
| Aerococcus viridans | 1 | 1,47 |
| Candida famata | 3 | 4,41 |
| Dermococcus nishinomiyaensis | 1 | 1,47 |
| Erisipelotrix rusiopathiae | 4 | 5,88 |
| Fackmalia hominis | 1 | 1,47 |
| Granulicatella adiacens | 3 | 4,41 |
| Granulicatella elegans | 1 | 1,47 |
| Kocuria kristinae | 1 | 1,47 |
| Kocuria rosea | 4 | 5,88 |
| Leuconostoc mesenterioides | 1 | 1,47 |
| Leuconostoc mesenteroides cremosis | 3 | 4,41 |
| Rothia mucilaginosa | 1 | 1,47 |
| S. aureus | 33 | 48,53 |
| S. epidermidis | 1 | 1,47 |
| S. haemolyticus | 1 | 1,47 |
| S. hominis | 7 | 10,29 |
| S. ludgunensis | 3 | 4,41 |
| S. vitulinus | 1 | 1,47 |
| Serratia marcescens | 1 | 1,47 |
| Sphingomonas thalpophilium | 1 | 1,47 |
| Str. oralis | 12 | 17,65 |
| Str. parasanguinis | 2 | 2,94 |
| Str. pneumoniae | 11 | 16,18 |
| Str. salivarius | 2 | 2,94 |
| Str. spp. | 4 | 5,88 |
| Всего | 103 |
При повторном обследовании спектр микроорганизмов значительно сузился. В мазках с поверхности миндалин у детей были обнаружены представители только 16 семейств, родов и видов микроорганизмов (таблица 2). Как и при первом исследовании, золотистый стафилококк выявлялся практически у половины обследованных, но в более низких титрах (по сравнению с исходными р=0,04) (рисунок 1). У 11 детей (25,58%) рост бактерий отсутствовал, у 24 детей (55,81%) была идентифицирована 1 культура, у 6 (13,96%) – 2, у 2 (13,96%) – 3 культуры бактерий.
Таблица 2.
Микрофлора с поверхности миндалин ЧБД, выделенная при повторном обследовании
| Название | Количество культур | % носителей |
|---|---|---|
| Нет роста | 11 | 25,58 |
| Acinetobacter ursingii | 1 | 2,32 |
| Candida | 3 | 6,98 |
| E.coli | 1 | 2,32 |
| Enterobacter cloacae | 2 | 4,65 |
| Kocuria roseae | 1 | 2,32 |
| Micrococcus luteus | 1 | 2,32 |
| Pantoteae spp. | 1 | 2,32 |
| Ps.aeruginosa | 1 | 2,32 |
| S.aureus | 19 | 44,19 |
| S.epidermidis | 1 | 2,32 |
| S.warneri | 1 | 2,32 |
| Stenotrophomonas maltophyla | 1 | 2,32 |
| Str.oralis | 3 | 6,98 |
| Str.parasanguinis | 1 | 2,32 |
| Str.sanguinis | 2 | 4,65 |
| Str.spp. | 3 | 6,98 |
| Всего | 42 | 100,0 |
Рисунок 1. Динамика титра S. aureus у ЧБД, принимавших циклоферон
При анализе чувствительности к антибиотикам золотистого стафилококка, высеянного с поверхности миндалин ЧБД, при повторном исследовании было установлено несущественное уменьшение доли метициллин-, рифампицин-, эритромицин-, тетрациклин резистентных штаммов и достоверное снижение процента штаммов устойчивых к бензилпенициллину, ванкомицину и клиндамицину по сравнению с исходными показателями (таблица 3).
Таблица 3.
Доля (%) S. aureus, резистентных к антибиотикам до и после лечения
| Антибиотики | До приема циклоферона | После приема циклоферона | Р |
|---|---|---|---|
| MRSA | 10,00 | 5,26 | - |
| Бензилпенициллин | 84,09 | 63,64 | 0,05 |
| Ванкомицин | 26,67 | 4,55 | 0,03 |
| Клиндамицин | 20,93 | 0,0 | 0,02 |
| Линезолид | 0,0 | 0,0 | - |
| Моксифлоксацин | 0,0 | 0,0 | - |
| Оксациллин | 15,56 | 4,55 | - |
| Рифампицин | 4,44 | 0,0 | - |
| Эритромицин | 11,11 | 9,09 | - |
| Гентамицин | 0,0 | 0,0 | - |
| Ципрофлоксацин | 0,0 | 0,0 | - |
| Левофлоксацин | 0,0 | 0,0 | - |
| Тетрациклин | 6,67 | 0,0 | - |
| Нитрфурантоин | 0,0 | 0,0 | - |
| Бисептол | 0,0 | 0,0 | - |
| Дальфопристин | 0,0 | 0,0 | - |
На фоне приема циклоферона изменилась не только обсемененность поверхности миндалин золотистым стафилококком, но и непатогенной микрофлорой. При повторном обследовании среднее количество обнаруженных непатогенных видов бактерий и их титры были достоверно ниже (в обоих случаях p
Рисунок 2. Количество непатогенных видов микроорганиз
Рисунок 3. Динамика титра непатогенной микрофлоры у ЧБД, принимавших циклоферон
Поскольку циклоферон не обладает прямой антибактериальной активностью, можно предположить, что снижение обсемененности и видового разнообразия микроорганизмов поверхности миндалин обусловлено иммунокоррегирующими свойствами этого препарата.
Уменьшение количества устойчивых к антибиотикам штаммов на фоне приема циклоферона, несомненно, представляется весьма интересным и важным эффектом ввиду всеобщей тенденции к развитию резистентности к используемым в повседневной практике антибактериальным препаратам. Таким образом, препарат циклоферон можно рекомендовать к применению в составе комплексной терапии и для реабилитации ЧБД.
Выводы
Прием двух курсов препарата циклоферон (с перерывом в 1 месяц) по схеме, указанной в аннотации снижает у ЧБД видовое разнообразие микрофлоры поверхности миндалин, достоверно уменьшает обсеменённость поверхности миндалин микрофлорой, в том числе золотистым стафилококком.
Приём препарата циклоферон приводит к значимому снижению количества штаммов золотистого стафилококка устойчивых к бензилпенициллину, ванкомицину и клиндамицину.
Список литературы
В. Ю. Альбицкий, А. А. Баранов, Частоболеющие дети. Клинико-социальные аспекты. Пути оздоровления, Саратов (1986). А. Г.
Бойцов В.П. Иванов, О.Н. Ластовка, А.А. Порин, Введение в клиническую микробиологию, издательство СПбГМА им. И.И. Мечникова, Санкт Петербург (1999).
И. В. Василевский, Реабилитация часто болеющих детей: учебебно-методическое пособие, БелМАПО, Минск (2006).
И. В. Василевский, Медицина, № 2, 93 – 99 (2008).
Н. Я. Спивак, В.Г. Лисовенко, В.С. Зуева [и др.], Журнал микробиологии, эпидемиологии и иммунобиологии, № 5, 74 – 77 (1984).
Т. В. Капитан, Пропедевтика детских болезней с уходом за детьми, МЕДпресс-информ, Москва (2004).
О. В. Лутовина, Вестник новых медицинских технологий, 15(3), 56 – 60 (2008).
С. А. Ляликов, Медико-биологические проблемы жизнедеятельности, 5(1), 109 – 115 (2011).
Т. П. Маркова, Д. Г. Чувиров, Ремедиум, № 6, 26 – 28 (2010).
Г. А. Самсыгина, Г. С. Коваль, Педиатрия им. Г.Н. Сперанского, 89(2), 137 – 145 (2010).
Л . В. Феклисова, Е.Р. Мескина, Е.А. Воропаева, Л.В. Пожалостина [и др.], Эпидемиология и инфекционные болезни, № 4, 14 – 18 (2007).
А. А. Ярилин, Иммунология, Медицина, Москва (1999).
R. Gonzales, D.C. Malone, J.H. Maselli, M.A. Sande, Clin. Infect. Dis., 33, 757 – 762 (2001).
H. Goossens, M. Ferech, R.V. Stichele, M. Elseviers, The Lancet, 365, 579 – 587 (2005).
Клиническое значение изучения иммунологических аспектов при патологии верхних дыхательных путей обусловлено тем, что любой иммунный дисбаланс повышает вероятность развития заболевания, способствует развитию осложнений, аллергизации организма и хронизации процесса. Оценка роли местного и общего иммунитета при заболеваниях ЛОР-органов является одной из актуальных проблем в отоларингологии, учитывая существенную роль иммунопатологических механизмов при хроническом тонзиллите и рецидивирующем синусите.
Заболевания верхнечелюстных пазух являются одной из важнейших проблем отоларингологии, что обусловлено недостаточной эффективностью традиционных методов лечения (антибиотикотерапия, пункционное лечение, лазеротерапия, постоянный дренаж, синускатетеры и т. д.) и тенденцией к хроническому и рецидивирующему течению.
Альтернативой традиционным методам лечения является предупреждение развития обострений хронического тонзиллита (XT) и рецидивирующего синусита путем проведения иммунокорригирующеи терапии. Принимая во внимание роль вирусных инфекций как триггерных механизмов большинства обострений хронических заболеваний верхних дыхательных путей, изучение состояния системы интерферонов является важным направлением клинико-иммунологических исследований. Одним из актуальных, но мало изученных до настоящего времени вопросов является оценка перспектив применения интерфероногенов для профилактики и лечения заболеваний верхних дыхательных путей.
Цель исследования: определить эффективность иммунопрофилактики с использованием циклоферона при хронических тонзиллитах и рецидивирующих синуситах.
Оценить профилактический эффект применения циклоферона (ЦФ). Оценить показатели местного и общего иммунитета на фоне иммунопрофилактики ЦФ. Определить показания к применению ЦФ у больных с хроническим тонзиллитом и рецидивирующим синуситом. Разработать схемы наиболее эффективного введения ЦФ.
В выборку были включены лица с длительностью заболевания более 2 лет, без сопутствующих заболеваний и с наличием в анамнезе не менее двух эпизодов обострения в течение года.
Группу 2 составляли больные рецидивирующим синуситом в количестве 62 человек. Длительность заболевания была не менее 2 лет, больные также не были отягощены сопутствующей патологией. В группу 2 были включены пациенты с наличием не менее 2 обострений в течение года. Возраст всех пациентов мужского пола составил от 17 до 32 лет. Пациенты обеих групп были разделены на подгруппы соответственно применяемым методам.
Исследование содержимого лакун небных миндалин (НМ) производили до и после курса лечения при помощи устройства, разработанного в СПбНИИ ЛОР. Проводилось цитологическое исследование материала, извлеченного из крипт небных миндалин, посредством микроскопии нативного материала в камере Горячева. Получение смывов из полости носа производилось при помощи гортанного шприца путем промывания полости носа 2 мл физиологического раствора. Полученные смывы, как и лакунарный секрет и аликвотированные образцы сыворотки крови, замораживали при -20°С и сохраняли до проведения лабораторного исследования.
Результаты исследования и их обсуждение
Принимая во внимание, что ЦФ использовался с целью профилактики обострений хронического тонзиллита и рецидивирующего синусита, клиническими критериями оценки эффективности проводимых мероприятий были:
- Анализ динамики жалоб больного.
- Осмотр полости носа и глотки.
- Частота острых вирусных инфекций верхних дыхательных путей в осенне-зимний период. По каждой группе пациентов, в зависимости от нозологической формы и метода профилактики, анализ проводили раздельно, а затем обобщали полученные результаты.
Клинические результаты профилактики циклофероном при хроническом тонзиллите
Приведенные данные свидетельствуют о том, что различные схемы применения ЦФ при XT имеют различную клиническую эффективность. Наибольшие изменения происходят при местном применении ЦФ в разведении 1:2 и системном использовании ЦФ. Местное применение ЦФ в разведении 1:5 не сопровождалось выраженными достоверными эффектами, отличающимися от изменений у пациентов контрольной группы, которым не проводилась профилактика раствором циклоферона.
Таблица 1. Клинические результаты профилактики циклофероном у больных хроническим тонзиллитом (А — до профилактики; Б — после профилактики), абс. число/ процент
Жалобы:
Объективные данные:
Клинические результаты профилактики циклофероном при рецидивирующем синусите
В результате проведения системной профилактики рецидивирующего синусита в группе пациентов 2.1 (численностью 15 человек) в динамике объективных и субъективных симптомов был выявлен ряд изменений (табл. 2). Приведенные данные показывают, что все виды профилактических мероприятий при рецидивирующем синусите имеют результат в виде уменьшения субъективных и объективных проявлений заболевания.
Таблица 2. Клинические результаты профилактики ЦФ у больных рецидивирующим синуситом (А — до профилактики; Б — после профилактики)
Выделения из носа
Носовое дыхание
Степень отечности слизистой оболочки
Данные рентгенологического исследования
Наиболее выраженный эффект наблюдался при использовании раствора ЦФ системно (группа 2.1) и местно (группа 2.2). У больных значительно уменьшилось проявление заболевания, количество рецидивов по сравнению с контрольной группой уменьшилось в два раза, заболеваемость острыми респираторными инфекциями в группе 2.1 меньше в 2 раза, а в группе 2.2 случаев острых респираторных заболеваний отмечено не было.
Данные, полученные в группе 2.3 (местное применение раствора ЦФ в разведении 1:5), сопоставимы с результатами контрольной группы. Клинический эффект полученный у ряда пациентов, был непродолжительным, что в значительной мере и повлияло на количество обострений и заболеваемости респираторно-вирусными инфекциями.
При сравнении результатов профилактики XT и PC системным введением препарата найдено, что профилактический и иммуномодулирующий эффект циклоферона не зависит от характера патологии, что подтверждает высокий коэффициент корреляции (г= 0,647 ± 0,191, рСравнение эффективности применения разных схем введения препарата, в профилактике XT дало следующие результаты:
- высокое сходство эффективности системного введения и местного введения препарата в разведении 1: 2 (г= 0,582 ±0,192),
- полное отсутствие корреляции между результатами системного и местного (1:5) введения (г= -0,078 ± 0,235, р>>0,05) и достоверная обратная корреляция между результатами местной профилактики ЦФ в разведении 1:2 и 1:5 (г= 0,502 ± 0,204, р
Это подтверждает предположение о том, что в профилактике хронического тонзиллита системное и местное (1:2) введение ЦФ оказываются одинаково эффективными, в то время как местное (1:5) введение не имеет клинической и профилактической эффективности.
Различные схемы терапии синуситов не обнаружили достоверных положительных или отрицательных корреляций. Косвенно это подтверждает выдвинутую гипотезу об ином характере местной профилактики ЦФ в разведении 1:2, это особенно заметно по изменению структуры подклассов синтезируемых антител по сравнению с системным введением препарата в том же разведении при терапии хронического тонзиллита.
Приведенный анализ полученных результатов еще раз подтверждает высокую профилактическую эффективность циклоферонотерапии как в случае хронических тонзиллитов, так и рецидивирующих синуситов.
Ключевые слова: ОРВИ, грипп, часто болеющие дети, ротавирусная инфекция, ВИЧ, метаанализ, Циклоферон ®
Keywords: ARVI, flu, frequently ill children, rotavirus infection, HIV, meta-analysis, Cycloferon ®
Резюме. В обзоре суммированы данные некоторых публикаций по применению меглюмина акридонацетата (Циклоферона) у детей, отобранные из многочисленных источников литературы. Показана эффективность препарата при острых респираторных вирусных инфекциях и гриппе, в том числе у часто болеющих детей и детей с аллегопатологией. Обзор также включает данные собственных исследований по применению Циклоферона при ротавирусной инфекции и ВИЧ-инфекции у детей. Достаточно подробно поясняется механизм действия препарата. В заключение даны результаты метаанализа публикаций об эффективности клинического применения Циклоферона.
Summary. The review summarizes data from some publications on the use of meglumin acridonacetate (Cycloferon ® ) in children, selected from numerous literature sources. The drug has been shown to be effective in acute respiratory viral infections and flu, including in frequently ill children and children with allegopathology. The review also includes data from our own research on the use of Cycloferon ® in rotavirus infection and HIV-infection in children. The mechanism of action of the drug is explained in sufficient detail. In conclusion, the results of meta-analysis of publications on the effectiveness of clinical use of Cycloferon ® are given.
Несмотря на весьма обширный список лекарственных препаратов, острые респираторные заболевания (ОРЗ) остаются до сих пор плохо контролируемыми инфекциями. Одной из причин этого является их полиэтиологичность: в настоящее время известно более 200 вирусов шести семейств, вызывающих заболевания носоглотки и дыхательных путей.
В связи с возрастанием роли вирусов в патологии человека интерес врачей и исследователей к противовирусной терапии постоянно растет. За последние десятилетия появилось множество препаратов, действующих на респираторные вирусы на различных этапах их жизненного цикла. Однако ввиду отсутствия у практического врача чувствительных методов вирусологической экспресс-диагностики у пациентов с острыми респираторными вирусными инфекциями (ОРВИ) часто и вполне обоснованно применяют препараты, обладающие широким спектром противовирусного действия за счет неспецифических механизмов влияния на иммунитет [1].
Механизм действия Циклоферона
Основным достоинством Циклоферона является его полифункциональность – сочетание различных фармакологических эффектов. Широкий спектр профилактического и лечебного действия препарата при ОРВИ обусловлен прямым воздействием на репликацию вирусов и его интерферониндуцирующей, противовоспалительной и иммунокорригирующей активностью [2].
Циклоферон ® как индуктор интерферона
Ведущую роль в защите против вирусов играют интерфероны 1-го и 2-го типов (INF-α/β и γ). Процесс образования интерферона требует индукции, а неодинаковая способность людей индуцировать интерферон связана с особенностями иммунного ответа. Низкая индукция INF-α и INF-γ при ОРВИ служит признаком измененной реактивности больных, объясняя возникновение реинфекции и бактериальных осложнений при текущей вирусной инфекции, активируя латентные очаги и наслоение суперинфекции. Депрессия иммунных реакций, наиболее выраженная в начале вирусной инфекции, особенно гриппозной, создает условия для попадания персистирующей в верхних дыхательных путях микробной флоры в другие – в норме стерильные – отделы с развитием в них воспалительного процесса.
У пациентов с осложненным течением ОРВИ на фоне заболеваний ЛОР-органов также наблюдается снижение индукции INF-α и INF-γ. Исходя из этого, в последние годы стали говорить о так называемой многоцелевой монотерапии ОРЗ, когда с помощью одного лекарственного средства удается добиться нескольких клинических эффектов. В этом плане рациональным является использование препаратов, стимулирующих продукцию собственного интерферона, активирующих естественный иммунитет и корригирующих адаптивный. Циклоферон ® индуцирует синтез INF-α. Преимуществами препарата являются быстрое проникновение в кровь, низкое связывание с белками, широкое распространение в органах, тканях и биологических жидкостях организма. 99% введенного препарата элиминируется почками в неизмененном виде в течение 24 часов. Однократное введение Циклоферона обеспечивает относительно длительную (до 72 часов) циркуляцию интерферона на терапевтическом уровне. Циклоферон ® не обладает пирогенностью и аллергенностью; отсутствует опасность возникновения аутоиммунных процессов, отсутствуют мутагенный, тератогенный, эмбриотоксический, канцерогенный эффекты; не метаболизируется в печени и хорошо сочетается с традиционными терапевтическими средствами лечения. Высокая степень безопасности позволяет применять Циклоферон ® как в педиатрической практике, так и у лиц пожилого возраста. Сопутствующие соматические заболевания не требуют корректировки дозы препарата. Поскольку Циклоферон ® активирует выработку организмом эндогенного интерферона, не обладающего антигенностью, закономерно отсутствуют негативные эффекты, присущие препаратам экзогенного интерферона. Синтез интерферона сбалансирован и подвергается контрольно-регуляторным механизмам, обеспечивающим защиту организма от перенасыщения.
Циклоферон ® как регулятор цитокинов
Одним из важных направлений формирования полноценного иммунного ответа является регуляция синтеза INF-γ. Продукция INF-γ Th1 осуществляется благодаря стимуляции INF-γ-индуцирующих цитокинов (ИЛ-12, ИЛ-2 и ФНО-α). ИЛ-12, лидируя в быстрой активации моноцит/макрофагальной системы посредством стимуляции синтеза INF-γ, выступает в роли синергиста ИЛ-12, который стимулируется при действии Циклоферона [2].
Циклоферон ® как противовирусное средство
В результате проведенных исследований было показано протективное действие Циклоферона при пероральном применении в отношении экспериментальной гриппозной инфекции (штамм A/Aichi/2/68 (H3N2)) у белых мышей. Показано, что применение препарата вызывает индукцию интерферона и проводит к увеличению продолжительности жизни животных, угнетению репродукции вируса в легких, снижению инфекционной активности вируса [3].
Аденовирусы представляют собой широкую группу патогенов человека, которые в настоящее время не имеют конкретных и безопасных лекарств для лечения. Продемонстрирована прямая (не IFN-опосредованная) противовирусная активность Циклоферона (10-карбоксиметил-9-акриданона, CMA), мощного индуктора интерферона, против аденовируса типа 6 (Ad6) в клетках Hep-2. Продукцию вируса и детали морфогенеза изучали с помощью иммуноферментного анализа (ИФА) с антителами к белку гексона Ad6 и просвечивающей электронной микроскопии соответственно. ИФА показал, что CMA не ингибирует синтез вирусного белка, но вместо этого сильно снижает способность вируса генерировать инфекционное потомство вируса в зависимости от дозы. Ультраструктурное исследование показывает, что CMA изменяет структуру внутриядерных вирус-специфических включений. Предполагается, что CMA подавляет поздние стадии вирусного цикла в зараженной клетке [4].
Цикл репликации вируса простого герпеса (ВПГ) хорошо изучен, и его выраженные морфологические этапы репродукции в клетке делают его удобной моделью для изучения противовирусной актиности химических соединений. В ходе проведенных исследований впервые показано, что воздействие Циклоферона приводит к ярко выраженной задержке репликативного цикла ВПГ на стадии формирования ДНК-содержащих капсидов в ядрах клеток, тогда как воздействие INF-α проявляется на более поздних стадиях вирусного морфогенеза и препятствует формированию наружной липопротеидной оболочки вирионов ВПГ. Полученные результаты свидетельствуют, что Циклоферон ® обладает дополнительным, по сравнению с интерфероном, вирус ингибирующим действием [5].
Циклоферон ® как стимулятор образования дефект-интерферирующих вирусных частиц
Аномальные или дефектные формы вирусов обнаружены практически у всех инфекционных и онкогенных вирусов животных и человека; они образуются в процессе внутриклеточного цикла развития вирусов и/или под действием различных экзогенных факторов (химических, физических и биологических). Было экспериментально доказано формирование дефектных интерферирующих частиц вирусов под влиянием Циклоферона [5].
Клиническая эффективность Циклоферона
Циклоферон ® в профилактических целях в период сезонного подъема заболеваемости ОРВИ позволяет корригировать иммунные дисфункции в клеточном, гуморальном звеньях иммунитета, факторах неспецифической резистентности, обеспечивая снижение заболеваемости.
И.Л. Высочиной показаны снижение кратности (в 2,2 раза) и длительности эпизодов (на 2,7 дня), уменьшение проявлений синдрома лимфаденопатии, астенического и синдрома хронической усталости, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. В исследованиях И.В. Сарвилиной отмечены снижение частоты ОРВИ в 4,1 раза и уменьшение длительности обострения ОРЗ в 1,7 раза, а также остроты развития аллергии в 4,1 раза и частоты развития аллергии в 4,6 раза. В исследованиях М.Г. Романцова, Т.И. Гаращенко, Е.П. Сельковой показана эпидемиологическая эффективность Циклоферона (индекс эффективности 2,9 при колебаниях от 2,4 до 3,4 при показателе защиты от 58,5 до 67,1%), отмечено снижение уровня заболеваемости в 2,9 раза. В случаях ОРВИ, осложненной лакунарной ангиной, нормализация температуры (в первые 48 часов) отмечена у 88% больных против 24% пациентов, получающих антибиотики.
О.Г. Шульдяковой, М.Г. Романцовым, А.А. Шульдяковым (2007) показано снижение заболеваемости в 2,4-4,4 раза в организованных коллективах детей и подростков. При приеме курса Циклоферона наблюдается смена структуры ОРВИ среди заболевших, увеличиваются легкие, уменьшаются тяжелые и осложненные (в 4,3 раза и более) формы заболеваний. Улучшение клинической симптоматики происходит на фоне усиления макрофагальной активности, активации синтеза интерферона, снижения уровня ФНО, нарастания концентрации иммуноглобулина А (IgA), включая его секреторный компонент (s-IgA). Циклоферон ® наиболее эффективен, если начать его прием при первых признаках заболевания. Важно, что терапевтические свойства данного препарата не зависят от этиологии ОРВИ. Препарат хорошо проникает через гематоэнцефалический барьер, что препятствует развитию таких осложнений, как менингит, энцефалит и др. У взрослых и детей с 4 лет Циклоферон ® назначается по базовой схеме согласно инструкции.
Кроме того, хорошо известно, что при ОРВИ у многих пациентов может происходить реактивация ряда латентных инфекций. Применение в терапии Циклоферона, обладающего активностью в отношении ВПГ, цитомегаловируса (ЦМВ), способствует профилактике рецидивов герпесвирусных инфекций.
Циклоферон ® у часто болеющих детей
Изучено влияние включения в схему терапии препарата Циклоферон ® на эффективность лечения ОРВИ у часто болеющих детей. Проведен анализ результатов лечения 117 детей, разделенных на три группы в зависимости от схемы терапии. Кроме симптоматической и местной противовирусной терапии пациентам 1-й (контрольной) группы была назначена антибиотикотерапия, 2-й (сравнения 1) группы – антибиотики и Циклоферон ® , 3-й (сравнения 2) группы – Циклоферон ® . В начале лечения выявлено снижение уровня INF-α и INF-γ при сохраненных показателях сывороточного интерферона, что свидетельствовало о снижении компенсаторных реакций, обеспечивающих противовирусную защиту. Анализ параметров иммунного статуса выявил, что у половины детей происходит активация компенсаторных механизмов (стимуляция выработки CD4+, CD8+ и увеличение показателей HCT-теста), а у 1/3 – срыв (снижение уровня CD4+, CD16+, IgA и HCT-теста). После лечения отмечено восстановление интерфероногенеза у большинства (86,7%) больных, получавших Циклоферон ® , у 74,1% детей, получавших в схеме лечения Циклоферон ® и антибиотики, и только у 47,1% пациентов, получавших антибиотики. При сравнении иммунных показателей при лечении, включавшем антибиотикотерапию без Циклоферона и в сочетании с ним, в последнем случае чаще отмечена более выраженная и сбалансированная реакция в виде нормализации уровня CD4+ и CD8+. Таким образом, включение в схемы лечения ОРВИ у часто болеющих детей препарата Циклоферон ® оказывает положительное действие на иммунный статус, выражающееся в восстановлении изначально сниженного интерфероногенеза, а при сочетании Циклоферона с антибиотикотерапией – иммуномодулирующее действие с благоприятной динамикой иммунных показателей [6].
Дефекты системы иммунитета у часто болеющих детей разнообразны. На практике мы можем наблюдать нарушения различных звеньев врожденного и адаптивного иммунитета. Сведения об иммунном статусе таких пациентов, цитируемые в медицинской литературе, различны, приведены в разные периоды заболевания у детей различных возрастных групп. Для лечения детей используется обычно Циклоферон ® в таблетках. Иммунореабилитация в период ремиссии способствует нормализации активационных процессов системы иммунитета: уменьшению избыточной активации в виде отсутствия значимых отличий от уровня групп сравнения CD3+, CD8+, CD28+, активированных Т-лимфоцитов в подгруппах субпопуляций лимфоцитов, экспрессирующих рецепторы к липополисахариду [7].
Циклоферон ® в клинике инфекционных болезней
А.А. Шульдяков и соавт. в своей статье приводят научное обоснование использования индукторов интерферона в клинике большого ряда инфекционных болезней. Дана оценка эффективности Циклоферона в комплексном лечении больных гриппом и другими ОРВИ, герпесвирусными, арбовирусными и кишечными инфекциями, туберкулезом, в том числе на фоне ВИЧ-инфекции, хроническим бруцеллезом и др. [8].
Циклоферон ® в профилактике ОРЗ у детей С ВИЧ-инфекцией
Грипп и другие ОРВИ у детей, больных ВИЧ-инфекцией, представляет большую опасность не только в связи с повышенным риском осложнений и обострений хронической патологии, но и вследствие усугубления иммунодефицита. Поэтому профилактика заболеваний является приоритетной для данной группы детей.
Детально изученное противовирусное (в том числе подавление ВИЧ-1-активности), иммунокорригирующее действие Циклоферона (нормализация СД-4+-клеток, соотношение СД4/СД8+, влияние на макрофагально-фагоцитарную систему), его ингибирующее действие на возбудителей ряда оппортунистических инфекций, интерферон-индуцирующая и цитокин-регулирующая активность послужили основанием для назначения препарата детям с ВИЧ-инфекцией в качестве средства неспецифической профилактики гриппа и других ОРВИ в период сезонного подъема заболеваемости [9].
Проведенное исследование позволило выявить достоверное увеличение концентрации INF-γ и снижение концентрации ИЛ-4, ИЛ-8, ИЛ-1β в сыворотке крови ВИЧ-инфицированных детей через 6 месяцев после начала проведения программы профилактики ОРЗ Циклофероном. Увеличение концентрации INF-γ при одновременном снижении ИЛ-4 говорит в пользу активации Th1-ответа и индукции клеточных реакций, что является благоприятным фактором для течения ВИЧ-инфекции.
В целом отмечается значительное уменьшение проявлений инфекционного синдрома иммунной недостаточности, характеризующееся уменьшением частоты вирусных и бактериальных заболеваний органов дыхания и рецидивов оппортунистических инфекций (герпеса и кандидоза). Интегральный показатель – индекс частоты острых заболеваний – снижается в 2,7 раза [9].
Циклоферон ® при ротавирусной инфекции у детей
Острые кишечные инфекции (ОКИ) продолжают занимать одно из ведущих мест в инфекционной патологии, уступая по частоте лишь гриппу и другим ОРВИ. По данным Всемирной организации здравоохранения, ежегодно в мире регистрируется более 4 млрд случаев заболеваний, при этом заболеваемость у детей значительно превышает таковую у взрослых. В последние годы до 50-80% случаев ОКИ у детей связывают с вирусным поражением. Вирусные диареи обусловлены такими инфекционными агентами, как ротавирусы, аденовирусы, калицивирусы, торовирусы, астровирусы, коронавирусы и др., список которых постоянно растет. При этом ведущая роль в развитии вирусных диарей принадлежит ротавирусам, которые являются основной причиной гастроэнтеритов у детей младше 5 лет во всем мире. Ротавирусная инфекция на протяжении почти 30 лет сохраняет лидирующие позиции как причина заболеваемости и смертности детей раннего возраста.
Целью проведенного исследования стало изучение влияния индуктора синтеза эндогенного интерферона меглюмина акридонацетата на клиническое течение ротавирусного гастроэнтерита у детей.
Ранее описаны положительный опыт использования Циклоферона при ОКИ бактериальной и вирусной этиологии и при длительном бактерионосительстве, а также тот факт, что применение меглюмина акридонацетата увеличивает продукцию интерферонов иммунными клетками кишечника и способствует более быстрой элиминации ротавируса из организма.
Большинство пациентов с ротавирусной инфекцией были от 1 до 3 лет – 65,8 и 61,3% в основной и контрольной группах соответственно. 78,9 и 83,9% больных исследуемых групп не посещали детские учреждения.
При расчете частотных характеристик и отношения шансов (OR) двух ведущих клинических синдромов ротавирусной инфекции у пациентов исследуемых групп установлено, что интоксикационный синдром через 3 дня терапии сохранялся у 39,5% в основной и у 51,6% в контрольной группе, OR=1,64 (0,72-3,71). При этом на 5-й день терапии встречаемость диарейного синдрома у пациентов основной группы составила 36,8 против 69,4% в группе сравнения (p<0,01), OR=3,88 (1,7-9,1) [10].
Метаанализ эффективности Циклоферона
В результате систематического обзора и последующего метаанализа результатов рандомизированных клинических исследований по оценке эффективности иммуномодулятора Циклоферона в таблетках при вирусных заболеваниях органов дыхания у взрослых и детей (Н.К. Мазина и соавт., 2017) была получена обобщенная оценка его клинической эффективности с учетом неоднородности сравниваемых групп и изменчивости параметров отклика. Значения формализованных параметров клинической эффективности Циклоферона (повышение абсолютной и относительной пользы, OR, число больных, которых необходимо лечить дополнительно Циклофероном, чтобы достичь благоприятного исхода или предотвратить неблагоприятный исход у одного больного, и др.) вычисляли по данным, опубликованным в 16 статьях. Высокая неоднородность затруднила однозначную интерпретацию результатов, однако объединение однородных сравниваемых групп в метаанализе (с поправками на фиксированный и случайный эффекты) повысило статистическую мощность исследования. OR позитивного эффекта у детей (отсутствие новых случаев заболевания после профилактического приема) в возрасте от 6 до 18 лет составило 5,3 (при 95% доверительном интервале (ДИ) от 4,8 до 5,9), коэффициент гетерогенности χ²=249,5; р=0,000. ; I2=94,8% (при 95% ДИ от 92,7 до 96,3). Это свидетельствовало о неоднородности данных клинических исследований и приближало полученную оценку к медицинской практике. У взрослых применение Циклоферона для лечения ОРВИ повышало шанс перенести заболевание в легкой форме и избежать тяжелых осложнений: OR позитивных исходов составило 9,7 (при 95% ДИ от 7,0 до 13,0), при этом эффект был более однородным, чем в детской популяции: коэффициент гетерогенности χ²=7,4; р=0,061. ; I2=59,4% (при 95% ДИ от 0 до 86,5). Таким образом, применение Циклоферона для лечения и профилактики ОРВИ более чем в 5 раз повышает вероятность избежать заболевания либо перенести его в легкой форме [11].
Циклоферон ® производится в России в соответствии с европейским стандартом качества лекарственных препаратов (GCP).
Читайте также:

