Циркуляция вируса в крови
Обновлено: 18.04.2024
РНК-вирусы как причина развития рака - вирусный канцерогенез
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
РНК-содержащие вирусы вызывают развитие целого ряда различных опухолей у животных, при этом наиболее распространена индукция этими вирусами лимфом, лейкемий и сарком. Типичная структура таких вирусов - это две идентичные цепочки молекул РНК в сочетании с ферментом обратная транскриптаза, одетых в гликопротеиновую оболочку. При инфицировании вирусом его обратная транскриптаза заставляет клетки синтезировать ДНК, комплементарную вирусной РНК.
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
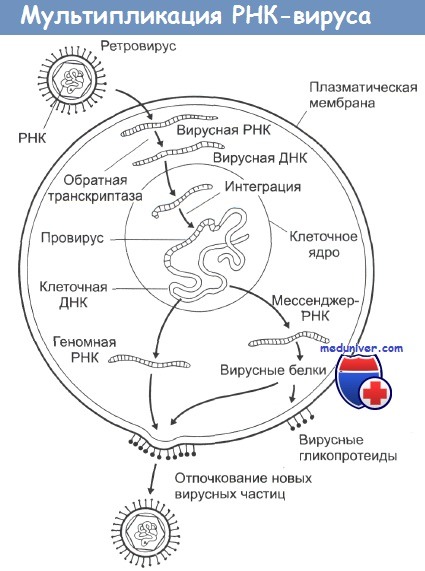
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
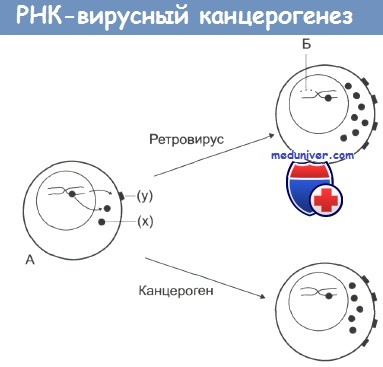
Онкогенная и злокачественная трансформация.
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Вирусные инфекции. Особенности патогенеза вирусных инфекций. Основные этапы патогенеза вирусных инфекций.
В основе патогенеза вирусных инфекций лежит взаимодействие генома вируса с генетическим аппаратом чувствительной клетки. Исключая поражения, вызываемые вирусами, распространяющимися по нервной ткани, патогенез вирусных инфекций сопровождает вирусемия (виремия)— циркуляция возбудителя в крови. В кровоток возбудитель проникает прямым путем или из лимфатической системы. Многие вирусы (например, ВИЧ, вирусы гриппа, кори, герпеса) поражают иммунокомпетентные клетки, что чаще проявляется в нарушении функций и уменьшении числа Т-хелперов, увеличении содержания и активации Т-супрессоров или В-клеток. Некоторые возбудители образуют внутриядерные или цитоплазматические тельца включений (например, тельца Бабеша~Нёгри). имеющие диагностическое значение.
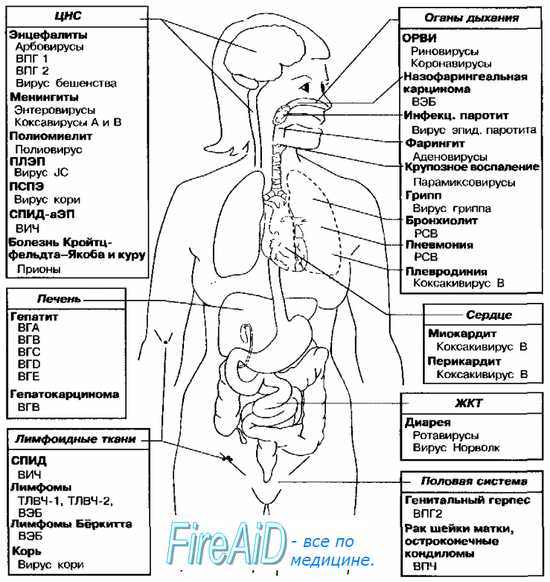
Рис. 5-9. Органы-мишени наиболее распространённых вирусных инфекций человека. ВЭБ — вирус Эпстайна-Барр, ВГА — вирус гепатита А, ВГВ — вирус гепатита В, ВГС — вирус гепатита С, BID — вирус гепатита D, ВГЕ — вирус гепатита Е, ВПЧ — вирус папилломы человека, ВПГ — вирус простого герпеса, ТЛВЧ — Т-пимфотропный вирус человека, ВИЧ — вирус иммунодефицита человека, ПЛЭП — прогрессирующая лейкоэнцефалопатия, РСВ — респираторно-синцитиальный вирус, ПСПЭ — подострый склерозирующий панэнцефалит, ОРВИ — острая респираторная вирусная инфекция, СПИД-аЭП — СПИД-ассоциированная энцефалопатия.
Основные этапы патогенеза вирусных инфекций
Проникновение вируса в организм. Основные входные ворота для возбудителей вирусных инфекции человека — дыхательные пути и ЖКТ, реже — кожные покровы. В некоторых случаях развиваются локальные поражения, но чаще в месте проникновения не возникает каких-либо проявлений или они носят стёртый характер, а возбудитель мигрирует в чувствительные ткани. Распространение возбудителя в организме может носить локальный или системный характер.
Локальные поражения вирусами типичны для возбудителей респираторных и кишечных инфекций, а также для некоторых кожных заболеваний. Продолжительность инкубационного периода большинства подобных инфекций составляет 2-3 сут. Первичную репликацию часто сопровождает вирусемия. Она обычно протекает бессимптомно или по типу продромальных явлений, но может возникать и на фоне выраженной клинической картины, не вызывая развития дополнительной симптоматики. Для подобных заболеваний характерно повторное заражение, так как циркулирующие AT не проявляют протективный эффект, а секреторный иммуноглобулин А (IgA) оказывает лишь кратковременное нейтрализующее действие на слизистой оболочке. Системные поражения. Из места проникновения возбудители попадают в кровоток, вызывая вирусемию, и постепенно фиксируются в чувствительных тканях. Первичное распространение обычно вызывает продромальные явления. Поскольку вирусемия предшествует поражению чувствительных тканей, то продолжительность инкубационного и продромального периодов подобных инфекций могут увеличиваться до 2-3 нед. Вирусемия при системных инфекциях обычно носит двухэтапный характер. Первый этап заканчивается поглощением циркулирующих вирусов клетками ретикулоэндотелиальной системы.
В дальнейшем возможно несколько вариантов:
• полная элиминация возбудителя (абортивная инфекция);
• размножение вирусов в фагоцитах с последующим выходом и развитием выраженной вторичной вирусемии, сопровождающейся появлением характерных клинических признаков заболевания (например, энцефалитов);
• некоторые вирусы (например, вирус гепатита В, пикорна- и тогавирусы) слабо поглощаются фагоцитами и могут циркулировать в крови в свободном состоянии, а возбудители колорадской клещевой лихорадки и лихорадки долины Рифт внедряются в эритроциты.
Основные органы-мишени наиболее распространённых вирусных инфекций представлены на рис. 5-9. Многие из указанных на рисунке возбудителей могут поражать, кроме названных, и другие ткани (так, полиовирусы способны вызывать поражения ЖКТ, а вирус эпидемического паротита обладает тропностью к эпителию извитых канальцев яичек).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В заражённых вирусом клетках возможны патологические проявления разностороннего характера.
Морфология патологических эффектов. Зараженные вирусом клетки. Основные реакции зараженных вирусом клеток.
Характерные проявления взаимодействий между вирусом и чувствительными клетками-видимые поражения заражённых клеток вплоть до их гибели, а также присутствие возбудителей в исследуемом материале.
Альтерация и воспаление зараженных вирусом тканей. При вирусных инфекциях на первый план выступает картина повреждения клеток и воспалительных изменений тканей, при различных инфекциях их соотношение и выраженность варьируют. В противоположность бактериальным инфекциям (где доминируют полиморфноядерные лейкоциты), при вирусных поражениях среди клеточных элементов воспалительных реакций доминируют мононуклеары (лимфо- и моноциты). На этапах, предшествующих разрушению клеток, можно визуально наблюдать их дегенеративные и некротические изменения.
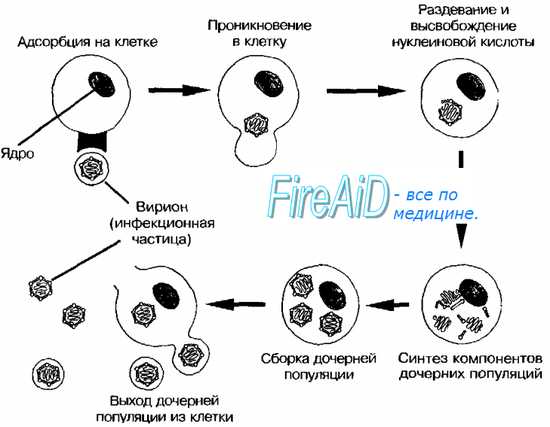
Тельца включений зараженных вирусом клеток. Микроскопия заражённых клеток часто позволяет выявить тельца включений — характерный, но не абсолютный признак вирусных поражений. Тельца значительно крупнее, чем отдельные вирионы, и часто окрашиваются кислыми красителями (например, эозином).
• При заражении клеток ДНК-содержащими вирусами тельца включений располагаются в ядре; исключение — тельца включений поксвирусов (тельца Гварнери).
• При заражении клеток РНК-содержашими вирусами тельца включений располагаются в цитоплазме (например, тельца Бабеша-Нёгри, выявляемые в цитоплазме клеток головного мозга при бешенстве).
Причины гибели зараженных вирусом клеток. Размножаясь в клетке, вирусы индуцируют синтез вирусспецифических белков, в той или иной степени подавляющих метаболизм клетки. Нарушение синтеза макромолекул вызвано нарушением трансляции клеточной мРНК. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление макромолекулярных синтезов в клетке вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы. Действие указанных вирусов реализуется на ранних этапах (до появления морфологических признаков цитопатического эффекта). Ингибирование синтеза РНК и ДНК обычно вторично по отношению к воздействию на белки, контролирующие экспрессию генов и пролиферацию клетки. Значительно реже нарушения вызывают вирусные белки, напрямую ингибирующие синтез нуклеиновых кислот. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление синтезов нуклеиновых кислот вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы.
Во время репродукции вируса в клетке накапливаются вирусные компоненты, оказывающие токсическое и повреждающее действие на клеточные структуры. Например, цитотоксические свойства проявляют капсомеры некоторых аденовирусов, гликопротеины парамиксовирусов. В процессе вирусной инфекции также происходит повреждение мембран лизосом, содержимое которых высвобождается и осуществляет аутолиз клетки. Таким образом, гибель клеток наступает в результате сочетания раннего подавления синтеза клеточных компонентов, накопления токсических вирусных продуктов и повреждения лизосом.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Наука и медицина
Мы думаем о Covid-19 как о респираторном вирусе, который поражает исключительно легкие.
Ученые задаются вопросом, в потоке медицинских статей, опубликованных за последние несколько недель, что если инфекция может проникнуть глубоко в нашу сосудистую систему и даже в наш мозг?
Так как коронавирус атакует?
Нос и горло
Именно здесь начинается инфекция, колонизируя верхние дыхательные пути, часто блокируя наше обоняние, прежде чем попасть в горло. Клетки верхних дыхательных путей содержат фермент, известным как белок ACE2. Этот белок позволяет короновирусу Sars-Cov-2позволяют фиксироваться на рецепторе клетки, проникать в клетку. Проникнув в клетку? вирус начинает размножаться с большой скоростью воспроизводя клетки вируса.
В этот момент пациенты очень заразны, но, возможно, еще не страдают какими-либо симптомами? кроме потери обоняния (потеря обоняния наблюдается у многих заразившихся). Это одна из самых хитрых и необычных уловок этого вируса — заставить жертву своей атаки, человека, распространять его среди людей, не давая зараженному человеку понять, что он болен и способен заразить того, для которого это, возможно, будет трагично.
Легкие
Если иммунная система организма человека не убивает вирус Sars-Cov-2 на этой ранней стадии, вирус распространяется по дыхательным путям в легкие. Именно внутри легких вирус становится очень опасным. Он проникает в миллионы крошечных воздушных мешочков в легких, вызывая их воспаление.

Для некоторых пациентов это может привести к острому респираторному дистресс-синдрому (ARDS) — потенциально смертельному состоянию, когда уровень кислорода в крови снижается до опасно низкого уровня.
Сердце и кровеносные сосуды
Легкие могут быть эпицентром Covid-19, но ученые считают, что он также может проникать в кровеносную систему, проникая в наши артерии.
Как именно вирус атакует сердце и кровеносные сосуды, остается загадкой, но эксперты полагают, что инфекция может вызывать сгустки крови, сердечные приступы, поскольку вирус связывается с рецепторами ACE2 на клетках, выстилающих наши кровеносные сосуды и сердце.
Одно исследование опубликованное в научном журнале JAMA Cardiology показало, что у 20 процентов из 416 пациентов, госпитализированных в Ухань с коронавирусом, было повреждение сердца.
Это может объяснить, почему пациенты с диабетом и сердечно-сосудистыми заболеваниями подвергаются риску тяжелой болезни с Covid-19, поскольку их сосудистая система уже находится в дополнительном напряжении.
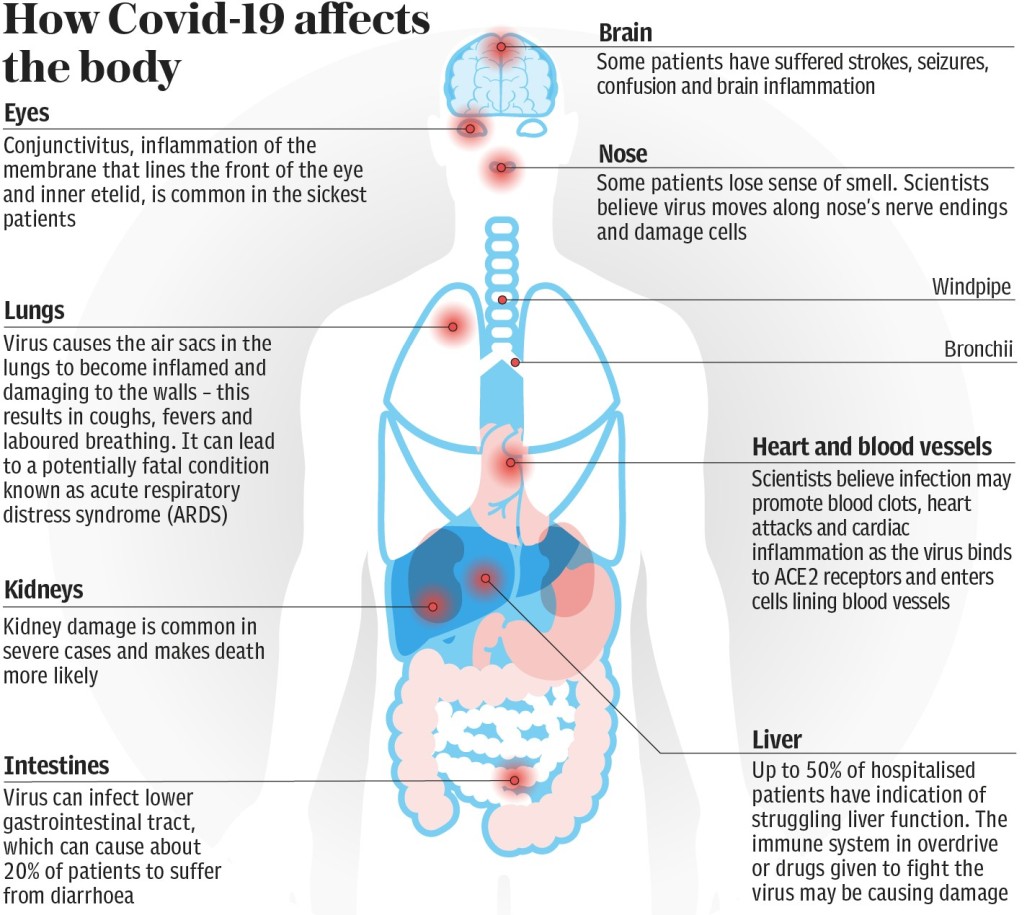
Печень
Почки
В тяжелых случаях Covid-19 может вызвать повреждение почек — одно предварительное исследование 85 госпитализированных пациентов в Ухани показало, что у 27 процентов была обнаружена почечная недостаточность.
Неясно, происходит ли это потому, что вирус поражает почки напрямую — в органе имеется множество рецепторов ACE2 — или это реакция организма на что-то еще, например, падение артериального давления.
В любом случае это может значительно увеличить потребность на диализные аппараты.
Головной мозг
Доктора до сих пор не знают, как вирус влияет на мозг, но исследования показали, что пациенты с Covid-19 переносили инсульт, судороги, спутанность сознания и воспаление мозга.
В Японии одно тематическое исследование сообщило о следах вируса в спинномозговой жидкости пациента Covid-19, у которого развился менингит и энцефалит. Это говорит о том, что Sars-Cov-2 может проникать в центральную нервную систему.
Читайте также:

