Цитокины при вирусных инфекциях
Обновлено: 19.04.2024
Лечение респираторных заболеваний представляет собой постоянную актуальную проблему для медицины. Местная антибактериальная терапия в большинстве случаев эффективна как при острых, так и при хронических инфекциях дыхательных путей. Антибиотик местного дей
Цитокины — это молекулы, продуцируемые иммунокомпетентными клетками. Они обеспечивают межклеточную взаимосвязь в ходе реализации иммунного ответа
Наряду с известными многоступенчатыми и многофакторными сторонами иммунного ответа на инфекционный агент особое значение имеет кооперация иммунокомпетентных клеток, опосредованная цитокинами. В настоящее время цитокиновая сеть в качестве важного эндогенного механизма иммунорегуляции активно изучается. Определение профиля цитокинов можно рассматривать как важнейшую характеристику иммунной системы, позволяющую глубже понять механизм патогенеза многих заболеваний, а также один из ключевых параметров эффективности иммунотропных препаратов.
В запуске специфического иммунного ответа участвуют противовоспалительные цитокины: IL-1, IL-6, IL-8, IL-12, TNF-, IFN- и др. Провоспалительные цитокины составляют альтернативную группу: IL-4, IL-10, IL-13, TGF-.
Интерлейкин 1 (IL-I) синтезируется в основном клетками моноцитарно-макрофагального ряда. Одно из основных свойств IL-1 заключается в способности стимулировать функциональную активность лейкоцитов, в том числе фагоциты, Т- и В-лимфоциты и костномозговое кроветворение.
Интерлейкин 8 — это сильнейший хемоатрактант для нейтрофилов.
Туморнекротирующий фактор альфа (TNF- ) является сильным активатором нейтрофилов, наделен антивирусной активностью. TNF- увеличивает проницаемость сосудов. При длительном хроническом воспалении служит одним из медиаторов деструкции тканей.
Интерферон и . Для INF- (лейкоцитарного интерферона) продуцентами являются макрофаги и В-лимфоциты. Синтез INF- осуществляется Т-лимфоцитами. Наиболее сильное противовирусное и антипролиферативное действие характерно для INF-. Интерфероны в основном известны как противовирусные препараты. Вместе с тем интерфероны являются важнейшими цитокинами, выполняющими роль регуляции кооперации клеток, участвующих в иммунном ответе. Это позволяет рассматривать препараты интерферонов как иммуномодуляторы. Установлено, что INF- осуществляет взаимодействие между Т-лимфоцитами и макрофагами. Имеются данные о том, что интерфероны всех типов играют первостепенную роль в созревании и дифференциации Т-клеток в тимусе, но одновременно угнетают сенсибилизацию и пролиферацию лимфоцитов, оказывают супрессорное действие на антителообразование в В-клетках и создают контактную чувствительность антител к рецепторам.
Роль цитокинов в течении острого и самоподдерживающегося хронического воспалительного процесса в слизистой оболочке верхних дыхательных путей очевидна. Проявление агрессии инфицирующего агента возможно только при условии, если он сможет преодолеть первый надэпителиальный эшелон защиты, представленный в основном неспецифическими механизмами иммунной системы. В дальнейшем наступает активация следующих эшелонов защиты. При этом эпителиальные клетки могут вызывать, распространять и модулировать воспаление. Они могут генерировать провоспалительные цитокины (IL-6, IL-8, TNF-), привлекающие воспалительные клетки. Каскад включения специфического иммунного ответа начинается с макрофагов. Активированные макрофаги высвобождают провоспалительные цитокины (IL-1, IL-6, IL-8, TNF-).

Активированные Th1-клетки продуцируют цитокины: IL-2, IL-10, IFN-. ThII модулируют иммунный ответ посредством цитокинов IL-1, IL-3, IL-4, IL-5, IL-6. Цитокины играют важную роль в активации и миграции в очаг воспаления моноцитов, нейтрофилов, эозинофилов и др. Активированный эндотелий сосудов способствует изменению свойств лейкоцитов, их примыканию к стенке сосуда и миграции через сосудистую стенку в очаг воспаления.
С цитокинами, продуцируемыми Т-клетками, связан широкий спектр патологических процессов. Повреждение тканей хозяина вызвано токсическими эффектами цитокинов (TNF- , IL-1) и других воспалительных медиаторов. TNF- , IL-1, секретируемые активизированными макрофагами, стимулируют высвобождение IL-8 из фибробластов и эпителиальных клеток.
Участие в воспалительном процессе интерферонов (IFN- и IFN-) определяется их биологическими эффектами. IFN- активирует естественные киллеры, ингибирует репродукцию вирусов и пролиферацию клеток. IFN- активирует продукцию провоспалительных цитокинов.
Стало возможным применение цитокинов в клинической практике. Описаны разнообразные иммунотропные эффекты препаратов интерфероногенов, индуцирующих синтез различных цитокинов, контролирующих процессы иммуногенеза.
Цель настоящей работы — посредством иммунологических методов исследования уровня провоспалительных цитокинов IL-1, IL-8, INF-, IFN- обосновать механизмы патогенетического действия отечественного препарата циклоферона — индуктора интерферона и цитокинов — в лечении больных рецидивирующим риносинуситом.
Исследование показателей иммунной системы проведено у 35 больных хроническим риносинуситом в возрасте от 14 до 62 лет. Из них с полипозной формой риносинусита было 14 человек, с гнойно-полипозной — 10 больных и 11 пациентов с гнойным риносинуситом. Для лечения использовали отечественный препарат — циклоферон.
Для иммунологического исследования у всех больных до и после лечения брали венозную кровь с добавлением гепарина из расчета 20 ЕД/мл.
Иммунологические обследования включали в себя определение субпопуляций лимфоцитов, функциональной активности нейтрофилов, исследование способности клеток периферической крови и небных миндалин к продукции IFN-, IFN-, ТNF-, IL-1, IL-8 in vitro, определение показателей гуморального иммунитета (иммуноглобулины класса G, A, M в сыворотке крови и SigA в назальных смывах методом радиальной иммунодиффузии, циркулирующие иммунные комплексы в сыворотке крови путем осаждения 3,5%-ным полиэтиленгликолем), а также риноцитограммы.
Для выявления способности клеток к продукции цитокинов брали венозную кровь в стерильных условиях с добавлением ЭДТА (2,6%) и/или взвесь мононуклеаров, полученных из ткани небных миндалин.
Антитела к вирусам простого герпеса класса G и М в сыворотке крови определяли с использованием иммуноферментного анализа.
Хорошим считался результат, если по завершении курса все клинические проявления болезни исчезали или уменьшались. Удовлетворительным — если сохранились без изменения один или несколько симптомов (заложенность носа, выделения, отек носовых раковин). Субъективно все больные отмечали улучшение состояния. Из 35 пациентов хорошо отреагировали на лечение 28 человек. У 7 итог был удовлетворительным. Клиническую динамику заболевания сопоставили с показателями исследования продукции цитокинов клетками цельной крови. Результаты, полученные в ходе обследования иммунной системы больных риносинуситом, леченных циклофероном, показали неоднозначное реагирование иммунокомпетентных клеток (ИКК) и продукции цитокинов.
Основным биологическим эффектом циклоферона признано его свойство интерфероногена, индуцирующего синтез эндогенного интерферона.
Установлено также, что циклоферон влияет на продукцию провоспалительных цитокинов TNF-, IL-1 и IL-8. После курса лечения повышался синтез TNF-, у 40% — IL-8 и у 28% — IL-1, и снижение продукции IL-1.
В зависимости от способности клеток крови к продукции различных видов провоспалительных цитокинов (интерфероны и TNF-, IL-1 и IL-8) были выделены четыре типа реагирования ИКК на введение циклоферона. I тип — повышение продукции интерферонов (чаще IFN-) в сочетании с активацией синтеза TNF-a, II тип — увеличение синтеза интерферонов ( и ), сопровождаемое снижением продукции провоспалительных цитокинов (TNF-, IL-1 и IL-8). III тип — увеличение синтеза провоспалительных цитокинов (одного, двух или трех). IV тип — снижение продукции провоспалительных цитокинов.
Первый тип реагирования отмечался у трети больных (10 человек). Анализ клинических проявлений заболевания у этой группы больных показал, что практически у всех пациентов хронический риносинусит характеризовался наличием признаков продуктивного процесса (полипозные разрастания, аденоиды, риносинусит). В большинстве случаев (80%) определялись в крови антитела класса М к вирусам простого герпеса.
Показатели местного иммунитета по данным риноцитограмм свидетельствовали, что в процессе лечения клеточное представительство на слизистой оболочке носа практически не менялось, но имело место увеличение значений параметров, характеризующих деструкцию клеток (нейтрофилов и клеток цилиндрического эпителия). В назальных смывах в процессе лечения выявилось снижение концентрации иммуноглобулинов класса А. Клинически выздоровление больных наступало через этап кратковременного усиления ринореи.
Следовательно, можно признать, что при первом типе реагирования происходила активация цитотоксических механизмов на местном уровне.
Второй тип реагирования наблюдали у 22% пациентов. На основе анализа клинических проявлений заболевания у всех пациентов было отмечено сочетание хронического риносинусита с проявлениями гиперэргической реакции иммунной системы: у 3 пациентов — эозинофилия в крови (более 10%), у 1 — вазомоторный ринит, у 1 — гипертрофическое разрастание носовых раковин и у 1 — лейкоцитоз (11,2х10 9 /л). У 4 больных в сыворотке крови обнаруживались антитела класса М к ВПГ.
Исследования клеток цельной крови свидетельствовали об увеличении количества мононуклеаров, маркированных СД95 (маркеры апоптоза; апоптоз — запрограммированная гибель клетки), снижении содержания В-лимфоцитов и уровня циркулирующих иммунных комплексов в сыворотке крови.
Состояние местного иммунитета характеризовалось увеличением в риноцитограмме доли нейтрофилов за счет целых неразрушенных клеток, что могло свидетельствовать о рекруитировании фагоцитов из кровеносного русла.
Следовательно, при этом типе отмечен антипролиферативный тип реагирования в сочетании с активацией неспецифического звена иммунитета непосредственно на слизистой оболочке в очаге воспаления.
Третий тип реагирования наблюдали у 7 пациентов (24%). Отмечено снижение продукции интерферонов в сочетании с активацией синтеза провоспалительных цитокинов. Анализ клинических проявлений показал, что в большинстве случаев заболевание сопровождается сочетанием симптомов продуктивного и гнойного воспаления.
Состояние иммунной системы до и после лечения циклофероном по показателям периферической крови характеризовалось увеличением значений данных неспецифического звена иммунитета: количества лейкоцитов, абсолютных значений уровня зрелых нейтрофилов, количества активно фагоцитирующих клеток и их фагоцитарного показателя.
Отмечалось повышение содержания В-лимфоцитов в цельной крови.
Четвертый тип реагирования отмечался у 20% пациентов.
Анализ клинических проявлений заболевания выявил практически у всех пациентов полипозную форму риносинусита. В данной группе больных изначально высокие показатели IgG в сыворотке крови снижались. Местный иммунитет по данным риноцитограмм характеризовался увеличением доли нейтрофилов без признаков деструкции.
Следовательно, в группах больных IV типа реагирования циклоферон способствовал снижению синтеза провоспалительных цитокинов в клетках крови с изначально высокой способностью к их продукции, что приводило к снижению проявлений воспалительного процесса в слизистой оболочке носа — уменьшались отечность ткани и объемы полипозных разрастаний.
Итак, на основе сравнительного анализа клинических особенностей протекания патологических процессов у больных хроническим риносинуситом с типом реагирования клеток крови при лечении циклофероном можно утверждать, что выявленным типам иммунного реагирования соответствовали различные варианты клинического проявления хронического риносинусита.
Таким образом, полученные результаты влияния циклоферона на иммунную систему больных хроническим риносинуситом дают возможность расширить показания и обосновать рекомендации к назначению циклоферона в лечении риносинусита. Иммуномодулирующие характеристики действия циклоферона на иммунную систему пациентов позволяют рекомендовать его при остром риносинусите с целью устранения острого воспаления. При наличии пролиферативных процессов в виде гипертрофии слизистой оболочки носа и полипов назначение циклоферона может привести к снижению интенсивности гиперплазии воспаленной ткани. В тех случаях, когда имеются гиперэргические реакции — аллергия, — уменьшить их интенсивность.
В статье представлен цитокиновый профиль сыворотки венозной крови и отделяемого из уретры мужчин с хроническим уретритом герпетической и хламидийной этиологии. Выявлены наиболее специфические иммунологические показатели, раскрывающие напряженность иммунной системы при хронической вирусной и бактериальной инфекции на системном – ФНОα (AUC=1), ИЛ-1β (AUC=0,97), ИЛ-10 (AUC=0,87), ИЛ-13 (AUC=0,97), и локальном уровнях – ИЛ-13 (AUC=0,99) и ИЛ-22 (AUC=0,99). Произведена оценка собственного эффекта иммуномодуляторов в лечении герпетической и хламидийной урогенитальной инфекций. Собственный эффект применения рекомбинантного интерлейкина-2 составил 7 % (при этом у 76 % пациентов значения исследуемых медиаторов воспаления вернулись к контрольным уровням), а рекомбинантного интерферона-γ – 13 % (при этом у 89 % мужчин показатели соответствовали контролю).

1. Герпетическая инфекция: дискутабельные вопросы диагностики и лечения / Е.В. Маркелова, А.С. Красницкая, А.В. Сайбель, Е.К. Гапоненко // Актуальные вопросы аллергологии и иммунологии: сб. ст. и тез. 10-ой Регион. науч.-практич. конф. / отв. ред. Е. В. Просекова, В. А. Сабыныч. – Владивосток: Мор. гос. ун-т им. адм. Г.И. Невельского, 2012. – С. 21–25.
2. Дисбаланс иммунорегуляторных Th1- и Th2-цитокинов при персистентных вирусных инфекциях / И.О. Наследникова, Н.В. Рязанцева, В.В. Новицкий [и др.] // Мед. иммунология. – 2007. – Т. 9, № 1. – С. 53–60.
3. Исаков В.А. Патогенез и лечение социально значимых вирусных урогенитальных инфекций (герпеса и папилломавирусной инфекции) / В.А. Исаков, Д.В. Исаков // Клин. фармакология и терапия. – 2014. – Т. 23, № 1. – С. 68–74.
4. Мавров Г.И. Иммунные нарушения при половых инфекциях множественной этиологии (Herpessimplex, Chlamydiatrachomatis, Trichomonasvaginalis) / Г.И. Мавров, А.Е. Нагорный // Дерматология, венерология, косметология. – 2010. – Т. 38, № 3. – С. 117–122.
5. Новые диагностические маркеры при герпетической и хламидийно-герпетической инфекции / Н.С. Чепурнова, Е.В. Маркелова, М.С. Тулупова, Л.Г. Волчкович // Тихоокеанский медицинский журнал. – 2016. – № 4. – С. 57–60. DOI: 10.17238/PmJ1609-1175.2016.4.57–60.
6. Симбирцев А.С. Цитокины в патогенезе инфекционных и неинфекционных заболеваний человека / А.С. Симбирцев // Мед. академ. журн. – 2013. – Т. 13, № 3. – С. 18–41.
7. Хрянин А.А. Иммунологические нарушения при хроническом течении урогенитальной хламидийной инфекции / А.А. Хрянин, И.Д. Сафронов, А.В. Ефремов // Герпес. – 2009. – № 2. – С. 71–76.
8. Юцковская И.А. Состояние локального иммунитета у мужчин с хроническим уретритом / И.А. Юцковская, Е.В. Маркелова, А.Д. Юцковский // Дальневост. вестн. дерматовенерологии, дерматокосметологии и сексопатологии. – 2007. – № 1. – С. 15–18.
9. Imbalanced oxidative stress causes Chlamydial persistence during non-productive human herpes virus co-infection / B. K. Prusty, L. Bohme, B. Bergmann [et al.] // PLOS ONE. – 2012. – Vol. 7, no. 10. – Р. 1–17.
10. Interleukin-13 promotes susceptibility to chlamydial infection of the respiratory and genital tracts / K.L. Asquith, J.C. Horvat, G.E. Kaiko [et al.] // PLoSPathog. – 2011. – Vol. 7, no. 5. – Р. e1001339.
11. Protective immunity against mouse upper genital tract pathology correlates with high IFNgamma but low IL-17 T cell and anti-secretion protein antibody responses induced by replicating chlamydial organisms in the airway / C. Lu, H. Zeng, Z. Li [et al.] // Vaccine. – 2012. – Vol. 30, no. 2. – Р. 475–485.
12. Seminal levels of IL-10, IL-12, and IL-17 in men with asymptomatic chlamydia infection / H. Hakimi, M.M. Akhondi, M.R. Sadeghi [et al.] // Inflammation. – 2014. – Vol. 37, no. 1. – P. 122–126.
13. Spontaneous secretion of interleukin-17 and -22 by human cervical cells in Chlamydia trachomatis infection / R. Jha, P. Srivastava, S. Salhan [et al.] // Microbes And Infection. – 2011. – Vol. 13, no. 2. – Р. 167–178.
14. The effect of bacterial contamination of semen on sperm chromatin integrity and standard semen parameters in men from infertile couples / R. Rybar, P. Prinosilova, V. Kopecka [et al.] // Andrologia. – 2012. – Vol. 44, no. 1. – Р. 410–418.
15. The duration of chlamydia muridarum genital tract infection and associated chronic pathological changes are reduced in IL-17 knockout mice but protection is not increased further by immunization / D.W. Andrew, M. Cochrane, J.H. Schripsema [et al.] // Plos One. – 2013. – Vol. 8, I, no. 9. – P. e76664.
Материалы и методы. Проведено обследование на инфекции, передающиеся половым путем 96 мужчин, согласно общепринятым стандартам. Мужчины основной группы (ОГ) были распределены на 2 подгруппы: 42 мужчины с хроническим вирусным уретритом (генитальный герпес) и 24 мужчины с бактериальным уретритом (хламидиоз), средний возраст ОГ – 33,0±4,2 лет. Группу сравнения (контрольная группа) составили 30 практически здоровых мужчин-добровольцев, средний возраст -31,1±1,1 лет. Противовирусная терапия проводилась препаратом Валацикловир, который назначался перорально в дозе 500 мг 2 раза в день в течение 10 дней, затем 500 мг 1 раз в день в течение 20 дней, антибактериальная терапия проводилась с использованием Доксициклина в дозе 100 мг 2 раза в день в течение 10 дней. В качестве иммуномодуляторов использовались интерлейкин-2 человека рекомбинантный в дозе 500 тыс. МЕ 1,0 мл подкожно в область плеча через день, 6 инъекций и интерферон гамма в дозе 500 тыс. МЕ 1,0 мл подкожно в область плеча через день, 10 инъекций. Наблюдение всех пациентов осуществлялось в течение 28 дней (лабораторные исследование включали анализы цитокинового статуса и исходно и через 28 дней). Определение уровня ФНОα, ФНОβ, ИЛ-1β, ИЛ-2, ИЛ-2sR, ИЛ-13, ИЛ-17, ИЛ-22, ИФНγ, ИЛ-10, ТФРβ1, ИФНα в сыворотке венозной крови и отделяемом из уретры проводили с помощью специфических реактивов фирмы “R&DDiagnosticsInc.” (USA) методом сендвич-варианта твердофазного иммуноферментного анализа, согласно прилагаемых инструкций. Учет результатов производили с помощью иммуноферментного анализатора “Multiscan” (Финляндия). Расчет количества цитокинов проводили путем построения калибровочной кривой с помощью компьютерной программы. Количество выражали в нг/мл или пг/мл. Для оценки иммуностимулирующего действия модуляторов использовалась формула Земскова А.М. (2003):
где Рис – значение параметра в абсолютных величинах до начала лечения, Рm – то же после традиционной терапии, Рм – то же после проведения традиционного лечения с модулятором.

Рис. 1. Проекция имеющихся наблюдений на двумерную плоскость в сыворотке венозной крови

Рис. 2. Проекции имеющихся наблюдений на двумерную плоскость в отделяемом из уретры
Дальнейшая оценка значений исследуемых показателей была проведена методом линейной регрессии – ROC-анализом, который позволил сузить набор иммунологических маркеров хронических уретритов: в сыворотке венозной крови – ФНОα (AUC=1), ИЛ-1β (AUC=0,97), ИЛ-10 (AUC=0,87), ИЛ-13 (AUC=0,97), а в отделяемом из уретры – ИЛ-13 (AUC=0,99) и ИЛ-22 (AUC=0,99). Проведенный анализ определил использование именно этих параметров для оценки эффективности терапии.
Выводы. У пациентов с хроническим вирусным уретритом в сыворотке венозной крови установлено изменения уровней провоспалительных цитокинов (ФНОα, ИЛ-1β, ИЛ-2, ИЛ-2sR, ИЛ-17, ИФНα), причем значения ИЛ-2 были самыми высокими, а ИЛ-1β самыми низкими. Все исследуемые противовоспалительные цитокины изменялись в этой группе, однако уровень ИЛ-10 был наиболее высоким среди групп. В отделяемом из уретры обнаружен дефицит ИЛ-1β и высокие уровни ИЛ-2sR и ИФНα (самый высокий уровень среди исследуемых групп), при самых низких значениях ТФРβ1. При исследовании эффекта от лечения с использованием стандартных схем и схем в сочетании с иммуномодулирующими препаратами было определено следующее: при хроническом вирусном уретрите целесообразно применение комплексной схемы терапии, включающей в себя противовирусные и иммуномодулирующие препараты, что обусловлено положительной динамикой изменения уровня цитокинов в сыворотке венозной крови и отделяемом из уретры. Собственный эффект рекомбинантного интерлейкина-2 составил 14 % (при этом у 91 % пациентов значения исследуемых медиаторов воспаления вернулись к контрольным уровням), а рекомбинантного интерферона-γ – 8 % (при этом у 80 % мужчин показатели соответствовали контролю). У мужчин с хроническим бактериальным уретритом установлены разнонаправленные изменения цитокинов: значения провоспалительных медиаторов выходили за пределы контрольных показателей, однако только в этой группе зафиксированы самые низкие уровни ФНОβ, на фоне высокой продукции противовоспалительных цитокинов. В отделяемом из уретры определено следующее: среди провоспалительного ряда именно в группе с бактериальным уретритом выявлены самые низкие уровни ФНОβ и высокие значения ИЛ-2sR, при этом отмечены разнонаправленные изменения противовоспалительныхмедиаторов – дефицит ИЛ-10 и ИЛ-13, и избыток ТФРβ1. При хроническом бактериальном уретрите целесообразно применение комплексной схемы терапии, включающей антибактериальные и иммуномодулирующие препараты, что обусловлено положительной динамикой показателей в сыворотке венозной крови и отделяемом из уретры. Собственный эффект применения рекомбинантного интерлейкина-2 составил 7 % (при этом у 76 % пациентов значения исследуемых медиаторов воспаления вернулись к контрольным уровням), а рекомбинантного интерферона-γ – 13 % (при этом у 89 % мужчин показатели соответствовали контролю).

У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
Реферат
Заключение. Имеющиеся данные позволяют предположить, что нарушение регуляции цитокинового ответа является одним из механизмов, лежащих в основе прогрессирования COVID-19 и развития органной недостаточности. В то же время выраженность данных нарушений у части больных не позволяет объяснить развитие тяжелых осложнений, в связи с чем необходим поиск альтернативных патогенетических механизмов.
Поступила: 08.02.2021
Принята к печати: 05.03.2021
Читать статью в PDF

Функции цитокинов
По механизму действия цитокины можно условно подразделить на следующие группы:
- Провоспалительные цитокины: интерлейкины (ИЛ) — ИЛ-1, -6, -12; фактор некроза опухолей (TNFα); интерфероны (IFNα, -β, -γ); хемокины — ИЛ-8, моноцитарный хемоаттрактивный белок-1 (MCP-1), полипептиды (RANTES) и др. — продуцируются и действуют на иммунокомпетентные клетки, инициируя воспалительный ответ. Многие авторы отмечают, что высокий уровень этих цитокинов является отражением активности и тяжести патологического процесса.
- Противовоспалительные цитокины: ИЛ-4, ИЛ-10; трансформирующие факторы роста (TGFβ) и др., регулирующие специфические иммунные реакции и ограничивающие развитие воспаления.
- Регуляторы клеточного и гуморального иммунитета (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими) [4,5].
Цитокины ответственны за развитие местных защитных реакций в тканях с участием различных типов клеток крови, эндотелия, эпителия и соединительной ткани. На местном уровне цитокины регулируют все последовательные этапы развития воспаления и адекватность ответа на внедрение патогена. Адекватность воспалительного ответа степени повреждения является основным условием сохранения защитной функции воспалительной реакции [6–8].
Гиперпродукция цитокинов приводит к развитию системной воспалительной реакции, нарушению функции отдаленных органов, при этом дальнейшее нарастание концентрации может служить причиной развития ряда критических состояний, в частности, септического шока и полиорганной недостаточности [9–11].
Иммунодефицитные состояния. Пациенты с первичным иммунодефицитом обладают ограниченными возможностями для полной элиминации патогена из организма. Персистирующая инфекция запускает механизм высвобождения цитокинов, что приводит к развитию гемофагоцитарного лимфогистиоцитоза. Например, данный синдром развивается на фоне инфекции вирусом Эпштейна—Барр у пациентов с лимфопролиферативным синдромом, сцепленным с Х-хромосомой [33, 34].
В настоящее время существует несколько классификаций СВЦ, например, классификация по степени тяжести в Общих терминологических критериях для обозначения нежелательных явлений (Common Terminology Criteria for Adverse Events, CTCAE v.5), Lee Grading Scale, MD Anderson Grading Scale, Penn Grading Scale, на основании которых выделяют 4 степени тяжести синдрома. Наиболее часто используется классификация CTCAE v5.0, в соответствии с которой 1-я степень тяжести включает в себя лихорадку; 2-я степень — артериальную гипотонию, для коррекции которой достаточно введение жидкости, и гипоксемию, отвечающую на респираторную поддержку с фракцией вдыхаемого кислорода (FiO2) < 0,4; 3-я степень — артериальную гипотонию, для коррекции которой достаточно введения одного вазопрессорного агента, и гипоксемию, отвечающую на респираторную поддержку с FiO2 > 0,4; 4-я степень — жизнеугрожающее состояние. СВЦ имеет собственный код в МКБ-10 — D89.83. В 2017 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) одобрило применение препарата тоцилизумаб для лечения вызванного CAR T-клетками тяжелого или жизнеугрожающего синдрома высвобождения цитокинов у пациентов от двух лет и старше [40].
Гемофагоцитарный лимфогистиоцитоз, или гемофагоцитарный синдром, ГФС (Hemophagocytic lymphohistiocytosis, HLH), представляет собой тяжелую генерализованную воспалительную реакцию, в патогенезе которой ключевую роль играет активация макрофагов, цитотоксических лимфоцитов и естественных киллеров (NK-клеток), развитие лавинообразной гиперцитокинемии с тяжелыми вторичными тканевыми повреждениями. Впервые ГФС был описан J.W. Farquhar и А.Е. Claireaux в 1952 г. [41]. В соответствии с актуальной классификацией Международного гистиоцитарного общества первичный и вторичный ГФС относятся к H-группе гистиоцитозов. Первичный ГФС относится к аутосомно-рецессивным, генетически обусловленным заболеваниям, обычно развивается у детей первых лет жизни. Вторичный ГФС развивается на фоне инфекционного, опухолевого или аутоиммунного процесса. В 1979 г. Risdall et al. описали развитие ГФС на фоне вирусной инфекции [42]. К настоящему времени описано развитие вторичного ГФС у пациентов с инфекцией, вызванной вирусами Эпштейна—Барр, простого герпеса, гриппа, гепатита, иммунодефицита человека, а также цитомегаловирусной, парвовирусной, аденовирусной и коронавирусной инфекциями [43–45]. Клинически вторичный, или реактивный, ГФС проявляется, как правило, упорной лихорадкой, увеличением печени и селезенки, развитием полиорганной недостаточности, цитопении и вторичных инфекций. Для диагностики вторичного ГФС были разработаны критерии H-Score [46] (табл. 1).
Таблица 1. Диагностические критерии вторичного ГФС (H-Score) [46]
Table 1. H-score diagnostic criteria for secondary HLH [46]
Параметры
Баллы
Температура тела, °С:
гепато- ИЛИ спленомегалия
Содержание ферритина в сыворотке крови, нг/мл:
Содержание триглицеридов в сыворотке крови, ммоль/л:
Содержание фибриногена в плазме, г/л:
Содержание аспартатаминотрансферазы сыворотки, МЕ/л:
Гемофагоцитоз в аспирате костного мозга:
Диагноз вторичного ГФС может считаться установленным при сумме баллов по H-Score более 169. Однако диагностика ГФС достаточно сложна и не всегда может быть основана на простом подсчете суммы баллов [47, 48]. Данный синдром имеет самостоятельный код в МКБ-10 — D76.2 (гемофагоцитарный синдром, связанный с инфекцией). Лечение ГФС основано на протоколе HLH-94 и включает в себя применение кортикостероидов, этопозида, циклоспорина А, а также ритуксимаб [49, 50].
Одной из разновидностей вторичного ГФС является синдром активации макрофагов, САМ (Macrophage activation syndrome, MAS), впервые описанный в 1985 г. при системном ювенильном идиопатическом артрите [51]. Данный синдром наиболее часто встречается при иммуновоспалительных заболеваниях в педиатрической практике, генетических аутоиммунных заболеваниях (например, при мутации гена NLRC4), а также некоторых онкогематологических заболеваниях (например, при Т-клеточной лимфоме) [52, 53]. Одним из триггеров развития данного потенциально фатального осложнения является инфекция, чаще всего вызванная вирусами [54].
Table 2. Temple University COVID-19 Research Group diagnostic criteria for “cytokine storm” in COVID-19 [69]
Обязательные критерии:
1) клинические проявления инфекции;
2) лабораторное подтверждение инфекции;
3) характерные изменения на КТ;
4) ферритин > 250 нг/мл;
+ по 1 критерию из каждой группы дополнительных критериев:
группа I
группа II
группа III
нейтрофилы > 11,4 клеток/мкл
D-димер > 4930 нг/мл;
тропонин I > 1,09 нг/мл
хлор > 106 ммоль/л;
калий > 4,9 ммоль/л;
мочевина : креатинин > 29
АЛТ — аланинаминотрансфераза; анион. разн. — анионная разница; АСТ — аспартатаминотрансфераза, ЛДГ — лактатдегидрогеназа; мочевина : креатинин — соотношение мочевина/креатинин; СРБ — С-реактивный белок.
Таблица 3. Диагностические критерии мультисистемного воспалительного синдрома [71]
Table 3. Diagnostic criteria for Multisystem Inflammatory Syndrome in Adults (MIS-A) [71]
1. Тяжелые клинические проявления заболевания у пациентов ≥ 21 года, требующие стационарного лечения.
2. Подтвержденная коронавирусная инфекция, вызванная вирусом SARS-CoV-2.
3. Выраженное нарушение функции одной или более систем, кроме дыхательной (например, гипотензия или шок, артериальный или венозный тромбоз/эмболия, острое повреждение печени.
4. Лабораторные признаки выраженной воспалительной реакции (например, повышение содержания С-реактивного белка, ферритина, D-димера или ИЛ-6).
5. Отсутствие тяжелого поражения органов дыхания (для исключения ситуации, когда органная дисфункция и воспаление связано с тканевой гипоксией.
Критерии применимы к пациентам со слабо или умеренно выраженными респираторными симптомами; не применимы — к пациентам с альтернативным диагнозом, например бактериальным сепсисом.
Таблица 4. Диагностические критерии гипервоспалительного синдрома [72]
Table 4. Diagnostic criteria for hyperinflammatory syndrome in COVID-19 [72]
Лихорадка
· Температура тела > 38,0 °C
Активация макрофагов
· Повышение содержания ферритина ≥ 700 мкг/л
Гематологические нарушения
· Отношение нейтрофилы : лимфоциты ≥ 10 ИЛИ 2 признака: содержание гемоглобина ≤ 9,2 г/дл И тромбоцитов ≤ 110 × 10 9 /л
Коагулопатия
· Содержание D-димера ≥ 1,5 мкг/мл
Повреждение печени
· ЛДГ ≥ 400 ЕД/л ИЛИ АСТ ≥ 100 ЕД/л
Цитокинемия
· Содержание ИЛ-6 ≥ 15 пкг/мл, ИЛИ триглицеридов ≥ 150 мг/дл, ИЛИ С-реактивного белка ≥ 15 мг/дл
АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза, ЛДГ — лактатдегидрогеназа.
Во-первых, весь предшествующий опыт применения тоцилизумаба охватывал только неинфекционные заболевания, поэтому чисто теоретически подавление воспаления с помощью блокады рецепторов ИЛ-6 может не только продлить период виремии, но и способствовать прогрессированию вирусного поражения [79, 80].
Кроме того, при применении тоцилизумаба возможно развитие парадоксальной реакции, проявляющейся реактивацией вторичного ГФС [82]. По мнению некоторых исследователей, цитокиновый ответ у пациентов с COVID-19 в большей степени напоминает таковой при сепсисе, чем при ГФС/CAM на фоне онкогематологических или иммуновоспалительных заболеваний, поэтому, хотя ИЛ-6 является составным компонентом цитокинового каскада, его роль в развитии органной дисфункции не ясна, а эффект от блокады его рецепторов может оказаться очень ограниченным [83].
Несмотря на то что тоцилизумаб вошел в национальные рекомендации по лечению COVID-19 в России, Китае, Италии, Испании, Греции, Швейцарии, Ирландии, Польши, Турции, Израиля, Японии, Египта, Ирана и еще ряда стран (по показаниям, отличающимся от утвержденных в инструкции показаний для применения — off label), до настоящего времени данные о его эффективности и безопасности при применении у пациентов с COVID-19 носят противоречивый характер. В то время как данные о положительном эффекте применения получены преимущественно на основании обсервационных исследований и описания серии наблюдений [84–88], результаты опубликованных рандомизированных контролируемых исследований менее впечатляющие [89–93] (табл. 5).
Таблица 5. Рандомизированные контролируемые исследования тоцилизумаба при COVID-19
Table 5. Randomized controlled studies with tocilizumab in COVID-19
RCT-TCZ-COVID-19 [94]
BACC Bay group [95]
COVACTA [96]
CORIMUNO-TOCI-1 [97]
TOCIBRAS [98]
EMPACTA [99]
REMAP-CAP [100]
Количество пациентов, получавших тоцилизумаб
Доля пациентов, получавших системные кортикостероиды, %
Различия в смертности
Анализ объединенных результатов данных исследований не выявил положительного влияния тоцилизумаба в отношении снижения смертности (ОШ 0,91, 95% ДИ 0,72–1,14) [101]. В результате систематического обзора исследований тоцилизумаба при COVID-19 Cortegiane et al. пришли к заключению, что в настоящее время не имеется убедительных данных в отношении пользы применения тоцилизумаба у пациентов с тяжелым течением COVID-19. Авторы отметили низкое качество многих исследований, связанное с большим количеством систематических ошибок [102]. Действительно, несмотря на достаточно большое количество исследований, посвященных изучению применения тоцилизумаба у пациентов с COVID-19, их результаты не позволяют сделать однозначный вывод. Отчасти это связано со значительными различиями в первичных конечных точках, критериях включения, сроках введения препарата, а также гетерогенностью выборки и небольшим количеством пациентов. Возможно, результаты исследования RECOVERY, предварительные результаты которого продемонстрировали положительный эффект тоцилизумаба, позволят завершить дискуссию в отношении данного вопроса [101]. Пока, на основании имеющихся данных, можно сделать несколько выводов: 1) применение тоцилизумаба в виде монотерапии не оказывает достоверного положительного эффекта пациентам с COVID-19; 2) тоцилизумаб в сочетании с системными кортикостероидами может оказывать положительный эффект у пациентов с тяжелым течением COVID-19; 3) терапия тоцилизумабом не приводит к значительному увеличению инфекционных осложнений.
Заключение
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Бобкова С.С., Жуков А.А., Проценко Д.Н., Самойленко В.В., Тюрин И.Н. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.

Хотя ситуация развивается стремительно, тяжелое течение заболевания, проявляющееся лихорадкой и пневмонией, приводящее к острому респираторному дистресс-синдрому (ОРДС), было описано в 20 % случаев COVID-19. Это напоминает течение ОРДС, вызванного синдромом выброса цитокинов (цитокиновый шторм), и вторичный гемофагоцитарный лимфогистиоцитоз, наблюдаемый у пациентов с SARS-CoV и MERS-CoV, а также у пациентов с лейкемией, получающих Т-клеточную терапию. Учитывая этот опыт, необходимо создание терапевтических средств, основанных на подавлении синдрома выброса цитокинов, таких как тоцилизумаб, которые прошли клинические испытания для лечения COVID-19.
SARS-CoV-2 — это бета-коронавирус, который наиболее тесно связан с SARS-CoV. Оба вируса используют рецептор ангиотензинпревращающего фермента, связанный с карбоксипептидазой (ACE2), чтобы проникнуть в клетки. Этот рецептор повсеместно экспрессируется в сердечной и легочной ткани, а также в некоторых кроветворных клетках, включая моноциты и макрофаги. Ключевой особенностью инфекции COVID-19 является лимфопения (низкий уровень лимфоцитов в крови), которая коррелирует с клинической тяжестью процесса. При SARS-CoV инфицируются моноциты и дендритные клетки, тогда как при MERS-CoV инфицируются моноциты и Т-клетки через дипептидилпептидазу 4 (DPP4). Возможно, что SARS-CoV-2 также поражает дендритные клетки. Апоптоз и истощение пула Т-клеток в результате нарушения процессов активации из-за дисфункции дендритных клеток может способствовать патологии иммунной системы при COVID-19. Однако лимфопения не является специфическим биомаркером неблагоприятного прогноза при COVID-19, поскольку она также является биомаркером, который коррелирует с летальным исходом в пандемии гриппа A (H1N1) 2009 года.
Было установлено, что цитокиновый шторм является основным фактором тяжелого течения SARS-CoV и MERS-CoV у пациентов. Повышенные сывороточные концентрации интерлейкина-6 (IL-6) и других провоспалительных цитокинов являются признаками тяжелого течения инфекции MERS-CoV. Синдром высвобождения цитокинов часто встречается у пациентов с COVID-19, а повышенный уровень IL-6 в сыворотке коррелирует с дыхательной недостаточностью, ОРДС и неблагоприятными клиническими исходами. Повышенный уровень C-реактивного белка (CРБ),экспрессия которого стимулируется IL-6, также является биомаркером тяжелой бета-коронавирусной инфекции.
Инфицирование бета-коронавирусом моноцитов, макрофагов и дендритных клеток приводит к их активации и секреции IL-6 и других провоспалительных цитокинов. IL-6 обладает выраженными провоспалительными свойствами (см. рис. 1). IL-6 может передавать сигналы по двум основным путям, которые называются классической цис-передачей или транс-передачей. При передаче цис-сигналов IL-6 связывается с мембраносвязанным рецептором IL-6 (mIL-6R) в комплексе с gp130; нисходящая сигнальная трансдукция опосредуется, в свою очередь, JAKs (Janus kinases) и STAT3 (сигнальный преобразователь и активатор транскрипции-3). Связанный с мембраной комплекс gp130 экспрессируется повсеместно, в отличие от mIL-6R, экспрессия которого ограничена в основном иммунными клетками. Активация передачи сигналов в рамках цис-передачи приводит к плейотропным эффектам на приобретенный иммунитет (В- и Т-клетки), а также врожденную иммунную систему [нейтрофилы, макрофаги и естественные клетки-киллеры (NK)], которые могут вносить вклад в возникновение цитокинового шторма.
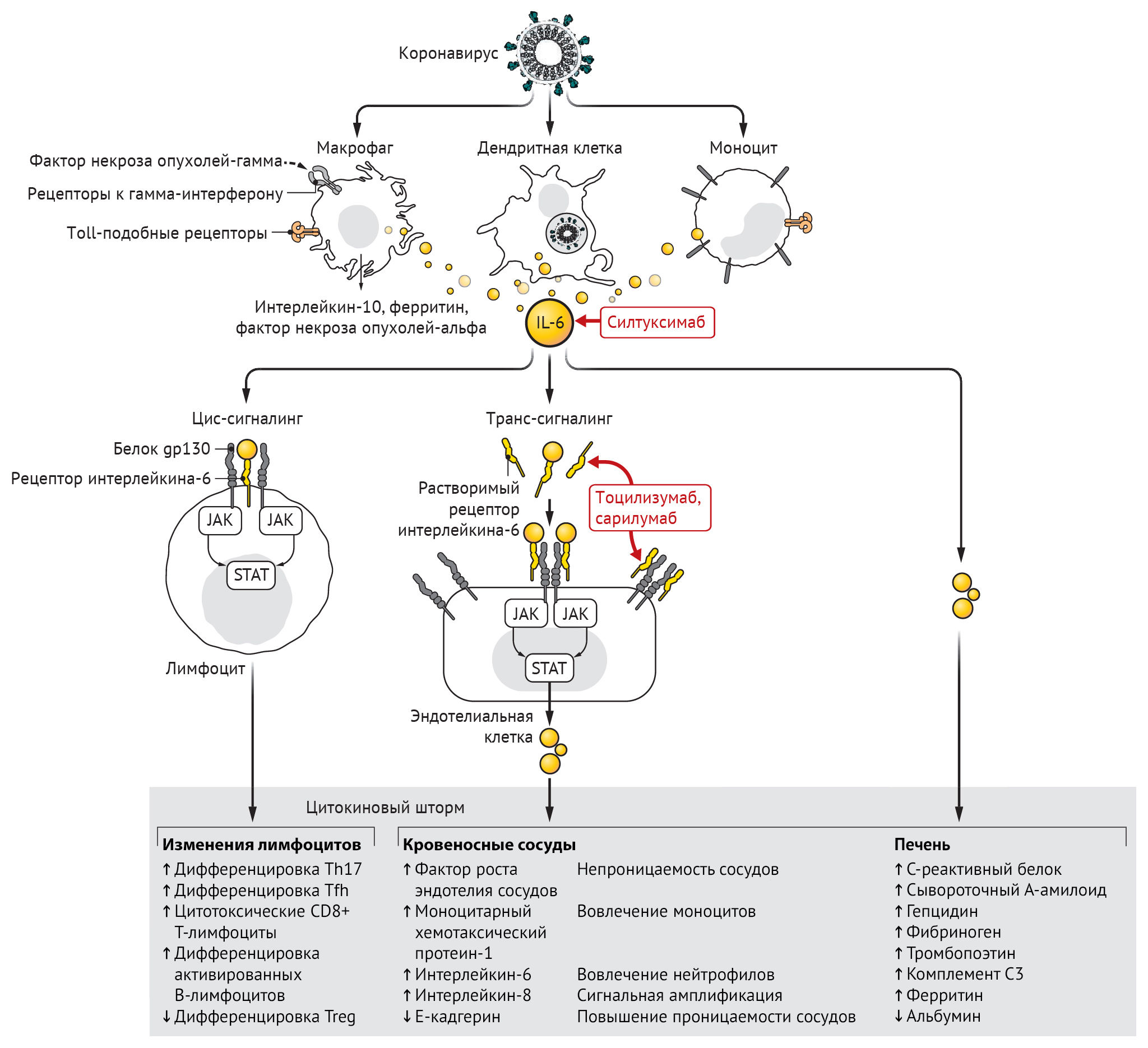
Коронавирусная инфекция приводит к активации моноцитов, макрофагов и дендритных клеток. Позже высвобождение IL-6 запускает каскад амплификации, который приводит к цис-передаче сигналов с дифференцировкой Т-лимфоцитов в TH-17, помимо других лимфоцитарных изменений, и к транс-передаче сигналов во многих типах клеток, таких как, например, эндотелиальные клетки. Обусловленное этим увеличение выработки системных цитокинов вносит вклад в патофизиологию тяжелого течения COVID-19, включая гипотензию и острый респираторный дистресс-синдром (ОРДС), которые можно лечить антагонистами IL-6, такими как тоцилизумаб, сарилумаб и силтуксимаб.
Вторичный гемофагоцитарный лимфогистиоцитоз — это гипервоспалительный синдром, характеризующийся высвобождением цитокинов, цитопенией (низкое количество клеток крови) и полиорганной недостаточностью (включая печеночную). У взрослых вторичный гемофагоцитарный лимфогистиоцитоз чаще всего связан с тяжелыми вирусными инфекциями, но также встречается у пациентов с лейкемией, получающих специальную Т-клеточную терапию. В дополнение к повышенным уровням цитокинов для вторичного гемофагоцитарного лимфогистиоцитоза характерны высокие уровни ферритина в сыворотке крови. Экспрессирующие CD163 макрофаги выступают в качестве источника ферритина. Учитывая их роль в передаче сигналов ретикулоэндотелиального железа, вторичный гемофагоцитарный лимфогистиоцитоз известен также как синдром активации макрофагов. Ретроспективное исследование пациентов с COVID-19 показало, что повышение сывороточного ферритина и IL-6 коррелировало с уровнем выживаемости и наблюдалось у погибших.
У пациентов, получающих CART-терапию (лечение Т-клетками химерного рецептора антигена (chimeric antigen receptor — CAR)), также могут развиться как цитокиновый шторм, так и вторичный гемофагоцитарный лимфогистиоцитоз. CART-терапия включает перепрограммирование Т-лимфоцитов пациента с целью повышения экспрессии на них молекул CAR, которые распознают антигены на опухолевых клетках. При переливании этих перепрограммированных клеток обратно пациенту они нацеливаются на опухолевые клетки, тем самым активируя противоопухолевый иммунный ответ. Эмили Уайтхед, первый пациент, получивший CD19-нацеленные Т-клетки CAR-19 с целью лечения острого лимфобластного лейкоза в 2012 году, побочным эффектом получила тяжелую форму цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза, что привело к развитию ОРДС, полиорганной недостаточности и гипотонии, которая была невосприимчива к стандартному лечению стероидами. Из-за значительного повышения сывороточного IL-6 у этой пациентки эмпирически было принято решение о начале терапии тоцилизумабом, антагонистом IL-6R, одобренным в то время для лечения ревматических состояний, таких как ювенильный идиопатический артрит. Она получала однократную дозу тоцилизумаба на 7-й день после введения CARТ-лимфоцитов. Спустя несколько часов у пациентки снизилась температура, после чего было принято решение об отмене лечения гипотонии и отказ от поддержки ИВЛ после разрешения ОРДС. В настоящее время тоцилизумаб с подтвержденной эффективностью и минимальными побочными эффектами у сотен пациентов одобрен Управлением по контролю за продуктами и лекарствами США (FDA) для лечения заболеваний, протекающих с синдромом цитокинового шторма, вызванного CARТ-терапией.
Эффективность антагонистов IL-6-IL-6R для лечения цитокинового шторма и вторичного гемофагоцитарного лимфогистиоцитоза подчеркивает центральную роль передачи сигналов IL-6 в патофизиологии цитокин-управляемых гипервоспалительных синдромов. Тяжелые случаи COVID-19 можно лечить как раз путем ингибирования пути IL-6, учитывая связанные с цитокиновым штормом и подобным вторичному гемофагоцитарному лимфогистиоцитозу повышения цитокинов в сыворотке крови. Действительно, предварительные результаты исследования 21 пациента с COVID-19, получавшего тоцилизумаб в Китае, обнадеживают: лихорадка спадала у всех пациентов в течение первого же дня приема тоцилизумаба. Потребность в кислороде была снижена у 75 % пациентов.
Во всем мире проводятся контролируемые клинические испытания с целью тестирования эффективности антагонистов IL-6 и IL-6R для лечения пациентов с COVID-19 с тяжелыми респираторными осложнениями. Один вопрос, который необходимо решить, заключается в том, будет ли иметь место дифференциальная эффективность между антагонистами IL-6 и антагонистами IL-6R. Относительно этого поднимается вопрос, что ингибиторы IL-6R могут подавлять как цис-, так и транс-передачу сигналов, а также транс-презентацию, недавно описанный третий способ передачи сигналов. Транс-презентация включает связывание IL-6 с mIL-6R, экспрессируемым на иммунной клетке, которая образует комплекс с gp130 на клетках T-хелпера-17 (TH17), что приводит к передаче сигналов Т-клеток вниз по каскаду, который может приводить к ОРДС. Однако ингибиторы IL-6 могут подавлять только цис- и транс-передачу сигналов. Непосредственная цель применения антагонистов IL-6 состоит в том, чтобы облегчить течение тяжелых случаев COVID-19 и свести к минимуму потребности в интенсивной терапии данных пациентов. Долгосрочная цель должна заключаться в разработке противовирусных препаратов и вакцин, которые предотвращают инфекцию или облегчают ее течение.
Читайте также:

