Цитомегаловирус герпеса половых путей
Обновлено: 22.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.
Определение
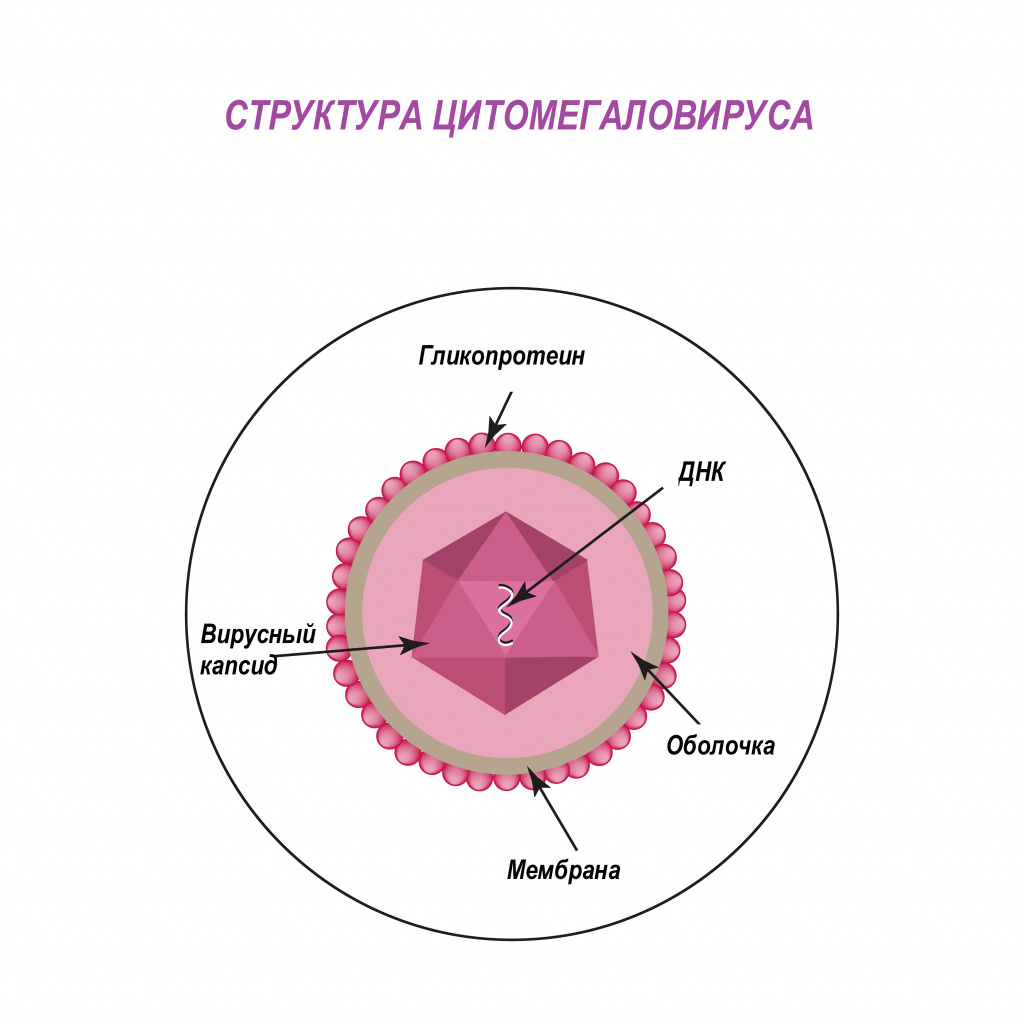
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений - от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Попадая в клетки организма, цитомегаловирус способен оставаться в них пожизненно. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. При угнетении иммунитета вирус активизируется, вызывая клинические симптомы болезни.
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% - то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
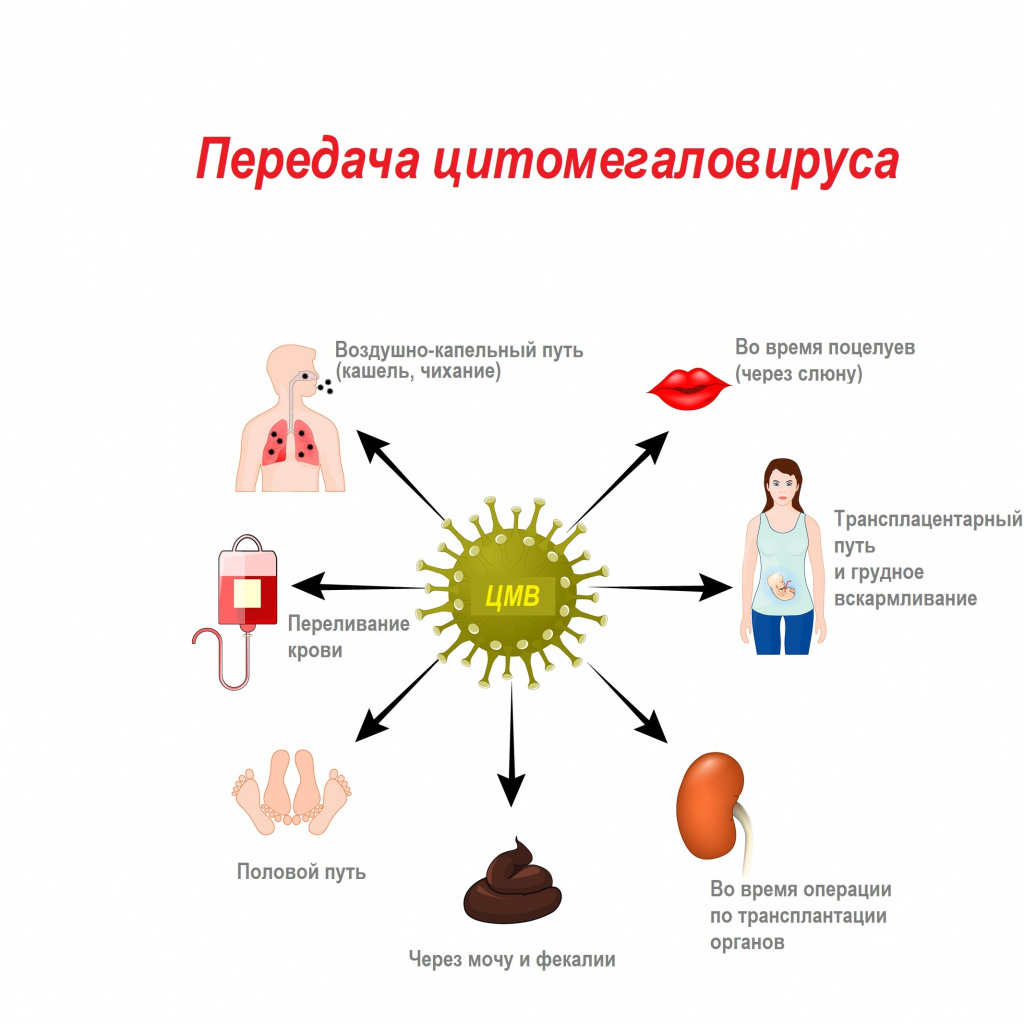
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.
- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело - вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования - общие и специфические:
-
общий анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу. Cytomegalovirus; CMV Antibody, IgG; CMV infection; CMV-specific IgG. Краткое описание исследования Anti-CMV-IgG .
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирусная инфекция входит в группу репродуктивно значимых инфекций, обозначаемых как TORCH-комплекс (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes); первичное инфицирование данными возбудителями, либо обострение .
К каким врачам обращаться
С первичными жалобами пациенты обращаются к врачу-терапевту или врачу общей практики (семейному врачу), детей ведет врач-педиатр . Могут потребоваться консультации инфекциониста - для верификации диагноза, стоматолога - при поражениях слизистой оболочки рта, кардиолога - при наличии врожденного порока сердца, нейрохирурга - при пороках центральной нервной системы, невропатолога - для оценки неврологической патологии, гематолога - при выраженных гематологических изменениях и геморрагическом синдроме, окулиста - для исследования глазного дна, отоларинголога - для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию - для восстановления обмена веществ в организме;
- симптоматическую терапию - для купирования воспалительных и токсических проявлений заболевания.
Проблема клинически выраженной инфекции актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих кортикостероидную, туберкулостатическую терапию, а также перенесших ожоговую травму.
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Особенности течения цитомегаловирусной инфекции урогенитального тракта у сексуально активных женщин
Журнал: Клиническая дерматология и венерология. 2013;11(3): 69‑75
Чернова Н.И. Особенности течения цитомегаловирусной инфекции урогенитального тракта у сексуально активных женщин. Клиническая дерматология и венерология. 2013;11(3):69‑75.
Chernova NI. Specific features of cytomegalovirus infection of the urogenital tract in sexually active women. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(3):69‑75. (In Russ.).
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Цитомегаловирусная инфекция (ЦМВИ) — широко распространенное инфекционное заболевание человека, с вертикальным, половым, парентеральным, оральным путями передачи, реализующимися через кровь, цервикальный и вагинальный секреты, сперму и женское молоко. В большинстве случаев инфекция протекает без клинических проявлений. При иммуносупрессии, вызванной разными причинами, цитомегаловирус (ЦМВ) способен привести к развитию заболевания с многообразными симптомами, что обусловлено его способностью инфицировать практически все системы органов (ретинит, увеит, серонегативный мононуклеоз, пневмония, гепатит, болезни желудочно-кишечного тракта, центральной нервной системы, посттрансфузионный синдром) [1—5].
В среднем у 90—95% взрослого населения обнаруживаются антитела к ЦМВ. В литературе приводятся многочисленные данные об особенностях течения ЦМВИ у новорожденных, беременных и иммунонекомпетентных пациентов. В настоящий момент обследованию на ЦМВИ подлежат следующие категории граждан: женщины при подготовке к беременности, беременные и пациенты с выявленными иммунодефицитными состояниями. Изучению значимости ЦМВ в патологии взрослого населения уделяется особое внимание [6—9]. Однако не учитывается, что ЦМВ нередко способствует хроническому воспалительному поражению органов малого таза и гениталий, что обусловливает низкую эффективность терапии инфекций, передаваемых половым путем (ИППП), и снижение репродуктивной способности пациентов.
Цель настоящего исследования — определение форм течения ЦМВИ урогенитального тракта у сексуально активных женщин репродуктивного возраста.
Материал и методы
Под наблюдением находились 356 пациенток с ЦМВИ, которая характеризовалась наличием в крови анти-CMV IgG.
Для выявления достоверных триггерных клинических и лабораторных факторов, ассоциирующихся с ЦМВИ урогенитального тракта, данные опроса и обследования больных сравнивали с результатами аналогичных исследований, проведенных в контрольной группе, которая состояла из 120 женщин. Критериями отбора являлись: репродуктивный возраст, отсутствие беременности, лактации, системной и местной антибактериальной терапии в течение 1 месяца до начала данного обследования, нормальное состояние микрофлоры урогенитального тракта и исключенная ЦМВИ.
Результаты
Важное значение для выяснения характера ЦМВИ имеют сведения о перенесенных соматических и инфекционных заболеваниях. Частота экстрагенитальной патологии косвенно отражает состояние противоинфекционной защиты организма и иммунной системы в целом.

При анализе соматической патологии (табл. 2) наиболее часто в основной группе по сравнению с контрольной отмечались инфекционные вирусные заболевания (82,58% случаев), патология желудочно-кишечного тракта (55,9%) и заболевания органов дыхания (20,51%). У пациенток с ЦМВИ в 4,2 раза чаще отмечалась патология эндокринной системы (в 31,46% случаев; p<0,05).
Подробному анализу были подвергнуты данные о гинекологических заболеваниях, которые относятся к факторам, влияющим на состояние системного и локального иммунитета.

Среди перенесенных гинекологических заболеваний наиболее часто встречались патология шейки матки (44,10% случаев; p<0,05) и воспалительные заболевания органов малого таза (75%; p<0,05) по сравнению с контролем (табл. 3). Кроме того, у женщин с ЦМВИ чаще наблюдались ИППП (в 55,34% случаев; p<0,05) и бесплодие (28,65%; p<0,05).

При изучении особенностей сексуального анамнеза (табл. 4) выявлено, что у пациенток с ЦМВИ в 3 раза чаще (p<0,05) отмечалось раннее начало половой жизни. Соотношение женщин по количеству половых партнеров в обеих группах было сопоставимым. В ходе анализа особенностей сексуальных предпочтений установлено, что пациентки основной группы чаще практиковали аногенитальные контакты (p<0,05).
Незащищенные половые контакты (включая без использования презерватива с последующей обработкой раствором мирамистина) в анамнезе имели более 84% пациенток с ЦМВ и 70% женщин из группы контроля (p<0,05).
Таким образом, вероятным предрасполагающим фактором для ЦМВИ урогенитального тракта являлось раннее начало половой жизни и большое количество незащищенных аногенитальных контактов.
При клиническом обследовании анализировали особенности субъективных ощущений, проводили тщательный общий и гинекологический осмотр.
Таким образом, у пациенток с ЦМВИ при гинекологическом осмотре чаще выявлялся острый или хронический воспалительный процесс в малом тазу.

Результаты микроскопического исследования мазков отделяемого генитального тракта, окрашенных по Граму, представлены в табл. 6.

Анализ результатов культурального исследования отделяемого мочеполового тракта женщин выявил доминирование грибов Candida spp. (48,60%), G. vaginalis (30,62%), T. vaginalis (21,35%). У большинства женщин в биотопах влагалища имела место ассоциация ЦМВИ с условно-патогенными бактериями (Streptococcus, St. aureus, Ureaplasma spp., M. hominis) в высоком титре (более 10 5 КОЕ/мл; табл. 7).

Результаты комплексного обследования этих женщин представлены в табл. 8.
У 71 (19,9%) женщины состояние вагинальной микроэкологии было оценено как нормоценоз. Проанализировав полученные данные, можно было выделить его некоторые особенности, которые в ряде случаев позволили назвать указанное состояние нормоценозом только условно. Так, только у 22 (6,18%) женщин из 356 состояние микроэкологии полностью соответствовало всем критериям нормы репродуктивного возраста: при микроскопии вагинального отделяемого отсутствовала выраженная лейкоцитарная реакция (количество лейкоцитов не превышало 10 в поле зрения), эпителий был представлен клетками поверхностного и промежуточного слоев, количество микрофлоры было умеренным при абсолютном преобладании морфотипа лактобактерий. Морфотипы условно-патогенных микроорганизмов (УПМ) не определялись. При культуральном исследовании титр лактобацилл составлял 10 6-8 КОЕ/мл вагинального отделяемого, а концентрации УПМ были низкими (менее 10 3 КОЕ/мл).
Наиболее частой патологией среди 356 обследованных пациенток с ЦМВИ оказался кандидоз (57,30%), в большинстве случаев сопровождавшийся умеренным повышением титра УПМ (Streptococcus группы В в 10 6 КОЕ/мл и St. aureus более 10 6 КОЕ/мл).
Аэробный вагинит (1,12%) как вариант дисбиоза влагалища был обусловлен колонизацией вагинального биотопа высокими титрами E. coli (более 10 7 КОЕ/мл) и стрептококков группы В (10 6 КОЕ/мл). По данным микроскопии в этих случаях также отмечалась выраженная лейкоцитарная реакция (более 40 лейкоцитов в поле зрения).
У 21,06% женщин микроскопически был установлен бактериальный вагиноз, что сопровождалось высокой колонизацией факультативно-анаэробной и анаэробной флоры (более 10 6 КОЕ/мл).
В 0,56% случаев состояние вагинальной микроэкологии было оценено как другой вариант дисбиоза влагалища, когда при минимальном содержании микрофлоры (данные микроскопии) доминировали факультативно-анаэробные и аэробные УПМ (грамположительные кокки), а лактоморфотипы были единичными в поле зрения.
Таким образом, только у 19,9% пациенток с ЦМВИ имелся классический вариант микроценоза, в остальных случаях микрофлора влагалища претерпевала изменения, связанные с нарастанием титра факультативно-анаэробных УПМ. У 80,1% женщин выявлены нарушения микроценоза влагалища, в большинстве случаев связанные с увеличением количества Candida spp. При исследовании отделяемого из уретры с помощью ПЦР идентифицированы возбудители ИППП и УПМ. Наиболее часто выявлялись ДНК HPV (11,52%), T. vaginalis, M. hominis, HSV 1-го и 2-го типов (2,81 и 3,08% соответственно), С. trachomatis были идентифицированы в уретре у 5,34% больных.
В цервикальном канале в 5 раз чаще определялись УПМ и патогены. Так, наиболее часто у женщин с ЦМВИ были выделены вирус папилломы человека (42,13%), T. vaginalis (11,52%), M. hominis (21,63%), С. trachomatis (18,82%) и Ureaplasma spp. (24,44%).
В соскобах из влагалища также наиболее часто определялась ДНК вируса папилломы человека (43,25%), T. vaginalis (21,35%), M. hominis (14,89%), Ureaplasma spp. (19,38%), а также G. vaginalis (25%).
При исследовании проб из прямой кишки были идентифицированы ДНК ВПЧ (28,93%) и M. hominis (11,24%).

Для верификации диагноза ЦМВИ проводили расширенный анализ результатов, полученных разными методами исследования (табл. 9).
При анализе данных с целью выявления маркеров ЦМВИ установлена наибольшая частота обнаружения анти-CMV IgG — 356 (100%) случаев. Анти-CMV IgM были выявлены у 89 (25%) женщин. Обнаружение антител класса G к CMV свидетельствовало как об инфицированности, так и о наличии в большинстве случаев сформированного специфического противовирусного иммунитета. Выявление антител класса М совместно с IgG было одним из признаков реактивации данной вирусной инфекции.
При исследовании материала, полученного из урогенитального тракта с помощью ПЦР, ДНК CMV была обнаружена у 208 (58,43%) женщин.
ЦМВ на культуре фибробластов легких человека при исследовании крови выявлен у 93 (26,12%) женщин, мочи — у 199 (55,90%), слюны — у 204 (57,30%) больных, влагалищного отделяемого — у 225 (63,20%), из цервикального канала — в 268 (75,28%) случаях. В целом ЦМВ был обнаружен у 268 (75,28%) пациенток.
Учитывая этиологию, патогенез и клинические проявления ЦМВИ урогенитального тракта, пациенткам с реактивированной и латентной формой ЦМВИ проводилась комплексная терапия инфекционного процесса в соответствии с клиническими рекомендациями по ведению больных с ИППП. Противовирусное лечение включало использование препарата Панавир. Основное действующее вещество данного препарата — гексозный гликозид, полученный методом ферментативного гидролиза с последующей газожидкостной хроматографией, состоящий из глюкозы, рамнозы, арабинозы, маннозы, ксилозы, галактозы, уроновых кислот. В ряде экспериментальных и клинических исследований установлена противовирусная и иммуномодулирующая активность Панавира. Данный препарат повышает неспецифическую резистентность организма к разным инфекциям и способствует индукции интерферона, Панавир (5 мл 0,004% раствора) применялся парентерально (внутривенно струйно) 1 раз в сутки через 48 ч (3 инъекции в 1-ю неделю лечения), затем — через 72 ч (2 инъекции во 2-ю неделю терапии). Всего на курс пришлось 5 инъекций в течение 2 недель.
При контрольном исследовании, проведенном через 14 дней после лечения, лишь у 2 (8,0%) пациенток с латентной формой ЦМВИ выявлен CMV в культуре клеток отделяемого цервикального канала, ДНК CMV не определялась у 24 (96%) больных. В результате лечения при реактивированной форме ЦМВИ была констатирована негативация IgM анти-CMV в крови у 100% женщин. При исследовании CMV на культуре фибробластов эмбрионов человека вирурия установлена у 1 (5,56%) пациентки, выделение из цервикального канала отмечено у 3 (16,67%). Результаты вирусологического обследования крови, слюны, влагалищных выделений были отрицательными у всех женщин. При проведении ПЦР наличие ДНК CMV выявлено у 2 (11,11%) пациенток, получавших парентерально Панавир.
Таким образом, в ходе исследования определены основные диагностические клинико-лабораторные критерии разных форм ЦМВИ урогенитального тракта сексуально активных женщин репродуктивного возраста, на основании которых возможности определения данной инфекции существенно увеличились. Наличие клинических проявлений при реактивированной ЦМВИ и определение вирусов при подостром или хроническом течении воспалительных заболеваний органов малого таза способствовали определению значимости данной инфекции в развитии патологии гениталий. Применение препарата Панавир в комплексной терапии повышало эффективность лечения в 89,5% случаев, что позволяет рекомендовать препарат Панавир для комплексной терапии ЦМВИ.
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова"
Институт химической физики им. Н.Н. Семенова РАН, Москва
Совершенствование терапии цитомегаловирусной инфекции у мужчин
Журнал: Клиническая дерматология и венерология. 2016;15(3): 48‑52
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Увеличилось количество сексуально активных мужчин с хроническими воспалительными заболеваниями органов малого таза (ВЗОМТ), при обследовании которых в соскобах из уретры выявлялись ДНК цитомегаловируса (ЦМВ). Цель исследования — совершенствование подходов к диагностике и терапии цитомегаловирусной инфекции урогенитального тракта. Материал и методы. Под наблюдением находились 56 пациентов с ВЗОМТ, обусловленными патогенной, условно-патогенной микрофлорой и ЦМВ. Назначали 0,004% раствор Панавира по 5 мл внутривенно, антибактериальные препараты. Результаты. Комплексная терапия с применением антибактериальных препаратов и 0,004% раствор Панавира по 5 мл внутривенно у пациентов с инфекцией ЦМВ в урогенитальном тракте показала эффективность в 84,61% случаев.
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова"
Институт химической физики им. Н.Н. Семенова РАН, Москва
Выделяют два периода жизни человека, наиболее уязвимых для инфицирования, — детский возраст до 5—6 лет, когда передача инфекции происходит от матери к ребенку или от детей, выделяющих вирус. Вторым критическим периодом является возраст 16—30 лет: в данной группе лиц передача вируса осуществляется от лиц с латентным или субклиническим течением инфекции, главным образом половым путем как при гомо-, так и гетеросексуальных контактах.
Среди условий, способствующих реактивации ЦМВИ, выделяют: стрессы (психотравмы, длительные интеллектуальные и физические перегрузки, хронический дефицит сна); инфекции, имеющие повреждающее действие на иммунную систему; нарушения метаболизма вследствие заболевания органов эндокринной системы (гипотиреоз, тиреотоксикоз, недостаточность половых гормонов, сахарный диабет) или дефицита белков, микроэлементов, витаминов; истощение антиоксидантной системы в результате хронической инфекции, радиационных поражений, заболеваний внутренних органов, токсического действия продуктов свободнорадикального окисления; интоксикации различного генеза. К ятрогенным факторам относят длительный прием иммуносупрессантов, включая глюкокортикоиды и цитостатики.
По данным Е.А. Григорьевой и соавт. (2003), к ухудшению состояния больных ЦМВИ приводили интеркуррентные заболевания, хронические воспалительные заболевания гениталий. Вторичный иммунодефицит, проявляющийся резким угнетением фагоцитарной активности нейтрофилов крови, функциональной активности Т-лимфоцитов и недостаточностью иммунного ответа, способствует реактивации ЦМВ, способного в свою очередь вызывать депрессию практически всех звеньев иммунитета: угнетение клеток-киллеров, дисфункцию макрофагов, дефицит продукции интерлейкинов. Отмечено, что при ассоциации с другими возбудителями ЦМВ может приобретать цитопатические свойства, поддерживать воспалительную реакцию, снижать эффективность специфической терапии (Дерябин П.Г., 2003; Чернова Н.И., 2013). Полное выздоровление происходит лишь в том случае, если из организма удален возбудитель и выключены иммунопатологические механизмы, а временный дефект иммунологической реактивности ликвидирован. Следовательно, диагностика ЦМВИ заключается не только в детекции ЦМВ в организме пациента, но и в определении факторов, способствующих повышению вирусной активности, которая обусловливает патологические изменения в органах.
Решение этих задач зависит от мастерства врачей, чья недостаточная компетентность может приводить к диагностическим ошибкам, следовательно, к неправильному лечению. При назначении терапии следует учитывать, что наибольшую эффективность следует ожидать от препаратов, сочетающих этиотропный и иммуномодулирующий эффекты. Наряду с созданием новых химических средств идет интенсивный поиск среди соединений растительного происхождения. В данном аспекте определенный интерес представляет отечественный препарат Панавир — очищенный экстракт побегов растения Solanum tuberosum, биологически активный полисахарид, основное действующее вещество которого — гексозный гликозид, полученный методом ферментативного гидролиза с последующей газожидкостной хроматографией, состоящий из глюкозы, рамнозы, арабинозы, маннозы, ксилозы, галактозы, уроновых кислот, результат более чем десятилетних исследований ученых НИИ физико-химической медицины РАМН. Доклинические исследования на моделях вирусных инфекций на протяжении ряда лет проходили в основном в НИИ вирусологии им. Д.И. Ивановского и в НИИ физико-химической медицины РАМН. Так, под руководством проф. А.А. Кущ в лаборатории клеточной инженерии ГН НИИ вирусологии им. Д.И. Ивановского была показана высокая противовирусная активность Панавира в отношении ЦМВ. Препарат в определенном диапазоне доз полностью предотвращал вирус-индуцированное цитопатическое действие (ЦПД) в культурах клеток, обладал способностью тормозить развитие ЦПД в клетках, повышал жизнеспособность клеток в присутствии вирусов. В экспериментах in vitro было показано, что препарат обладает относительно низким цитотоксическим и антипролиферативным действием в отношении целого ряда клеточных культур (перевиваемые клетки линии Vero, диплоидные клетки фибробластов эмбрионов человека, клетки SW-13). В ходе токсикологических исследований было выявлено, что ЛД50 в несколько тысяч раз выше оптимальной терапевтической дозы, а также было показано, что Панавир не обладает тератогенными, мутагенными свойствами, не изменяет реологические показатели крови. Доклинические исследования in vitro и in vivo выявили противовирусные свойства препарата в отношении инфекций, вызываемых самыми разными вирусами, как ДНК-, так и РНК-содержащими, например, вирусами простого герпеса (ВПГ) 1-го и 2-го типов, ЦМВ, вирусом гепатита С, гриппа А, В, аденовирусами, что свидетельствует о поливалентном характере противовирусной активности нового препарата. Характерными особенностями механизма противовирусной активности Панавира являются его влияние на ингибирование синтеза вирусных белков и доказанное повышение жизнеспособности клеток в культуре в присутствии вирусов, снижение титров вирусов в культуре клеток и в эксперименте на животных, увеличение латентного периода развития экспериментальной инфекции in vitro и in vivo, митогенная активность в реакции бласттрансформации лимфоцитов, способность модулировать уровень лейкоцитарных интерферонов α и γ. Противовирусное действие Панавира включает несколько механизмов:
1) препятствие адгезии вируса на поверхности клетки;
2) блокада пенетрации вируса в клетку;
3) нарушение синтеза капсидных белков и заключительной сборки вируса.
В ходе исследований, проведенных в ЦНИКВИ Минздрава России, на кафедре кожных и венерических болезней МГМСУ, Уральском НИИ дерматовенерологии, МОНИКИ, Научном центре акушерства и гинекологии, показана высокая эффективность Панавира в терапии пациенток с генитальной герпетической, папилломавирусной, цитомегаловирусной инфекциями.
При ЦМВИ Панавир назначают в форме 0,004% раствора по 5 мл внутривенно по схеме: три инъекции через 48 ч в течение 1-й недели и две инъекции с интервалом 72 ч в течение 2-й недели (всего пять инъекций на курс).
Цель исследования — совершенствование терапии ЦМВИ у мужчин.
Материал и методы
Под наблюдением находились 56 мужчин в возрасте от 20 до 35 лет с ЦМВИ урогенитального тракта (УГТ).
Лабораторная диагностика
1. Микроскопическое исследование с целью определения эпителия, лейкоцитарной реакции, морфотипа биоты, внутриклеточных грамотрицательных диплококков (Neisseria gonorrhoeae), Trichomonas vaginalis.
2. Культуральное исследование с целью выявления роста N. gonorrhoeae, T. vaginalis, Ureaplasma urealyticum, Mycoplasma hominis, условно-патогенной микрофлоры.
3. Молекулярно-генетическое исследование с целью детекции ДНК Chlamydia trachomatis, N. gonorrhoeae, T. vaginalis, Mycoplasma genitalium, Ureaplasma spp., Gardnerella vaginalis, M. hominis, вируса папилломы человека (ВПЧ) и ВПГ (качественное и количественное).
4. Для детекции ЦМВИ использовали иммуноферментный анализ (ИФА) с выявлением в сыворотке крови специфических анти-ЦМВ классов IgM (качественный анализ) и IgG (количественный анализ). Вирусологическое выявление ЦМВ проводили на культуре фибробластов легких эмбриона человека, при исследовании крови, слюны, мочи, эякулята. ДНК ЦМВ в отделяемом из УГТ определяли посредством полимеразной цепной реакции (ПЦР). Всем пациентам проведено микроскопическое и бактериологическое исследование клинического материала из уретры.
На протяжении исследования проводилось четыре визита, включающих однократный осмотр во время лечения, далее через 30, 60 и 90 дней после лечения с лабораторным контролем на 30-й и 90-й день лечения.
Больные были разделены на две группы: в 1-ю вошли 14 мужчин без ИППП, во 2-ю — 42 человека с инфекционными заболеваниями УГТ. Антимикробная терапия определялась чувствительностью микрофлоры к антибиотикам, возможностью создания в очаге инфекции концентрации препаратов, подавляющих жизнедеятельность микроорганизмов, отсутствием или маловыраженным побочным действием на организм больного. Учитывая этиологию, патогенез, клиническую симптоматику, терапия проводилась в соответствии с клиническими рекомендациями: джозамицин по 500 мг 3 раза в сутки или доксициклина моногидрат по 100 мг в сутки. В зависимости от топического диагноза курс составлял 10—20 сут. Препараты применялись в комбинации с метронидазолом по 500 мг 2 раза в день 5—10 дней.
Всем больным с ИППП был назначен 0,004% раствор Панавира по 5 мл внутривенно — три инъекции через 48 ч в течение 1-й недели и две инъекции с интервалом 72 ч в течение 2-й недели.
Оценка эффективности терапии основывалась на данных динамики субъективных и объективных симптомов и результатов лабораторной диагностики.
На протяжении исследования проводилось четыре визита, включающих два осмотра до лечения, далее через 30 (с лабораторным контролем) и 90 дней после проведенной терапии.
Результаты
Средний возраст пациентов составил 29,15±4,18 года. Количество холостых и состоящих в браке оказалось одинаковым (по 50%). При анализе данных сексуального анамнеза мужчин, обратившихся за медицинской помощью, было констатировано, что 100% пациентов имели незащищенные орогенитальные контакты с новым партнером, при этом женатые мужчины имели связи вне брака, 12 человек отмечали случайные половые контакты.
Основные жалобы были представлены дискомфортом в уретре и промежности, наличием выделений, а также дизурическими расстройствами разной степени выраженности. Длительность перечисленных симптомов отмечалась в среднем от 3 мес до 2 лет. В результате проведенной терапии было установлено, что применение комплексной терапии способствовало купированию дискомфорта в области гениталий у большинства пациентов обоих групп.
У пациентов 2-й группы в отделяемом уретры отмечался лейкоцитоз от 10 до 80 в поле зрения. При культуральном исследовании рост T. vaginalis регистрировался у 22 обследованнных, условно-патогенной микрофлоры — у 100%. Через 30 и 90 дней после лечения нормализация лейкоцитоза отмечалась у 34 пациентов. При бактериологическом обследовании более высокие количественные показатели для таких возбудителей, как Streptococcus fаecalis, Staphylococcus epidermidis, Candida albicans, отмечены у 8 больных.
До лечения при помощи ПЦР выявлены С. trachomatis у 12 больных, а также ВПЧ, ВПГ у 33 пациентов 2-й группы (табл. 1).

Таблица 1. Результаты исследования ПЦР
В большинстве случаев была диагностирована микстинфекция, включающая 3—4 ассоцианта. Через 30 и 90 дней после проведенной терапии результаты были отрицательными у 42 (100%) больных.
При включении в исследование у всех мужчин (n=56, или 100%) были положительными анти-ЦМВ IgG и отрицательными IgМ. При обследовании крови, мочи, слюны, эякулята, соскобов из уретры с помощью молекулярно-генетического и вирусологического методов ЦМВ наиболее часто (78,69%) определялся в эякуляте и соскобах из уретры (60,66%) у пациентов с ИППП, тогда как у мужчин без патогенной микрофлоры в соскобах из уретры и в моче (14,29%) (табл. 2).

Таблица 2. Выявление маркеров CMV
Все пациенты переносили лечение хорошо, побочных эффектов или аллергических реакций отмечено не было.
Заключение
Результаты исследования демонстрируют высокую эффективность предложенного комплексного метода лечения генитальной бактериально-вирусной инфекции с использованием противовирусного препарата Панавир в форме 0,004% раствора по 5 мл внутривенно и антибактериальных препаратов.
Как показывает наблюдение за пролеченными больными в течение 90 дней, возникновение реактивации ЦМВИ после комплексной терапии с применением системного введения препарата Панавир в форме 0,004% раствора по 5 мл внутривенно произошло у 4 (9,52%) больных ИППП и у 4 (28,57%) — без ИППП.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Генитальный герпес: причины появления, классификация, симптомы, диагностика и способы лечения.
Определение
Генитальный герпес – хроническое рецидивирующее заболевание вирусной этиологии, передающееся преимущественно половым путем. Герпес считается крайне распространенным эрозивно-язвенным заболеванием половых органов - ежегодно в мире регистрируется 500 000 новых случаев обращений по этому поводу. В Российской Федерации у лиц старше 18 лет инфицированность вирусом, вызывающим генитальный герпес, составляет 17,2 случая на 10 000 населения.
В 70% случаев заболевание протекает бессимптомно, что и обусловило широкое распространение этой патологии.
Причины появления генитального герпеса
Генитальный герпес вызывает вирус простого герпеса (ВПГ) I и/или II типов. Вирус герпеса I типа чаще всего поражает слизистую оболочку рта и носит название орального (лабиального) герпеса. При заражении этим вирусом очаги поражения локализуются на лице в области губ.
Вирус герпеса II типа чаще вызывает генитальный герпес, однако оба типа могут провоцировать развитие патологии оральной и генитальной локализации. Для ВПГ II типа более характерно рецидивирующее течение, чем для ВПГ I.
- Половой путь – самый часто встречающийся путь передачи генитальной герпетической инфекции.
- Передача вируса бытовым путем является самой редкой.
- Аутоинокуляция – перенос вируса с зараженных участков слизистой на здоровые самим больным.
- Трансплацентарный – через плаценту от инфицированной матери плоду.
- Перинатальный – в процессе родов.
- Контактно-бытовой (при несоблюдении правил ухода и гигиены).
- Аутоинокуляция (см. выше).
- Беспорядочная половая жизнь без использования барьерной контрацепции (презервативов).
- Нарушение правил личной и бытовой гигиены.
- Снижение иммунитета (в силу наличия длительно текущих хронических заболеваний, несбалансированного питания, подверженности частым стрессам, нарушения режима сна).
- Первый эпизод развития клинической симптоматики генитального герпеса.
- Рецидивирующая герпетическая инфекция.
- Инфекция мочеполовых органов.
- у мужчин,
- у женщин.
- Инфекция прямой кишки и перианальной кожи.
- Герпес с типичной клинической картиной.
- Атипичное течение.
Если иммунная система справляется с вирусом на этом этапе, то формируется иммунитет и носительство вируса, не исключающее рецидива заболевания при ослаблении защитных функций организма.
Если у организма нет ресурсов противостоять ВПГ, то вирус проникает во внутренние органы и фиксируется на них. При снижении иммунитета, прочих вирусных инфекциях или при обострениях хронических заболеваний ВПГ из органов вновь выходит в кровь и с ее током разносится по организму.
Симптомы генитального герпеса
При первичном инфицировании инкубационный период составляет от 1 до 10 дней, а клинические проявления длятся от 18 до 24 дней с нарастанием симптоматики в течение недели. До возникновения очагов повреждения у 50% больных появляются продромальные симптомы - парестезии, чувство жжения в генитальной области, невралгии в ягодичной, паховой бедренной областях, дизурия - и продолжаются до 24 часов. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением (образованием корочек). Симптомы общей интоксикации, свойственные любой вирусной инфекции, – недомогание, слабость, субфебрилитет, головная боль - развиваются, как правило, при первичном инфицировании, при рецидиве они минимальны.
Непервичная генитальная герпетическая инфекция протекает менее выраженно: длительность клинических проявлений составляет до 15 дней, реже наблюдается бессимптомное выделение вируса, длительность слущивания поврежденного эпителия составляет всего 4-5 дней.
Высыпания на половых органах и/или в перианальной области всегда носят пузырьковый характер, содержимое прозрачное, основание пузырьков гиперемировано (красного цвета); могут быть множественными и единичными.
Пораженная область слизистой оболочки отечная. У мужчин самая частая локализация высыпаний – мошонка, половой член, лобок, промежность, перианальная область.
У женщин – клитор, влагалище, вульва, лобок, шейка матки, перианальная область. В случае присоединения вторичной (чаще бактериальной) инфекции появляются гнойные и слизисто-гнойные выделения.
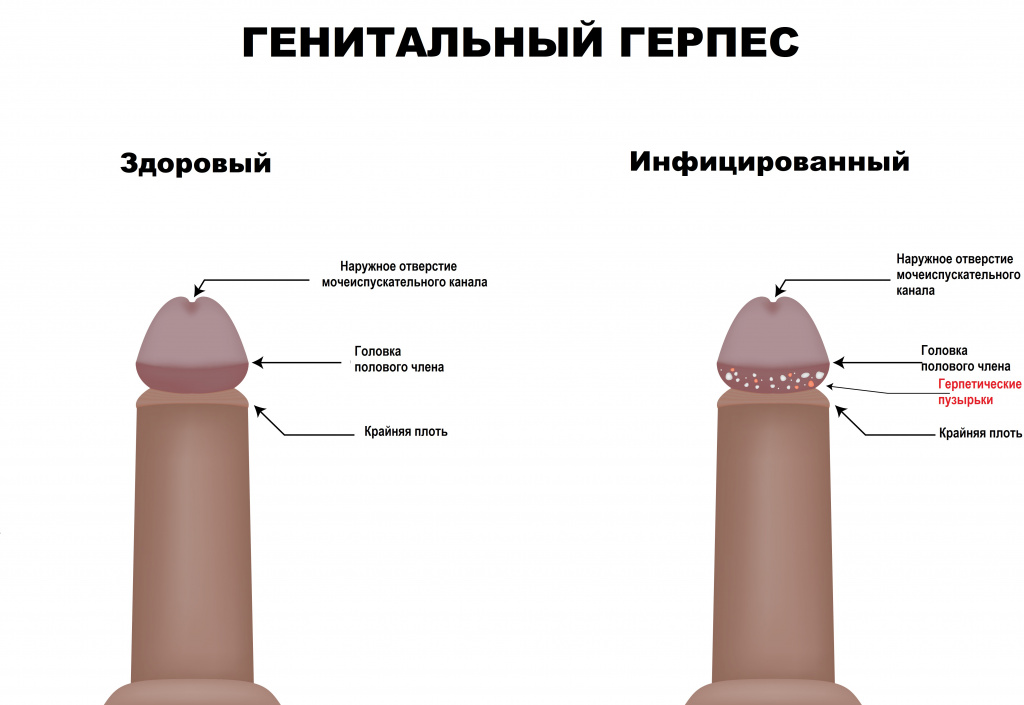
В случае обострения генитального герпеса присутствует боль при половом контакте.
Диагностика генитального герпеса
Диагностика этого заболевания строится на характерной клинической картине высыпаний и на выявлении ДНК вируса в крови или в отделяемом с пораженных тканей.
Необходимо сдать анализы крови для подтверждения инфицированности вирусом герпеса и определения активности процесса, для выявления ДНК вируса в эякуляте, секрете простаты, в соскобе клеток урогенитального тракта, а также в соскобах с конъюнктивы, кожи, слизистой оболочки носа, ротоглотки.
Раздельное определение ДНК-вируса простого герпеса 1 типа (губного или лабиального) и 2 типа (генитального) в сыворотке крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени. Термин "герпес" (от древнегреч. – ползти, ползучи.
Ташкентский медицинский педиатрический институт
Наиболее распространенные вирусные инфекции, передаваемые половым путем (герпетическая, папилломавирусная, цитомегаловирусная)
Журнал: Клиническая дерматология и венерология. 2011;9(3): 82‑87
Сиразитдинова В.Ф. Наиболее распространенные вирусные инфекции, передаваемые половым путем (герпетическая, папилломавирусная, цитомегаловирусная). Клиническая дерматология и венерология. 2011;9(3):82‑87.
Sirazitdinova VF. The most widespread sexually-transmitted viral infections (herpetic, papillomaviral, cytomegaloviral). Klinicheskaya Dermatologiya i Venerologiya. 2011;9(3):82‑87. (In Russ.).
Ташкентский медицинский педиатрический институт
В работе представлены эпидемиология, этиология, патогенез, клиническая картина, лабораторные методы и основные принципы лечения наиболее распространенных вирусных инфекций, передаваемых половым путем (герпетической, папилломавирусной, цитомегаловирусной).
Ташкентский медицинский педиатрический институт
Герпесвирусная инфекция
В 40% случаев первичное инфицирование вирусом простого герпеса (ВПГ) происходит воздушно-капельным путем именно в раннем детском возрасте. Около 2 млрд людей регулярно встречаются с клиническими проявлениями подобных заболеваний. Актуальность проблемы обусловлена недостаточностью знаний о закономерности развития латенции и персистирования герпесвирусов в организме человека, ростом рецидивирующих форм заболевания и не всегда удовлетворительными результатами лечения. ВПГ является одной из ведущих причин мертворождаемости, самопроизвольных выкидышей, преждевременных родов, заболеваемости новорожденных во время родов или постнатально (75—80%).
В России официальные статистические данные ВПГ суммируются только с 1993 г., и за 5 лет (1994—1999 гг.) заболеваемость увеличилась с 7,4 до 16,3 случая на 100 тыс. населения [1]. В Республике Узбекистан интенсивный показатель заболеваемости ГГ отмечен в 2001 г. — 1,2 на 100 тыс. населения (в 1997 г. – 0,9 на 100 тыс. населения).
Источником инфекции могут быть не только больные герпесом, но и вирусоносители, не имеющие симптомов герпеса. Перенесенные в детстве инфекции ВПГ-1 не предотвращают заражения ВПГ-2, но тяжесть течения заметно снижается, чаще заболевание переходит в латентную и бессимптомную форму.
Герпетическая инфекция характеризуется разнообразными клиническими проявлениями, локализацией, тяжестью течения. Инкубационный период, как правило, составляет 2—12 дней. Первичная инфекция обычно протекает субклинически. К основным клиническим формам герпетической инфекции относят герпетические поражения кожи, слизистых оболочек полости рта, острые респираторные заболевания, генитальный герпес, герпетические поражения глаз, энцефалиты и менингоэнцефалиты, висцеральные формы (гепатит, пневмонию), герпес новорожденных, генерализованный герпес, герпес у ВИЧ-инфицированных [2, 3].
В развитии герпетических пузырьков выделяют четыре стадии: эритемную, везикулезную, корковую и клинического выздоровления (отторжение корок).
Наиболее распространенными среди населения являются ограниченные герпетические поражения кожи, имеющие разнообразную локализацию. Наиболее часто они располагаются на коже лица (губы, нос, щеки, полость рта, глаза), на коже и слизистых оболочках гениталий, на коже кистей, ягодиц и др. Обычно они представлены группой пузырьков на гиперемированной и отечной коже. Прозрачное содержимое элементов сыпи вскоре мутнеет. Иногда пузырьки, сливаясь, образуют многокамерный элемент. При их вскрытии возникают эрозии, содержимое неразрушенных пузырьков ссыхается и образуются корки.
Механизмы передачи герпетической инфекции:
Группами риска по заражению являются лица с множественными и случайными половыми контактами [4].
Поражение кожи при ВПГ также может протекать в атипичных формах (абортивной, отечной, зостериформной, геморрагической, язвенно-некротической, герпетиформной экземы — вариолиформного пустулеза Юлиусберга–Капоши). У детей отмечается неонатальный герпес, который проявляется в трех клинических формах:
1) локальной с повреждением кожи и слизистых оболочек (наиболее легкая форма герпеса; составляет 20—45% всех случаев);
2) локальной с поражением ЦНС (герпетические энцефалиты, менингоэнцефалиты; данная форма составляет около 30% всех случаев);
3) диссеминированной с поражением ЦНС, печени, легких, надпочечников, синдромом диссеминированного внутрисосудистого свертывания [6].
В настоящее время для лабораторной диагностики герпетической инфекции наиболее часто используют:
— вирусологические методы обнаружения и идентификации ВПГ;
— методы выявления антигенов ВПГ (иммунофлюоресцентный и иммуноферментный анализы);
— полимеразную цепную реакцию (метод ПЦР);
— выявление антител с помощью иммуноферментного анализа;
— методы исследования и оценки иммунного статуса.
Материал для исследования берется в зависимости от локализации поражений [7]. В качестве материала для исследования ПЦР-методом ИППП служит соскоб эпителиальных клеток из уретры или цервикального канала, на инфекции новорожденных — соскоб эпителиальных клеток с миндалин и мест поражений у детей, цереброспинальная жидкость, кровь, моча [8].
Лечение больных ВПГ представляет определенные трудности и зависит от механизма заражения, формы течения, тяжести инфекционного процесса и локализации поражений. Ни один из известных противовирусных химиопрепаратов не способен элиминировать ВПГ из организма [9]. В основном все они направлены на временную стимуляцию (временное искусственное повышение) иммунитета, стимуляцию интерферонового статуса, что, как и любая искусственная стимуляция, может осложняться отдаленными негативными последствиями [10]. Существуют следующие подходы к противовирусной терапии:
1) лечение первичного эпизода ГГ;
2) эпизодическая противовирусная терапия (для купирования рецидивов);
3) профилактическая (превентивная или супрессивная) терапия (непрерывное лечение на протяжении определенного времени для предупреждения рецидивов).
Папилломавирусная инфекция
Инфекция, вызванная вирусом папилломы человека (ВПЧ), может встречаться в любом возрасте у мужчин и женщин. Согласно официальным статистическим данным, в Российской Федерации ежегодно регистрируется примерно 50 тыс. новых случаев папилломавирусной инфекции (ПВИ). Распространенность ПВИ, по данным некоторых авторов, варьирует от 36% у женщин моложе 25 лет до 2,8% у женщин 45 лет и старше и коррелирует с сексуальной активностью, а пик частоты заболеваний приходится на 16—36 лет [11].
ВПЧ передается половым путем (пресс-релиз ВОЗ, 1996 г.). Установлено, что частота поражения шейки матки ВПЧ и частота выявления антител к ВПЧ прямо пропорциональны количеству половых партнеров на протяжении жизни, увеличиваясь приблизительно на 4% с каждым новым партнером и ранним началом половой жизни. Наиболее часто ПВИ выявляется среди лиц 17—25 лет [12].
Пути передачи ПВИ — все виды половых контактов, перинатальное заражение.
Клиническая картина. Инкубационный период ПВИ составляет 1–12 мес (в среднем 3 мес). Выделяют клиническую, субклиническую и латентную формы аногенитальной ВПЧ-инфекции. Клинические проявления генитальной ПВИ у беременных и небеременных пациенток не отличаются (остроконечные кондиломы, папилломы с экзофитным ростом, плоские папилломы). Кондиломы выявляются на коже промежности, на слизистой оболочке вульвы и влагалища, в уретре, в области ануса. Они представляют собой бородавчатые возвышения, которые могут быть единичными, но чаще множественными, слившимися в группы и напоминающими цветную капусту или петушиные гребни. Их поверхность покрыта многослойным плоским эпителием, нередко с ороговением. Особенно быстрый рост остроконечных кондилом наблюдается во время беременности. Субклинические формы могут быть выявлены только с помощью кольпоскопии, цитологического и гистологического исследований и представлены интраэпителиальными папилломами с эндофитным ростом. В зависимости от проявлений ПВИ на гениталиях выделяют клиническую, субклиническую и латентную формы. Клиническая форма ПВИ — в основном генитальные бородавки в виде остроконечных (экзофитных), папиллярных или кератотических образований. Субклиническая форма ПВИ проявляется в виде плоских кондилом, которые чаще локализуются на шейке матки и реже – во влагалище и в большинстве случаев незаметны при осмотре. Латентная форма ПВИ не может быть диагностирована кольпоскопически, цитологически и гистологически, так как не сопровождается морфологическими изменениями в инфицированной ткани. Используют следующие лабораторные методы: ПЦР, Hybrid сapture (метод на основе гибридизации в растворе). Эти методы позволяют определить серотип вируса, который имеет значение для прогнозирования дальнейшего развития заболевания [13].
У детей единственно значимым заболеванием, обусловленным ВПЧ, является ювенильный рецидивирующий респираторный папилломатоз. Это редкое заболевание дыхательного эпителия, вызываемое генитальными типами ВПЧ. Его частота составляет 1,7—2,6 на 100 тыс. детей. Существует предположение, согласно которому данное заболевание является следствием интранатального инфицирования, но риск его чрезвычайно мал и составляет 1 на 1500 родов среди женщин с генитальной ПВИ [14].
Лабораторные исследования заключаются в цитологии эпителия шейки матки и материала, полученного из цервикального канала (возможно и из других локализаций). Для исследования спинномозговой жидкости, содержимого материала, везикул и язв, чаще используют методы амплификации нуклеиновых кислот, преимущественно ПЦР-анализ с типированием ВПЧ. Чувствительность и специфичность ПЦР достигает 100%. Эти методы в настоящее время широко используются в клинической практике. Особое внимание следует уделять при наличии атипичных или незаживающих кондилом, подозрении на злокачественные образования, при высыпаниях, не поддающихся лечению, кровоточивости, зуде. Однако следует учитывать, что в подавляющем большинстве случаев (около 90%) происходит самопроизвольное элиминирование ВПЧ и лишь определение ранних белков вируса (Е6/Е7) с помощью ИФА может спрогнозировать малигнизацию [7, 15, 16].
Несмотря на многочисленные методы лечения ПВИ гениталий частота рецидивов этого заболевания высока, и ни один из предложенных методов лечения не является полностью эффективным и безопасным. Лечение кондилом осуществляют с учетом их локализации, характера процесса (наличие или отсутствие дисплазии) и сопутствующих заболеваний (другие инфекции, нарушения микробиоценоза влагалища) [17]. Таким образом, современная программа лечения ПВИ включает цитотоксическую терапию (подофиллин, подофиллотоксин, кондилин, 5-фторурацил), физические (криодеструкция, лазеро- и диатермокоагуляция, электрохирургическое иссечение, радиоволновая терапия) и химические (трихлоруксусная кислота, ферезол, солкодерм) деструктивные методы, иммунологические методы (α-, β-, γ-интерферон), комбинированные методы (применение различных комбинаций физических, химических и медикаментозных методов).
Цитомегаловирусная инфекция
Цитомегаловирусная инфекция (ЦМВИ; цитомегалия, вирусная болезнь слюнных желез, инклюзионная цитомегалия, болезнь с включениями) относится к так называемым болезням цивилизации, которые весьма распространены в мире. В последние годы распространенность иммунодефицитных состояний повысилась в связи с появлением ВИЧ-инфекции, действием факторов, нарушающих экологическое равновесие, различными ятрогенными вмешательствами (лекарственная болезнь, гемотрансфузии, применение цитостатиков, в частности при трансплантации органов и тканей) [18]. ЦМВИ в мире инфицируется до 2% новорожденных и 45–60% детей первого года жизни. По данным Всемирной организации здравоохранения, процент выявления антител в зависимости от социально-экономического статуса среди населения разных групп составляет 40—100%, а цитомегаловирус нередко сочетается с ИППП.
Источниками инфекции могут быть носители или больные ЦМВИ. Вирус передается через биологические жидкости и выделения (кровь, мочу, слюну, слезную жидкость, отделяемое носоглотки, спинномозговую жидкость, грудное молоко, околоплодные воды, цервикальный и вагинальный секреты, сперму, фекалии).
Пути передачи ЦМВИ многочисленны. Возможны следующие механизмы и пути передачи ЦМВИ в естественных условиях:
— фекально-оральный (характерен бытовой путь передачи через загрязненные руки, предметы обихода и др.);
— воздушно-капельный, контактный (инфекция передается через поврежденные кожные покровы и мацерированные слизистые оболочки);
— трансплацентарный (определяет развитие внутриутробной инфекции), восходящий путь инфицирования возможен также при прохождении плодом родового канала, что обусловливает заражение в интранатальном периоде;
— аспирационный, при кормлении грудным молоком, инфицированной роженицы;
— при гемотрансфузиях и трансплантации органов;
Наиболее вероятными средствами трансмиссии ЦМВИ считают половые пути и грудное молоко (20% серопозитивных матерей имеют цитомегаловирус в грудном молоке и 30% из них могут выделять его в молоко в течение 1 года после родов).
Факторами риска развития внутриутробной ЦМВИ считают предшествующие в анамнезе аборты, выкидыши, мертворождения, раннюю детскую смертность, юный возраст матери или возраст старше 35 лет, наличие хронической патологии, осложненное течение беременности и родов. О пренатальном инфицировании свидетельствует выявление симптомов заболевания с первых дней жизни ребенка. Характерны желтуха, гепатоспленомегалия, геморрагический синдром, поражаются другие органы и системы: легкие (интерстициальная пневмония), ЦНС (гидроцефалия, менингоэнцефалит), пищеварительная система (энтерит, колит, фиброз, поликистоз поджелудочной железы, почки). Острая врожденная форма ЦМВИ, как правило, носит генерализованный характер, протекает тяжело, осложняется присоединением вторичных инфекций и часто заканчивается летально в первые недели жизни ребенка. У детей, перенесших врожденную ЦМВИ в раннем возрасте, развиваются вторичные инфекции мочевыводящих путей в виде острого (19%) или хронического (7%) пиелонефрита, цистита, а также иммунопатологические процессы в форме острого (5%) или хронического (1,4%) гломерулонефрита [19]. ЦМВИ у детей старшего возраста протекает по варианту острой респираторной вирусной инфекции или инфекционного мононуклеоза. Таким образом, инфицирование детей старшего возраста и взрослых в большинстве случаев не приводит к развитию заболевания. Формируется бессимптомное вирусоносительство или субклиническая, инаппарантная форма хронической ЦМВИ. Наблюдаются также интерстициальная пневмония, субклинический миокардит, энцефалиты, менингиты, тромбоцитопения, гемолитическая анемия, гепатит, нефрит, увеит.
1) использовать два метода диагностики для обнаружения прямых маркеров ЦМВИ (быстрый культуральный метод и ПЦР);
2) исследовать две биологические жидкости (кровь, мочу) от одного пациента;
3) в обязательном порядке проводить повторное обследование пациентов из группы риска независимо от результатов первичного анализа.
Целью терапевтических мероприятий является окончание фазы активной репликации вируса или ее предотвращение как путем воздействия на иммунитет, так и непосредственно на синтез ДНК возбудителя. Для достижения указанной цели используют три основных подхода:
1) иммунотропную (иммуномодулирующую) терапию;
3) комбинацию иммуномодулирующей терапии и химиотерапии.
Из противовирусных препаратов эффективен ацикловир (виролекс, зовиракс), применяемый местно, перорально или внутривенно. Одним из основных факторов противоинфекционной резистентности является микроэкология детского организма. Во всех случаях при ЦМВИ, особенно у детей раннего возраста, имеет место нарушение состава микрофлоры кишечника, поэтому в комплексной терапии необходимо уделять пристальное внимание коррекции дисбиоза, учитывая огромную роль нормальной микрофлоры кишечника в иммунном ответе макроорганизма.
В настоящее время проблеме ИППП, в том числе у беременных и детей, во всем мире уделяется большое внимание, что напрямую связано с негативным влиянием этой группы заболеваний на репродуктивное здоровье и благополучие популяции в целом. Для сохранения репродуктивного здоровья подрастающего поколения необходимо не только использовать современные методы диагностики и лечения на основе принципов доказательной медицины, но и совершенствовать профилактику социально значимых инфекций.
Читайте также:

