Цитомегаловирус и герпес в уретре
Обновлено: 19.04.2024
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова"
Институт химической физики им. Н.Н. Семенова РАН, Москва
Совершенствование терапии цитомегаловирусной инфекции у мужчин
Журнал: Клиническая дерматология и венерология. 2016;15(3): 48‑52
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Увеличилось количество сексуально активных мужчин с хроническими воспалительными заболеваниями органов малого таза (ВЗОМТ), при обследовании которых в соскобах из уретры выявлялись ДНК цитомегаловируса (ЦМВ). Цель исследования — совершенствование подходов к диагностике и терапии цитомегаловирусной инфекции урогенитального тракта. Материал и методы. Под наблюдением находились 56 пациентов с ВЗОМТ, обусловленными патогенной, условно-патогенной микрофлорой и ЦМВ. Назначали 0,004% раствор Панавира по 5 мл внутривенно, антибактериальные препараты. Результаты. Комплексная терапия с применением антибактериальных препаратов и 0,004% раствор Панавира по 5 мл внутривенно у пациентов с инфекцией ЦМВ в урогенитальном тракте показала эффективность в 84,61% случаев.
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова"
Институт химической физики им. Н.Н. Семенова РАН, Москва
Выделяют два периода жизни человека, наиболее уязвимых для инфицирования, — детский возраст до 5—6 лет, когда передача инфекции происходит от матери к ребенку или от детей, выделяющих вирус. Вторым критическим периодом является возраст 16—30 лет: в данной группе лиц передача вируса осуществляется от лиц с латентным или субклиническим течением инфекции, главным образом половым путем как при гомо-, так и гетеросексуальных контактах.
Среди условий, способствующих реактивации ЦМВИ, выделяют: стрессы (психотравмы, длительные интеллектуальные и физические перегрузки, хронический дефицит сна); инфекции, имеющие повреждающее действие на иммунную систему; нарушения метаболизма вследствие заболевания органов эндокринной системы (гипотиреоз, тиреотоксикоз, недостаточность половых гормонов, сахарный диабет) или дефицита белков, микроэлементов, витаминов; истощение антиоксидантной системы в результате хронической инфекции, радиационных поражений, заболеваний внутренних органов, токсического действия продуктов свободнорадикального окисления; интоксикации различного генеза. К ятрогенным факторам относят длительный прием иммуносупрессантов, включая глюкокортикоиды и цитостатики.
По данным Е.А. Григорьевой и соавт. (2003), к ухудшению состояния больных ЦМВИ приводили интеркуррентные заболевания, хронические воспалительные заболевания гениталий. Вторичный иммунодефицит, проявляющийся резким угнетением фагоцитарной активности нейтрофилов крови, функциональной активности Т-лимфоцитов и недостаточностью иммунного ответа, способствует реактивации ЦМВ, способного в свою очередь вызывать депрессию практически всех звеньев иммунитета: угнетение клеток-киллеров, дисфункцию макрофагов, дефицит продукции интерлейкинов. Отмечено, что при ассоциации с другими возбудителями ЦМВ может приобретать цитопатические свойства, поддерживать воспалительную реакцию, снижать эффективность специфической терапии (Дерябин П.Г., 2003; Чернова Н.И., 2013). Полное выздоровление происходит лишь в том случае, если из организма удален возбудитель и выключены иммунопатологические механизмы, а временный дефект иммунологической реактивности ликвидирован. Следовательно, диагностика ЦМВИ заключается не только в детекции ЦМВ в организме пациента, но и в определении факторов, способствующих повышению вирусной активности, которая обусловливает патологические изменения в органах.
Решение этих задач зависит от мастерства врачей, чья недостаточная компетентность может приводить к диагностическим ошибкам, следовательно, к неправильному лечению. При назначении терапии следует учитывать, что наибольшую эффективность следует ожидать от препаратов, сочетающих этиотропный и иммуномодулирующий эффекты. Наряду с созданием новых химических средств идет интенсивный поиск среди соединений растительного происхождения. В данном аспекте определенный интерес представляет отечественный препарат Панавир — очищенный экстракт побегов растения Solanum tuberosum, биологически активный полисахарид, основное действующее вещество которого — гексозный гликозид, полученный методом ферментативного гидролиза с последующей газожидкостной хроматографией, состоящий из глюкозы, рамнозы, арабинозы, маннозы, ксилозы, галактозы, уроновых кислот, результат более чем десятилетних исследований ученых НИИ физико-химической медицины РАМН. Доклинические исследования на моделях вирусных инфекций на протяжении ряда лет проходили в основном в НИИ вирусологии им. Д.И. Ивановского и в НИИ физико-химической медицины РАМН. Так, под руководством проф. А.А. Кущ в лаборатории клеточной инженерии ГН НИИ вирусологии им. Д.И. Ивановского была показана высокая противовирусная активность Панавира в отношении ЦМВ. Препарат в определенном диапазоне доз полностью предотвращал вирус-индуцированное цитопатическое действие (ЦПД) в культурах клеток, обладал способностью тормозить развитие ЦПД в клетках, повышал жизнеспособность клеток в присутствии вирусов. В экспериментах in vitro было показано, что препарат обладает относительно низким цитотоксическим и антипролиферативным действием в отношении целого ряда клеточных культур (перевиваемые клетки линии Vero, диплоидные клетки фибробластов эмбрионов человека, клетки SW-13). В ходе токсикологических исследований было выявлено, что ЛД50 в несколько тысяч раз выше оптимальной терапевтической дозы, а также было показано, что Панавир не обладает тератогенными, мутагенными свойствами, не изменяет реологические показатели крови. Доклинические исследования in vitro и in vivo выявили противовирусные свойства препарата в отношении инфекций, вызываемых самыми разными вирусами, как ДНК-, так и РНК-содержащими, например, вирусами простого герпеса (ВПГ) 1-го и 2-го типов, ЦМВ, вирусом гепатита С, гриппа А, В, аденовирусами, что свидетельствует о поливалентном характере противовирусной активности нового препарата. Характерными особенностями механизма противовирусной активности Панавира являются его влияние на ингибирование синтеза вирусных белков и доказанное повышение жизнеспособности клеток в культуре в присутствии вирусов, снижение титров вирусов в культуре клеток и в эксперименте на животных, увеличение латентного периода развития экспериментальной инфекции in vitro и in vivo, митогенная активность в реакции бласттрансформации лимфоцитов, способность модулировать уровень лейкоцитарных интерферонов α и γ. Противовирусное действие Панавира включает несколько механизмов:
1) препятствие адгезии вируса на поверхности клетки;
2) блокада пенетрации вируса в клетку;
3) нарушение синтеза капсидных белков и заключительной сборки вируса.
В ходе исследований, проведенных в ЦНИКВИ Минздрава России, на кафедре кожных и венерических болезней МГМСУ, Уральском НИИ дерматовенерологии, МОНИКИ, Научном центре акушерства и гинекологии, показана высокая эффективность Панавира в терапии пациенток с генитальной герпетической, папилломавирусной, цитомегаловирусной инфекциями.
При ЦМВИ Панавир назначают в форме 0,004% раствора по 5 мл внутривенно по схеме: три инъекции через 48 ч в течение 1-й недели и две инъекции с интервалом 72 ч в течение 2-й недели (всего пять инъекций на курс).
Цель исследования — совершенствование терапии ЦМВИ у мужчин.
Материал и методы
Под наблюдением находились 56 мужчин в возрасте от 20 до 35 лет с ЦМВИ урогенитального тракта (УГТ).
Лабораторная диагностика
1. Микроскопическое исследование с целью определения эпителия, лейкоцитарной реакции, морфотипа биоты, внутриклеточных грамотрицательных диплококков (Neisseria gonorrhoeae), Trichomonas vaginalis.
2. Культуральное исследование с целью выявления роста N. gonorrhoeae, T. vaginalis, Ureaplasma urealyticum, Mycoplasma hominis, условно-патогенной микрофлоры.
3. Молекулярно-генетическое исследование с целью детекции ДНК Chlamydia trachomatis, N. gonorrhoeae, T. vaginalis, Mycoplasma genitalium, Ureaplasma spp., Gardnerella vaginalis, M. hominis, вируса папилломы человека (ВПЧ) и ВПГ (качественное и количественное).
4. Для детекции ЦМВИ использовали иммуноферментный анализ (ИФА) с выявлением в сыворотке крови специфических анти-ЦМВ классов IgM (качественный анализ) и IgG (количественный анализ). Вирусологическое выявление ЦМВ проводили на культуре фибробластов легких эмбриона человека, при исследовании крови, слюны, мочи, эякулята. ДНК ЦМВ в отделяемом из УГТ определяли посредством полимеразной цепной реакции (ПЦР). Всем пациентам проведено микроскопическое и бактериологическое исследование клинического материала из уретры.
На протяжении исследования проводилось четыре визита, включающих однократный осмотр во время лечения, далее через 30, 60 и 90 дней после лечения с лабораторным контролем на 30-й и 90-й день лечения.
Больные были разделены на две группы: в 1-ю вошли 14 мужчин без ИППП, во 2-ю — 42 человека с инфекционными заболеваниями УГТ. Антимикробная терапия определялась чувствительностью микрофлоры к антибиотикам, возможностью создания в очаге инфекции концентрации препаратов, подавляющих жизнедеятельность микроорганизмов, отсутствием или маловыраженным побочным действием на организм больного. Учитывая этиологию, патогенез, клиническую симптоматику, терапия проводилась в соответствии с клиническими рекомендациями: джозамицин по 500 мг 3 раза в сутки или доксициклина моногидрат по 100 мг в сутки. В зависимости от топического диагноза курс составлял 10—20 сут. Препараты применялись в комбинации с метронидазолом по 500 мг 2 раза в день 5—10 дней.
Всем больным с ИППП был назначен 0,004% раствор Панавира по 5 мл внутривенно — три инъекции через 48 ч в течение 1-й недели и две инъекции с интервалом 72 ч в течение 2-й недели.
Оценка эффективности терапии основывалась на данных динамики субъективных и объективных симптомов и результатов лабораторной диагностики.
На протяжении исследования проводилось четыре визита, включающих два осмотра до лечения, далее через 30 (с лабораторным контролем) и 90 дней после проведенной терапии.
Результаты
Средний возраст пациентов составил 29,15±4,18 года. Количество холостых и состоящих в браке оказалось одинаковым (по 50%). При анализе данных сексуального анамнеза мужчин, обратившихся за медицинской помощью, было констатировано, что 100% пациентов имели незащищенные орогенитальные контакты с новым партнером, при этом женатые мужчины имели связи вне брака, 12 человек отмечали случайные половые контакты.
Основные жалобы были представлены дискомфортом в уретре и промежности, наличием выделений, а также дизурическими расстройствами разной степени выраженности. Длительность перечисленных симптомов отмечалась в среднем от 3 мес до 2 лет. В результате проведенной терапии было установлено, что применение комплексной терапии способствовало купированию дискомфорта в области гениталий у большинства пациентов обоих групп.
У пациентов 2-й группы в отделяемом уретры отмечался лейкоцитоз от 10 до 80 в поле зрения. При культуральном исследовании рост T. vaginalis регистрировался у 22 обследованнных, условно-патогенной микрофлоры — у 100%. Через 30 и 90 дней после лечения нормализация лейкоцитоза отмечалась у 34 пациентов. При бактериологическом обследовании более высокие количественные показатели для таких возбудителей, как Streptococcus fаecalis, Staphylococcus epidermidis, Candida albicans, отмечены у 8 больных.
До лечения при помощи ПЦР выявлены С. trachomatis у 12 больных, а также ВПЧ, ВПГ у 33 пациентов 2-й группы (табл. 1).

Таблица 1. Результаты исследования ПЦР
В большинстве случаев была диагностирована микстинфекция, включающая 3—4 ассоцианта. Через 30 и 90 дней после проведенной терапии результаты были отрицательными у 42 (100%) больных.
При включении в исследование у всех мужчин (n=56, или 100%) были положительными анти-ЦМВ IgG и отрицательными IgМ. При обследовании крови, мочи, слюны, эякулята, соскобов из уретры с помощью молекулярно-генетического и вирусологического методов ЦМВ наиболее часто (78,69%) определялся в эякуляте и соскобах из уретры (60,66%) у пациентов с ИППП, тогда как у мужчин без патогенной микрофлоры в соскобах из уретры и в моче (14,29%) (табл. 2).

Таблица 2. Выявление маркеров CMV
Все пациенты переносили лечение хорошо, побочных эффектов или аллергических реакций отмечено не было.
Заключение
Результаты исследования демонстрируют высокую эффективность предложенного комплексного метода лечения генитальной бактериально-вирусной инфекции с использованием противовирусного препарата Панавир в форме 0,004% раствора по 5 мл внутривенно и антибактериальных препаратов.
Как показывает наблюдение за пролеченными больными в течение 90 дней, возникновение реактивации ЦМВИ после комплексной терапии с применением системного введения препарата Панавир в форме 0,004% раствора по 5 мл внутривенно произошло у 4 (9,52%) больных ИППП и у 4 (28,57%) — без ИППП.
Среди причин уретрита герпетическая инфекция в список самых частых заболеваний не входит.
Однако поражение мочеиспускательного канала вирусами семейства Herpesviridae, встречается все чаще.

В основе подобной тенденции лежит внедрение новых методов диагностики заболеваний, передающихся половым путем (ЗППП) и неконтролируемое использование антибиотиков.
Герпетический уретрит: общая характеристика
Из-за анатомических особенностей половых органов человека, мочеиспускательный канал очень часто поражается возбудителями венерических инфекций.

При незащищенных половых контактах передаются:
- Гонококки.
- Хламидии.
- Трихомонады.
- Микоплазмы.
- Грибки.
- Папилломавирусы.
И конечно же – вирусы герпеса.
В это семейство входит несколько возбудителей.
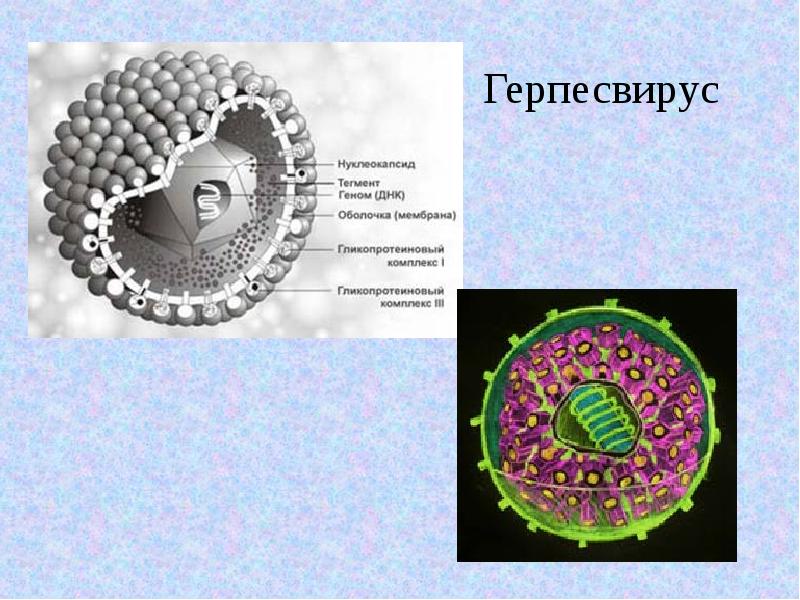
Больше всего проблем человеку причиняют вирусы простого герпеса типа 1 и типа 2 (ВПГ 1 и ВПГ 2).
Микроорганизмы попадают на кожу при телесном контакте.
По нервным окончаниям достигают ганглиев поясничного отдела спинного мозга и там размножаются.
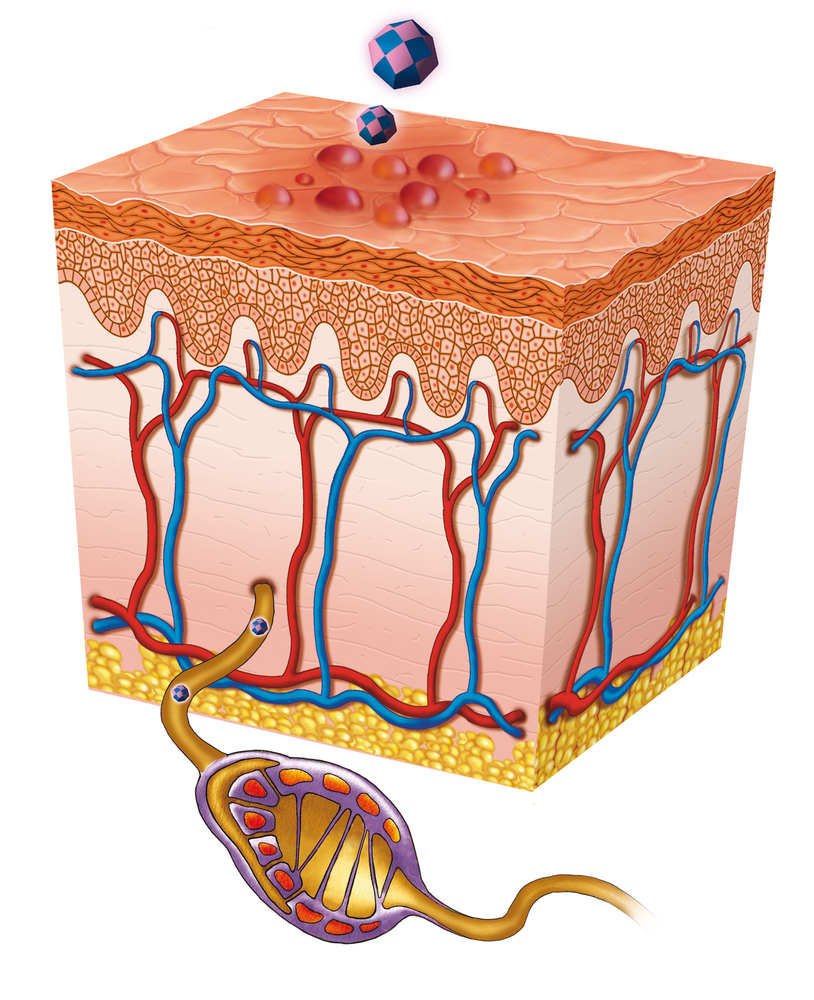
Наступает фаза ремиссии.
Периодически, выходят из нейронов спинного мозга и по чувствительным нервным волокнам движутся на периферию – к половым органам.
Начинается обострение или атака.
После чего клиника проходит и начинается очередная ремиссия.
Такое волнообразное течение считается одним из признаков инфекции герпеса.

Герпетический уретрит
рассказывает подполковник
медицинской службы, врач
Ленкин Сергей Геннадьевич
Содержание данной статьи проверено и подтверждено на соответствие медицинским
стандартам врачем дерматовенерологом, урологом, к.м.н.
Ленкиным Сергеем Геннадьевичем
| Наименование | Срок | Цена |
|---|---|---|
| Прием уролога | 900.00 руб. |
Клинические проявления герпетического уретрита

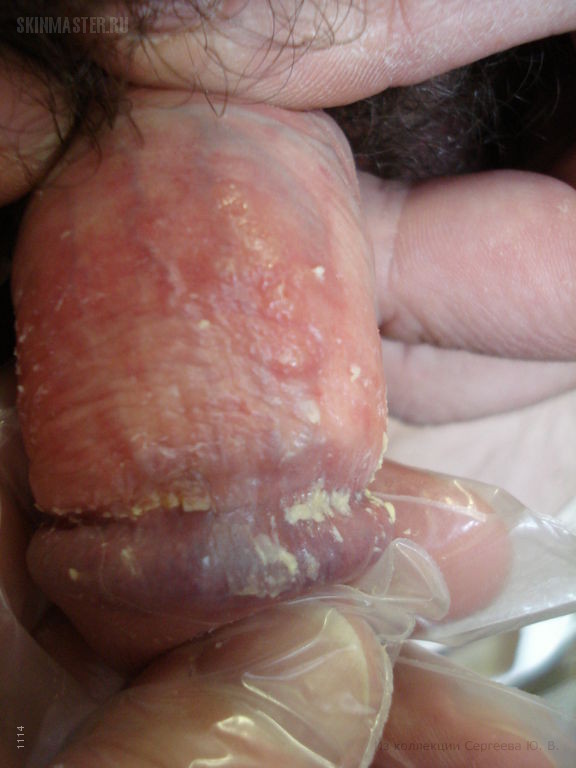
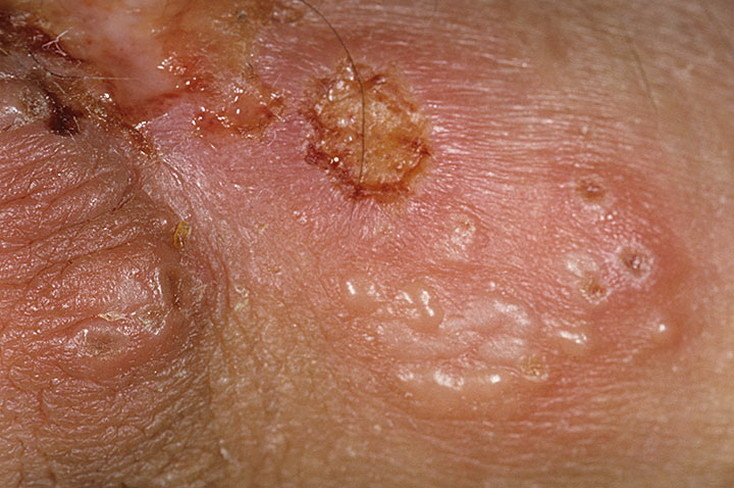
Как и почти все случаи герпетической инфекции, уретрит сопровождается типичными симптомами:
- Боль и жжение в области мочеиспускательного канала без визуально заметных поражений.
- Рези при мочеиспускании. .
- Появление характерных мелких везикул на других участках паха – крайняя плоть, большие и малые половые губы.
- Самопроизвольное вскрытие пузырьков.
- В ряде случаев – увеличение паховых лимфатических узлов (особенно – в течение первых лет после заражения).
Но такая классическая картина встречается далеко не всегда.

Причина в том, что у многих людей на герпес наслаивается клиника других ЗППП, которыми пациент часто заражается одновременно с ВПГ.
Тогда на фоне трихомоноза присоединяется неприятный запах, выделения из уретры при гонорее.
Сифилитический твердый шанкр может замаскировать собой герпетические везикулы.
Герпетический уретрит: диагностические мероприятия
В клинической практике именно сопутствующая инфекция создает много диагностических сложностей.
И тогда вычленить поражение ВПГ 1 или ВПГ 2 на общем микробном фоне весьма непросто.
Более типична такая ситуация для герпетических уретритов у мужчин, так как мочеиспускательный канал сильного пола легко уязвим для любых ЗППП.
У женщин же чаще поражается влагалище и половые губы.

Чтоб установить диагноз, врачи ориентируются на:
- Жалобы пациентов.
- Внешние признаки, характерные для атаки вируса герпеса.
- Показатели уретрального мазка.
Критерием уретрита становится выявление минимум 5 лейкоцитов в одном поле зрения при микроскопии мазка.
А в пользу того, что воспаление уретры имеет герпетическую природу, свидетельствуют описанные немного выше симптомы.
Это рецидивирующее течение, жжение при чистой сначала коже, везикулезные высыпания на других поверхностях половых органов.
Лабораторная идентификация вирусных инфекций для широкой клинической практики не используется.
В некоторых случаях, если все же необходимо установить герпетическую природу уретрита, применяется быстрый культуральный метод:
- I. Материал из уретры наносят на лунки со специальными клетками Vero.
- II. Выдерживают 24-48 часов.
- III. Подкрашивают материал в лунках смесью 2-х моноклональных мышиных антител, реагирующих с ВПГ 1 и ВПГ 2.
- IV. Вносят кроличьи антимышиные иммуноглобулины, меченые люминофором.
- V. Проводят люминесцентную микроскопию образцов.
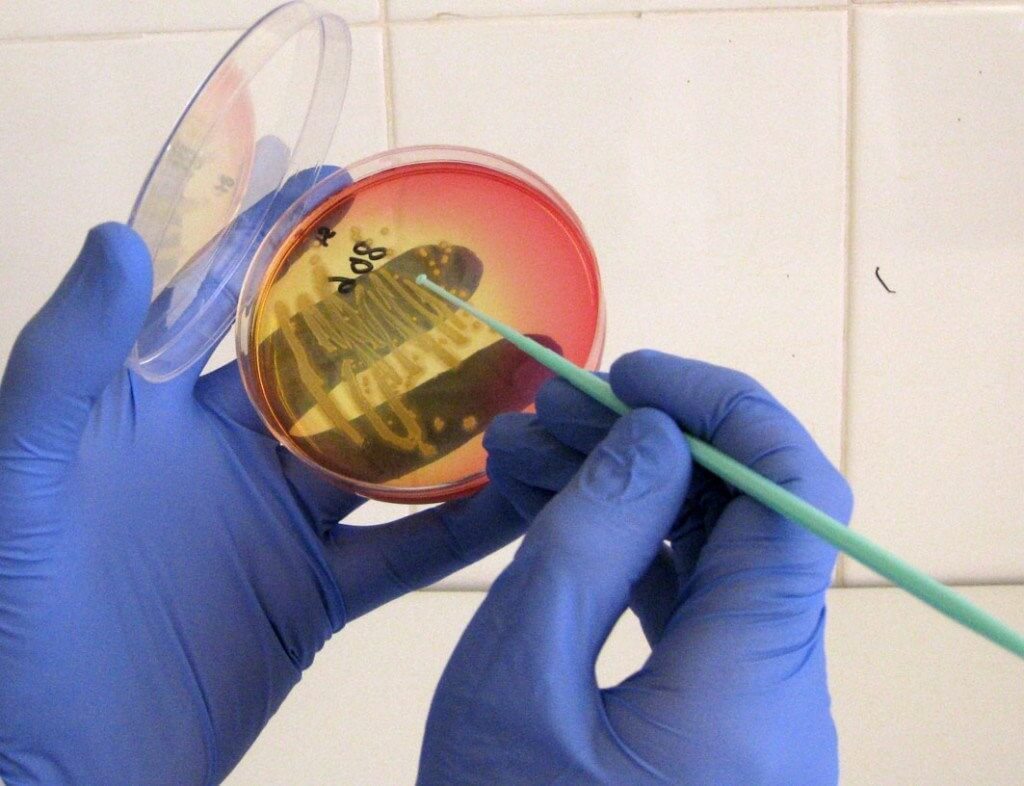
Благодаря такой методике удается доказать, что уретрит имеет герпетическую природу у женщин примерно в 30% случаев, и в 36% случаев среди пациентов сильного пола.
Что касается мужчин, то при подобном исследовании сока простаты почти у 80% больных было выявлено герпетическое поражение предстательной железы.
Лечение герпетического уретрита
В острой фазе усилия медиков направлены на скорейшее стихание процесса.

- Анальгетики. Герпесвирусы могут причинять очень сильную боль.
- Противовирусные средства для местного использования. Мази с активным в отношении ВПГ веществом наносятся на пораженную область половых органов и инстиллируются в уретру.
- Системная противогерпетическая терапия – таблетки, инъекции.
- Ранозаживляющие вещества после вскрытия везикул.
К пациентам с сопутствующей инфекцией подход немного другой.
Им в схему лечения обязательно добавляют противомикробные или противогрибковые препараты.
Эффективный и правильно подобранный список лекарств позволяет сократить срок активных проявлений герпеса до 4-5 дней.
На время обострения половая жизнь настоятельно не рекомендуется.

Герпетический уретрит: профилактика
Этот этап важен не менее, чем борьба с острой инфекцией.
Доказано, что частые обострения герпетического уретрита, даже на фоне адекватного лечения, иногда приводят к сращению малых половых губ у девочек, нарушениям чувствительности у взрослых пациентов обоего пола.
На фоне ремиссии герпеса необходимость в местном применении противовирусных средств отпадает.
На первый план выходят общие системные методики:
- Периодический прием лекарств с противогерпетической активностью. Наиболее изучен и известен ацикловир.
- Иммуномодулирующие препараты. Позволяют снизить активность репликации вируса в нейронах спинного мозга.
- Организация и ведение здорового образа жизни.
- Вакцинация специфическими прививками.

Значительные проблемы могут возникать при появлении симптомов герпетического уретрита у беременных женщин.
Так как инфекция способна осложнить течение нормального вынашивания.
Поэтому тем, кто планирует стать мамой, не помешает обратиться к врачам и пройти курс предварительной терапии.
Особенно, если у женщины ранее отмечались признаки герпеса любой локализации.
При подозрении на герпетический уретрит обращайтесь к автору этой статьи – урологу в Москве с 15 летним опытом работы.
Вирусный цистит – форма воспаления мочевого пузыря, развивающаяся при нарушениях в иммунной системе.
Они могут быть связаны с заболеваниями (ВИЧ) или приемом препаратов, угнетающих иммунитет.
Некоторые вирусы способны вызвать воспаление даже в случае незначительного нарушения работы иммунной системы.
Рецидивирующие инфекции нижних мочевыделительных путей – частая проблема среди пациентов женского пола.
Этой патологией страдает до 30% женщин в возрасте 25-35 лет.
Среди мужчин этой же возрастной категории распространенность заболевания лишь 0,75%.

Основные проблемы, возникающие при рецидивирующем цистите:
- боль
- нейровегетативные расстройства
- сексуальные нарушения
Чаще всего цистит вызывает грамотрицательная бактериальная флора, в основном это кишечная палочка.
Это может быть также хламидия, грибок кандида, уреаплазма.
Иногда цистит вызывают вирусы.
Чаще всего это герпес или папилломавирус 16 и 18 типов.
Ранее считалось, что вирусная этиология рецидивирующего цистита характерна только для женщин с иммунодефицитом.
Но сегодня эти патологии встречаются гораздо чаще.
Потому что они могут быть вызваны ятрогенными (медицинскими) факторами.
Причиной становится:
- прием глюкокортикоидов, цитостатиков
- бесконтрольная антибиотикотерапия
- иммуносупрессивное лечение
Наиболее тяжелые вирусные циститы развиваются после трансплантации костного мозга.
В этом случае они могут быть вызваны:
- аденовирусом
- цитомегаловирусом
- паломавирусом
- герпесом 1, 2 и 6 типа
Развиваются тяжелые геморрагические циститы.
Это неблагоприятный прогностический фактор, так как вирусы поражают и другие органы.
Среди людей, у которых развился геморрагический цистит после трансплантации стволовых клеток, однолетняя выживаемость составляет лишь 16%.
У пациентов без значительного иммунодефицита острый цистит могут вызывать герпетическая и папилломавирусная инфекции.
Цистит при папилломавирусной инфекции
ВПЧ может вызывать цистит.
При этом он не всегда определяется в уретре.
Чаще всего возбудителями становятся типы 16 и 18.
Они вызывают патологические изменения эпителия мочевого пузыря.
Одно из исследований показало, что у женщин с вирусным циститом, связанным с ВПЧ, в 100% случаев этот вирус определяется в средней порции мочи.
Но использование в качестве биоматериала для ПЦР мазка из уретры позволяет идентифицировать его менее чем в 10% случаев.
Вирус папилломы человека передается половым путем.
Он очень опасен, особенно для женщин.
У них он может вызвать рак.
Чаще всего опухоли развиваются на шейке матки.
ВПЧ делят по уровню онкогенности на три группы:
Низкоонкогенные типы ВПЧ встречаются чаще всего.
Но они реже вызывают цистит.
Высокоонкогенные типы ВПЧ распространены в меньшей степени.
Но они более опасны, чаще провоцируют воспаление мочевого пузыря.

У этих вирусов более высокий риск злокачественного перерождения.
Многие люди заражаются вирусом папилломы.
Но вирусный цистит развивается у них редко.
Для возникновения этого заболевания нужны предрасполагающие факторы.
Чаще всего при цистите обнаруживаются в мочевом пузыре ВПЧ 16 или 18 типа.
Чуть реже – 6 и 11 типов.
Последние являются низкоонкогенными.
Эти вирусы не столь агрессивны, и обычно приводят лишь к появлению кондилом.
Они распространены в популяции значительно в большей степени, чем ВПЧ 16 и 18.
Но процент людей, у которых в результате заражения развивается цистит, намного меньше.
Высокоонкогенные типы диагностируются не так часто.
Однако при появлении клинических признаков вирусного цистита обследование мочи или биоптата слизистой мочевого пузыря с более высокой вероятностью позволит обнаружить именно ВПЧ большого онкогенного риска.
В то время как низкоонкогенные типы чаще не распространяются за пределы наружных половых органов.
Основные причины, почему у человека может развиться вирусный цистит после заражения папилломавирусной инфекцией:
- женский пол – у женщин уретра короче и шире, поэтому вирус легче проникает в пузырь
- проведение исследований и лечебных процедур, в ходе которых вирус заносится в пузырь (катетеризация, инстилляции, хирургические операции с трансуретральным доступом)
- патогенность вируса (16 и 18 типы встречаются реже, но в мочевой пузырь проникают чаще)
- состояние иммунной системы – чем слабее иммунитет, тем выше вероятность цистита
Важна восприимчивость макроорганизма к вирусу.

При полностью сохраненной функции иммунной системы у большинства людей после заражения не появляются даже кондиломы на половых органах.
Вирусная инфекция проходит без симптомов.
Самоизлечение наступает не позже, чем через 12 месяцев.
В случае незначительных иммунных нарушений появляются аногенитальные бородавки, начинаются предраковые изменения эпителия репродуктивных органов.
При выраженном иммунодефиците клиническое течение папилломавирусной инфекции наиболее неблагоприятное.
Появляются обширные папиллярные разрастания.
Возможен деструктивный рост папиллом.
Нередко происходит малигнизация (превращение в рак).
Кроме того, инфекция часто распространяется в организме, в том числе в мочевой пузырь.
Появляются признаки цистита.
Они могут сохраняться длительное время, и периодически рецидивируют.
Появляются симптомы: боль над лоном, кровь в моче и императивные позывы к мочеиспусканию.
Герпетический цистит
Вирусный герпетический цистит всегда вторичен.
Он развивается как осложнение уретрита, реже – цистита.
Болезнь возникает редко.
Причин тому две:
- вирус герпеса редко вызывает симптомы, в основном лишь при иммунных нарушениях (для вируса более характерна бессимптомная персистенция);
- вирус герпеса редко проникает в мочевой пузырь.
Чаще всего герпес поражает только наружные половые органы.

Но у 30% пациентов генитальная герпетическая инфекция распространяется в уретру.
У 5% людей вирус проникает и в мочевой пузырь.
Симптомы вирусного цистита при герпесе
Основными симптомами герпетического вирусного цистита являются:
- частые позывы
- выделение крови с мочой
Может ли развиться цистит при гриппе?
Цистит при гриппе развиться может.
Но с самим вирусом гриппа он не связан.
В большинстве случаев цистит не является вирусным.
Под гриппом большинство людей подразумевают любые вирусные инфекции, поражающие респираторный тракт.
Однако в действительности далеко не каждый случай ОРЗ связан с вирусом гриппа.
Его также вызывает парагрипп, риновирус, аденовирус.
Последний также способен спровоцировать цистит.
Правда, в основном он возникает у детей или пациентов с выраженным иммунодефицитом.
Обычно же на фоне гриппа цистит спровоцирован бактериями или грибками.
Причинами его могут быть:
- ослабление иммунной системы
- длительная лихорадка
- применение антибиотиков, которые хоть и не нужны при гриппе, но всё же назначаются или самостоятельно принимаются пациентами довольно часто
Цистит может иметь бактериальную или грибковую этиологию.
Обычно он острый, а не хронический.
Заболевание излечивается одновременно с гриппом или в течение некоторого времени после завершения воспалительного процесса в легких.
Диагностика вирусного цистита
Вирусный цистит диагностируется при:
- наличии признаков воспаления мочевого пузыря, которые подтверждены в ходе клинического обследования, лабораторных анализов или инструментальной диагностики;
- наличии в моче или мазке из уретры вируса, который определяется при помощи ПЦР или аналогичного теста, направленного на обнаружение генетического материала;
- отсутствия бактерий, грибков или других микроорганизмов, которые гораздо чаще, по сравнению с вирусами, вызывают воспалительные процессы мочевого пузыря (по данным посева).
В подавляющем большинстве случаев причиной цистита являются бактерии, а не вирусы.
Поэтому лечение часто проводят эмпирически.
Врач исходит из того, что воспаление пузыря вызвано кишечной палочкой.
Только если терапия не работает, требуется тщательное обследование.
Проводится посев мочи на флору.

Если возбудители не выявлены, доктор подозревает вирусный цистит.
В пользу этой формы заболевания также говорят признаки иммунодефицита: клинические и лабораторные.
Этиологическая диагностика предполагает:
1. Микроскопическое исследование осадка мочи.
Выявляются не только признаки воспаления, но и бактериальная флора.
Если её нет, это увеличивает вероятность вирусной этиологии цистита.
В норме моча стерильная, никаких бактерий в ней нет.
2. Посев мочи.
Проводится для выявления бактериальной или грибковой флоры.
3. ПЦР.
В качестве материала исследуют мазок из уретры или среднюю порцию мочи.
Второй метод более эффективен.
Бывают случаи, когда вируса больше нет в уретре.
При этом он сохраняется в мочевом пузыре, поэтому может быть обнаружен при исследовании мочи.
ПЦР проводится на:
- герпес 1 и 2 типа
- ВПЧ минимум 4 типов: 6, 11, 16, 18 (другие типы вызывают заболевание реже)

В качестве биоматериала для исследования также может использоваться биоптат слизистой оболочки пузыря.
Но биопсия выполняется не всем пациентам.
При уретроскопии в случае цистита папилломавирусной этиологии в мочевом пузыре определяются разрастания слизистой оболочки.
Они выступают в просвет органа.
Обычно имеют белесоватый цвет.
Образования пронизаны множеством кровеносных сосудов.
Более чем у половины пациенток выявляются папилломы.
Они располагаются в зоне шейки пузыря и треугольника Льето.
При необходимости проводится биопсия.
Она позволяет выявить предраковые процессы и отличить вирусный цистит от папиллярной карциномы (разновидности рака).
У всех большинства пациентов при морфологическом исследовании биоптата отмечается:
- папиллярная сквамозная гиперплазия
- койлоцитоз
- признаки хронического воспаления
- полнокровие
- гиперплазия эпителия
- плоскоклеточная метаплазия
У 20% больных появляются кондиломы в мочевом пузыре.
Лечение вирусного цистита
Основные направления лечения при вирусном цистите:
- устранение симптомов;
- уничтожение вируса, возбудителя цистита;
- предотвращение очередного обострения;
- коррекция иммунного статуса.
Вирусные циститы у большинства людей вызваны ВПЧ или герпесом.
Поэтому есть смысл рассмотреть, как лечат эти заболевания.
При папилломавирусной инфекции специфического лечения нет.
Поэтому основным направлением остается иммунокоррекция.
Применяются также неспецифические противовирусные препараты.
Лечением занимается врач-иммунолог.
Он исследует иммунитет человека при помощи иммунограммы.

Затем назначает лекарства, которые позволяют нормализовать функцию иммунной системы.
Обычно это приводит к элиминации вируса в течение нескольких месяцев.
Но иногда возникает необходимость в инвазивном лечении.
При возникновении предраковых процессов требуется удаление патологических очагов, чтобы избежать возникновения папиллярного рака мочевого пузыря.
Герпетическую инфекцию лечат ацикловиром или валацикловиром.
Эти препараты назначаются при каждом обострении.
В случае рецидивирующего герпетического цистита лечебная тактика может быть следующей:
1. Супрессивная терапия.
Пациент постоянно принимает противовирусные препараты.
Лечение может продолжаться годами.
Оно длится до тех пор, пока не будет восстановлен иммунный статус.
Например, если герпетический цистит развился на фоне ВИЧ, то валацикловир принимают, пока под влиянием антиретровирусной терапии уровень CD4-клеток увеличится до 200/мкл и более.
2. Коррекция иммунного статуса.
Назначаются препараты для улучшения иммунитета.
Часто это приводит к тому, что рецидивы герпетического цистита происходят реже, становятся менее тяжелыми, а иногда полностью проходят.
3. Специфическая иммунизация.
Против герпеса разработана вакцина.
Она лечебная, а не профилактическая.
Вакцинация выполняется в период ремиссии заболевания.
Она усиливает не общий, а противогерпетический иммунитет.
Нужны ли антибиотики при вирусном цистите?
При вирусном цистите антибиотики не назначают.
Ими лечат только бактериальные воспалительные процессы.
Большинство антибиотиков, которые продаются в аптеке и позиционируются как средства для лечения воспаления мочевого пузыря, при заболевании вирусной этиологии не сработают.
Более того: они могут нанести вред.
Потому что бесконтрольная антибиотикотерапия приводит к дисбалансу микрофлоры.
В результате погибшие бактерии могут быть замещены другими, более агрессивными.
Иногда это приводит к осложнениям вирусного цистита.
Вирусный цистит: куда обратиться?
В случае развития вирусного цистита вы можете обратиться в нашу клинику.
Мы специализируемся на лечении воспалительных заболеваний органов мочеполовой системы.
Врач проведет диагностику.
Он выяснит, воспален ли мочевой пузырь, почему развилось заболевание и какими возбудителями оно вызвано.
Затем врач подберет этиотропную терапию.
В нашей клинике проводятся все необходимые исследования: лабораторные и инструментальные.
Применяются современные схемы терапии вирусного цистита.
При подозрении на вирусный цистит обращайтесь к автору этой статьи – урологу, венерологу в Москве с многолетним опытом работы.
Цитомегаловирусная инфекция является достаточно распространенным явлением.
Ее развитие провоцирует цитомегаловирус (ЦМВ), который паразитирует внутри клеток и изменяет их геном.
Течение данной патологии хроническое и отличается клиническим разнообразием.
Оно может характеризоваться отсутствием симптоматики.
Или тяжелыми проявлениями с поражением внутренних органов и структур центральной нервной системы.
Основой диагностики заболевания является лабораторное исследование.

Если обнаружили цитомегаловирус,
дальнейшая тактика зависит от результатов дополнительного обследования.
А также наличия и выраженности клинических проявлений.
Особенности течения цитомегаловирусной инфекции
Цитомегаловирус является облигатным внутриклеточным организмом, который относится к роду вирусов герпеса.
Он представлен ДНК (дезоксирибонуклеиновая кислота), которая после заражения встраивается в клетки организма человека.
Вирус может длительное время находится в латентном (неактивном) состоянии, ничем себя не проявляя.
При активизации вируса происходит репликация (удваивание) ДНК с выходом из клетки дочерних вирусных частиц.
Такой процесс приводит к изменению генома клетки и ее свойств.
В частности, она начинает активно делиться.
Это значительно повышает вероятность последующего ее перерождения в доброкачественное или злокачественное новообразование.
Цитомегаловирус (ЦМВ) – одна из самых распространенных на сегодня вирусных инфекций, передающихся половым путем.

Обнаружен цитомегаловирус –
что делать рассказывает
подполковник медицинской службы,
врач Ленкин Сергей Геннадьевич
Содержание данной статьи проверено и подтверждено на соответствие медицинским
стандартам врачем дерматовенерологом, урологом, к.м.н.
Ленкиным Сергеем Геннадьевичем
| Наименование | Срок | Цена |
|---|---|---|
| Прием венеролога | 900.00 руб. | |
| Антитела к цитомегаловирусу, IgM | 1 д. | 600.00 руб. |
| Антитела к цитомегаловирусу, IgG | 1 д. | 600.00 руб. |
| ДНК Cytomegalovirus | 1 д. | 300.00 руб. |
Методики диагностики цитомегаловируса
Факт наличия цитомегаловирусной инфекции в организме человека, а также активности течения патологического процесса, определяется с помощью нескольких методик лабораторного исследования:
- ПЦР – цитомегаловирус обнаружен может быть в любом исследуемом материале.
Для выявления ДНК достаточно его минимального количества.
Цитомегаловирус в мазке обнаружен может быть только при выделении инфекции.
, который позволяет определить наличие специфических антител к вирусу.
Они продуцируются иммунной системой после заражения человека.
Для определения дальнейшей тактики в отношении необходимости применения противовирусной терапии в большинстве клиник выполняются обе методики лабораторного исследования.
Дальнейшая тактика при обнаружении цитомегаловируса
Дальнейшая тактика при обнаружении цитомегаловируса, в зависимости от результатов ПЦР
После проведенного исследования, направленного на выявление и идентификацию ДНК цитомегаловируса в биологическом материале, можно получить несколько результатов:
- Отрицательный результат – в материале нет вируса.
Однако, он может находиться в организме в латентном состоянии, поэтому обязательно необходимо проведение ИФА. - ДНК цитомегаловируса обнаружено в мазке из уретры или половых органов – такой результат указывает на активное течение инфекционного процесса с его локализацией в структурах урогенитального тракта.
- Обнаружен цитомегаловирус в крови – это указывает на активизацию инфекционного процесса с поражением клеток крови, лимфоидной ткани и других структур иммунитета.
В случае наличия результатов, которые указывают на активное течение инфекции, в большинстве случаев требуется противовирусная терапия.
Она проводится с использованием лекарственных средств, обладающих активностью в отношении цитомегаловируса.
Тактика лечения цитомегаловируса, в зависимости от результатов ИФА
Существует 2 основных класса антител, которые продуцируются в ответ на попадание вируса внутрь клеток – IgG и IgM.
Выявление этих классов антител указывает на давнее заражение и активизацию инфекции.
Наличие только IgG является результатом давнего заражения и латентного течения инфекции.
Изолированное выявление только IgM указывает на недавнее заражение и острое течение инфекции.
Но если при этомДНК цитомегаловируса обнаружено в крови или мазке, обязательно проводится противовирусное лечение.
При обнаружении цитомегаловируса в любом из анализов обращайтесь к автору этой статьи – венерологу, урологу в Москве с 15 летним опытом работы.
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Особенности течения цитомегаловирусной инфекции урогенитального тракта у сексуально активных женщин
Журнал: Клиническая дерматология и венерология. 2013;11(3): 69‑75
Чернова Н.И. Особенности течения цитомегаловирусной инфекции урогенитального тракта у сексуально активных женщин. Клиническая дерматология и венерология. 2013;11(3):69‑75.
Chernova NI. Specific features of cytomegalovirus infection of the urogenital tract in sexually active women. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(3):69‑75. (In Russ.).
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Цитомегаловирусная инфекция (ЦМВИ) — широко распространенное инфекционное заболевание человека, с вертикальным, половым, парентеральным, оральным путями передачи, реализующимися через кровь, цервикальный и вагинальный секреты, сперму и женское молоко. В большинстве случаев инфекция протекает без клинических проявлений. При иммуносупрессии, вызванной разными причинами, цитомегаловирус (ЦМВ) способен привести к развитию заболевания с многообразными симптомами, что обусловлено его способностью инфицировать практически все системы органов (ретинит, увеит, серонегативный мононуклеоз, пневмония, гепатит, болезни желудочно-кишечного тракта, центральной нервной системы, посттрансфузионный синдром) [1—5].
В среднем у 90—95% взрослого населения обнаруживаются антитела к ЦМВ. В литературе приводятся многочисленные данные об особенностях течения ЦМВИ у новорожденных, беременных и иммунонекомпетентных пациентов. В настоящий момент обследованию на ЦМВИ подлежат следующие категории граждан: женщины при подготовке к беременности, беременные и пациенты с выявленными иммунодефицитными состояниями. Изучению значимости ЦМВ в патологии взрослого населения уделяется особое внимание [6—9]. Однако не учитывается, что ЦМВ нередко способствует хроническому воспалительному поражению органов малого таза и гениталий, что обусловливает низкую эффективность терапии инфекций, передаваемых половым путем (ИППП), и снижение репродуктивной способности пациентов.
Цель настоящего исследования — определение форм течения ЦМВИ урогенитального тракта у сексуально активных женщин репродуктивного возраста.
Материал и методы
Под наблюдением находились 356 пациенток с ЦМВИ, которая характеризовалась наличием в крови анти-CMV IgG.
Для выявления достоверных триггерных клинических и лабораторных факторов, ассоциирующихся с ЦМВИ урогенитального тракта, данные опроса и обследования больных сравнивали с результатами аналогичных исследований, проведенных в контрольной группе, которая состояла из 120 женщин. Критериями отбора являлись: репродуктивный возраст, отсутствие беременности, лактации, системной и местной антибактериальной терапии в течение 1 месяца до начала данного обследования, нормальное состояние микрофлоры урогенитального тракта и исключенная ЦМВИ.
Результаты
Важное значение для выяснения характера ЦМВИ имеют сведения о перенесенных соматических и инфекционных заболеваниях. Частота экстрагенитальной патологии косвенно отражает состояние противоинфекционной защиты организма и иммунной системы в целом.

При анализе соматической патологии (табл. 2) наиболее часто в основной группе по сравнению с контрольной отмечались инфекционные вирусные заболевания (82,58% случаев), патология желудочно-кишечного тракта (55,9%) и заболевания органов дыхания (20,51%). У пациенток с ЦМВИ в 4,2 раза чаще отмечалась патология эндокринной системы (в 31,46% случаев; p<0,05).
Подробному анализу были подвергнуты данные о гинекологических заболеваниях, которые относятся к факторам, влияющим на состояние системного и локального иммунитета.

Среди перенесенных гинекологических заболеваний наиболее часто встречались патология шейки матки (44,10% случаев; p<0,05) и воспалительные заболевания органов малого таза (75%; p<0,05) по сравнению с контролем (табл. 3). Кроме того, у женщин с ЦМВИ чаще наблюдались ИППП (в 55,34% случаев; p<0,05) и бесплодие (28,65%; p<0,05).

При изучении особенностей сексуального анамнеза (табл. 4) выявлено, что у пациенток с ЦМВИ в 3 раза чаще (p<0,05) отмечалось раннее начало половой жизни. Соотношение женщин по количеству половых партнеров в обеих группах было сопоставимым. В ходе анализа особенностей сексуальных предпочтений установлено, что пациентки основной группы чаще практиковали аногенитальные контакты (p<0,05).
Незащищенные половые контакты (включая без использования презерватива с последующей обработкой раствором мирамистина) в анамнезе имели более 84% пациенток с ЦМВ и 70% женщин из группы контроля (p<0,05).
Таким образом, вероятным предрасполагающим фактором для ЦМВИ урогенитального тракта являлось раннее начало половой жизни и большое количество незащищенных аногенитальных контактов.
При клиническом обследовании анализировали особенности субъективных ощущений, проводили тщательный общий и гинекологический осмотр.
Таким образом, у пациенток с ЦМВИ при гинекологическом осмотре чаще выявлялся острый или хронический воспалительный процесс в малом тазу.

Результаты микроскопического исследования мазков отделяемого генитального тракта, окрашенных по Граму, представлены в табл. 6.

Анализ результатов культурального исследования отделяемого мочеполового тракта женщин выявил доминирование грибов Candida spp. (48,60%), G. vaginalis (30,62%), T. vaginalis (21,35%). У большинства женщин в биотопах влагалища имела место ассоциация ЦМВИ с условно-патогенными бактериями (Streptococcus, St. aureus, Ureaplasma spp., M. hominis) в высоком титре (более 10 5 КОЕ/мл; табл. 7).

Результаты комплексного обследования этих женщин представлены в табл. 8.
У 71 (19,9%) женщины состояние вагинальной микроэкологии было оценено как нормоценоз. Проанализировав полученные данные, можно было выделить его некоторые особенности, которые в ряде случаев позволили назвать указанное состояние нормоценозом только условно. Так, только у 22 (6,18%) женщин из 356 состояние микроэкологии полностью соответствовало всем критериям нормы репродуктивного возраста: при микроскопии вагинального отделяемого отсутствовала выраженная лейкоцитарная реакция (количество лейкоцитов не превышало 10 в поле зрения), эпителий был представлен клетками поверхностного и промежуточного слоев, количество микрофлоры было умеренным при абсолютном преобладании морфотипа лактобактерий. Морфотипы условно-патогенных микроорганизмов (УПМ) не определялись. При культуральном исследовании титр лактобацилл составлял 10 6-8 КОЕ/мл вагинального отделяемого, а концентрации УПМ были низкими (менее 10 3 КОЕ/мл).
Наиболее частой патологией среди 356 обследованных пациенток с ЦМВИ оказался кандидоз (57,30%), в большинстве случаев сопровождавшийся умеренным повышением титра УПМ (Streptococcus группы В в 10 6 КОЕ/мл и St. aureus более 10 6 КОЕ/мл).
Аэробный вагинит (1,12%) как вариант дисбиоза влагалища был обусловлен колонизацией вагинального биотопа высокими титрами E. coli (более 10 7 КОЕ/мл) и стрептококков группы В (10 6 КОЕ/мл). По данным микроскопии в этих случаях также отмечалась выраженная лейкоцитарная реакция (более 40 лейкоцитов в поле зрения).
У 21,06% женщин микроскопически был установлен бактериальный вагиноз, что сопровождалось высокой колонизацией факультативно-анаэробной и анаэробной флоры (более 10 6 КОЕ/мл).
В 0,56% случаев состояние вагинальной микроэкологии было оценено как другой вариант дисбиоза влагалища, когда при минимальном содержании микрофлоры (данные микроскопии) доминировали факультативно-анаэробные и аэробные УПМ (грамположительные кокки), а лактоморфотипы были единичными в поле зрения.
Таким образом, только у 19,9% пациенток с ЦМВИ имелся классический вариант микроценоза, в остальных случаях микрофлора влагалища претерпевала изменения, связанные с нарастанием титра факультативно-анаэробных УПМ. У 80,1% женщин выявлены нарушения микроценоза влагалища, в большинстве случаев связанные с увеличением количества Candida spp. При исследовании отделяемого из уретры с помощью ПЦР идентифицированы возбудители ИППП и УПМ. Наиболее часто выявлялись ДНК HPV (11,52%), T. vaginalis, M. hominis, HSV 1-го и 2-го типов (2,81 и 3,08% соответственно), С. trachomatis были идентифицированы в уретре у 5,34% больных.
В цервикальном канале в 5 раз чаще определялись УПМ и патогены. Так, наиболее часто у женщин с ЦМВИ были выделены вирус папилломы человека (42,13%), T. vaginalis (11,52%), M. hominis (21,63%), С. trachomatis (18,82%) и Ureaplasma spp. (24,44%).
В соскобах из влагалища также наиболее часто определялась ДНК вируса папилломы человека (43,25%), T. vaginalis (21,35%), M. hominis (14,89%), Ureaplasma spp. (19,38%), а также G. vaginalis (25%).
При исследовании проб из прямой кишки были идентифицированы ДНК ВПЧ (28,93%) и M. hominis (11,24%).

Для верификации диагноза ЦМВИ проводили расширенный анализ результатов, полученных разными методами исследования (табл. 9).
При анализе данных с целью выявления маркеров ЦМВИ установлена наибольшая частота обнаружения анти-CMV IgG — 356 (100%) случаев. Анти-CMV IgM были выявлены у 89 (25%) женщин. Обнаружение антител класса G к CMV свидетельствовало как об инфицированности, так и о наличии в большинстве случаев сформированного специфического противовирусного иммунитета. Выявление антител класса М совместно с IgG было одним из признаков реактивации данной вирусной инфекции.
При исследовании материала, полученного из урогенитального тракта с помощью ПЦР, ДНК CMV была обнаружена у 208 (58,43%) женщин.
ЦМВ на культуре фибробластов легких человека при исследовании крови выявлен у 93 (26,12%) женщин, мочи — у 199 (55,90%), слюны — у 204 (57,30%) больных, влагалищного отделяемого — у 225 (63,20%), из цервикального канала — в 268 (75,28%) случаях. В целом ЦМВ был обнаружен у 268 (75,28%) пациенток.
Учитывая этиологию, патогенез и клинические проявления ЦМВИ урогенитального тракта, пациенткам с реактивированной и латентной формой ЦМВИ проводилась комплексная терапия инфекционного процесса в соответствии с клиническими рекомендациями по ведению больных с ИППП. Противовирусное лечение включало использование препарата Панавир. Основное действующее вещество данного препарата — гексозный гликозид, полученный методом ферментативного гидролиза с последующей газожидкостной хроматографией, состоящий из глюкозы, рамнозы, арабинозы, маннозы, ксилозы, галактозы, уроновых кислот. В ряде экспериментальных и клинических исследований установлена противовирусная и иммуномодулирующая активность Панавира. Данный препарат повышает неспецифическую резистентность организма к разным инфекциям и способствует индукции интерферона, Панавир (5 мл 0,004% раствора) применялся парентерально (внутривенно струйно) 1 раз в сутки через 48 ч (3 инъекции в 1-ю неделю лечения), затем — через 72 ч (2 инъекции во 2-ю неделю терапии). Всего на курс пришлось 5 инъекций в течение 2 недель.
При контрольном исследовании, проведенном через 14 дней после лечения, лишь у 2 (8,0%) пациенток с латентной формой ЦМВИ выявлен CMV в культуре клеток отделяемого цервикального канала, ДНК CMV не определялась у 24 (96%) больных. В результате лечения при реактивированной форме ЦМВИ была констатирована негативация IgM анти-CMV в крови у 100% женщин. При исследовании CMV на культуре фибробластов эмбрионов человека вирурия установлена у 1 (5,56%) пациентки, выделение из цервикального канала отмечено у 3 (16,67%). Результаты вирусологического обследования крови, слюны, влагалищных выделений были отрицательными у всех женщин. При проведении ПЦР наличие ДНК CMV выявлено у 2 (11,11%) пациенток, получавших парентерально Панавир.
Таким образом, в ходе исследования определены основные диагностические клинико-лабораторные критерии разных форм ЦМВИ урогенитального тракта сексуально активных женщин репродуктивного возраста, на основании которых возможности определения данной инфекции существенно увеличились. Наличие клинических проявлений при реактивированной ЦМВИ и определение вирусов при подостром или хроническом течении воспалительных заболеваний органов малого таза способствовали определению значимости данной инфекции в развитии патологии гениталий. Применение препарата Панавир в комплексной терапии повышало эффективность лечения в 89,5% случаев, что позволяет рекомендовать препарат Панавир для комплексной терапии ЦМВИ.
Читайте также:

