Дезинфекция вирус папилломы человека
Обновлено: 18.04.2024
Е.В. Файзуллина
Казанский государственный медицинский университет
Генитальная папилломавирусная инфекция является распространенным заболеванием, передающимся половым путем. Вирус папилломы человека (ВПЧ) — высокоспецифичная в отношении человека инфекция, обладающая способностью инфицировать эпителиальные клетки, вызываемая вирусом из семейства Papovaviridea. Инфицирование ВПЧ половых органов, так же как и кожных покровов, происходит при наличии микротравм, при этом резервуаром ВПЧ-инфекции служат уретра, бартолиниевы железы, семенная жидкость. Идентифицировано более ста видов ВПЧ, из которых 35 инфицируют урогенитальный тракт человека, вызывая поражение покровного эпителия кожи и слизистых оболочек половых органов. ВПЧ-инфекция является наиболее распространенной инфекцией, передаваемой половым путем (ИППП), которой инфицирована большая часть сексуально активного населения. Кроме этого, папилломавирусы — единственная группа вирусов, для которых доказана индукция опухолей у человека. Число инфицированных в мире за последнее десятилетие увеличилось в 12 раз (Молочков В.А., 2004).
МКБ X пересмотра, раздел А 63. Аногенитальные бородавки.
Этиология
Вирус, относящийся к роду А семейства Papovaviridea, сохраняется при температуре 50?С в течение 30 минут. В процессе репликационного цикла геном вируса экспрессирует от 8 до 10 белковых продуктов; за онкогенные свойства вируса ответственны онкопротеины Е6 и Е7. По онкогенной активности различают ВПЧ низкой степени риска — HPV6, 11,42,43,44; средней – HPV31,33,35, 51,52, 58 и высокой — HPV16, 18,45,56 степени риска. Одним или более типами ВПЧ инфицировано не менее 50% взрослого населения, живущего активной половой жизнью, в большинстве случаев генитальная ВПЧ-инфекция у них является нераспознанной, протекающей субклинически или асимптомно. Генитальная ВПЧ-инфекция имеет высокую контагиозность; заражение при однократном половом контакте происходит примерно в 60% случаев.
Патогенез
Инвазия вируса происходит через микроповреждения тканей. ВПЧ инфицирует стволовые клетки базального слоя, которые затем являются постоянным источником инфицирования эпителиальных клеток. Вирусы инфицируют делящиеся незрелые клетки базально-клеточного слоя, находящиеся близко к поверхности, что во многом объясняет частоту инфицирования шейки матки и нижней трети влагалища и вульвы.
Вирусная ДНК включается в ядерный материал клетки хозяина. Интегрированная форма ВПЧ способна к злокачественной трансформации, поскольку вирусная ДНК начинает контролировать клеточный генетический материал для воспроизводства ВПЧ-кодированных белков. Интеграция ВПЧ высокого риска в клеточный геном хозяина усиливает продукцию двух онкопротеинов — Е6 и Е7, взаимодействующих с эндогенными клеточными регуляторными белками, ведущими к дерегуляции цикла клеточной прогрессии, что является разрешающим моментом в формировании цервикальной неоплазии, образованию плоских кондилом, невидимых вооруженным глазом (Прилепская В.Н., 1997).
Однако по мнению В.А. Молочкова и соавт. (2004), инфицирование эпителиальных клеток ВПЧ является необходимым, но не достаточным событием для развития рака. Для формирования необратимой неоплазии необходимы следующие факторы: во-первых, активная экспрессия генов Е6 и Е7, причем высокоонкогенных типов ВПЧ-16 и 18; во-вторых, индукция метаболических механизмов конверсии эстрадиола в 16-ОН; в третьих, индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
Первая стадия неоплазии CIN I характеризуется активной репликацией вируса и его бессимптомным выделением. Опухолевая трансформация возникает с большей вероятностью при взаимодействии ВПЧ с другими инфекционными агентами (цитомегаловирусы, вирус простого герпеса 2 типа, С. trachomatis, микоплазма и уреаплазма).
Факторы риска
ВПЧ является необходимым, но не достаточным фактором цервикальной неоплазии. Предрасполагающими факторами риска для развития заболевания могут быть: неблагополучный социально-экономический статус и сексуальное поведение, нарушения клеточного и гуморального иммунитета, сопутствующие сексуально-трансмиссивные заболевания (гонорея, сифилис герпес, трихомониаз хламидиоз и т.д.), молодой возраст, курение, беременность, дисбиоз вагинального биотопа, гипо- и авитаминозы (Марченко Л.А., 2001).
Риск ВПЧ-инфекции наиболее высок у гомосексуалистов. Не исключены случаи перинатальной передачи инфекции младенцам, рожденным от инфицированных матерей во время родоразрешения через естественные родовые пути, за счет аспирации околоплодных вод, цервикального или вагинального секрета; случаи папилломатоза гортани, трахеи, бронхов у детей, рожденных с применением операции кесарева сечения, что, по мнению ряда авторов, свидетельствует о возможности трансплацентарной передачи инфекции и нецелесообразности применения кесарева сечения с единственной целью — предупреждения заражения новорожденного ВПЧ (Koutsky L.A., Kiviar N.B.,1999).
Течение заболевания и клинические разновидности
Инкубационный период при аногенитальных бородавках составляет от 1 до 3 месяцев. В большинстве случаев ВПЧ-инфекция не манифестирует сразу, оставаясь некоторое время асимптомной. Прогрессия ВПЧ-инфекции высокого онкогенного риска в цервикальную интраэпителиальную неоплазию и рак in situ обычно происходит в сроки от 5 до 30 лет.
1. Клинические формы (видимые невооруженным взглядом):
1.1. Экзофитные кондиломы (остроконечные типичные, паппилярные, папуловидные);
1.2. Вестибулярный паппиломатоз ( мелкие паппиломовидные образования преддверья влагалища).
2. Субклинические формы (не видимые невооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/ или цитологическом или гистологическом исследовании):
Плоские кондиломы (типичная структура с множеством койлоцитов);
Малые формы (различные поражения метапластического эпителия с единичными койлоцитами);
Кондиломатозный цервицит/вагинит.
3. Латентные формы (отсутствие клинических, морфологических или гистологических изменений при обнаружении ДНК ВПЧ);
4. Цервикальная интраэпителиальная неоплазия (плоскоклеточные интраэпителиальные поражения):
CIN - CIN 1 — слабо выраженная дисплазия +/- койлоцитоз, дискератоз;
4.2 CIN II — выраженная дисплазия +/- койлоцитоз, дискератоз;
4.3 CIN III или CIS - тяжелая дисплазия или карцинома in situ+/- койлоцитоз, дискератоз;
4.4 Микроинвазивная плоскоклеточная карцинома.
Поверхность покрыта многослойным плоским эпителием по типу дискератоза. В подлежащей строме имеются атипичные сосуды, явления воспаления. Локализация ОК различна, в основном, в местах возможной мацерации: клитор, малые половые губы, устье уретры, влагалище, шейка матки, анус.
Манифестация генитальной ВПЧ-инфекции сопровождается появлением генитальных бородавок. Экзофитные формы остроконечных кондилом представляют из себя типичное проявление инфекции, обусловленной доброкачественными типами вируса ВПЧ6 и ВПЧ11. Эндофитные кондиломы могут быть плоскими и инвертированными, располагаются на шейке матки и имеют вид плоских или слегка возвышающихся бляшек, определяются при расширенной кольпоскопии.
Субклиническая форма болезни обнаруживается только при кольпоскопии в виде мелких плоских бородавок или устанавливается на основании характерной гистологической картины в виде койлоцитоза. Отсутствие клинических и гистологических признаков инфекции при выявлении ДНК ВПЧ свидетельствует о латентной или асимптомной инфекции.
Наружное отверстие уретры у женщин поражается в 4-8% случаев, более глубокое поражение мочеиспускательного канала вызывает явления вялотекущего уретрита.
Анальные бородавки чаще встречаются у лиц, практикующих анальный секс, и редко располагаются выше зубчатой линии прямой кишки. У лиц, практикующих орально-генитальные контакты, генитальные бородавки могут поражать губы, язык, небо.
Генитальные бородавки, как правило, бессимптомны, и часто случайно выявляются при осмотре или на основании Pap-мазка. В связи с этим вначале больные не предъявляют жалоб на связанный с ними дискомфорт. Однако, крупные, травмированные, изъязвленные или подвергшиеся вторичной инфекции бородавки сопровождаются зудом, болью, неприятным запахом. Уретральные бородавки у мужчин могут вызывать раздвоение струи мочи, обструкцию уретрального отверстия.
У больных с нарушением клеточного иммунитета (ВИЧ-инфекция, иммуносупрессивная терапия, беременность), — развиваются очень крупные генитальные бородавки — гигантская кондилома Бушке-Левенштейна, инвазивная и деструирующая опухоль, ассоциирующаяся с ВПЧ 6 и 1 1 типа.
ВПЧ-инфекция, обусловленная типами вируса высокого онкогенного риска (ВПЧ-16 и 18), является этиологическими агентами довольно гетерогенной группы заболеваний: бовеноидный папулез, цервикальная интраэпителиальная неоплазия, рак шейки матки, реже - рак влагалища, вульвы, ануса (Баткаев Э.А. с соавт., 2001; Киселев В.И., Киселев О.И., 2003).
Бовеноидный папулез ассоциируется с ВПЧ-16, а также с другими типами ВПЧ - 1, 6, 11, 18, 31-35, 39, 42, 48, 51-54 и проявляется плоскими папулами и пятнами с гладкой, бархатистой поверхностью. Заболевание обычно развивается у мужчин, имеющих много половых партнеров. У партнерш таких пациентов выявляется инфекция ВПЧ шейки матки и цервикальной интраэпителиальной неоплазии. Течение бовеноидного папулеза обычно доброкачественное. У некоторых больных бовеноидный папулез может персистировать годами, трансформируясь (особенно у лиц пожилого возраста) в плоскоклеточный рак.
Диагностика папилломавирусной инфекции
Лабораторная диагностика ВПЧ-инфекции проводится на основании цитологического, гистологического исследования биоптатов, определения антител к ВПЧ, обнаружения ДНК ВПЧ и онкобелка Е7.
Клинический осмотр наружных половых органов, вульвы, влагалища следует проводить при хорошем освещении. Для выявления субклинической генитальной ВПЧ-инфекции проводится расширенная кольпоскопия. Ложноположительные результаты при этом методе обычно являются следствием воспалительных и дискератических процессов вульвы и влагалища.
Кольпоскопия и биопсия показаны всем женщинам с цервикальной интраэпителиальной неоплазией класса II (CIN II) или класса III (CINIII), независимо от подтверждения у них наличия ВПЧ-инфекции.
Наиболее простые методы для идентификации ВПЧ — иммунологические методы: РСК, ИФА, ПИФ.
Диагностика ВПЧ-инфекции шейки матки включает тестирование по Папониколау (РАР-тест). Молекулярно-биологические методы реакция гибридизации in situ, ПЦР, ДНК-зонд. Гистологическое исследование биоптатов тканей эпителия и эпидермиса используются и при малосимптомных или асимптомных формах вирусных заболеваний гениталий. Использование молекулярно-биологических методов исследования целесообразно для доказательства наличия ВПЧ с его типированием, так как и ДНК-гибридизация, и полимеразная цепная реакция позволяют выявить онкогенные типы вируса 16 и 18.
Основным методом диагностики ВПЧ является цитологический — обнаружение койлоцитарных клеток в биоптате эпителия шейки матки (клетки МПЭ промежуточного и поверхностного типа с многоядерным строением), патогномоничные для ВПЧ.
При гистологическом исследовании генитальных бородавок обнаруживается умеренное утолщение рогового слоя с папилломатозом, паракератозом и акантозом; могут присутствовать фигуры митоза. Диагностически важным считается наличие в глубоких участках мальпигиева слоя койлоцитов — больших эпителиальных клеток с круглыми гиперхромными ядрами и выраженной перинуклеарной вакуолизацией.
Лечение
При выборе метода лечения ВПЧ-инфекции учитывается анамнез, соматический статус, предшествующая противовирусная терапия, локализация, количество, размеры остроконечных и плоских кондилом. Тактика лечения должна быть индивидуальной с учетом переносимости тех или иных методов лечения. Местное лечение АБ направлено на удаление кондилом и атипически измененного эпителия, с применением различных видов химических коагулянтов, цитостатиков и физиохирургических методов лечения. После удаления папилломатозных разрастаний для профилактики рецидива АБ необходима местная и общая терапия противовирусными препаратами, индукторами интерферона, неспецифическими иммуномодуляторами. Больных с папилломавирусной инфекцией следует предупредить, что данное заболевание является сексуально трансмиссивным, поэтому обследование и лечение необходимо проводить обоим партнерам, а на период терапии и ближайшие 6-9 месяцев рекомендовать барьерные методы контрацепции.
Местное лечение ВПЧ (данные приведены по Подзолковой Н.М. с соавт, 2007).
В течение трех лет (2006-2008 гг.) нами были обследованы и пролечены 650 женщин с аногенитальными бородавками (АБ). Данные представлены в таблице 1.
Таблица 1.
Группы пациенток по локализации и распространенности АБ
| Группа | Локализация ОК | Количество пациенток | % |
|---|---|---|---|
| 1. | Влагалище | 17 | 2,6 |
| 2. | Вульва | 173 | 23,6 |
| 3. | Влагалище + вульва | 258 | 39,7 |
| 4. | Влагалище + большие половые губы | 126 | 19,4 |
| 5. | Влагалище + вульва + большие половые губы | 76 | 11,7 |
| Всего | 650 | 100 | |
Таблица 2.
Число сеансов радиоволновой деструкции АБ, требующихся для достижения стойкой ремиссии заболевания у женщин
| Группа | 1 сеанс | 2 сеанс (10-12 дней) | 3 сеанс (14-21 день) | Более 3 сеансов | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Чел. | % | Чел. | % | Чел. | % | Чел. | % | Чел. | % | |
| 1 | 7 | 41,2 | 10 | 58,82352941 | 0 | 0 | 0 | 0 | 17 | 100 |
| 2 | 121 | 69,9 | 41 | 23,69942197 | 11 | 6,4 | 0 | 0 | 173 | 100 |
| 3 | 118 | 45,7 | 112 | 43,41085271 | 25 | 9,7 | 3 | 1,2 | 258 | 100 |
| 4 | 13 | 10,3 | 77 | 61,11111111 | 29 | 23,0 | 7 | 5,6 | 126 | 100 |
| 5 | 0 | 0,0 | 23 | 30,26315789 | 41 | 53,9 | 12 | 15,8 | 76 | 100 |
| Итого: | 650 | |||||||||
В настоящее время выявлено более 100 видов вируса, имеющего название Human papillomavirus.
Наиболее известные и чаще всего диагностируемые у людей типы включают HPV-6, HPV-11, HPV-16 и HPV-18.
Папилломавирусы человека (Human papillomavirus, HPV, Papillomaviridae) — это вирусы семейства Papillomaviridae.

Включают более 170 типов.
Некоторые типы ВПЧ передаются половым путем и могут провоцировать развитие генитальных кондилом/папиллом.
Другие штаммы способны привести к более серьезным последствиям и стать причиной рака шейки матки.
Более 40 штаммов способны инфицировать область гениталий, остальные типы ВПЧ сопровождаются бородавками на лице, руках, ногах.
Типы, вызывающие аногенитальные бородавки, как правило, относятся к HPV-6, HPV-11.
Они не имеют тенденцию провоцировать онкологические заболевания и могут самостоятельно проходить спустя некоторое время.
Но большие образования рекомендуется удалять с целью предотвращения их травмирования.
У большинства людей ВПЧ никогда не провоцирует симптомов или проблем со здоровьем.
Практически в 90% случаев при развитии бородавок или папиллом наблюдается тенденция их самостоятельного исчезновения в течение двух лет.
Но иногда, на фоне снижения иммунитета и других, благоприятных для вируса факторов, Human papillomavirus активизируется.
Это сопровождается рядом симптомов:
- Развитие генитальных бородавок.
- Респираторный папилломатоз (редкое состояние, при котором бородавки растут на слизистой гортани).
- Рак шейки матки.
- Другие, менее распространенные, но серьезные раковые заболевания, включая генитальные онкологические опухоли.
Согласно клиническим исследованиям, большая часть генитальных бородавок и рака шейки матки являлись следствием заражения ВПЧ.

В отличие от других заболеваний, заражение которыми происходит в ходе незащищенного секса, ВПЧ требует только контакта кожи с кожей.
Ни сексуального акта, ни обмена биологической жидкостью не требуется.
Поскольку нет лекарств, доступных для лечения инфекции, профилактика ВПЧ у женщин, а также мужчин — лучший способ защитить свое здоровье и предотвратить инфицирование партнера.
Как можно защитить себя от ВПЧ
Поскольку оральный, анальный и вагинальный секс рассматриваются как основные возможности заражения ВПЧ, есть один верный способ избежать инфицирования вирусом.
Это полный отказ от сексуальных контактов.
Подобный подход не является реалистичным, поэтому необходимо знать все профилактические стратегии и понимать их важность.
Безопасные сексуальные контакты являются первой линией защиты от ВПЧ для большинства людей.
Презервативы имеют решающее значение для снижения риска развития ВПЧ.

Однако важно понимать, что они не защищают потенциально уязвимые участки кожи.
Такие как мошонка, преддверие влагалища, наружные половые губы или анус.
Об этом свидетельствует четырехлетнее исследование, проведенное американскими центрами по контролю и профилактике ИППП.
Вывод по окончанию клинических испытаний был таков, что беспрерывное использование презервативов снижает риск инфицирования ВПЧ только на 50%.
В том числе среди немоногамных мужчин и женщин с многочисленными секс-партнерами.
Значение имеет постоянное и правильное использование презервативов во время орального секса.
Это значительно снижает риски респираторного папилломатоза.
Аналогичным образом следует рассмотреть вопрос о сокращении числа секс-партнеров.
Большинство исследований продемонстрировали прямую корреляцию между ВПЧ-инфекциями и цифрами сексуальных партнеров, которые человек имел на протяжении всей жизни.
Фактически, в одном из исследований 2013 года в Германии было сделано заключение об основных факторах риска для осложнений, связанных с ВПЧ.
Это число половых партнеров и начало секса в более молодом возрасте (чем младше возраст, тем большее число партнеров по жизни).
Вакцинация как профилактика ВПЧ
Активная иммунизация является основой современной программы вакцинации.
Суть процедуры состоит из применения мертвых или значительно ослабленных микроорганизмов или их компонентов.
Они не вызывают заболевания, но при этом позволяют нашему организму выявлять структуру патогена и создавать антитела.
Организм сохраняет эту способность в случае повторного контакта с патогенным микроорганизмом.
В настоящее время существует три вакцины для предотвращения многих форм ВПЧ, в частности высокого онкологического риска:
- Gardasil (является профилактикой ВПЧ 6, 11, 16 и 18 штамма)
- Cervarix (профилактика ВПЧ 16 и 18 типа)
- Gardasil 9 (профилактика ВПЧ 6, 11, 13, 31, 33, 45, 52 и 58)
Вакцинация против ВПЧ не рекомендуется для всех пациентов.
Препарат должен подбираться в индивидуальном порядке в зависимости от возраста и относительного риска:
- Вакцинация против ВПЧ может назначаться детям в возрасте от 11 до 12 лет. Детям в возрасте 9 лет также может быть предложена вакцина, если это необходимо.
- Вакцинация рекомендуется женщинам в возрасте до 26 лет и мужчинам в возрасте до 21 года.
- Людям с высоким риском заражения (включая мужчин, имеющих половые контакты с мужчинами, транссексуалов и людей с ВИЧ) можно назначать вакцину, если они ранее не получали или не проходили курс вакцинации.
- Любой пациент, у которого был диагностирован ВПЧ, может пройти вакцинацию в качестве профилактики развития инфекции со штаммами высокого онкориска.
Gardasil и Gardasil 9 одобрены для использования у женщин в возрасте 9-45 лет, и у мужчин в возрасте от 9 до 26 лет.
Эти вакцины требуют проведения трех инъекций в течение 6 месяцев.
Для здоровых, иммунокомпетентных людей, не инфицированных ВИЧ, могут назначаться только две дозы препарата.
Cervarix также одобрен для вакцинирования у женщин в возрасте от 9 до 45 лет.

В настоящее время Cervarix не одобрен только в Канаде, для вакцинирования мужского населения.
Научно-исследовательский центр Бантинга, подчиненный Министерству здравоохранения Канады, определил целесообразность использования вакцины только для пациентов женского пола.
Вакцинирование проводится с использованием трех инъекций в течение 6 месяцев.
Если пациент не принимает иммуносупрессивные препараты и не относится к категории ВИЧ-инфицированных, разрешается снижение дозирования вакцины до двух инъекций.
ВОЗ рекомендует Cervarix женщинам в возрасте от 9 до 27 лет, у которых ранее был выявлен ВПЧ.
А также заболевания органов малого таза, спровоцированные вирусом.
Также вакцина в обязательном порядке рекомендуется пациенткам старше 27 лет в качестве профилактики ВПЧ и рака шейки матки.
Специалисты из США, Европы и Японии подтвердили эффективность и необходимость вакцинации препаратом Церварикс.
ВПЧ — это инфекция, передающаяся половым путем.
В идеале вакцина должна вводиться до сексуального дебюта, чтобы обеспечить максимальную пользу.
От чего защищают вакцины?
Гардасил обеспечивает защиту от четырех типов ВПЧ.
Два из них вызывают примерно 70% всех раковых заболеваний шейки матки (HPV-16, HPV-18).
Два других типа почти в 90% случаев провоцируют аногенитальные бородавки у мужчин и женщин (HPV-6, ВПЧ-11).
Gardasil 9 примерно до 20% снижает риск аногенитальных раковых заболеваний, вызываемыми другими пятью типами HPV (31, 33, 45, 52, 58).
Cervarix также обеспечивает защиту от двух типов ВПЧ, которые могут привести к раку шейки матки (HPV-16, HPV-18).

Вакцинирование необходимо проводить до момента заражения или развития клинической картины.
При протекающей инфекции вакцины не смогут повлиять на ее устранение или каким-то образом уменьшить ее проявление.
В настоящее время не существует вакцины, которая обеспечит защиту от всех типов ВПЧ.
Насколько эффективны вакцины?
Препараты для вакцинации (Gardasil и Cervarix) от HPV продемонстрировали высокую эффективность.
Они предотвращают инфицирование штаммами вирусов, которые указаны непосредственно в аннотации к препаратам.
Даже при наличии у пациента одного из типов вируса вакцины будут защищать от других ВПЧ.
Таким образом снижая риск развития онкологического процесса.
Профилактика ВПЧ: проблемы безопасности и побочные эффекты вакцины
Одна из проблем, которая часто возникает при обсуждении любой из вакцин против ВПЧ — безопасны ли они и какие возможны побочные реакции.
Все три вакцины могут сопровождаться умеренными или относительно незначительными побочными эффектами.
Это болезненность и покраснение в месте инъекции, а также головные боли, боли в животе.
Подобные явления возникают крайне редко и не требуют особого лечения, не считаются потенциально опасными для пациента.
Кроме того, вакцины не содержат бактериостатических веществ или консервантов, которые могут являться опасными для здоровья человека.
Профилактика ВПЧ такими вакцинами как Гардасил и Церварикс обеспечивают защиту от вируса в среднем на 10 лет.
Нуждаются ли вакцинированные пациентки в скрининге рака шейки матки?
В настоящее время вакцины против ВПЧ не защищают от всех типов вирусной инфекции.
Поэтому пациенткам, прошедшим вакцинирование, рекомендуется регулярное (не менее одного раза в год) проведение тестирования по Папаниколау (мазок на Пап).

Мужское обрезание как профилактика ВПЧ
Согласно результату исследования, опубликованного в журнале NEJM (медицинский журнал Англии), обрезание у мужчин как профилактика ВПЧ может снизить риск заражения вирусом более, чем на 35%.
Сегодня процедура циркумцизио широко не поддерживается.
Тем не менее, было доказано, что обрезание может снизить риск инфицирования вирусом простого герпеса 2 (генитальный герпес) почти на 25%.
Вирус папилломы человека (ВПЧ) – масштабная по распространению вирусная инфекция.
Насчитывает более сотни типов.
Относится к группе инфекций, передаваемых половым путем (ИППП).
Выделяются 3 группы папилломавирусов:
- неонкогенные
- низкоонкогенные
- высокоонкогенные, из них 16 и 18 типы встречаются в 70%, тип 16 отмечается при онкологии в 41-54% вероятности

Основной способ передачи инфекции – сексуальный контакт.
Это обуславливает распространение среди жителей планеты, достигая цифры в 70%.
В процентном соотношении женское население более подвержено поражению вирусом.
Способы передачи:
- половая близость (вагинальный, оральный, анальный контакт, с проникновением и без)
- контактно-бытовой
- передача инфекции матерью ребенку при родах
Клиника ВПЧ
Поражение организма вирусом происходит на клеточном уровне.
В атакуемой клетке ПВЧ отмечается в двух формах:
- доброкачественная, вирус вне клеточной хромосомы человека
- злокачественная, ДНК вируса в геноме человеческой клетки, меняет его структуру, приводит к перерождению
При доброкачественном варианте человек не замечает болезни, чаще организм сам очищается от чужеродных вирусов.
Активация и переход к клиническим проявлениям наступает у ослабленных, и ВИЧ-инфицированных людей.
Симптомов, как правило, не наблюдается.
К клиническим проявлениям относят:
- Низкоонкогенные аногенитальные бородавки
- Респираторный рецидивирующий папилломатоз (РРП), редкая патология, папилломы локализуются в дыхательных путях (гортань, голосовые связки, носоглотка). Папилломатоз гортани характерен для младшего детского возраста, но бывает и у взрослых
- Онкологические патологии, вызванные папилломавирусом: рак шейки матки (РШМ), вульвы, вагины, ануса, полового члена, протекают долгое время без симптомов. При обнаружении проблемы преобладает симптоматика онкологии
Для РШМ на определенной стадии характерны вагинальные кровотечения между менструациями и после полового контакта. Боли в пояснице, ногах, в тазу, ухудшение состояния, потеря аппетита и веса. Раздражение во влагалище, выделения со специфическим запахом, отек одной ноги. С дальнейшим утяжелением проявлений.
Опасен ли ВПЧ при беременности
ВПЧ при беременности не приговор, инфекция не влияет на плод и течение беременности.
Настороженность вызывают штаммы вирусов, вызывающие рост генитальных бородавок 6, 11, и типы повышенной онкогенности 16 и 18.
Лечение в период беременности требуется не всегда.
Пристальное наблюдение за проблемой (цитология, кольпоскопия), при необходимости применяют иммуномодуляторы для повышения защитных свойств организма.
Хирургическое вмешательство показано крайне редко, при угрозе для здоровья ребенка удаляются онкогенные образования.
Последствия ВПЧ у мужчин
Мужчина бывает вирусоносителем без явных проявлений клиники, или имеет проявления, например остроконечные кондиломы.
Если кондиломы появились у женщины, у ее полового партнера берется соскоб эпителия с головки полового члена, исследуется материал из ануса.
В некоторых странах мужчин на ПВЧ не обследуют в плановом порядке.
Взрослые люди независимо от пола одинаково подвержены возникновению таких патологий, как рак и предрак анальной области с участием ВПЧ.
Эпителий ануса так же атакуется вирусом, как и шейка матки.
Анальный рак отмечается у мужчин в 40% случаев, частота заболеваний растет, в частности в группе риска.
Отслеживается связь анального рака и предрака с ВИЧ-инфицированием по причине снижения иммунитета, анальных половых связей.
ВИЧ-положительные пациенты показывают более высокий процент заболевания.
ВПЧ активируется раньше, инкубационный период меньше, чем у здоровых людей.
ВПЧ для ВИЧ-позитивных пациентов является оппортунистической инфекцией и требует особого внимания.
К ранней диагностике анального рака относят:
Цитологический скрининг у мужчин проводит дерматовенеролог раз в 6 месяцев, если нет клинических проявлений при подтвержденном ВПЧ.
Если есть кондиломы, их удаляют.
Онкология как последствия ВПЧ
Взаимосвязь рака шейки матки с папилломавирусом 16 типа обнаружил Нобелевский лауреат 2008 года Гарольд цур Хаузен.
Научно установлено присутствие онкогенных ПВЧ при РШМ в 100% случаев.
Все больше данных подтверждает присутствие вирусов 16 и 18 типов при диагностике рака ануса, гениталий.
Связь этих заболеваний с ВПЧ имеет оптимистичный характер в плане предотвращения болезни путем первичной профилактики.
Она разработана для сокращения онкологического поражения женщин РШМ.
Рак шейки матки забирает 52% жизней женщин, это высокий показатель смертности.
Из них 85% женщины, из стран с низким и средним уровнем жизни.
Тяжелые последствия ВПЧ
Папилломавирус сопровождает такие заболевания:
- Верруциформная эпидермодисплазия – редкая патология, вызываемая некоторыми штаммами вируса. Проявляется изменением структуры клеток эпидермиса с характерными высыпаниями на пораженных участках в виде плоских бородавочных элементов или пятен, покрытых чешуйками. Имеет генетическую предрасположенность по рецессивному типу. Дисплазия эпидермиса может перейти в рак кожи, чаще всего при участии штаммов вируса 5, 8, 47
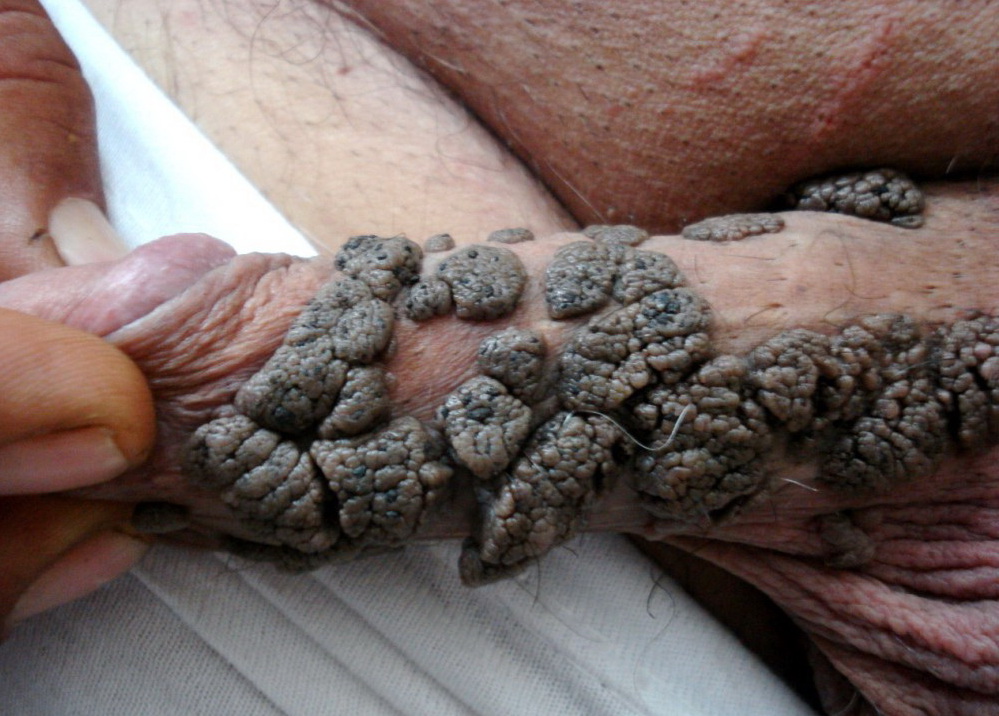
- Бовеноидный папулез (болезнь Боуэна) 16, 34, 35, 55 – редкая патология, протекает при участии 16 типа и сопутствующих типов, проявляется папулезным высыпанием в области мошонки, паха, полового члена, лобка, больших и малых половых губ. Папулы отдельные и слитые в бляшки до 2 см, с неоднородной поверхностью. Течение болезни затяжное, риск перерождения в онкологию 3%
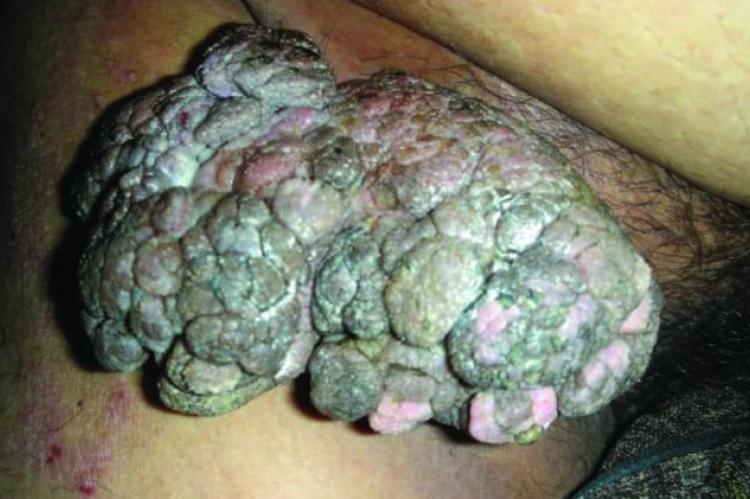
- Осложнения от папиллом и кондилом – редкое перерождение в злокачественные новообразования, при участии высокоонкогенных штаммов, чему способствует постоянное механическое повреждение, ослабленный иммунитет – чаще у мужчин, локализация половые органы, область ануса. Из узелков, растущих вширь и вглубь, образуется широкое основание, образование склонно к изъязвлению и деструкции, к рецидиву, относится к предраку. Необходимо глубокое хирургическое иссечение
Диагностика ВПЧ

Современные методики обнаруживают вирус, определяют тип и потенциальную настороженность.
- Кольпоскопия – осмотр с использованием кольпоскопа.
- Цитология – микроскопия мазка. В результатах: норма 1, 2 класс, 3 класс дополняется гистологией, 4, 5 класс обнаружение злокачественных клеток. В мазках койлоциты и дискератоциты, измененные клетки.
- Гистология биопатов – микроскопическое изучение измененных клеток в тканях.
- Антитела к вирусу – отслеживаются в крови до появления клинических проявлений. Ранняя диагностика, но не устанавливает точно тип и концентрацию ПВЧ.
- Амплификационный (Digene-тест) – точное обнаружение ВПЧ. С указанием типов, концентрации. Материал – соскоб со слизистой оболочки вагины или уретры.
- Неамплификационный (ПЦР) – применяется для онкогенных штаммов. Материал: мазки, кровь, моча, амниотическая жидкость. Обнаруживается ДНК вируса.
- Дерматоскопия – характеризует новообразование при помощи оптики.
- Онкомаркер S-100 используется при определенных формах рака (рак кожи, меланома); осуществляют контроль над прогрессом заболевания, ответом на терапию. Диагностическая ценность низкая.
Лечение ВПЧ
Лечения инфекции, вызванной ВПЧ, на сегодня нет.
Большинство людей даже не подозревают о наличии заболевания.
Некоторые штаммы вируса изгоняются организмом самостоятельно.
Другие не приносят явных проблем и клинических проявлений.
Лечение заключается в устранении проявлений заболевания.

Проводят удаление генитальных бородавок, дисплазии, хирургическим или химическим путем.
- выжигание электрокаутером или лазером
- замораживание жидким азотом
- хирургическое удаление (кюретаж, иссечение)
- лечение химическими препаратами
- противовирусная и иммуномоделирующая терапия
- при диагностике рака – хирургическое вмешательство, радиотерапия и химиотерапия
Лечение позволяет не перейти из фазы предрак в более тяжелую стадию, не дает инфекции прогрессировать.
Показывает положительные результаты лечения при раннем обнаружении.
Профилактика ВПЧ
Разработана эффективная первичная профилактика РШМ, широко применяемая во многих странах современного мира.
Скрининг – тестирование на предраковые состояния и рак у здоровых женщин.
Эффективность методов для понижения смертности в глобальных масштабах, при раннем выявлении заболевания высока, как и вероятность излечения.
Проводится в возрасте 30-49 лет, учитывая длительную инкубацию.
Виды скрининга:
- визуальный осмотр с применением уксусной кислоты
- тесты на штаммы высокого риска
- цитологический тест окрашивание по Папаниколау шеечных и анальных мазков (РAP), цитология жидкости (LBC)
В странах, где применение скрининговых программ и раннее лечение предотвращает возникновение РШМ до 80%, реально виден результат.
При позднем, симптоматическом выявлении заболевания, лечение малоэффективное.
Вакцинация против ВПЧ
Вакцина против ПВЧ на 2013 год применялась уже в 55 странах ВОЗ.
Вакцинация не отменяет применение скрининга на РШМ, а дополняет его.
Проведение вакцинации для профилактики онкологии от ВПЧ 16 и 18 типов эффективно до внедрения вируса в организм человека.
Вакцины не излечат инфекцию и онкологию, вызванную папилломавирусом, поэтому их применяют до начала половых контактов.
В некоторых странах вакцинируют мальчиков, для сокращения аногенитального рака, вирусоносительства.
Одна из вакцин гарантирует перекрестное воздействие на вирус вызывающий рост генитальных кондилом у обоих полов.
Девочек по рекомендации ВОЗ вакцинируют в 9-13 лет, для минимизации затрат здравоохранения на эффективную профилактику РШМ.
Математическое моделирование прогнозирует при полном курсе первичного вакцинирования девочек 12-13 лет (3 дозы):
- значительное снижение рисков заболеваемости РШМ – на 63%
- предрака на 51%
- цитологические нарушения у женщин до 30 лет снижаются на 27%
Рекомендованный возраст для вакцинации: мальчики и девочки 9 – 17 лет, девушки 18 – 26 лет.
Ведутся исследования для вакцинации людей старше 30 лет.
Вакцины от ВПЧ
Наличие вакцины означает возможность первичной профилактики РШМ и других онкологических заболеваний.
Вакцины успешно применяются и показывают эффективность профилактических мер в США, Франции, Германии и других странах.

Вакцинация трехкратная, проводится с первым интервалом в 2 месяца и вторым в 4 месяца.
Возможна укороченная схема с первым интервалом в месяц и вторым в 2 месяца.
В случае наступления беременности вакцинация переносится в послеродовой период.
Проведение профилактики в течение 12 месяцев считается успешной и законченной вакцинацией.
Однако, отношение к вакцинации остается неоднозначным.
Вакцинация снижает риски от определенных штаммов вируса 16 и 18, но РШМ начинают вызывать штаммы, ранее признанные неонкогенными.
Прививка женщин, имеющих сексуальные контакты, практически нерезультативна.
Есть опасения, что вакцинация подростков вызовет пренебрежение к другим способам защиты.
При появлении признаков ВПЧ обращайтесь к автору этой статьи – дерматовенерологу в Москве с многолетним опытом работы.
М.А.Гомберг, д.м.н., профессор, А.М.Соловьев, к.м.н., доцент, МГМСУ, Москва
В последнее время папилломавирусная инфекция привлекает особое внимание в связи с ролью этой группы вирусов в развитии рака. В 2008 г. Нобелевской премией по медицине было отмечено доказательство того, что некоторые типы вируса папилломы человека (ВПЧ) способны вызывать рак шейки матки. По Handley J.M., et al. (1994), к ВПЧ-поражениям относят: клинические формы — аногенитальные бородавки (остроконечные кондиломы, вульгарные бородавки), симптоматические внутриэпителиальные неоплазии на ранних стадиях при отсутствии дисплазии (плоские кондиломы); субклинические формы — бессимптомные внутриэпителиальные неоплазии при отсутствии дисплазии; латентные формы (отсутствие морфологических или гистологических изменений на фоне обнаружения ДНК ВПЧ).
Лечение аногенитальных ВПЧ-поражений, согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, должно быть направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса. Во всех основных рекомендациях по ведению больных с ВПЧ-инфекцией — CDC, Европейских рекомендациях, рекомендациях ВОЗ, и в том числе в рекомендациях РОДВ, приведен именно такой подход.
Роль вирусов папилломы человека (ВПЧ) в развитии множества доброкачественных и злокачественных новообразований кожи и слизистых оболочек не вызывает сомнений. Полагают, что все 500тыс. случаев рака шейки матки, ежегодно диагностируемые в мире, вызваны генитальной ВПЧ-инфекцией (Bulletin Word Health Organization, 2007).
В различных клинических рекомендациях и протоколах подробно описываются методы лечения именно клинических проявлений ВПЧ, но обходится стороной вопрос так называемого вирусоносительства или бессимптомного выделения вируса. Причем вопросу тактики врача при бессимптомном выделении вируса у пациента ВПЧ уделяется мало внимания не только в практических рекомендациях, но и в научно-исследовательской литературе.
Мы предлагаем свой подход к этой проблеме.
Прежде всего мы исходим из того, что наш долг — ставить во главу угла интересы пациента. Если он встревожен наличием ВПЧ и желает избавиться от этой инфекции, мы должны постараться успокоить его и обсудить все имеющиеся в настоящее время возможности лечения. В противном случае нам будет трудно рассчитывать на доверие с его стороны.
Мы считаем, что такое обсуждение должно состоять из 3 частей.
1. Информирование пациента относительно характера течения и последствий инфекции.
2. Методы профилактики рака шейки матки (при выявлении вируса у женщин).
3. Возможности воздействия на ВПЧ с целью его элиминации.
1. ИНФОРМИРОВАНИЕ ПАЦИЕНТА
При первом же визите необходимо рассказать человеку о возможных рисках, связанных с инфицированием ВПЧ. Однако консультирование нужно проводить очень осторожно, чтобы не спровоцировать у человека развитие психоневроза и канцерофобии.
Пациент с выявленным ВПЧ должен знать о своей потенциальной заразности для неинфицированных лиц, поэтому ему надо рекомендовать использовать презерватив при половых контактах и обязательно информировать своего полового партнера о вирусоносительстве.
Следует проинформировать пациентов о том, что возможно самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
2. ПРОФИЛАКТИКА РАКА ШЕЙКИ МАТКИ (ПРИ ВЫЯВЛЕНИИ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА У ЖЕНЩИН)
Всем женщинам, инфицированным ВПЧ, следует провести кольпоскопическое исследование, в том числе с окраской раствором Люголя или раствором уксусной кислоты, а также цитологические тесты по Папаниколау. Периодичность обследований обсуждается с гинекологом в зависимости от степени онкогенности выявленных вирусов и результатов кольпоскопии и цитологии. Цитологические исследования следует проводить не реже, чем 1 раз в 6 месяцев. Для женщин старше 26 лет этот подход является практически единственным способом профилактики рака шейки матки.
Имеются публикации об эффективности российского препарата индинол для профилактики рака шейки матки у женщин, инфицированных ВПЧ. Однако контролированных плацебо-исследований не проводилось.
3.ВОЗДЕЙСТВИЕ НА ВПЧ
Наиболее дискуссионным является вопрос о воздействии на выделение вируса, поэтому остановимся на нем подробнее. Врач, безусловно, должен информировать пациента о том, что в настоящее время нет методов, позволяющих достоверно и с высокой степенью вероятности устранить вирус из организма.
Необходимость проведения лечебных мероприятий обсуждается индивидуально с каждым пациентом. Желательно, чтобы врач принимал решение о проведении лечения с целью устранения ВПЧ в отсутствие клинических проявлений только после подписания пациентом информированного согласия, во избежание возможных последующих недоразумений.
Теоретически, учитывая локализацию вируса в эпителиальных клетках и то, что происходит постоянное слущивание эпителия, можно предположить, что ВПЧ может исчезнуть вместе со старыми эпителиальными клетками. Видимо, именно этим объясняются случаи самопроизвольного исчезновения ВПЧ. Между тем очевидно, что элиминации ВПЧ из организма с гораздо большей эффективностью можно добиться при активизации противовирусного иммунитета, ингибирующего размножение ВПЧ и его внедрение в другие клетки. Доказать возможность достижения такого результата на практике можно только путем проведения соответствующих специальных исследований.
Потенциально возможны 3 способа инфицирования: от матери к ребенку (трансплацентарно; во время родов, в том числе путем кесарева сечения; возможно — через слюну или грудное молоко), посредством передачи вируса воздушно-капельным или контактно-бытовым путями. Cчитается, что ВПЧ-инфекция передается в основном половым путем, что объясняет ее широкую распространенность среди сексуально активного населения. В частности, в США ежегодно диагностируют 6,2 млн новых случаев генитальной ВПЧ-инфекции (Steinbrook R., 2006).
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность. Этого можно достичь как неспецифическими, так и специфическими методами.
К неспецифическим относят различные способы укрепления защитных сил организма, так называемый здоровый образ жизни: правильное питание, профилактический прием витаминов, биологически активных добавок.
Отдельный вопрос — проведение гомеопатического лечения. Но поскольку об этих способах часто упоминается в научно-популярной литературе, в рамках данной статьи мы их комментировать не будем.
Установлено, что при применении интерферонов снижается количество вирусной ДНК (по данным ПЦР) у пациентов в очагах поражения [Arany I., et al., 1995].
Интерферон применяют местно и системно (подкожно, внутримышечно, внутривенно или ректально).
В большинстве исследований была показана невысокая эффективность наружного применения интерферона [Keay S., et al, 1988] при наличии клинических проявлений, а при лечении больных с субклиническими очагами ВПЧ-инфекции и цервикальных неоплазиях (ЦИН) были получены обнадеживающие результаты [Gross G., 1996].
По данным различных авторов, при системном применении альфа-интерферона в дозе от 1,5 до 3 млн МЕ внутримышечно или подкожно через день в течение 4 недель в качестве монотерапии у 11—100% пациентов наблюдается полное исчезновение бородавок [Gross G., et al., 1986; Zwiorek L., et al., 1989], что свидетельствует о возможном ингибирующем влиянии препаратов интерферонов на ВПЧ.
При системном применении интерферонов побочными эффектами обычно являются гриппоподобные состояния, выраженность которых зависит от полученной дозы [Handley, et al., 1994]. Эти побочные явления можно ослабить приемом нестероидных противовоспалительных препаратов.
Считается возможным самостоятельное исчезновение ВПЧ. Известно, что у лиц более молодого возраста вероятность исчезновения вируса с течением времени выше, чем у лиц старше 25 лет.
На российском рынке представлен широкий выбор интерферонов различных производителей, как отечественных, так и зарубежных, — генферон, виферон, кипферон, реаферон, роферон-А, интрон А, реальдирон и т.д. Предпочтительнее назначать рекомбинантные, а не человеческие интерфероны.
При назначении интерферонов надо учитывать не только частые побочные реакции, но и то, что их введение может подавлять синтез собственных эндогенных интерферонов. Поэтому в отсутствие клинических проявлений интерфероны применяют только в том случае, когда о целесообразности такого назначения свидетельствуют результы исследования иммунного статуса. Следует также отметить и высокую стоимость качественных препаратов интерферона.
Воздействовать на противовирусный иммунитет можно с помощью индукторов эндогенного интерферона и других активаторов иммунитета. На российском фармацевтическом рынке представлено много иммуноактивных препаратов, которые, согласно инструкции производителя или рекомендациям исследователей, можно применять для комбинированного лечения аногенитальных бородавок (в сочетании с различными деструктивными методами). На основании этого их можно рекомендовать для противовирусной терапии при отсутствии клинических проявлений.
Гепон — синтетический олигопептид, состоящий из 14 аминокислотных остатков, относится к группе иммуномодуляторов. Препарат показан для повышения эффективности иммунной защиты от инфекций, лечения и профилактики оппортунистических инфекций, вызванных бактериями, вирусами или грибами. Гепон оказывает иммунофармакологическое и противовирусное действие:
У больных с ослабленной иммунной системой гепон:
Так, например, после удаления очагов ВПЧ-поражений любым деструктивным методом, аппликации гепона (от 3 до 6 аппликаций через день) позволяют ускорить процесс заживления и снизить уровень рецидивирования. Системно препарат применяют по 2 мг перорально 3 раза в неделю. Курс можно повторять с интервалом в 1 неделю [Соловьев А.М., 2003].
Изопринозин (инозин пранобекс) — противовирусное средство с иммуномодулирующими свойствами. Препарат, индуцируя созревание и дифференцирование Т-лимфоцитов и Т1-хелперов, потенцируя индукцию лимфопролиферативного ответа в митогенных или антиген-активных клетках, нормализует дефицит или дисфункцию клеточного иммунитета. Изопринозин моделирует цитотоксичность Т-лимфоцитов и натуральных киллеров, функцию Т8-супрессоров и Т4-хелперов, а также повышает количество иммуноглобулина G и поверхностных маркеров комплемента. Препарат повышает синтез интерлейкина-1 (ИЛ-1) и интерлейкина-2 (IL-2), регулирует экспрессию рецепторов IL-2, существенно увеличивает секрецию эндогенного γ-интерферона и уменьшает продукцию интерлейкина-4 в организме. Изопринозин усиливает действие нейтрофильных гранулоцитов, хемотаксис и фагоцитоз моноцитов и макрофагов. Кроме этого, он оказывает прямое противовирусное действие, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной и-РНК. Одним из показаний для применения препарата являются инфекции, вызванные вирусом папилломы человека: остроконечные кондиломы, папилломавирусная инфекция вульвы, вагины и шейки матки (в составе комплексной терапии).
Для женщин старше 26 лет цитологическое исследование слизистой шейки матки, проводимое 2 раза в год, является практически единственным способом профилактики рака шейки матки.
В литературе описаны различные схемы и результаты применения изопринозина.
При инфекциях, вызванных ВПЧ, изопринозин назначают по 3 г/сут (2 таблетки 3 раза в сутки) как дополнение к местной терапии или хирургическому вмешательству на протяжении 14—28 дней для пациентов с низкой степенью риска или 5 дней в неделю последовательно в течение 1—2 недель в месяц в течение 3 мес для пациентов с высокой степенью риска.
Известно о зарубежном опыте применения инозин пранобекса в качестве терапии, дополняющей деструкцию аногенитальных бородавок [Davidson-Parker J., et al., 1988]. Препарат назначали по 1 г 3 раза в сутки в течение 14—28 дней.
В работе Забелева А.В. и соавт. (2005) показано исчезновение атипичного эпителия у женщин с ВПЧ-ассоциированными плоскоклеточными интраэпителиальными поражениями низкой степени после проведения курсов лечения изопринозином. Препарат назначали по 1 грамму 3 раза в сутки в течение 5 дней, 3 курса с интервалом в 1 месяц. В исследовании, проведенном Sun Kuie Tay (1996), показаны аналогичные результаты — улучшение морфологической картины эпителия вульвы. Инозин пранобекс назначали по 1 г 3 раза в сутки в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, тогда как в группе, принимавшей плацебо, только у 16,7%. О прекращении выделения ВПЧ у 65,6% больных после проведения комбинированной терапии (изопринозин + деструкция очагов) ЦИН низкой степени сообщает Прилепская В.Н. (2007). При использовании только деструкции очагов этот результат был достигнут у 46,9% больных. Изопринозин назначали за 7—10 дней до проведения деструкции по 1 г 3 раза в сутки в течение 5 дней. В исследовании Шевниной И.В. (2009) показаны похожие результаты — прекращение выделения ВПЧ у 77% больных при комбинированной терапии женщин с ЦИН и аногенитальными бородавками. Изопринозин назначали по 1 г 3 раза в сутки в течение 10 дней, затем по 0,5 г 3 раза в сутки в течение 20 дней.
Для решения поднятой в этой статье проблемы интересным является факт прекращения обнаружения ВПЧ из очагов поражения в ходе проводимой комбинированной терапии с применением иммуномакса. При проведении вирусологического обследования пациентов до лечения в среднем у 70% выявлялся ВПЧ в очагах поражения. После проведенного комбинированного лечения в ходе контрольного наблюдения у 45% больных было отмечено прекращение выделения ВПЧ [Перламутров Ю.Н. и соавт., 2003]. Полученные результаты свидетельствуют, что проведение терапии иммуномаксом влияет на противовирусный иммунитет и приводит к прекращению не только рецидивов, но и выделения ВПЧ из очагов поражения. В связи с этим в перспективе иммуномакс можно будет использовать не только для лечения остроконечных кондилом, но и для предотвращения вирусовыделения у больных без клинических проявлений инфекции.
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ С ИММУНОМОДУЛИРУЮЩИМ ДЕЙСТВИЕМ
Панавир — растительный полисахарид, полученный из растения Solanum tuberosum, относится к классу высокомолекулярных гексозных гликозидов сложного строения с молекулярной массой 1000 кД. В настоящее время в России он является одним из самых популярных препаратов, использующихся для противовирусной терапии. Причем лечение папилломавирусной инфекции является лишь одним из показаний к его применению.
После однократной инъекции панавира в 2,7—3 раза повышается уровень лейкоцитарного интерферона, что соответствует воздействию терапевтических доз интерферона [Колобухина и соавт., 2005].
Повышение функциональной эффективности противовирусного иммунитета является основным способом, который предположительно может помочь в устранении вируса из организма или уменьшить его активность.
Со степенью распространенности неопластического процесса связывают эффективность препарата в отношении прекращения вирусовыделения [Иванян А.Н. и соавт., 2004]. Так, после проведения комплексного лечения у пациенток с 1-й степенью распространенности процесса вирус не выявлялся в 90,5%, при 2-й степени — в 71,1%, при 3-й степени — в 39,6%, при 4-й степени — в 9,4% случаев. Достоверное снижение вирусной нагрузки с 398,2 RLU до 176,2 RLU (p<0,05) через 1 месяц после окончания монотерапии панавиром ВПЧ-инфекции отмечает Мелехова Н.Ю. (2005).
Продолжаются исследования противовирусной активности панавира с целью установления мишени, объясняющей его высокую противовирусную активность, а также по расширению показаний к его применению. Но уже сейчас можно говорить о том, что он является одним из наиболее перспективных противовирусных агентов с доказанным иммуномодулирующим действием.
В этой статьей мы начали дискуссию о целесообразности попытки устранения папилломавирусной инфекции при отсутствии ее клинических проявлений. Существующие рекомендации по наблюдению таких пациентов могут не удовлетворить тех из них, которые хотели бы получить квалифицированную помощь в устранении этой инфекции. Поэтому мы предлагаем 3-х этапную тактику ведения таких больных: консультирование, цитологический контроль у женщин и использование противовирусных препаратов с иммуномодулирующим действием.
Читайте также:

