Диагностика вирусных инфекций экспресс метод
Обновлено: 25.04.2024
1. Дайте понятие вирусам. Охарактеризуйте особенности строения и жизни вирусной частицы.
2. Какими факторами осуществляется защита организма человека от вируса.
3. Назовите группу и механизм действия препаратов на вирусы. Приведите примеры препаратов.
4. Назовите типы инфекции, вызываемые вирусами.
5. Назовите представителей кишечных, кровяных, респираторных вирусных инфекций, инфекций кожных покровов и слизистых.
7. Назовите, как называются мероприятия, ликвидирующие эпидемический процесс.
Самостоятельная работа студентов:
Запишите определения методов исследования вирусных инфекций.
Зарисйте в атлас внутриклеточные включения при натуральной оспе (тельца Гварниери), при бешенстве (тельца Бабеша-Негри).
3. Составьте план противоэпидемических мероприятий на вирусную инфекцию (инфекцию определяет преподаватель).
Краткие теоретические положения
Введение
Расширение возможностей в лечении и профилактике вирусных болезней с использованием противовирусных препаратов, иммуномодуляторов и вакцин с различным механизмом действия нуждается в быстрой и точной лабораторной диагностике. Узкая специфичность некоторых противовирусных препаратов также требует быстрой и высокоспецифичной диагностики инфицирующего агента. Появилась необходимость в количественных методах определения вирусов для мониторинга противовирусной терапии. Помимо установления этиологии заболевания лабораторная диагностика имеет важное значение в организации противоэпидемических мероприятий.
Ранняя диагностика первых случаев эпидемических инфекций позволяет своевременно провести противоэпидемические мероприятия – карантин, госпитализацию, вакцинацию и пр. Реализация программ по ликвидации инфекционных заболеваний, например натуральной оспы, показала, что по мере их выполнения возрастает роль лабораторной диагностики. Существенную роль играет лабораторная диагностика в службе крови и акушерской практике, например, выявление доноров, инфицированных вирусом иммунодефицита человека (ВИЧ), вирусом гепатита В (HBV), диагностика краснухи и цитомегаловирусной инфекции у беременных.
Методы диагностики вирусных инфекций
Для успешного выделения вирусов клинический материал должен быть взят в соответствии с патогенезом предполагаемого заболевания и в наиболее ранние сроки.
Как правило, берутся:
– при респираторных инфекциях – носоглоточный смыв;
– при энтеровирусных инфекциях – смыв и фекалии (рео-, энтеровирусы);
– при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа);
– при экзантемных инфекциях – смывы (корь, краснуха);
– при арбовирусных инфекциях – кровь, спинномозговая жидкость.
1. Быстрые (экспресс-методы) — прямое обнаружение вируса или его компонентов (антигенов, НК), включений непосредственно в клиническом материале.
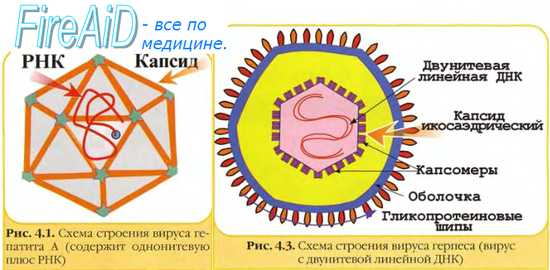
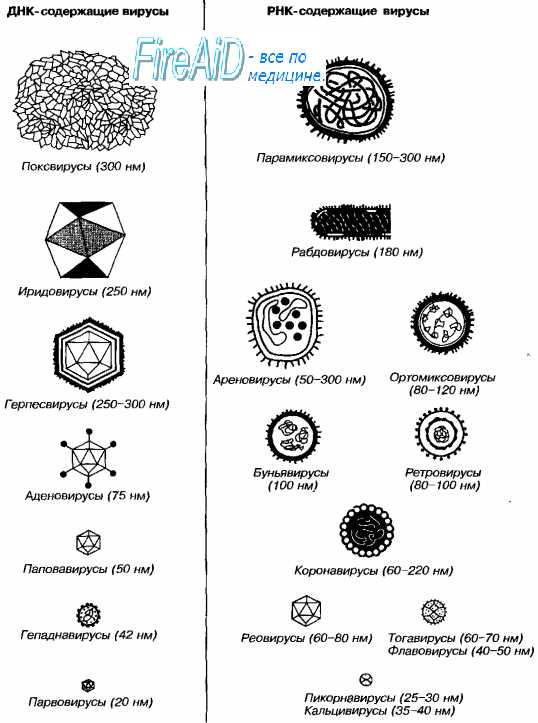
А. Вирусоскопический метод заключается в обнаружении вируса в исследуемом материале под микроскопом. Чаще всего используют электронный микроскоп. Световая микроскопия из-за ничтожно малых размеров вирусов практически не применяется. При данном методе можно определить тип НК, размеры вириона, форму вириона, а также выявить внутриклеточные включения, которые образуются в пораженных клетках при некоторых инфекциях.


II. Вирусологический метод основан на:
Культивировании вирусов в чувствительных биологических системах (клеточных культурах, курином эмбрионе, организмах лабораторных животных),их индикации по цитопатогенному действию на биологическую систему (рис.1), идентификации по ингибиции действия вирусов соответствующими противовирусными антителами (рис.2).


Рис. 1. Цитопатическое действие вирусов на клетку: А - нормальный рост, Б - ЦПД вирусов на клетку

Рис.2 Ингибиция вируса антителами
Вирусологическое исследование - это "золотой стандарт" вирусологии и должно проводится в специализированной вирусологической лаборатории. В настоящее время оно используется практически только в условиях возникновения эпидемической вспышки того или иного вирусного инфекционного заболевания.
III. Серологический метод — определение противовирусных антител (оптимально — IgM) и/или определение динамики нарастания их титров за определенный период заболевания в парных сыворотках. Диагностически значимым считают нарастание титра антител в 4 и более раз.
Метод парных сывороток: осуществляем сбор венозной крови в количестве 10 мл в начале болезни и в конце, приготавливаем сыворотку, определяем количество антител в первой и второй сыворотке.
При этом четырехкратное нарастание титра антител во второй сыворотке в большинстве случаев служит показателем протекающей или свежеперенесенной инфекции. При исследовании одной сыворотки, взятой в острой стадии болезни, диагностическое значение имеет обнаружение антител класса Ig М, свидетельствующее об острой инфекции.
Современные методы диагностики:
1. ПЦР - выявляют персистирующие вирусы по НК, находящиеся в клиническом материале, с трудом обнаруживаемые или не обнаруживаемые другими методами.
2. Радиоизотопный иммунный анализ (РИА) - метод основан на метке антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного антигена. Широкое распространение метод получил в 80-е годы, особенно для определения маркеров HBV и других некультивируемых вирусов. К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков).
3. Иммуноферментный анализ (ИФА) – Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на мечении антител ферментами, а не красителями. Наиболее широко используется пероксидаза хрена и щелочная фосфатаза, применяют также b-галактозидазу и b-лактамазы. Меченые антитела связываются с антигеном, и такой комплекс обнаруживается при добавлении субстрата для фермента, с которым конъюгированы антитела. Конечный продукт реакции может быть в виде нерастворимого осадка, и тогда учет проводится с помощью обычного светового микроскопа, или в виде растворимого продукта, который обычно окрашен (или может флюоресцировать или люминесцировать) и регистрируется инструментально.
Поскольку с помощью ИФА можно измерять растворимые антигены, то не требуется наличия интактных клеток в образце и таким образом могут использоваться различные виды клинического материала.
Другое важное преимущество метода ИФА – возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии. ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте.
Твердофазный ИФА, дающий растворимый окрашеный продукт реакции, нашел наибольшее распространение. ИФА может быть использован как для определения антигена (тогда на твердую фазу – дно лунки полистиролового планшета – наносятся антитела), так и для определения антител (тогда на твердую фазу наносятся антигены).
4. Реакция иммунофлюоресценции (РИФ) – Метод основан на использовании антител, связанных с красителем, например флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики.
В практике применяются два варианта РИФ: прямой и непрямой. В первом случае применяются меченные красителем антитела к вирусам, которые наносятся на инфицированные клетки (мазок, культура клеток). Таким образом, реакция протекает одноэтапно. Неудобством метода является необходимость иметь большой набор конъюгированных специфических сывороток ко многим вирусам.
При непрямом варианте РИФ на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале, а затем наслаивается антивидовая сыворотка к гамма-глобулинам животного, в котором готовилась специфическая иммунная сыворотка, например антикроличья, антилошадиная и т. п. Преимущество непрямого варианта РИФ состоит в потребности лишь одного вида меченых антител.
Метод РИФ широко применяется для быстрой расшифровки этиологии острых респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки верхних дыхательных путей. Успешное применение РИФ для прямой детекции вируса в клиническом материале возможно лишь в случае содержания в нем достаточно большого числа инфицированных клеток и незначительной контаминации микроорганизмами, которые могут давать неспецифическое свечение.
5. Другие методы диагностики –
РТГА используется для диагностики заболеваний, вызванных гемагглютинирующими вирусами. Она основана на связывании антителами сыворотки больного добавленного стандартного вируса. Индикатором реакции являются эритроциты, агглютинирующиеся вирусом (формирование характерного "зонтика") при отсутствии специфических антител и оседающие на дно неагглютинированными при их наличии.
РСК является одной из традиционных серологических реакций и используется для диагностики многих вирусных инфекций. В реакции принимают участие две системы: антитела сыворотки больного + стандартный вирус и эритроциты барана + антитела к ним, а также оттитрованный комплемент. При соответствии антител и вируса этот комплекс связывает комплемент и лизиса бараньих эритроцитов не происходит (положительная реакция). При отрицательной РСК комплемент способствует лизису эритроцитов. Недостатком метода является его недостаточно высокая чувствительность и трудность стандартизации реагентов.
Для учета значимости РСК также, как и РТГА, необходимо титрование парных сывороток, то есть взятых в начале заболевания и в период реконвалесценции.
РПГА – агглютинация сенсибилизированных вирусными антигенами эритроцитов (или полистироловых шариков) в присутствии антител. На эритроцитах могут быть сорбированы любые вирусы, независимо от наличия или отсутствия у них гемагглютинирующей активности. В связи с наличием неспецифических реакций сыворотки исследуются в разведении 1:10 и более.
РНГА – агглютинация эритроцитов, сенсибилизированных специфическими антителами в присутствии вирусных антигенов. Наибольшее распространение РОПГА получила при выявлении HBs-антигена как у больных, так и у доноров крови.
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Выявление противовирусных антител ( AT ) в сыворотке крови. РТГА. РСК. РИФ. Иммуносорбционные методы выявления противовирусных антител.
Более простой и доступный подход — выявление противовирусных антител ( AT ) в сыворотке. Образцы крови необходимо отбирать дважды: немедленно после появления клинических признаков и через 2~3 нед. Чрезвычайно важно исследовать именно два образца сыворотки. Результаты однократного исследования нельзя считать окончательными из-за невозможности связать появление AT с настоящим случаем. Вполне возможно, что эти AT циркулируют после предшествующей инфекции. В подобной ситуации роль исследования сыворотки, полученной в период рекон-валесценции, трудно переоценить. На наличие заболевания в период отбора первой пробы указывает не менее чем четырёхкратное увеличение титра AT, выявленное при исследовании второй пробы.
Перечисленные ниже методы не позволяют дифференцировать антитела ( AT ), образующиеся во время болезни и циркулирующие после выздоровления (продолжительность этого периода вариабельна для различных инфекций). Поскольку для адекватной диагностики необходимо подтвердить достоверное увеличение титров AT в двух пробах, то первую пробу исследуют в острой фазе, а вторую — в период выздоровления (через 2-3 нед). Полученные результаты носят ретроспективный характер и более пригодны для проведения эпидемиологических обследований.
РТГА выявляет AT, синтезируемые против гемагглютининов вирусов (например, вируса гриппа). Метод позволяет легко выявлять подобные антитела ( AT ) в сыворотке больного.
РСК — основной метод серодиагностики вирусных инфекций (среди доступных). Реакция выявляет комплементсвязывающие IgM и IgG, но не дифференцирует их; для оптимизации получаемых результатов постановка реакции требует определённых навыков персонала.
РИФ. При возможности получить биоптат инфицированной ткани и доступности коммерческих наборов AT, меченных флюоресцеином, диагноз может подтвердить реакция прямой иммунофлюоресценции. Постановка реакции включает инкубацию исследуемой ткани с AT, их последующее удаление и люминесцентную микроскопию образца.
Иммуносорбционные методы выявления противовирусных антител
Иммуносорбционные методы (например, ИФА и РИА) более информативны, поскольку выявляют IgM и IgG по отдельности, что позволяет делать определённые выводы о динамике инфекционного процесса или состоянии реконвалесценции. Для выявления AT известный Аг сорбируют на твёрдом субстрате (например, на стенках пробирок, пластиковых микропланшетах, чашках Петри) и вносят различные разведения сыворотки пациента. После соответствующей инкубации несвязавшиеся AT удаляют, вносят антисыворотку к Ig человека, меченную ферментом, повторяют процедуру инкубирования и отмывания несвязанных AT и вносят какой-либо хромогенный субстрат (чувствительный к действию фермента). Поскольку изменение окраски пропорционально содержанию специфических AT, то вполне возможно определение их титра спектрофотометрическим способом. В диагностике ВИЧ-инфекции наи- большее распространение нашёл метод иммуноблотннга.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика гриппа. Лечение гриппа. Профилактика гриппа.
Материалы для исследования при гриппе — смывы и мазки из носоглотки, мазки-отпечатки из носовой полости и кровь.
Основные методы диагностики гриппа — вирусоскопические, вирусологические и серологические. К методом экспресс-диагностики гриппа относят определение Аг вируса в мазках-отпечатках из носа и смывов носоглотки в РИФ и ИФА.
Выделение возбудителя гриппа проводят заражением 10-11-суточных куриных эмбрионов или, реже, различных клеточных культур. Вирусы гриппа проявляют слабый цитопатический эффект и чаще определяют феномен гемадсорбции. Типовую принадлежность вирусов идентифицируют в РСК; подтип гемагглютинина — в РТГА (вирусы гриппа агглютинируют эритроциты человека и различных животных); подтип нейраминидазы — в реакции ингибирования активности фермента.

Лечение гриппа
Препараты выбора при лечении гриппа —- амантадин или ремантадин, ИФН и его индукторы, противогриппозный у-глобулин. Терапевтические мероприятия следует начинать как можно раньше.
Профилактика гриппа. Иммунопрофилактика гриппа.
Разработаны методы активной и пассивной иммунопрофилактики гриппа. Для пассивной иммунизации применяют противогриппозный иммуноглобулин человека, приготовленный из крови доноров, иммунизированных гриппозными вакцинами.
Для активной иммунизации против гриппа применяют живые и инактивированные вакцины. Живые аттенуироеанные вакцины проявляют большую иммуногенность. Инактивированные вакцины включают вирионные (приготовлены из высоко-очищенных культур вирусов), субвирионные или расщеплённые (получают обработкой высоко-очищенных культур вирусов детергентами), субъединичные (содержат только гемагглютинин и нейраминидазу) препараты. Вакцинацию осуществляют в периоды наибольшего риска развития эпидемий. Она в большей степени показана лицам младшего и преклонного возраста, страдающим обструктивными лёгочными и сердечно-сосудистыми заболеваниями, а также сотрудникам ЛПУ.
Применение убитых вакцин от гриппа требует ежегодной ревакцинации; их эффективность не превышает 60-70%. Поскольку антигенные вариации возбудителя наблюдают часто, то набор Аг соответствующего вируса для иммунизации может быть определён только после начала вспышки заболевания.
В основе диагностики ОРВИ и гриппа лежит совокупность клинических проявлений заболевания и данных лабораторного обследования.
Малая доступность, низкая точность и длительность лабораторного определения возбудителя лежат в основе назначения эмпирической терапии при отсутствии результатов диагностических тестов и методов.
В Российской Федерации рекомендованными методами клинико-лабораторной диагностики респираторных инфекций являются:
- эпидемиологический анализ заболеваемости ОРВИ и гриппом, оценка сезонности и информации о циркулирующих штаммах вирусов;
- оценка жалоб, данных объективного осмотра, сбор эпидемиологического анамнеза и анамнеза заболевания;
- молекулярно-биологическая диагностика с использованием полимеразной цепной реакции (ПЦР) – обнаружение генетического материала (ДНК либо РНК в зависимости от возбудителя) в биоматериале, взятом у пациента;
- метод флуоресцирующих антител, иммуноферментный и радиоиммунологический анализ, серологические методы исследования (РТГА, РСК) биоматериалов, взятых из носо- и ротоглотки (мазки);
- иммунохроматографические тесты для массового скрининга и экспресс-диагностики гриппа с определением антигенов вируса;
- при наличии бактериальных осложнений рекомендуется выполнение посева микрофлоры с дальнейшим определением чувствительности к антибиотикам 1-5 .

Методы диагностики бактериальной и вирусной инфекции
Изменения в клиническом анализе крови с определением лейкоцитарной формулы зависят от выраженности лихорадочно-интоксикационного синдрома:
- при неосложненном течении гриппа выявляются нормоцитоз или лейкопения, нейтропения, эозинопения, относительный лимфо- и моноцитоз;
- бактериальные осложнения характеризуются повышением скорости оседания эритроцитов (СОЭ), лейкоцитозом, увеличением количества палочкоядерных нейтрофилов;
- интерстициальные вирусные поражения легких характеризуются лейкопенией, увеличением количества палочкоядерных нейтрофилов, анемией и тромбоцитопенией.
Общий анализ мочи при неосложненном течении гриппа без изменений. В случае выраженного лихорадочно-интоксикационного синдрома наблюдаются следующие изменения транзиторного характера (при купировании интоксикации показатели приходят в норму): увеличение относительной плотности мочи, лейкоцитурия, протеинурия, цилиндрурия.
На ЭКГ можно выявить характерные для токсикоза изменения: снижение вольтажа зубцов Р и Т в разных отведениях, относительное удлинение интервала Q–Т, удлинение интервала Р–Q. Изменения нестойкие и проходят в течение 1–2 недель 1-5 .
ОАК – общий анализ крови.
ОАМ – общий анализ мочи.

Методы диагностики COVID (ПЦР, антитела - IgM, IgG)
Методы исследования при COVID-19 делятся на прямые и непрямые.
Прямые методы направлены на обнаружение возбудителя COVID-19 – SARS-CoV-2.
- Молекулярно-биологическая диагностика с использованием полимеразной цепной реакции (ПЦР), направленная на обнаружение РНК SARS-CoV-2 в биоматериале, взятом у пациента.
- Экспресс-тесты на выявление вирусных антигенов SARS-CoV-2.
Вирусные антигены представляют собой структурные белки вирусной частицы. Анализ на выявление вирусных антигенов относится к экспресс-диагностике, при положительном результате рекомендовано подтверждение методом ПЦР.
Непрямые методы направлены на обнаружение антител к SARS-CoV-2, вырабатываемых в ответ на контакт с возбудителем.
- Анализ на выявление антител к SARS-CoV-2 (IgM и IgG).
Результатом инфекционного процесса, вызванного коронавирусом, является выработка антител IgM и IgG. Выявление IgM в венозной крови свидетельствует о текущем инфекционном процессе. Данный тип антител вырабатывается в первые дни заболевания, достигая максимума в острый период болезни с дальнейшим постепенным снижением и исчезновением к моменту выздоровления.
IgG выявляются в венозной крови на 10–14-й день от начала заболевания, циркулируют в кровеносном русле в течение длительного времени после выздоровления и свидетельствуют о контакте с возбудителем COVID-19, перенесенном заболевании или носительстве.
При явлениях бронхита (для исключения очаговой пневмонии) и наличии физикальных признаков поражения легочной ткани (верификация пневмонии) проводится рентгенография органов грудной клетки. При низкой информативности проведенного рентгенографического исследования рекомендуется проведение КТ либо МРТ для выявления изменений в легких. Могут быть выявлены усиление легочного рисунка, уплотнение бронхов. Рентгенологические признаки пневмонии зависят от типа возбудителя пневмонии 1-5 .

Дифференциальная диагностика
В большинстве случаев грипп диагностируют на основании клинической симптоматики. Однако в периоды низкой активности вирусов гриппа и при отсутствии эпидемий инфекция, вызванная другими респираторными вирусами, такими как риновирус, респираторный синцитиальный вирус, вирус парагриппа и аденовирус, может также протекать как гриппоподобное заболевание, что затрудняет дифференциальную диагностику.
Для постановки окончательного диагноза необходим сбор респираторных образцов (выделения из горла, носа и носоглотки, аспираты или смывы из трахеи) с дальнейшим исследованием в лаборатории путем прямого выявления антигенов, изоляции вирусов или выявления специфичной для гриппа РНК методом полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР). В клиниках для выявления гриппа применяются диагностические экспресс-тесты, но по сравнению с методами ОТ-ПЦР они обладают низкой чувствительностью, а надежность их результатов в значительной мере зависит от условий, в которых они используются 1-5 .
Читайте также:

