Для местного лечения во влажной среде инфицированных ран
Обновлено: 18.04.2024
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов. Ведущим ограничением в выборе антибактериальных препаратов в настоящее время является широкое распространение полирезистентных микроорганизмов. Это значительно сужает выбор как системных, так и местных препаратов эмпирической антибактериальной терапии ран. В настоящее время в целях профилактики прогрессирования раневой инфекции находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов.
К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран, можно отнести сульфаниламид (Ранавексим), сульфатидин серебра, неомицин с бацитрацином. Местная терапия инфицированных ран должна базироваться на этиологических и анамнестических характеристиках раны, фазе раневого процесса и объеме поражения. Местное применение антибактериальных препаратов (например, сульфаниламида) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги).
Ключевые слова: раны, антибактериальная терапия, полирезистентность, местное применение антибиотиков, сульфаниламид.
Для цитирования: Левчук И.П., Костюченко М.В. Антибактериальные препараты для местной терапии ранений различной этиологии. РМЖ. Медицинское обозрение. 2018;2(2(II)):64-68.
Levchuk I.P., Kostyuchenko M.V.
Pirogov Russian National Research Medical University, Moscow
The article deals with modern problems of antibiotic therapy of the wounds of various etiologies, possibilities and limitations of the use of topical antibiotics. Currently, the main limitation in the choice of antibacterial drugs is the widespread use
of multiresistant microorganisms. This fact significantly reduces the choice of both systemic and topical drugs for empirical antibiotic therapy of wounds. At present, topical antibiotics are often used to prevent the progression of wound infection, which often allows to avoid systemic side effects. Topical antibacterial preparations most actively used for outpatient management of wounds can be attributed to a sulfanilamide (Ranavexim), sulfatides silver, neomycin with bacitracin. Topical therapy
of wounds should be based on etiological and anamnestic characteristics of the wound, phase of the wound process and the extent of the lesion. Topical use of antibacterial drugs (e. g. sulfanilamide) is possible with small lesions without an active infectious process in the wound (such as abrasions, scratches, small cuts and burns).
Key words: wounds, antibacterial therapy, multidrug resistance, topical application of antibiotics, sulfanilamide.
For citation: Levchuk I.P., Kostyuchenko M.V. Antibacterial drugs for topical therapy of the wounds of various etiologies // RMJ. Medical Review. 2018. № 2(II). P. 64–69.
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов
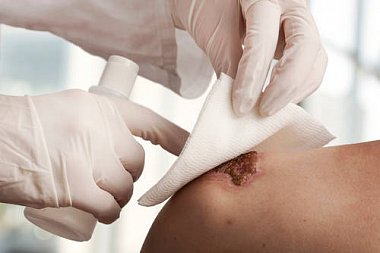
Все раны, полученные в нестерильных условиях, являются инфицированными, рост бактериальной флоры в ране провоцирует развитие воспалительного процесса, сопровождающегося повышением местной температуры, гиперемией, болью и нарушением функции части тела, на которой находится рана. Частота развития инфекционных осложнений остается весьма значительной и достигает в целом 45%. Наиболее подвержены развитию инфекционных осложнений раны, загрязненные землей, с нарушением кровоснабжения в области непосредственно самого повреждения или всей части тела, огнестрельные и минно-взрывные раны, укусы животных и человека. В зависимости от вида повреждения и условий окружающей среды в раны могут попадать различные микроорганизмы: резидентные — постоянно живущие и размножающиеся на коже (преимущественно коагулазонегативные кокки, например Staphylococcus epidermidis, S. aureus, и дифтeроиды, например Corinebacterium spp., реже — грамотрицательные бактерии), и транзиторные — в норме отсутствующие и попадающие на кожу после контакта с контаминированными объектами окружающей среды и больными людьми. В зависимости от области тела (голова, конечности, перианальная область и т. д.) спектр резидентной микрофлоры может быть различным. Транзиторная флора
также неодинакова по составу, который зависит от характера раны, этиологии, окружающей среды и может быть представлен различными инфекционно-опасными микроорганизмами (Escherichia coli, Klebsiella spp., Pseudomonas spp., Salmonella spp. и другими грамотрицательными бактериями, S. aureus, вирусами и грибами, Candida albicans, ротавирусами и др.). При повреждении кожи транзиторные микроорганизмы способны длительно колонизировать и инфицировать кожу, формируя при этом новую, гораздо более опасную резидентную (но не нормальную) флору. В большинстве случаев инфицирование обусловливается микробными ассоциациями. Так, укусы собак сопровождаются инфекционным осложнением примерно в 20% случаев, кошек — до 30–50%, человека — 70–80% [1–3].

Из-за изменения гистохимических параметров тканей в результате повреждения и разрушения защитной барьерной функции кожи даже непатогенные микроорганизмы могут стать причиной выраженных воспалительных, гнойных процессов. Для выбора оптимальной антибактериальной терапии необходимо учитывать возможный микробный спектр раны (табл.1).
Антибактериальная терапия
В настоящее время внебольничные штаммы остаются чувствительными к большому числу антибиотиков, в т. ч. β-лактамам. До конца 1990-х годов метициллин-резистентные микроорганизмы (MRSA) были исключительно внутрибольничной проблемой с преимущественным распространением в Европе. Однако в настоящее время имеются сведения и о внебольничных резервуарах полирезистентного стафилококка зоонозного происхождения, который составляет в общей массе до 50% и более на юге Европы и 10–25% в Центральной Европе и Великобритании [14]. В России в амбулаторных условиях частота встречаемости MRSA не превышает 3,8%, однако в условиях стационара частота встречаемости этих микроорганизмов, а также устойчивых к цефалоспоринам грамотрицательных E. coli и Klebsiella spp. достигает 60,4–84,9%. При выявлении высокого риска инфицированности MRSA-штаммами необходимо включить анти-MRSA-препарат в схему лечения [6–7].
В целях профилактики прогрессирования раневой инфекции в настоящее время находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов. Системной антибактериальной терапии не требуется при очагах менее 5 см после адекватной хирургической обработки [6].
В случае обширных раневых дефектов, клинических проявлений инфекции, включая системные признаки воспаления (повышение температуры тела >38° С или снижение 12×10 9 /л или лейкопения 90 уд./мин; одышка >24 дыханий/мин), иммунодефицитного состояния необходимо системное применение антибиотиков [7]. Местные лекарственные формы с антибактериальным компонентом при этом также находят место в протоколах лечения.
Активно применяющиеся в настоящее время антибактериальные препараты, при кажущемся на первый взгляд многообразии, с учетом современной концепции лечения инфицированных ран и требований, предъявляемых к подобным препаратам, имеют существенные ограничения. Спектр действия большей части широко известных препаратов значительно сузился для стационарного применения в связи с полирезистентностью микроорганизмов (табл. 2) и ограничением из-за побочных эффектов при больших раневых поверхностях (табл. 3).
Многие местно применяемые антибактериальные препараты имеют достаточно жесткие ограничения для стационарного применения в связи с резистентностью микрофлоры, а также по площади раневой поверхности из-за активного всасывания и токсичности при попадании в системный кровоток [20]. К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран с целью профилактики развития раневой инфекции, можно отнести сульфаниламид, сульфатидин серебра, неомицин с бацитрацином, при риске негоспитальных устойчивых штаммов — мупироцин и фузидовую кислоту. Сульфаниламид не потерял актуальности и характеризуется противомикробным действием по отношению к негоспитальным штаммам грамположительных и грамотрицательных кокков, E. coli, Shigella spp., Vibrio cholerae, Haemophilus influenzae, Clostridium spp., Bacillus anthracis, Corynebacterium diphtheriae, Yersinia pestis, а также Chlamydia spp., Actinomyces spp., Toxoplasma gondii и некоторым другим бактериям при ранах и ожогах, полученных в результате несчастных случаев и в чрезвычайных ситуациях [15–16, 21].
Применяя местные антибактериальные препараты, которые непосредственно контактируют с раной, необходимо учитывать их форму выпуска и состав вспомогательных веществ, соотнося их с фазами раневого процесса.
В первой фазе раневого процесса рекомендуются для местного применения препараты на водорастворимой основе с сульфаниламидом [6]. Сульфаниламид в виде порошка для местного применения (Ранавексим в банке с дозатором) поглощает раневой экссудат, не травмирует ткани раневой поверхности, препятствует развитию микрофлоры в ране и вторичному инфицированию [21, 22]. При использовании лекарственной формы в упаковке с дозатором легко контролируются дозировка лекарственного вещества и равномерность нанесения порошка без контакта с раневой поверхностью, что уменьшает риск побочных эффектов. При глубоких ранениях в полость раны вносят 5–15 г порошка для наружного применения (Ранавексим), при этом максимальная суточная доза для взрослых составляет 15 г, для детей старше 3-х лет — 300 мг, при местном применении в виде порошка (непосредственном нанесении на раневую поверхность) препарат не обладает раздражающим ткани действием [15, 21, 23].
Во второй фазе раневого процесса следует отдавать преимущество формам, не наносящим ущерба грануляциям.
Учитывая мультирезистентность микроорганизмов, в настоящее время эмпирические схемы антибактериальной терапии претерпевают значительные изменения. Давно известные и широко используемые антибиотики остаются, как правило, препаратами выбора лишь для ведения небольших ран в амбулаторных условиях у пациентов с низким риском инфицирования MRSA и другими устойчивыми штаммами. Раны, требующие хирургического лечения в условиях стационара, автоматически переводят пациентов в группу риска, и выбор препарата меняется. При этом антибактериальный спектр применяемого препарата должен включать возможных возбудителей с учетом этиологических и анамнестических характеристик раны.
Заключение
Таким образом, при назначении антибактериальной терапии ран необходимо учитывать этиологию и обстоятельства, при которых было получено повреждение, возможный спектр возбудителей, лечение амбулаторное или стационарное, риск инфицирования резистентной микрофлорой, особенности хирургического лечения раны и фазу раневого процесса. При этом, несмотря на широкое использование местных форм антибактериальных препаратов, в настоящее время отсутствуют четкие стандартизированные подходы относительно фаз раневого процесса. Только местное применение антибактериальных препаратов (например, сульфаниламида в форме порошка для наружного применения — Ранавексима) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги). При глубоких и обширных раневых дефектах после хирургической обработки применяется системная антибактериальная терапия, дополняемая при необходимости местными лекарственными формами.
Влага – это ключевой элемент, который поддерживает жизнь и функционирование всех клеток в организме. Только во влажной среде клетка остается живой, способна делиться и таким образом, происходит заживление раны. Идея влажного заживления ран возникла в 1962 году, когда Джордж Винтер установил, что эпителизация ран ускоряется в два раза во влажной среде по сравнению с заживлением под струпом (под коркой).
Клетки нуждаются в адекватном количестве влаги, чтобы мигрировать от здорового края раны по направлению к ее центру – в процессе миграции клетки делятся, обеспечивая закрытие раны. Клетки не могут мигрировать в сухой ране, в которой затруднены процессы образования новых грануляций, и новые клетки эпителия вынуждены с трудом прокладывать себе дорогу под струпом. Именно поэтому раны, которые подсушивают, будут заживать намного медленнее, чем те, в которых поддерживается адекватный уровень влаги.
Кроме всего прочего, при влажном заживлении в ране поддерживается необходимая температура и снижается вероятность растрескивания и повторного инфицирования.
Чтобы ответить на вопрос "Как лечить трофическую язву?", нужно сначала определиться с выбором повязки, так как это очень важная часть процесса заживления. Ключевая роль и функция повязки для трофической язвы – создавать благоприятную среду, которая будет способствовать ускорению процессов заживления. Наилучшие условия для заживления создают влагоудерживающие повязки, не травмирующие рану. Средства для влажного заживления ран включают губчатые повязки (Биатен, Baitain), альгинаты, гидрогели (Пурилон, Purilon), гидроколлоидные повязки (Комфил Плюс, Comfeel Plus) и прозрачные пленки (Гидрофилм, Hydrofilm).
Необходимо также обращать внимание на поддержание правильной влажности кожи рядом с раной, чтобы избежать ее пересыхания, мацерации или раздражения. Избыток влаги может вызвать мацерацию самой раны и тканей околораневой поверхности. Чтобы избежать таких осложнений используются суперабсорбирующие повязки, обеспечивающие эффективный дренаж раны. Если Вы закрываете такие раны непрозрачной повязкой, которая не позволяет следить за ходом наполнения повязки раневым экссудатом, обязательно используйте защитные кремы, которые формируют барьерную пленку и защищают кожу от мацерации.
Гидроколлоидные покрытия отличаются целым рядом преимуществ в лечении хронических и острых ран:
- Поддерживают оптимальный уровень влажности в ране, необходимый для заживления
- Герметично закрывают рану и надежно защищают ее от проникновения патогенных микроорганизмов и вирусов
- Ускоряют процессы аутолитического (естественного) очищения раны
- Эффект от воздействия таких покрытий на биологические процессы заживления широко изучены в сотнях различных исследований.
Во влажной среде, которую создают гидроколлоидные покрытия, клетки остаются живыми и продолжают вырабатывать факторы роста и цитокины, необходимые для быстрого процесса заживления.
Во влажной среде увеличивается количество фибробластов (клеток соединительной ткани, которые синтезируют коллаген, эластан - вещества, из которых формируются ткани. Таким образом ускоряется процесс образования новых грануляций и образования новых тканей. Гидроколлоидные покрытия (Комфил Плюс) активно применяются для лечения как острых, так и хронических ран – трофических язв, диабетических язв, пролежней, для лечения ожоговых ран и мест взятия трансплантатов.
Как вылечить трофическую язву гидроколлоидными пластырями Комфил Плюс?
1. Убедитесь, что в язве нет гноя и некротических тканей. Иначе используйте для начала лечения салфетки с интенсивным очищающим действием Протеокс-Т, ПАМ-Т или Протеокс-ТМ.
2. Для чистой трофической язвы с умеренной и слабой экссудацией (отделяемой жидкостью) подберите пластырь Комфил Плюс правильного размера - пластырь должен на 2 сантиметра выходить за края раны. Для ран с сильной экссудацией рекомендуем использовать повязки Биатен (Biatain) или Биатен Аг (Biatain Ag) с серебром.
3. Проводит туалет раны только растворами слабых антисептиков, не повреждающих здоровые клетки (хлоргексидин, мирамистин). Не используйте перекись водорода.
4. Накладывайте пластыри Комфил Плюс согласно инструкции и меняйте один раз в 2-5 дней в зависимости от степени экссудации.
5. После полной эпителизации язвы не спешите отказываться от дальнейшего использования пластырей Комфил Плюс - носите повязки еще некоторое время с целью защитить молодую ткань от механических повреждений, пересыхания и растрескивания.
Для цитирования: Чадаев А.П., Климиашвили А.Д. Современные методики местного медикаментозного лечения инфицированных ран. РМЖ. 2002;26:1211.
Российский государственный медицинский университет
ГКБ № 4, Москва
Н аложение лекарственных средств на раневую поверхность применялось испокон веков для лечения ран. Но время, разумеется, вносило свои коррективы: менялись взгляды на течение раневого процесса, появлялись новые лекарственные препараты, совершенствовались методы лечения.
Основные принципы деления процесса заживления ран на фазы или стадии течения были разработаны И.Г. Руфановым (1954), С.С. Гирголавом (1956), R. Ross (1968), В.И. Стручковым (1975) и М.И. Кузиным (1990). По современным представлениям, определяющим патогенетическую направленность лечебных мероприятий, раневой процесс разделяют на 3 фазы: воспаления, регенерации и реорганизации рубца с эпителизацией. В фазе воспаления вначале преобладают сосудистые реакции, характеризующие механизм воспаления, а затем происходит очищение раны от погибших тканей. Вторая фаза связана с образованием грануляционной ткани. Реорганизация рубца и эпителизация являются основными компонентами, завершающими течение раневого процесса.
Принцип подбора лекарственных средств и применения методов лечения, эффективных в той или иной фазе раневого процесса, практически отработан и традиционно не пересматривается в течение длительного времени. Медикаментозные средства используют в зависимости от конкретной фазы течения раневого процесса. Лекарственные средства, применяемые в фазе воспаления, должны оказывать антимикробный, дегидратирующий и некролитический эффекты. Препараты, используемые в фазах регенерации и реорганизации рубца с эпителизацией, должны обладать иными свойствами: стимулировать регенеративные процессы, способствуя росту грануляций и ускорению эпителизации, защищать грануляционную ткань от вторичной инфекции и подавлять рост вегетирующей в ране микрофлоры.
Совершенствование местного лечения направлено в основном на применение самых современных эффективных препаратов, и сложность подбора этих препаратов заключается в динамичном и многогранном течении процесса в зависимости от индивидуальных особенностей конкретного пациента.
В последнее время получило развитие новое направление в совершенствовании местного лечения – разработка носителей лекарственных средств. Положительное значение носителей лекарств было обнаружено еще в отношении иммобилизованных на них протеиназ (П.И. Толстых и др., 1985; В.К. Гостищев и др., 1986). На первых этапах внедрения в практику раневых покрытий использовались марлевые салфетки. Впоследствии при лечении различных по своей патогенетической природе ран применялись покрытия с самыми разнообразными фиксирующими материалами: от фильтровальной бумаги до различных многослойных многофункциональных материалов и перевязочных средств (И.А. Ерюхин, 1995; L. Flint, 1996).
Материал и методы
Левомеколь – мазь на водорастворимой основе полиэтиленоксида, содержащая левомицетин и метилурацил. Мазь обладает выраженной осмотической активностью и оказывает антимикробное и противовоспалительное действие. Метилурацил – пиримидиновое производное, стимулирует рост и размножение клеток за счет активации обменных процессов и, в частности, нуклеинового обмена. Изготовленный в виде 10% мази на жировой основе, препарат оказывает противовоспалительное действие, ускоряет заживление ран, не повреждая грануляций, но не обладает прямой противомикробной активностью. В фазе воспаления раневого процесса мы применяли левомеколь, а по мере формирования грануляций, то есть в фазе регенерации, заменяли ее 10% метилурациловой мазью.
Лечение проведено больным при открытом течении гнойных ран после вскрытия и хирургической обработки разнообразных заболеваний мягких тканей или вялотекущих гнойных процессов, так как главной задачей исследования являлось выяснение воздействия препаратов на раневой процесс независимо от причин их возникновения (табл. 2).
Результаты и обсуждение
Результаты лечения ран оценивали по клинической эффективности местного применения препаратов. В комплекс клинической оценки эффективности лечения были включены следующие параметры:
- сроки очищения ран;
- время появления грануляций;
- время появления эпителизации;
- индекс Поповой (СЗР) в процентном выражении.
Планиметрию раны для оценки скорости ее заживления проводили с помощью нанесения контуров раны на миллиметровую бумагу до начала лечения, а далее на 5, 7, 9, 11 и 15 дни в зависимости от объективных и субъективных факторов. Скорость заживления раны (СЗР) или индекс Поповой, выраженный в процентах, рассчитывали следующим образом:
ИП = (S – Sn) x 100/S x t
При этом S – величина площади раны при предшествующем измерении, Sn – величина площади раны в настоящий момент, t – число дней между первым и последующим измерением.
Результаты сравнительной оценки эффективности местного лечения гнойных ран при вторичном их заживлении в основной и контрольной группах представлены в табл. 3.
Хронические раны, зачастую не имеющие тенденции к самостоятельному заживлению, являются серьезной проблемой системы здравоохранения всех стран в целом и сильно беспокоят пациентов. Лечение хронических ран представляет собой сложную задачу, большую роль в нем играют топические препараты. Лекарственные средства на основе соединений серебра показали высокую эффективность при лечении хронических ран, по данным клинических исследований. Сульфатиазол серебра в качестве местного лекарственного средства обладает рядом преимуществ при лечении хронических ран и является одним из средств выбора в лечении данной патологии.
Сульфатиазол серебра (Аргосульфан ® ) способствует поддержанию влажной среды в ране, что часто является важным критерием при выборе топического лекарственного средства для лечения хронических ран. Препарат характеризуется комбинированным продолжительным противомикробным действием благодаря сочетанию сульфатиазола и серебра, а также постепенному высвобождению ионов серебра из препарата в рану. Препарат показал высокую эффективность при лечении хронических ран. Все это в сочетании с низкой частотой развития нежелательных реакций делает сульфатиазол серебра (Аргосульфан ® ) незаменимым средством в лечении данной патологии.
Ключевые слова: лечение хронических ран, топические препараты, соединения серебра, сульфатиазол серебра,
Аргосульфан ® .
Для цитирования: Родин А.В., Голуб А.В., Привольнев В.В. Топическое применение сульфатиазола серебра в лечении хронических ран. РМЖ. Медицинское обозрение. 2018;26(12):19-23.
A.V. Rodin, A.V. Golub, V.V. Privolnev
Smolensk State Medical University
Chronic wounds, often without a tendency to self-healing, are a serious problem of the health care system of all countries that worries patients. Treatment of chronic wounds is a difficult task — topical drugs play a significant role in it. Drugs based on silver compounds have shown high efficacy in the treatment of chronic wounds according to clinical studies. Sulfathiazole silver as a local drug has several advantages in the treatment of chronic wounds, which makes this drug one of the chosen in the treatment of this pathology.
Sulfathiazole silver (Argosulfan ® ) helps to maintain a moist environment in a wound, which is often an important criterion when choosing a topical drug for the treatment of chronic wounds. A combined long-term antimicrobial effect characterizes the drug due to a combination of sulfathiazole and silver, as well as the gradual release of silver ions from the agent into the wound. The drug has shown high efficacy in the treatment of chronic wounds. All this, combined with the low incidence of adverse effects, makes sulfathiazole silver (Argosulfan ® ) an indispensable agent in the treatment of this pathology.
Key words: treatment of chronic wounds, topical agents, silver compounds, sulfathiazole silver, Argosulfan ® .
For citation: Rodin A.V., Golub A.V., Privolnev V.V. Topical administration of sulfathiazole silver in the treatment of chronic wounds // RMJ. Medical Review. 2018. № 12. P. 19–23.
В статье рассмотрено топическое применение сульфатиазола серебра в лечении хронических ран. Показано, что сульфатиазол серебра в качестве местного лекарственного средства обладает рядом преимуществ при лечении хронических ран и является одним из средств выбора в лечении данной патологии.
Введение
Хроническая рана (ХР) — это рана, которая существует более 4 нед. (по некоторым данным, более 3 мес.) и не имеет тенденции к заживлению (за исключением обширных гранулирующих ран после ожогов) [1, 2]. Вероятные причины нарушения заживления раны могут быть разделены на местные и системные. К местным причинам относятся:
нарушение артериального кровотока;
нарушение венозного оттока;
повторная травма;
локальная инфекция;
локальное нарушение иннервации;
наличие в ране инородных тел, несъемных протезов;
малигнизация хронической раны/язвы;
значительное постоянное натяжение кожных краев.
Системными факторами, способствующими формированию ХР, являются:
пожилой возраст;
иммунодефицитные состояния;
наличие васкулита;
развитие кахексии;
полинейропатия;
онкологический процесс;
нарушения углеводного обмена;
коллагенозы и другие системные заболевания [1].
Общая характеристика ХР
ХР характеризуется наличием некротической ткани, отсутствием формирующейся грануляционной ткани и спонтанной эпителизации, наличием локальной инфекции и признаками нарушения местного кровоснабжения [1].
Трудноизлечимые ХР, такие как диабетическая язва нижних конечностей, пролежни, трофические венозные и артериальные язвы, длительно незаживающие послеоперационные раны, являются серьезной проблемой не только для пациента, но и для систем здравоохранения разных стран. По некоторым оценкам, на лечение ХР в США тратится 25 млрд долларов ежегодно [3, 4].
Для ХР характерно формирование биопленок. Образующиеся биопленки, способствующие размножению микроорганизмов и нарушающие процессы заживления ран, играют важную роль в патогенезе нарушений репарации [5].
Клиническое исследование 50 случаев ХР у взрослых пациентов показало, что биопленки развиваются в 60% ХР по сравнению с 6% наблюдений острых ран [6]. Кроме того, Wolcott et al. (2016) идентифицировали Pseudomonas aeruginosa как доминирующие штаммы микроорганизмов, образующие биопленки в ХР [5]. Формирующиеся биопленки замедляют течение раневого процесса и удлиняют фазу воспаления. Помимо синегнойной палочки, в микробиоме ХР часто встречаются S. aureus и S. epidermidis. В ряде случаев могут высеваться анаэробы, такие как Fingelodia, Prevotella, Peptoniphilus, Peptostreptococcus, и Anaerococcus [5]. Во многих случаях в ране присутствует смешанная микрофлора. Ряд исследователей указывают на присутствие грибов, которые высеваются при микробиологическом исследовании ХР [7].
Принципы ведения пациентов с ХР
По отношению к ХР может быть рекомендована следующая тактика:
вторичная хирургическая обработка с выполнением некрэктомии при необходимости;
адекватное дренирование;
ведение раны с влажной средой;
использование оптимальных антисептиков, отказ от цитотоксических средств;
использование современных перевязочных средств согласно стадиям раневого процесса;
транспорт в рану необходимых веществ при помощи мазей и перевязочного материала;
использование дополнительных средств с доказанной эффективностью для лечения ран [1, 8–10].
Значительную роль в лечении ХР играет применение топических антимикробных средств.
Выбор топических антимикробных средств для лечения ХР

Многие топические противомикробные препараты в настоящее время считаются важным компонентом лечения ран [11, 12].
Местные лекарственные средства для лечения ран можно разделить на 6 основных групп (рис. 1) [13].
Многие антисептики обладают широким спектром противомикробной активности. Вопросы об использовании антисептиков на открытых ранах, положительном и отрицательном их влиянии на заживление ран по-прежнему
остаются дискутабельными. Одним из основных преимуществ антисептиков является то, что практически никогда не образуются резистентные к ним штаммы микроорганизмов, что делает их выбор предпочтительным. Однако некоторые антисептики in vitro цитотоксичны как для микроорганизмов, так и для клеток хозяина [14]. Одними из наиболее эффективных топических антимикробных лекарственных средств являются препараты серебра [15].
Общая характеристика препаратов серебра
Серебро оказывает антимикробное действие, находясь в ионизированной форме, что требует влажной среды. Ионизированное серебро может атаковать по меньшей мере 3 клеточных компонента: клеточные мембраны, цитоплазматические органеллы и ДНК. Ввиду многокомпонентного механизма действия резистентность микроорганизмов к препаратам серебра развивается крайне редко [14]. Помимо противомикробного действия, препараты серебра характеризуются локальной противовоспалительной активностью, механизм развития которой до конца не изучен [16].
В современных лекарственных средствах и перевязочных материалах серебро может сочетаться с альгинатами, пенами, гидрогелями, гидрофибрами и может использоваться в качестве покрытия на сетчатых структурах. Это позволяет высвобождаться ионам постепенно во влажной среде, а также не допускает чрезмерной экссудации и тем самым предотвращает мацерацию кожных покровов [14].
Применение препаратов серебра для местного лечения ХР

Лекарственные средства, содержащие соединения серебра, широко применяются при лечении ран и раневой инфекции [17]. Значительное количество исследований эффективности препаратов серебра посвящено местному лечению ХР (табл. 1).
Приведенные данные доказывают эффективность топических препаратов серебра при лечении ХР.
Сульфатиазол серебра как топическое антимикробное лекарственное средство
Заключение
Лечение ХР представляет собой сложную задачу и должно быть комплексным. Значительную роль в этом играют топические средства. При наличии критической микробной колонизации в ХР показано местное применение противомикробных лекарственных препаратов.
Идеальное антимикробное средство для местного лечения ран должно обладать следующими характеристиками:
иметь противомикробную активность в отношении широкого спектра микроорганизмов;
сохранять противомикробную активность относительно биопленок;
быть устойчивым к воздействию органических соединений;
иметь способность к проникновению в глубжележащие ткани, в т. ч. через некротическую ткань и струп;
обладать минимальной системной абсорбцией;
не вызывать формирования микробной резистентности;
обладать хорошей местной и системной переносимостью;
поддерживать положительную динамику заживления ран путем препятствования распространению воспаления;
ускорять заживление ран (с достижением желаемых косметических и функциональных результатов);
быть простым в применении;
иметь невысокую стоимость [36].
Сульфатиазол серебра обладает всеми вышеперечисленными свойствами. Кроме того, сульфатиазол серебра (Аргосульфан ® ) способствует поддержанию влажной среды в ране, что часто является важным критерием при выборе топического лекарственного средства для лечения ХР. Препарат характеризуется комбинированным продолжительным противомикробным действием благодаря сочетанию сульфатиазола и серебра, а также постепенному высвобождению ионов серебра из препарата в рану. С учетом высокой частоты формирования биопленок в ХР применение сульфатиазола серебра в этих ситуациях также является оправданным. Препарат показал высокую эффективность при лечении ХР. Все это в сочетании с низкой частотой развития нежелательных реакций делает сульфатиазол серебра (Аргосульфан ® ) незаменимым средством в лечении данной патологии.
Читайте также:

