Днк геномные вирусы герпеса
Обновлено: 25.04.2024
Цель работы — продолжение анализа формальных характеристик герпесвирусных ДНК, а также сопоставление их с плотностью ДНК-микрогомологий вирус/хозяин и с геномной макроструктурой герпесвирусов.
Материалы и методы. Проанализированы по 20 штаммов и изолятов каждого из пяти типов вирусов герпеса человека (HHV1, HHV2, HHV3, HHV4, HHV5), 10 штаммов HHV8, 5 штаммов HHV6A, 4 штамма HHV6B и 3 штамма HHV7. Для определения частоты тетрануклеотидов использовали инструменты GenBank, а для сравнения — фрагменты ДНК человека размером с ДНК герпесвирусов.
Результаты. Минимальная концентрация CTAG в ДНК герпесвирусов в основном характерна для двух- и односегментных геномов с прямыми или инвертированными концевыми повторами (классов A, D и E), тогда как минимальная плотность TCGA — главным образом для значительно менее структурированной ДНК (классов B, C и F). По нарастанию плотности CTAG геномы герпесвирусов человека образуют последовательность, близкую к последовательности 20 нт-гомологий ДНК герпесвирус/человек, организованной по нарастанию плотности, что также коррелирует с макроструктурой ДНК. Параллель этой минимизации со структурой ДНК вирусов герпеса или с их принадлежностью к тому или иному подсемейству в литературе не отмечена. Хотя герпесвирусные ДНК довольно велики (125–295 Кб), некоторые из них (например, ДНК HHV4, HHV5 и HHV7) демонстрируют заметные отклонения от второго правила четности ДНК и, таким образом, могут служить компонентом вирусных молекулярных сигнатур.
В Обсуждении предлагаются возможные гипотезы происхождения некоторых из отмеченных явлений.
Ключевые слова
Введение
Герпесвирусы семейства Herpesviridae, включая HHV, делятся на три подсемейства: альфа-HV. бета-HV и гамма-HV [1]. Другой классификацией HV является классификация по макроструктуре ДНК (рис. 1). Она не совсем совпадает с делением на подсемейства и, в соответствии с общепринятыми взглядами [2], образует 6 классов — от A до F.

Рис. 1. Основные макроструктурные классы ДНК HHV (пропорции длин геномных фрагментов произвольны). TR1 — мономерные терминальные повторы (одиночные прямоугольники); TR2 — тандемные повторы (с нефиксированным числом повторов); TR0 — терминальных повторов нет. Группа BC[F] ДНК HHV выделена серым цветом.
Fig. 1. Basic macrostructural classes of HHV DNA (the proportions of the lengths of the genome fragments are arbitrary). TR1 — monomeric terminal repeats (single rectangles), TR2 — tandem organized repeats (non-fixed number of repeats), TR0 — no terminal repeats. BC[F] group of the HHV DNA (see text) is highlighted in gray.
Сегменты и концевые повторы ДНК класса F не структурированы, хотя иногда они просто не показаны в GenBank. Существуют герпесвирусные ДНК с более экзотической макроструктурой (например, скутавирусы), но их очень немного. Данные, полученные нами в предлагаемой работе, позволили нам объединить классы A, D и E в одну группу (сегменты ДНК, ограниченные мономерными концевыми повторами), а B, C и F — в другую (отсутствие макроструктуры или нефиксированное число тандемно организованных коротких концевых повторов).
Ранее мы заметили, что молекулы ДНК гер- песвируса и его хозяина содержат короткие (20-29 нт) идентичные последовательности — микрогомологии, концентрация которых не случайна и, как мы полагаем, объясняется длительными (в эволюционном масштабе) близкими межгеномными отношениями между партнерами [3]. Позже [4, 5] мы обнаружили, что такие микрогомологии имеют характерные особенности распределения в геноме герпесвируса, концентрируясь в основном в его концевых (прямых или инвертированных) повторах, особенно в тех областях TR, в которых нет генов. Самое интересное — это последовательность видов HHV по нарастанию плотности геномных микрогомологий вирус/хозяин, которая согласуется с макроструктурой ДНК: меньшая плотность — в двухсегментных ДНК, большая — в несегментированных. В качестве рабочей гипотезы мы предположили, что двухсегментные вирусные геномы, у которых терминальные повторы взаимно инвертированы, склонны в латентном состоянии замыкаться, скорее, на себя (подобно эписомам) и меньше взаимодействовать с хозяйской ДНК, в то время как односегментные, имеющие прямые повторы, могут вытягиваться вдоль хозяйской ДНК, что облегчает межгеномное взаимодействие.
В качестве подхода для анализа мы использовали сравнение частот нуклеотидов в молекулах ДНК и второе правило четности ДНК Чаргаффа, CPR2 [6], которое становится наглядным в ДНК размером более 100 000 нт [7, 8]. CPR2 формулируется так же, как первое (CPR1), но относится только к одной цепи ДНК. Оно имеет приблизительную точность, которая увеличивается по мере удлинения анализируемой цепи. Оно относится не только к моно-, но и к олигонуклеотидам до 10-15 нт — с уменьшением строгости по мере удлинения анализируемого олигонуклеотида [7, 9]. В метагеномике часто используется тетрануклеотидный анализ для формирования молекулярных сигнатур [10]. Частота тетрануклеотидов (TN) в геномах герпесвирусов достоверно соответствует CPR2 и обеспечивает более детальную характеристику ДНК, чем моно-, ди- и тринуклеотиды [7, 11]. В принципе, симметрии TN генома HHV были описаны ранее [12], но они только подтвердили соответствие CPR2. Наш подход обнаруживает другие необычные свойства этих геномов.
Цель настоящей работы — продолжение анализа формальных характеристик герпесвирусных ДНК, а также сопоставление их с плотностью ДНК-микрогомологий вирус/хозяин и с геномной макроструктурой герпесвирусов.
Материалы и методы
Мы проанализировали около 90% нуклеотидных последовательностей полноразмерных молекул вирусной ДНК каждого рода всех трех семейств герпесвирусов позвоночных и беспозвоночных, содержащихся в GenBank. Проанализировав по 20 штаммов и изолятов каждого из 5 типов HHV (HHV1, HHV2, HHV3, HHV4, HHV5), 10 штаммов
HHV8, 5 штаммов HHV6A, 4 штамма HHV6B и 3 штамма HHV7, мы убедились в практической идентичности внутривидовых результатов и поэтому приводим в таблицах данные только по ДНК рефе- ренс-штаммов каждого вида герпесвирусов.
Для сравнения использовали ДНК человека длиной 1,5 мегануклеотида (5 фрагментов по 300 000 нт каждый):
- фрагмент Chr 03 163229646-163529646;
- фрагмент Chr 05 29372672-29672672;
- фрагмент Chr 14 64016329-64316329;
- фрагмент Chr 21 15306102-15606102;
- фрагмент Chr 21 33931862-34231862.
Для определения частоты TN мы использовали инструменты GenBank.
Результаты
Мы проанализировали TN-состав полностью секвенированных ДНК практически всех герпес- вирусов отряда Herpes virales, содержащихся в GenBank. Класс ДНК, т.е. преобладание G + C или A + T в одной из ее цепей, не дает слишком много в этом отношении, разделяя HHV на две группы по классам:
- класс АТ — HHV3 (альфа) и HHV6A, 6В, 7 (бета);
- класс GC — HHV1,2 (альфа), 5 (бета) и 4,8 (гамма).
Вместе с тем динуклеотидный анализ хорошо иллюстрирует CPR2 [8], по которому A ≈ T, C ≈ G, С + Т ≈ А + Г и С + А ≈ Т + Г для одной нити ДНК. Это определяется размером герпесвирусных ДНК — 125-295 Кб.
Таблица 1. Профиль идентичных (октет A) и неидентичных (октеты BI и B2) тетрамеров, содержащих 4TNT 8 типов HHV (референс-штаммы), выраженный в процентах от общего числа результатов по октетам А и В раздельо
Table 1. Profile of identical (octet A) and non-identical (octets B1 and B2) tetramers containing four different nucleotides (4ТN) of eight types of HHV (reference strains), expressed as a percentage of the total number of the octets A and B separately

Примечание. Жирными буквами обозначены тетрамеры CTAG и димеры CpG в обсуждаемых в тексте тетрамерах (соответствующие ячейки обоих октетов выделены серым цветом).
Note. Bold letters are tetramers CTAG and dimers CpG in the tetramers discussed in text (corresponding cells of the both octets are highlighted in gray).

Рис. 2. Частота (%) CTAG среди 4TN октета А в ДНК герпесвирусов человека. HHV4 и HHV8 (классы ДНК BC[F]) отмечены серым. В прямоугольнике — четыре HhV класса DE.
Fig. 2. Frequency (%) of CTAG among other 4TNs of the octet A in human herpesvirus DNA. HHV4 and HHV8 (BC[F] DNA classes) are marked in gray. In the rectangle there are four HHVs of DE classes.
Колонки чисел, относящихся к ДНК каждого вируса, представляют собой TN-профили ДНК, и они — в случае HHV4, 8 и 7 — демонстрируют определенное сходство с профилем ДНК человека. В некоторых случаях (HHV4, 5, 7) представленные попарно TN октетов BI и В2 демонстрируют характерные отклонения от CPR2, которые, вероятно, связаны с недостаточными размерами ДНК этих вирусов или с недостаточным числом штаммов в GenBank, которое не обеспечивает достоверность соответствующих данных. Позитивная сторона таких отклонений заключается в том, что они могут быть использованы в качестве компонентов молекулярных сигнатур этих вирусов.
Таблица 2. Обобщенная версия данных о ДНК HHV (семейство Herpesviridae)
Table 2. A generalized version of the data on the human herpesviruses DNA (family Herpesviridae)

Примечание. Не-CTAGmin ДНК выделены курсивом (CpG — жирным курсивом). HHV, в ДНК которых CpG>GpC, выделены серым цветом.
Note. Non-CTAGmin DNAs are highlighted in italics (CpG — in bold italics). HHVs in the DNA with CpG>GpC are highlighted in gray.
Далее мы провели TN-анализ полностью секвенированных ДНК почти всех других видов вирусов суперсемейства Herpesvirales (табл. 3).
Table 3. A generalized version of the data on the DNA of animal herpesviruses (families Herpesviridae, Alloherpesviridae and Malacoherpesviridae)

Окончание табл. 3 / End of Table 3

Note. Gray cells — BC [F] class DNA and "minimal" non-CTAG TN. Asterix in D* denotes the unusual macrostructure of the Testudinid HV3 DNA, in which two approximately equal segments bounded by terminal repeats are separated by a short unique sequence.
Термодинамическая модель CTAG в составе РНК показывает, что этот тетрамер нарушает оптимальную структуру стволовых петель молекулы, которые контролируют экспрессию генов, увеличивая их свободную энергию. Авторы этой гипотезы [15] предположили также, что общий предок Salmonella и Escherichia имел значительно более высокую плотность CTAG, но эволюционное вырождение привело к замене CTAG у его потомков, и эта тенденция в настоящее время сохраняется. В серии генов и в межгенных пространствах у Escherichia и Salmonella это вырождение выразилось в эволюционной замене CTAG, в первую очередь на CTGG.
В этом отношении наиболее уместно сравнить филогенетически родственные (одного рода) розеоловирусы человека HHV6 и HHV7. В ДНК обоих вирусов — по сравнению с другими вирусами герпеса — частоты CTAG и CTGG наиболее различны. Сравнение показывает, что если в HHV7 (NC_001716) отношение частот CTAG:CTGG составляет 530:301 соответственно, то в HHV6A (NC_001664) оно даже противоположное и составляет 303:391 — при близких размерах ДНК обоих вирусов. Если наблюдение Le Tang с соавт. [16] в какой-то мере применимо и к обсуждаемым герпес-вирусам, то HHV7, очевидно, ближе к эволюционному предшественнику обоих розеоловирусов, чем HHV6, в котором многие CTAG были заменены на CTGG. В то же время HHV6 приобрел способность интегрировать свой геном в геном хозяина, что, как правило, не является обязательным условием для более тесных отношений с ДНК хозяина [17], о чем свидетельствует сходство профиля TN HHV7 (но не HHV6) и ДНК человека (рис. 3), а также более высокий уровень ДНК-микрогомологии вирус/хозяин в HHV7, чем в HHV6, или более низкий уровень такой микрогомологии у мардивирусов с выраженными теломерными островками в концевых повторах сегментов ДНК [5, 18].

Рис. 3. 4TN-профиль ДНК HHV6A и HHV7 по сравнению с профилем 4TN ДНК человека.
Октет А: ДНК человека выделена серым, вирусная ДНК — черным. Октет B: график B1 ДНК человека выделен светло-серым, B2 — темно-серым; график B1 ДНК вируса выделен жирным черным, B2 — тонким черным.
Fig. 3. 4TN profile of HHV6A and HHV7 DNA compared to human DNA 4TN profile.
Octet A: human DNA is highlighted in gray, viral DNA — in black. Octet B: human B1 is highlighted in light gray, human B2 is highlighted in dark gray, virus B1 is highlighted in bold black, B2 — in thin black.
На рис. 3 дополнительно показаны некоторые особенности проанализированных профилей 4TN вирусных ДНК. В соответствии с CPR2 сходство между В1 и В2 в ДНК человека намного больше, чем в ДНК вирусов, поскольку фрагменты ДНК человека имеют здесь длину 300 Кб, а геномы HHV намного короче. В HHV7 различия между B1 и B2 достаточно характерны и могут использоваться в качестве элемента молекулярной сигнатуры ДНК этого вируса (то же относится к профилю 4TN HHV4; рис. 4). Тот факт, что GenBank представляет полные (почти полные) последовательности ДНК только трех штаммов HHV7, позволяет применять статистические методы для подтверждения представленных здесь данных с большими оговорками. По этой причине мы не использовали здесь эти методы, отметив, что сегодня это лишь похоже на факт.
На рис. 4 приведено сравнение 4TN-профиля ДНК другой пары вирусов — HHV1 и HHV4. В случае HHV1 низкое содержание CTAG позволяет вирусу вызывать острую продуктивную инфекцию и накапливаться в клетках входных ворот (в тех же фибробластах), а затем переходить в нейроны, где он будет оставаться на всю жизнь — в частности, из-за ингибирующего действия эпигенетических механизмов хозяина, одним из которых является метилирование вирусной ДНК. Концентрация динуклеотидов CpG в геноме HHV1 существенно превышает среднее значение (табл. 1).

Рис. 4. 4TN-профиль HHV1 и HHV4 ДНК по сравнению с профилем 4TN ДНК человека.
Октет А: ДНК человека выделена серым, вирусная ДНК — черным. Октет B: график B1 ДНК человека выделен светло-серым, B2 — темно-серым; график B1 ДНК вируса выделен жирным черным, B2 — тонким черным.
Fig. 4. 4TN profile of HHV1 and HHV4 DNA compared to human DNA 4TN profile.
Octet A: human DNA is highlighted in gray, viral DNA — in black. Octet B: human B1 is highlighted in light gray, human B2 is highlighted in dark gray, virus B1 is highlighted in bold black, B2 — in thin black.
Низкие уровни CTAG могут играть роль в обострении латентных инфекций. В случае HHV4 первичная литическая инфекция не характеризуется высоким уровнем вирусных синтезов, а после перехода в хроническую фазу она также регулируется эпигенетическими инструментами, включая метилирование цитозина в составе CpG [18, 19]. В то же время очевидная близость 4TN-профилей генома HHV4 и хозяина указывает на сходную реакцию на эти регулирующие инструменты. То же самое можно сказать о HHV8 и эпигенетической регуляции его генов [19, 20]. Из многих эпигенетических механизмов, которые модифицируют экспрессию генов вируса и хозяина, мы рассматриваем здесь только метилирование ДНК, точнее, метилирование цитозина в CpG, поскольку этот димер является частью тетрамера TCGA, что позволяет сравнивать его с другим тетрамером, CTAG, в предложенном здесь аспекте.
Причины пониженного содержания CpG неоднократно обсуждались и прежде [25], однако вопрос заключается не столько в низкой плотности CpG, сколько в контексте этой пары, т.е. в составе TCGA, поскольку этот тетрамер представлен в герпесвирусных ДНК в значительно меньшей концентрации, нежели ACGT.
Данные Le Tang и соавт. [16] показывают, что само по себе минимальное содержание CTAG (и TCGA) не ограничивается герпесвирусной ДНК.
В первом приближении для анализа плотности потенциально метилируемого цитозина в геномах герпесвирусов достаточно оценить соотношение CpG:GpC (т.е. проанализировать динуклеотидный профиль ДНК), которое не связано с типом генома (AT или GC). Эту оценку можно проследить в табл. 2: ДНК HHV с CpG>GpC (в серых ячейках). В этом случае результаты, представленные здесь, будут касаться только концентрации и соотношения CTAG/CpG в герпесвирусных ДНК, которые могут влиять на уровень вирусных синтезов. В наиболее общем (не строгом) виде это соотношение имеет зеркальный характер: наиболее низкая концентрация CTAG сопровождается самой высокой концентрацией CpG (табл. 1). Тем не менее соотношение CTAG/CpG обедняет получаемую информацию, которая указывает на различие именно в TN-профиле герпесвирусных ДНК, CTAG/TCGA. Другими словами, составляющей этого отношения является TCGA/ACGT, четко выраженное в рамках классов DE/A/BC[F] (табл. 1). В свою очередь, это указывает на необходимость учитывать контекст, который определяет функциональную ценность димера CpG. Возможно, этот контекст выходит за рамки тетрамера. Для надежных выводов необходимо расширить исследования за рамки герпесвирусов — при серьезном пополнении GenBank новыми полными последовательностями вирусных ДНК. Но в любом случае результаты, продемонстрированные здесь, указывают на то, что биологический смысл макроструктуры герпесвирусной ДНК гораздо глубже, чем принято считать.
Список литературы
1. Whitley R., Kimberlin D., Prober C. Pathogenesis and disease. In: Arvin A., Campadelli-Fiume G., Mocarsky E., Moore P.S., Roizman B., Whitley R., eds. Human Herpesviruses: Biology, Therapy and Immunoprophylaxis. Chapter 32. Cambridge: Cambridge University Press; 2007.
2. Pellett P., Roizman B. Herpesviridae. In: Knipe D.M., Howley P.M., eds. Fields Virology. Philadelphia: Lippincott Williams & Wilkins; 2013: 1802-2.
Об авторах
к.м.н., д.б.н., в.н.с. лаб. молекулярной биотехнологии
ведущий научный сотрудник
Эпидемиология герпесвирусов. Строение герпесвирусов.
Герпесвирусы могут передаваться от одного поколения хозяев к другому благодаря персистенции, часто латентной инфекции, при которой вирус периодически реактивируется и выделяется из организма. При некоторых герпесвирусных инфекциях выделение вируса может быть фактически непрерывным. Молекулярное филогенетическое изучение подтверждает, что, за небольшими исключениями, каждый вирус является уникальным, потому что он происходит от своего видового хозяина. Латентность позволяет герпесвирусам быть пожизненными даже в очень небольшой изолированной группе хозяев.
Попытки разработать критерии классификации герпесвирусов внутри семейства пока не увенчались успехом. Существующая классификация основана на их естественном паразитизме.
В зависимости от биологических свойств герпесвирусы делятся на 4 подсемейства, 3 из которых имеют названия альфа-, бета-, гаммагерпесвирусы и одно - без названия, объединяющие герпесподобные вирусы.
Подсемейство альфагерпесвирусы включает герпесвирусы 1 и 3 человека, герпесвирус 1 кур и вирус болезни Марека. Большинство альфагерпесвирусов размножаются быстро (цикл репликации меньше 24 ч) и вызывают латентную инфекцию первоначально в сенсорных ганглиях. Подсемейство бетагерпесвирусы представлено цитомегаловирусами многих видов млекопитающих. Прототипным вирусом является герпесвирус человека 5 — цитомегаловирус человека. Вирусы этого подсемейства размножаются медленно (цикл репликации более 28 ч) и вызывают лизис клеток спустя несколько дней. Они могут оставаться латентными в секреторных железах, лимфоретикулярных тканях, почках и других органах. Подсемейство гаммагерпесвирусы представляет лимфотропные вирусы. Прототипом является герпесвирус человека 4 — вирус Эпштейн-Барр. Гаммагерпесвирусы обладают узким хозяинным спектром и находятся латентно в лимфоцитах (лимфома Беркитта и др.), некоторые представители вызывают инфекцию с разрушением клеток эпителия и фибробластоидных клеток.
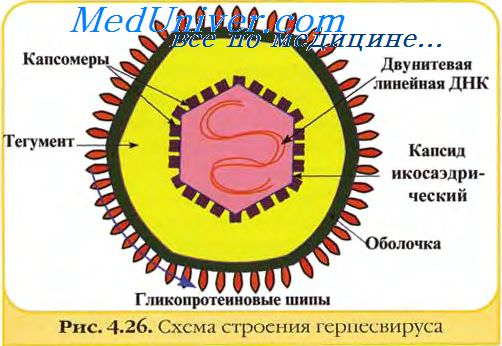
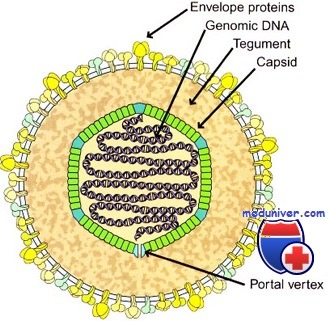
Вирионы герпесвирусов имеют диаметр около 120—150 нм и состоят из 4 структурных компонентов: сердцевины (ядра), содержащей линейную двуцепочечную ДНК размером 125—235 тпн, икосаэдрического нуклеокапсида диаметром 100-110 нм, содержащего 162 капсомера; аморфного материала (тегумент), окружающего капсид и оболочки с небольшими гликопротеиновыми выступами (пепломерами) на поверхности.

Тяжелый гингивостоматит вызванный герпесвирусом
ДНК-геном закручен вокруг волокнистого ядра, имеющего вид катушки, которая прикреплена волокнами к внутренней поверхности окружающего капсида. Вирусный геном в соответствующих экспериментальных условиях обладает инфекционностью.
Сердцевина вириона окружена икосаэдрическим капсидом, содержащим 162 частично полых капсомера (12 пентамеров и 150 гексамеров). Капсомеры высотой 12,5 нм и диаметром 9,5 нм имеют внутренний осевой канал диаметром 4 нм, простирающийся внутрь на половину длинной оси капсомера.
Количество гликопротеинов в оболочке герпесвирусов варьирует. В оболочке вируса простого герпеса их не менее 11. Число копий индивидуальных гликопротеинов может превышать 1000 на вирион. Содержание полипептидов в вири-оне точно не известно и различается у разных герпесвирусов. В общем, оно колеблется в пределах 35—45 полипептидов.
Все герпесвирусы кодируют широкий набор ферментов, связанных с метаболизмом нуклеиновых кислот, синтезом ДНК и процессингом белков. Синтез вирусных ДНК и сборка вирионов происходят в ядре клетки. Капсиды покрываются оболочкой, проходя через мембрану ядра. Образование инфекционного вирусного потомства сопровождается деструкцией зараженных клеток. Вероятно, что некоторые кодируемые вирусом белки играют заметную роль в патогенезе и иммунитете при герпесвирусной инфекции, не являясь необходимыми для репликации вируса в культуре клеток. Считают, что геномы герпесвирусов в латентном состоянии в клетках хозяина существуют в циркулярной эписомальной (экстрахромосомальной) форме.
Репликация герпесвирусов наиболее детально изучена на примере герпесвируса 1 человека (вирус простого герпеса 1). После прикрепления вириона путем связывания пепломерных гликопротеинов оболочки с рецепторами клетки, одним из которых является гепаринсульфатпротеогликан, нуклеокапсид входит в цитоплазму путем слияния оболочки вириона с мембраной клетки путем эндофагоцитоза. Затем ДНК-белковый комплекс освобождается от нуклеокапсида и быстро останавливает синтез макромолекул клетки.
Геном ВПГ-1 (153 тпн) содержит три области инициации-репликации. Он практически кодирует все гены, необходимые для репликации, кроме ДНК-лигазы и топоизомеразы. На первом этапе репликации функционирует ДНК-полимераза а, а затем функционирует вирусная ДНК-полимераза.
Три класса мРНК — а, (3 и 7-транскрибируются последовательно клеточной РНК полимеразой II. Таким образом а (ранние) РНК в последующем функционируют как мРНК и транслируются в а-белки, которые вызывают транскрипцию (3 (ранних) мРНК, трансляция которых приводит к синтезу (3 (ранних) белков и подавляет дальнейшую транскрипцию а мРНК. Затем начинается репликация вирусной ДН К с использованием тех же самых аир протеинов, так же как протеинов клетки. Транскрипционная программа затем возобновляется, и в результате появляются 7 (поздние) мРНК, которые транслируются в 7 протеины. Более 70 белков, кодируемых вирусом, образуются в цикле его репродукции, многие из а и (3 белков являются ферментами и белками, связанными с вирусной ДНК, тогда как 7 белки являются структурными вирионными компонентами. Сложный контроль регуляции экспрессии осуществляется на уровне транскрипции и трансляции. Вирусная ДНК реплицируется в ядре, и вновь синтезированная ДНК упаковывается в преформированные незрелые капсиды. Созревание вирионов связано с вхождением ДНК в нуклеокапсиды и связыванием нуклеокапсидов с измененным внутренним слоем оболочки ядра и последующим обволакиванием вирионов при почковании. Зрелые вирионы накапливаются внутри вакуолей в цитоплазме и освобождаются экзоцитозом или при цитолизе. Вирусспецифические белки обнаружены также в цитоплазматической мембране, где они участвуют в клеточном слиянии и могут в качестве Fc-рецепторов выступать мишенями в иммунном цитолизе. Герпесвирусная инфекция сопровождается образованием внутриядерных телец включений, которые обычно обнаруживают в фиксированных окрашенных препаратах.
Геном вируса кодирует синтез по меньшей мере четырех гликопротеинов (gB, gC, gD, gE). Имеет место посттрансляционное расщепление или другие модификации вирусных белков. Белок gB обладает фузогенной активностью и ответственен за проникновение вируса в клетку; gD — основной протективный антиген.
Белки gC и gE не играют существенной роли в репродукции вируса, но помогают ему ускользнуть от иммунной системы организма. В отсутствие репликации вирус редко вызывает сплавление клеток, а при наличии специфических условий — агглютинацию эритроцитов. Оболочка вириона играет существенную роль в антигенности и инфекционности вируса. Гликопротеины вирусной оболочки ответственны за прикрепление вирусной частицы к клетке, проникновение вируса в клетку, за индукцию нейтрализующих антител и образование иммунитета. Нейтрализующие антитела реагируют с главными вирусными гликопротеинами, находящимися в оболочке вириона. Мембранные антигены, индуцированные в зараженных клетках, содержат по крайней мере три гликопротеина, обнаруженных в структуре вириона. Эти данные послужили основанием для приготовления вакцин из вирусспецифических компонентов. Однократное введение вакцины из субъединиц приводило к активизации гуморальных и клеточных факторов иммунитета у мышей и кроликов, повышало их резистентность к экспериментальному заражению и снижало количество клеток ганглия тройничного нерва, несущих геном вируса.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Герпесвирусы. Виды герпесвирусов. Систематика герпесвирусов.
Герпесвирусы [греч. herpes, ползучее поражение кожи] представлены группой сравнительно крупных ДНК-геномных вирусов диаметром 150-200 нм.
Нуклеокапсид герпесвирусов организован по типу кубической симметрии; геном представлен двухнитевой молекулой ДНК, содержащей короткий (18%) и длинный (82%) компоненты. В отличие от прочих одетых вирусов, суперкапсиды герпесвирусов образованы фрагментами ядерных мембран, так как созревание дочерних популяций происходит на внутренней мембране ядер заражений клетки.
Суперкапсид герпесвирусов пронизывают гликопротеиновые шипы, образованные белками внутренней ядерной мембраны поражённых клеток. Между нуклеокапсидом и суперкапсидом герпесвирусов расположен покровный слой-тегумен [лат. tegumentum, покрытие], толщина которого варьирует у различных вирусов.

Герпесвирусы относительно нестабильны при комнатной температуре, термолабильны и быстро инактивируются растворителями и детергентами.
Герпесвирусы вызывают острые и латентные инфекции, а также обладают определённым онкогенным потенциалом. Доказана роль герпесвирусов в развитии болезней злокачественного роста у животных (например, болезнь Марека у цыплят), а также эпидемиологическая связь с образованием некоторых опухолей у человека. Современная систематика разделяет семейство Herpesviridae на подсемейства Alphaherpesviruses, Betaherpesviruses и Gammaherpesviruses.
• Альфагерпесвирусы проявляют высокую цитопатическую активность и патогенны для большого числа хозяев. Патогенные для человека виды включены в состав родов Simplexvirus (вирусы герпеса 1-го и 2-го типа, вирус В герпеса) и VariceUovims (вирус герпеса 3-го типа).
• Бетагерпесвирусы проявляют менее выраженную цитопатичность и патогенны для более узкого круга хозяев. Патогенные для человека виды включены в состав родов Cytomegalovirus (вирус герпеса 5 типа) и Roseolovirus (вирусы герпеса 6А, 6В и 7 типов).
• Гаммагерпесвирусы также патогенны для небольшой группы хозяев и способны размножаться в лимфоидных клетках. Патогенные для человека виды включены в состав рода Lymphocryptovirus (вирус герпеса 4 типа).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекции вызванные вирусом Эпштейна—Барр, вирусами герпеса типа 6,7,8: клиника, диагностика
Геном вируса Эпштейна—Барр кодирует характерный для него ядерный антигенный комплекс, латентный мембранный белок, терминальный протеин, мембранный антигенный комплекс, ранний и вирусный капсидный антигены.
Эпидемиология и патогенез инфекции вызванной вирусом Эпштейна—Барра. Как и цитомегаловирус, вирус Эпштейна—Барр широко распространён среди маленьких детей развивающихся стран и среди взрослого населения индустриальных стран. Попадая в организм человека через носоглотку, он поражает В-лимфоциты и распространяется по всему организму.
Вирус способен продлевать жизнь В-лимфоцитам, что приводит к развитию неоплазии, например лимфомы Беркитта (мелкоклеточная лимфома с нерассечёнными ядрами, которую регистрируют в Африке, ниже Сахары, в регионах с высокой заболеваемостью малярией), носоглоточной карциномы (распространена в Китае) и лимфомы (у пациентов со сниженным иммунитетом).
Кроме того, возбудитель может стать причиной лимфопролиферативных заболеваний у пациентов после трансплантации.
Клинические признаки инфекции вызванной вирусом Эпштейна—Барра. Основные признаки инфекции — повышение температуры, общее недомогание, боль в горле, лимфаденопатия и иногда гепатит. Длительность заболевания около 2 нед, но у некоторых пациентов наблюдают симптомы персистирующей инфекции. Эпштейна—Барр инфекция ассоциируется с возникновением опухолей.
Диагностика инфекции вызванной вирусом Эпштейна—Барра. Методы: быстрая реакция агглютинации на предметном стекле. Для подтверждения диагноза применяют ИФА (определение специфического IgM к вирусному капсидному антигену) и молекулярно-генетический метод.
Инфекции вызванные вирусами герпеса человека типа 6 и 7
Впервые выделенные в 1980-х годах, эти бета-герпес-вирусы — единственные представители рода Roseolovirus. Выделяют два подтипа ВГЧ-6, поражающих Т-лимфоциты человека, — А и В. Заражение происходит при контакте со слюной инфицированных лиц.
К концу второго года жизни вирус присутствует в организме практически всех людей. Отмечают внезапное возникновение экзантемы (шестая болезнь), лихорадки (в течение 3—5 дней).
Описано течение болезни без возникновения высыпаний. ВГЧ-6 играет большую роль в развитии фебрильных судорог и энцефалита у детей. Последний, наряду с молниеносным гепатитом, — достаточно редкое осложнение. Диагностические мероприятия включают обнаружение IgG с помощью ИФА и молекулярно-генетический метод.
Практически все дети в возрасте до пяти лет заражены ВГЧ-7. До настоящего времени клинические признаки чётко не описаны, но существуют доказательства связи заболевания с развитием энцефалита.
В основе диагностики — определение специфических антител в ИФА (исследование парных сывороток).
Инфекция вызванная вирусом герпеса человека типа 8 - саркомавирусом Капоши
ВГЧ-8 относят к у-герпес-вирусам. Он имеет много общего с вирусом герпеса обезьян. Механизм передачи — вертикальный и контактный. На начальной стадии заболевание протекает в виде мононуклеозоподобного синдрома. Позже у пациентов со сниженным иммунитетом (особенно у ВИЧ-инфицированных) развивается саркома Капоши.
Диагностика: молекулярно-генетический метод (в образцах поражённых тканей), ИФА, реакция непрямой флюоресценции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

