Днк набор вирусы и бактерии
Обновлено: 12.05.2024
Появление методов манипулирования генетическим материалом ознаменовало собой настоящую революцию в биологии, биотехнологии и медицине. Направленное вмешательство в геном живых организмов позволило решать широкий спектр задач, начиная от создания модифицированных видов бактерий, растений и животных, обладающих новыми ценными свойствами, и клеточных моделей, необходимых для создания новых лекарств, до разработки методов генотерапии, открывающей перспективы исправления врожденных генетических нарушений
Открытие ферментов рестрикции и ДНК-лигаз в 1960—1970-х гг. стало толчком к появлению генетической инженерии: с помощью этих ферментов оказалось возможным расщеплять ДНК на заданные фрагменты и вновь соединять их, формируя новые генетические конструкции. Так получали (и получают сейчас) различные варианты бактериальных и вирусных геномов.
Но специфичности рестриктаз совершенно недостаточно для работы с геномами растений и животных. Такие геномы содержат множество коротких последовательностей нуклеотидов, которые узнаются рестриктазами, поэтому направленное воздействие на один определенный участок становится невозможным. Между тем для решения большого числа важнейших задач биотехнологии и фундаментальной медицины требовались эффективные и точные инструменты для осуществления точечного воздействия на определенные участки ДНК в составах геномов высших организмов, в том числе человека.
Сначала были химеры
Бактериальное ноу-хау
Однако в 2012—2013 гг. в этой области произошел поистине революционный прорыв: был разработан новый метод генетической инженерии CRISPR/Cas, открывший принципиально новые возможности для манипуляций на уровне генома высших организмов (Cong et al., 2013). Этот метод чрезвычайно прост, обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.
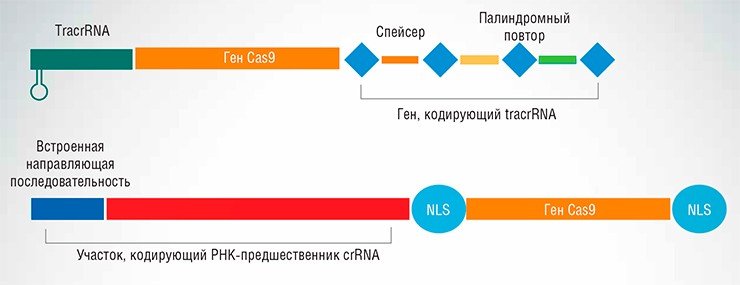
С помощью системы CRISPR/Cas можно осуществлять все виды модификаций генома: вносить точечные мутации, встраивать в определенные места новые гены либо, наоборот, удалять крупные участки нуклеотидных последовательностей, исправлять или заменять отдельные генетические элементы и фрагменты генов.
Технологически стратегия геномной инженерии с помощью системы CRISPR/Cas включает в себя следующие этапы: выбор целевой последовательности и определение вида необходимого воздействия; создание ген-направленной конструкции и доставка ее в клеточное ядро; анализ участка генома, подвергнутого воздействию.
Настоящее и будущее
Благодаря своей простоте, эффективности и широким возможностям система CRISPR/Cas за короткое время уже нашла применение в самых различных областях фундаментальной и прикладной биологии, биотехнологии и медицины.
Внося модификации в различные элементы генома клеток животных и растений и изучая последствия, ученые получают возможность исследовать роль отдельных генов в функционировании отдельных клеток и всего организма в целом. С помощью системы CRISPR/Cas уже получен ряд мутантных лабораторных животных (мышей, крыс, лягушек, рыб). Все эти модельные организмы открывают новые перспективы для исследований в области биологии развития, иммунологии и изучения заболеваний человека и животных.
Уникальная способность комплекса системы CRISPR/Cas избирательно связываться с определенными участками ДНК позволила разработать на ее основе регуляторы активности генов. Для этого в систему включают каталитически неактивный мутантный белок Cas9, к которому могут быть присоединены белки, активирующие или подавляющие функции промоторов, управляющих работой генов. При связывании такого комплекса с целевой ДНК может подавляться либо стимулироваться работа целевого гена.
Более того, при использовании системы CRISPR/Cas возможно одновременно вводить в клетки несколько генетических конструкций, направленных на разные участки генома. Это позволяет воздействовать на работу одновременно нескольких генов, чтобы исследовать взаимоотношения между ними и их участие в нормальных и патологических процессах жизнедеятельности. Таким способом можно, например, определить мутации в генах, ответственные за развитие устойчивости раковых опухолей к химиотерапии.
К важнейшим задачам современной биотехнологии и биомедицины, нуждающихся в развитии технологий редактирования геномов, относятся:
• создание растений и животных, обладающих новыми, ценными свойствами и признаками (урожайность, устойчивость к неблагоприятным условиям среды, вредителям и патогенам);
• получение мутантных модельных животных для исследования заболеваний человека;
• разработка методов генотерапии, исправления генетических мутаций в культивируемых стволовых клетках человека;
• создание клеточных моделей для поиска и доклинического исследования новых лекарств
Применение метода CRISPR/Cas в комбинации с клеточными технологиями открывает принципиальную возможность радикального избавления людей от генетических заболеваний, таких как сахарный диабет, хорея Хантингтона, мышечные дистрофии и др. Генетическое вмешательство может быть осуществлено на уровне эмбрионов, получаемых при проведении экстракорпорального оплодотворения, из которых можно вырастить организм, все клетки которого будут иметь модифицированный геном. Препятствием на пути развития таких технологий являются только этические проблемы: вся необходимая техника уже существует и опробована на лабораторных животных. Например, удалось вырастить здоровых мышей из эмбриональных клеток, в которых был скорректирован дефектный ген, ответственный за развитие катаракты. Эти особи дали здоровое потомство (Wu et al., 2013).
Одной из важнейших задач современной биотехнологии является создание новых пород скота, а также сельскохозяйственных культур растений, высокоурожайных и устойчивых к неблагоприятным условиям. Главной целью применения метода CRISPR/Cas в биотехнологии является создание генетически модифицированных животных и посевных растений, которые бы обладали новыми ценными свойствами. С помощью этой системы уже внесены точные модификации в геном пшеницы и табака, получены сорта риса, устойчивые к бактериям Xanthomonas, вызывающие бактериальную гниль, которая наносит большой экономический ущерб сельскому хозяйству (Chen, Gao, 2013).
Еще одним интересным биотехнологическим направлением применения системы CRISPR/Cas является получение линий животных или растений, способных синтезировать белки человека, например, инсулин, необходимый больным сахарным диабетом, или альбумин, использующийся при лечении геморрагического шока, ожогов и цирроза печени. Сейчас альбумин получают из плазмы крови человека – весьма ограниченного источника, однако мировая потребность в этом препарате постоянно растет и сегодня составляет 500 т в год. С помощью методов геномной инженерии ген альбумина человека уже введен в геном риса и крупного рогатого скота (He et al., 2011; Moghaddassi et al., 2014). Такой белок может быть выделен из растительных и животных тканей, где он синтезировался, и после очищения использован для медицинских целей.
Несомненно, в ближайшее время система CRISPR/Cas будет усовершенствована: можно ожидать упрощения белкового каталитического компонента, повышения избирательности действия системы, создания более эффективных средств доставки в разные типы клеток и целые организмы. Уже получены данные, указывающие на то, что на основе системы CRISPR можно создать средства направленного воздействия не только на ДНК, но и на РНК, что откроет новые возможности для регуляции активности генов и борьбы с вирусными инфекциями.
Хотя система редактирования геномов CRISPR/Cas была создана лишь в 2012 г., она уже применяется во многих лабораториях и компаниях развитых стран. Опубликованы сотни результатов исследований с применением этой технологии, описаны десятки успешных экспериментов по редактированию геномов дрожжей, грызунов, насекомых, растений и человеческих клеток.
Несмотря на активное применение этой технологии в крупных мировых научных центрах, в России CRISPR/Cas используют лишь в нескольких исследовательских центрах, в том числе в Новосибирском Академгородке. Сегодня технологии TALENs и CRISPR/Cas используют в лаборатории эпигенетики развития Института цитологии и генетики СО РАН, лаборатории молекулярной и клеточной медицины Института патологии кровообращения им. академика Е. Н. Мешалкина и в лаборатории стволовых клеток Института химической биологии и фундаментальной медицины СО РАН в работах, связанных с внесением мутаций в стволовые клетки человека, в частности, для создания клеточных моделей бокового амиотрофического склероза, болезни Альцгеймера, Паркинсона и синдрома удлиненного интервала QT.
Однако для проведения полномасштабных исследовательских работ с использованием TALENs и CRISPR/Cas необходимо создание консорциума по клеточным технологиям с привлечением ведущих специалистов на базе профильных НИИ РАМН: кардиологии, иммунологии, неврологии, онкологии и др. Создание в Новосибирском Академгородке Центра клеточных технологий может стать инфраструктурной основой для развития новых биомедицинских технологий и высокотехнологичной фармацевтической промышленности – приоритетных направлений развития научно-технического потенциала страны.
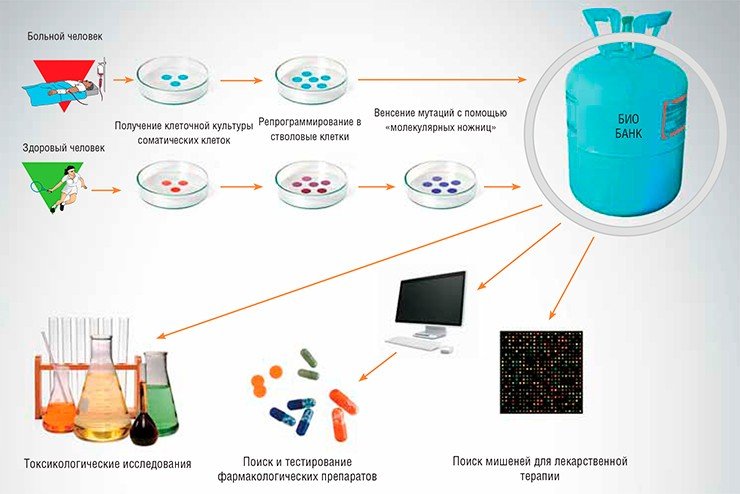
В настоящее время в разработке находится проект Биобанка клеточных моделей заболеваний человека, основой которого станут линии индуцированных плюрипотентных стволовых клеток, полученных из обычных соматических клеток людей, страдающих различными наследственными и приобретенными заболеваниями. Кроме того, в Биобанк войдут клеточные модели наследственных заболеваний человека – клеточные линии, полученные с помощью методов геномной инженерии TALENs и CRISPR/Cas.
Власов В. В. и др. Комплементарные здоровью. Прошлое, настоящее и будущее антисмысловых технологий // НАУКА из первых рук. 2014. № 1 (55). С. 38—50.
Кнорре Д. Г., Власов В. В. // Успехи химии. 1985. T. 54, № 9. С.1420—1447.
Медведев С. П. Как отредактировать наследственность // НАУКА из первых рук. 2014, № 1 (55). С. 10—14.
Сong L., Ran F.A., Cox D. et al. Multiplex genome engineering using CRISPR/Cas systems // Science. 2013, V. 339.
Kim Y.G., Cha J., Chandrasegaran, S. (1996). Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proc Natl Acad Sci U S A 93, 1156—1160.
Moghaddassi S., Eyestone W., Bishop C.E. (2014). TALEN-mediated modification of the bovine genome for large-scale production of human serum albumin. PLoS One 9, e89631.
Schwank, G., Koo, B.K., Sasselli, V. et al. (2013). Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell 13, 653—658.
Wu, Y., Liang, D., Wang, Y., Bai, M. et al. Correction of a genetic disease in mouse via use of CRISPR-Cas9. Cell Stem Cell 13, 659—662.
Появление методов манипулирования генетическим материалом ознаменовало собой настоящую революцию в биологии, биотехнологии и медицине. Направленное вмешательство в геном живых организмов позволило решать широкий спектр задач, начиная от создания модифицированных видов бактерий, растений и животных, обладающих новыми ценными свойствами, и клеточных моделей, необходимых для создания новых лекарств, до разработки методов генотерапии, открывающей перспективы исправления врожденных генетических нарушений
Открытие ферментов рестрикции и ДНК-лигаз в 1960—1970-х гг. стало толчком к появлению генетической инженерии: с помощью этих ферментов оказалось возможным расщеплять ДНК на заданные фрагменты и вновь соединять их, формируя новые генетические конструкции. Так получали (и получают сейчас) различные варианты бактериальных и вирусных геномов.
Но специфичности рестриктаз совершенно недостаточно для работы с геномами растений и животных. Такие геномы содержат множество коротких последовательностей нуклеотидов, которые узнаются рестриктазами, поэтому направленное воздействие на один определенный участок становится невозможным. Между тем для решения большого числа важнейших задач биотехнологии и фундаментальной медицины требовались эффективные и точные инструменты для осуществления точечного воздействия на определенные участки ДНК в составах геномов высших организмов, в том числе человека.
Сначала были химеры
Бактериальное ноу-хау
Однако в 2012—2013 гг. в этой области произошел поистине революционный прорыв: был разработан новый метод генетической инженерии CRISPR/Cas, открывший принципиально новые возможности для манипуляций на уровне генома высших организмов (Cong et al., 2013). Этот метод чрезвычайно прост, обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.

С помощью системы CRISPR/Cas можно осуществлять все виды модификаций генома: вносить точечные мутации, встраивать в определенные места новые гены либо, наоборот, удалять крупные участки нуклеотидных последовательностей, исправлять или заменять отдельные генетические элементы и фрагменты генов.
Технологически стратегия геномной инженерии с помощью системы CRISPR/Cas включает в себя следующие этапы: выбор целевой последовательности и определение вида необходимого воздействия; создание ген-направленной конструкции и доставка ее в клеточное ядро; анализ участка генома, подвергнутого воздействию.
Настоящее и будущее
Благодаря своей простоте, эффективности и широким возможностям система CRISPR/Cas за короткое время уже нашла применение в самых различных областях фундаментальной и прикладной биологии, биотехнологии и медицины.
Внося модификации в различные элементы генома клеток животных и растений и изучая последствия, ученые получают возможность исследовать роль отдельных генов в функционировании отдельных клеток и всего организма в целом. С помощью системы CRISPR/Cas уже получен ряд мутантных лабораторных животных (мышей, крыс, лягушек, рыб). Все эти модельные организмы открывают новые перспективы для исследований в области биологии развития, иммунологии и изучения заболеваний человека и животных.
Уникальная способность комплекса системы CRISPR/Cas избирательно связываться с определенными участками ДНК позволила разработать на ее основе регуляторы активности генов. Для этого в систему включают каталитически неактивный мутантный белок Cas9, к которому могут быть присоединены белки, активирующие или подавляющие функции промоторов, управляющих работой генов. При связывании такого комплекса с целевой ДНК может подавляться либо стимулироваться работа целевого гена.
Более того, при использовании системы CRISPR/Cas возможно одновременно вводить в клетки несколько генетических конструкций, направленных на разные участки генома. Это позволяет воздействовать на работу одновременно нескольких генов, чтобы исследовать взаимоотношения между ними и их участие в нормальных и патологических процессах жизнедеятельности. Таким способом можно, например, определить мутации в генах, ответственные за развитие устойчивости раковых опухолей к химиотерапии.
К важнейшим задачам современной биотехнологии и биомедицины, нуждающихся в развитии технологий редактирования геномов, относятся:
• создание растений и животных, обладающих новыми, ценными свойствами и признаками (урожайность, устойчивость к неблагоприятным условиям среды, вредителям и патогенам);
• получение мутантных модельных животных для исследования заболеваний человека;
• разработка методов генотерапии, исправления генетических мутаций в культивируемых стволовых клетках человека;
• создание клеточных моделей для поиска и доклинического исследования новых лекарств
Применение метода CRISPR/Cas в комбинации с клеточными технологиями открывает принципиальную возможность радикального избавления людей от генетических заболеваний, таких как сахарный диабет, хорея Хантингтона, мышечные дистрофии и др. Генетическое вмешательство может быть осуществлено на уровне эмбрионов, получаемых при проведении экстракорпорального оплодотворения, из которых можно вырастить организм, все клетки которого будут иметь модифицированный геном. Препятствием на пути развития таких технологий являются только этические проблемы: вся необходимая техника уже существует и опробована на лабораторных животных. Например, удалось вырастить здоровых мышей из эмбриональных клеток, в которых был скорректирован дефектный ген, ответственный за развитие катаракты. Эти особи дали здоровое потомство (Wu et al., 2013).
Одной из важнейших задач современной биотехнологии является создание новых пород скота, а также сельскохозяйственных культур растений, высокоурожайных и устойчивых к неблагоприятным условиям. Главной целью применения метода CRISPR/Cas в биотехнологии является создание генетически модифицированных животных и посевных растений, которые бы обладали новыми ценными свойствами. С помощью этой системы уже внесены точные модификации в геном пшеницы и табака, получены сорта риса, устойчивые к бактериям Xanthomonas, вызывающие бактериальную гниль, которая наносит большой экономический ущерб сельскому хозяйству (Chen, Gao, 2013).
Еще одним интересным биотехнологическим направлением применения системы CRISPR/Cas является получение линий животных или растений, способных синтезировать белки человека, например, инсулин, необходимый больным сахарным диабетом, или альбумин, использующийся при лечении геморрагического шока, ожогов и цирроза печени. Сейчас альбумин получают из плазмы крови человека – весьма ограниченного источника, однако мировая потребность в этом препарате постоянно растет и сегодня составляет 500 т в год. С помощью методов геномной инженерии ген альбумина человека уже введен в геном риса и крупного рогатого скота (He et al., 2011; Moghaddassi et al., 2014). Такой белок может быть выделен из растительных и животных тканей, где он синтезировался, и после очищения использован для медицинских целей.
Несомненно, в ближайшее время система CRISPR/Cas будет усовершенствована: можно ожидать упрощения белкового каталитического компонента, повышения избирательности действия системы, создания более эффективных средств доставки в разные типы клеток и целые организмы. Уже получены данные, указывающие на то, что на основе системы CRISPR можно создать средства направленного воздействия не только на ДНК, но и на РНК, что откроет новые возможности для регуляции активности генов и борьбы с вирусными инфекциями.
Хотя система редактирования геномов CRISPR/Cas была создана лишь в 2012 г., она уже применяется во многих лабораториях и компаниях развитых стран. Опубликованы сотни результатов исследований с применением этой технологии, описаны десятки успешных экспериментов по редактированию геномов дрожжей, грызунов, насекомых, растений и человеческих клеток.
Несмотря на активное применение этой технологии в крупных мировых научных центрах, в России CRISPR/Cas используют лишь в нескольких исследовательских центрах, в том числе в Новосибирском Академгородке. Сегодня технологии TALENs и CRISPR/Cas используют в лаборатории эпигенетики развития Института цитологии и генетики СО РАН, лаборатории молекулярной и клеточной медицины Института патологии кровообращения им. академика Е. Н. Мешалкина и в лаборатории стволовых клеток Института химической биологии и фундаментальной медицины СО РАН в работах, связанных с внесением мутаций в стволовые клетки человека, в частности, для создания клеточных моделей бокового амиотрофического склероза, болезни Альцгеймера, Паркинсона и синдрома удлиненного интервала QT.
Однако для проведения полномасштабных исследовательских работ с использованием TALENs и CRISPR/Cas необходимо создание консорциума по клеточным технологиям с привлечением ведущих специалистов на базе профильных НИИ РАМН: кардиологии, иммунологии, неврологии, онкологии и др. Создание в Новосибирском Академгородке Центра клеточных технологий может стать инфраструктурной основой для развития новых биомедицинских технологий и высокотехнологичной фармацевтической промышленности – приоритетных направлений развития научно-технического потенциала страны.
В настоящее время в разработке находится проект Биобанка клеточных моделей заболеваний человека, основой которого станут линии индуцированных плюрипотентных стволовых клеток, полученных из обычных соматических клеток людей, страдающих различными наследственными и приобретенными заболеваниями. Кроме того, в Биобанк войдут клеточные модели наследственных заболеваний человека – клеточные линии, полученные с помощью методов геномной инженерии TALENs и CRISPR/Cas.

Власов В. В. и др. Комплементарные здоровью. Прошлое, настоящее и будущее антисмысловых технологий // НАУКА из первых рук. 2014. № 1 (55). С. 38—50.
Кнорре Д. Г., Власов В. В. // Успехи химии. 1985. T. 54, № 9. С.1420—1447.
Медведев С. П. Как отредактировать наследственность // НАУКА из первых рук. 2014, № 1 (55). С. 10—14.
Сong L., Ran F.A., Cox D. et al. Multiplex genome engineering using CRISPR/Cas systems // Science. 2013, V. 339.
Kim Y.G., Cha J., Chandrasegaran, S. (1996). Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proc Natl Acad Sci U S A 93, 1156—1160.
Moghaddassi S., Eyestone W., Bishop C.E. (2014). TALEN-mediated modification of the bovine genome for large-scale production of human serum albumin. PLoS One 9, e89631.
Schwank, G., Koo, B.K., Sasselli, V. et al. (2013). Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell 13, 653—658.
Wu, Y., Liang, D., Wang, Y., Bai, M. et al. Correction of a genetic disease in mouse via use of CRISPR-Cas9. Cell Stem Cell 13, 659—662.

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Читайте также:

