Дружба вирусов с антителами
Обновлено: 19.04.2024

2. Choi D.H., Katakura Y., Matsuda R., Hayashi Y., Ninomiya K., Shioya S. Simulation model for predicting limit of detection and range of quantitation of competitive enzyme-linked immunosorbent assay // Journal of Bioscience and Bioengineering. – 2007. – Vol. 103, №5. – P. 427-431.
3. Ezan E., Tiberghien C., Dray F. Practical method for optimizing radioimmunoassay detection and precision limits // Clinical Chemistry. – 1991. – Vol. 37, №2. – P. 226-230.
4. Ferreira S.L.C., Bruns R.E., Ferreira H.S., Matos G.D., David J.M., Brandгo G.C., da Silva E.G.P., Portugal L.A., dos Reis P.S., Souza A.S., dos Santos W.N.L. Box-Behnken design: An alternative for the optimization of analytical methods // Analytica Chimica Acta. – 2007. – Vol. 597, №2. – P. 179-186.
5. Ferreira S.L.C., dos Santos W.N.L., Quintella C.M., Neto B.B., Bosque-Sendra J.M. Doehlert matrix: a chemometric tool for analytical chemistry – review // Talanta. – 2004. – Vol. 63, №4. – P. 1061-1067.
6. Friguet B., Chaffotte A.F., Djavadi-Ohaniance L., Goldberg M.E. Measurements of the true affinity constant in solution of antigen-antibody complexes by enzyme-linked immunosorbent assay // Journal of Immunological Methods. – 1985. – Vol. 77, №2. – P. 305-319.
7. Hayashi Y., Matsuda R., Maitani T., Imai K., Nishimura W., Ito K., Maeda M. Precision, Limit of Detection and Range of Quantitation in Competitive ELISA // Analytical Chemistry. – 2004. – Vol. 76, №5. – P. 1295-1301.
8. O'Connor T., Gosling J.P. The dependence of radioimmunoassay detection limits on antibody affinity // Journal of Immunological Methods. – 1997. – Vol. 208, №2. – P. 181-189.
9. Rodbard D., Lewald J.E. Computer analysis of radioligand assay and radioimmunoassay // Acta Endocrinologica. – 1970. – Vol. 65(1_Suppl). – P. S79-103.
10. Taylor J., Picelli G., Harrison D.J. An evaluation of the detection limits possible for competitive capillary electrophoretic immunoassays // Electrophoresis. – 2001. – Vol. 22, №17. – P. 3699-3708.
Количество публикаций, в которых представлены экспериментально или теоретически установленные корреляции между характеристиками иммунохимического взаимодействия (KD, ka, kd) и параметрами иммуноанализа, крайне ограничено. В 1970 г. Rodbard и Lewald [9] предложили первый алгоритм для описания радиоиммуноанализа и построения линейных градуировочных зависимостей с целью предсказания пределов обнаружения. Первая теоретическая модель, основанная на законе действующих масс, была предложена для радиоиммуноанализа только в 1991 г. [3]. В дальнейшем корреляцию между характеристиками иммунохимического взаимодействия и иммуноанализа характеризовали для радиоиммуноанализа [8], иммунного капиллярного электрофореза [10], иммуноферментного анализа (ИФА) [2], иммунохроматографического анализа (ИХА) [1].
Choi и соавт. [2] для предсказания параметров конкурентного ИФА (предела обнаружения и рабочего диапазона) комбинировали кинетические и математические модели, предложенные в работе [7], в которой для построения теоретической градуировочной кривой использовали данные об изменениях концентраций комплексов антиген - антитело и антитело - меченый антиген, определяемых с помощью дифференциального уравнения по методу Runge-Kutta. Данная модель, предложенная Hayashi и соавт. [7], позволяет, исходя из кинетических характеристик антител, наблюдаемых в анализе, установить оптимальные условия проведения конкурентного ИФА. Выбор антител для конкурентного ИФА, обеспечивающих низкий порог обнаружения и широкий рабочий диапазон, в большинстве случаев основывают на аффинности. Однако антитела с высокой аффинностью не всегда оптимальны. КА характеризует связывание в равновесном режиме, но реакция антиген-антитело в ходе анализа не всегда достигает равновесия. Поэтому ka становится более важной характеристикой, чем КА, при использовании реакций антиген-антитело в аналитических схемах, ограниченных по времени.
Таким образом, представляется крайне актуальным рост числа сведений о корреляциях между параметрами иммуноаналитических систем и характеристиками реакций, происходящих во время иммуноанализа. На сегодняшний день информация о подобном сравнительном анализе отсутствует как в библиографических базах данных, так и в обзорных публикациях по иммуноаналитическим методам, в том числе вышедших в последние годы. Уточнение физико-химических характеристик взаимодействия вирус-антитело в значительной степени зависит от корректного определения количества эпитопов на поверхности вирусных частиц, способных связываться с антителами. В распоряжении исследователя имеется широкий диапазон методов определения равновесных и кинетических характеристик реакции антиген–антитело. Выбор методического подхода диктуется особенностями изучаемой системы и доступностью инструментария.
Целью исследования являлось определение количественных характеристик взаимодействия вирус-антитело с применением методов иммуноферментного анализа и поверхностного плазмонного резонанса, установление зависимостей между характеристиками иммунохимических взаимодействий и показателей иммуноанатитических систем. В работе изучено взаимодействие поли- и моноклональных антител специфичных к вирусами растений: вирусу крапчатости гвоздики (ВКГ) (carnation mottle virus), Х-вирусу картофеля (ХВК) (potato virus X), вирусу табачной мозаики (ВТМ) (tobacco mosaic virus) и вирусу шарки сливы (ВШС) (plum pox virus).
Материалы и методы
1. Реагенты и оборудование
В работе использовали вирусы растений: ВКГ, ВТМ, ХВК и ВШС, предоставленные кафедрой вирусологии МГУ им. М.В. Ломоносова. Поликлональные антитела (ПАт), специфичные к ВКГ, ВТМ, ХВК, ВШС, получены на кафедре вирусологии МГУ им. М.В. Ломоносова, пять моноклональных антител (МАт) (1А5, 3G4 – против ХВК, 1D5B1, 2H2F6, 2F12E8 – против ВШС) – получены в результате совместной работы с ЦНИИ туберкулеза РАМН.
В лунках микропланшета проводили сорбцию МАт (или ПАт) в течение ночи при 4ºС из 100 мкл раствора в ФБС с концентрацией 1-3 мкг/мл. Микропланшет четырехкратно промывали ФБС-Т, после чего в лунки вносили по 10 мкл растворов вируса (ВШС или ХВК) в ФБС-Т (диапазон концентраций от 10 мкг/мл до 1 нг/мл), инкубировали 1 ч при 37ºС (первая стадия), далее – ПАт (или МАт соответственно) (5 мкг/мл), также инкубируя 1 ч при 37ºС. Затем микропланшет повторно промывали, добавляли по 100 мкл антивидовых антител, конъюгированного с пероксидазой (разведение 1 : 6000 в ФБС-Т), и инкубировали 1 ч при 37ºС. Далее планшет четырехкратно отмывали ФБС-Т и определяли пероксидазную активность связавшейся метки (см. п. 2.4).

,

,
[Ab-Ag]1 – равновесная концентрация комплекса иммобилизованное антитело-вирус;
[Ag] – равновесная концентрация вируса;
[Ab]im – концентрация иммобилизованного антитела;
[ПО] – концентрация добавляемого вируса, равная пределу обнаружения;

,

,
[Ab-Ag]2 – равновесная концентрация комплекса иммобилизованное антитело-вирус-антитело с пероксидазой;
[Ab]2 – концентрация конъюгата антител с пероксидазой.
3. Твердофазный ИФА вирусов растений (конкурентный формат)
Сорбцию вирусов в лунках микропланшетов осуществляли в течение ночи при 4°С из растворов с концентрациями 0,5 или 1,0 мкг/мл. Иммобилизацию проводили из объема 100 мкл ФБС или 50 мМ Na-карбонатного буфера, рН 9,2. После этого микропланшет четырехкратно отмывали ФБС-Т. В лунки микропланшета вносили по 50 мкл растворов вируса (концентрацию варьировали от 10 мкг/мл до 0,1 нг/мл) и антител (в концентрациях, указанных в разделе 3.5) в ФБС-Т. Микропланшет инкубировали 1 ч при +37°С и отмывали. Затем добавляли 100 мкл пероксидазного конъюгата антивидовых антител (разведение 1:6000 в ФБС-Т) и инкубировали 1 ч при 37°С. Далее планшет четырехкратно отмывали ФБС-Т и определяли пероксидазную активность связавшейся метки (см. п. 2.4).
4. Измерение пероксидазной активности
В качестве субстрата ПХ использовали ТМБ (0,4 мМ) в 40 мМ Na-цитратном буфере, рН 4,0, с 3 мМ Н2О2. В лунки микропланшета вносили по 100 мкл субстрата, инкубировали 15 мин в темноте при комнатной температуре, останавливали реакцию добавлением 50 мкл 1 М H2SO4 и измеряли оптическую плотность продуктов ферментативной реакции при длине волны 450 нм (А450).
5. Определение количественных характеристик иммунохимического взаимодействия
Для нахождения равновесной константы ассоциации (Ка) реакции антиген-антитело в растворе использовали модификацию конкурентного ИФА, предложенную в работе В. Friguet и соавт. [6]. Вирусы сорбировали в лунках микропланшета из объема 100 мкл при +4оС в течение ночи из растворов с концентрациями 0,5 или 1,0 мкг/мл в ФБС или в 50 мМ Na-карбонатном буфере, рН 9,2. Микропланшет четырехкратно отмывали ФБС-Т. В лунки вносили по 50 мкл растворов вируса (от 10 мкг/мл до 0,1 нг/мл) и IgG в ФБС-Т. Микропланшет инкубировали 60 мин при +37оС и отмывали, как описано выше. Затем добавляли 100 мкл пероксидазного конъюгата антивидовых антител (разведение 1:6.000 в ФБС-Т) и инкубировали 60 мин при +37°С. Далее планшет четырехкратно отмывали ФБС-Т и определяли пероксидазную активность связавшейся метки (см. п. 2.4).
6. Измерение констант иммунохимических реакций на приборе Biacore X
Результаты и обсуждение
1. Количественная характеристика реакции взаимодействия вирусов растений с антителами в иммуноферментном анализе
Количественные характеристики взаимодействия вирус-антитело являются определяющими для любого иммуноанализа. Для их определения был применен непрямой конкурентный ИФА по методике B. Friguet [6]. Методика позволяет определять равновесную константу реакции антиген – антитело в растворе. Для этого используют меченные ферментом соединения и детектируют по каталитической активности метки образование иммунных комплексов в конкурентной схеме анализа, на основании этих данных рассчитывать количественные характеристики взаимодействия. Предварительно условия анализа оптимизируют таким образом, чтобы исключить сдвиг равновесия в растворе при взаимодействии антител с иммобилизованным антигеном. В силу поливалентности вируса как антигена, обусловленной наличием повторяющихся белковых субъединиц в оболочке, KD следует рассматривать как эффективную величину, характеризующую суммарный вклад во взаимодействие отдельных антигенных детерминант (эпитопов) на поверхности вирусной частицы. Следует учитывать, что агглютинация приводит к отклонению экспериментальных равновесных кривых титрования вирусных частиц антител от теоретических зависимостей.
Предварительно были оптимизированы условия (подбор концентраций реагентов, выбор длительностей стадий), исключающие сдвиг равновесия в растворе при взаимодействии антител с иммобилизованным антигеном. Вирус в лунках микропланшетов сорбировали в следующих концентрациях: ХВК – 0,5 мкг/мл, ВТМ – 1,0 мкг/мл, ВКГ – 0,5 мкг/мл; концентрации антител, примененные в ИФА для этих вирусов, составляли 100, 350 и 100 нг/мл соответственно. Время инкубации смеси антител и вируса, достаточное для насыщения сайтов связывания и установления равновесия, во всех случаях было определено равным 60 минутам. В результате для каждой пары вирус-антитело были получены кривые конкурентного ИФА. На рис. 1 представлен пример конкурентной зависимости для ХВК.

Рис. 1. Концентрационные зависимости связывания ХВК с индивидуальными препаратами поликлональных антител в ИФА по методике Friguet и соавт.
При расчете KA концентрацию вируса представляли как молярную концентрацию вирусных частиц. Из-за поливалентности вируса как антигена KA является эффективной величиной, характеризующей суммарный вклад во взаимодействие отдельных антигенных детерминант (эпитопов). В соответствии с этим KA зависит от количества эпитопов, связанных с антителами в состоянии равновесия. Для всех охарактеризованных пар антитело-вирус были получены два линейных участка кривой связывания (на рис. 2 приведен пример линеаризации для ВКГ). Рассчитанные по данным ИФА эффективные значения KD для вирусной частицы как целого антигена и ПАт составили (линеаризация на участке с избытком вирусных частиц): ВКГ – (0,3-1,0) 10-12 М; ХВК – (2,7-4,7)∙10-12 М; ВТМ – (0,2-1,7)∙10-12 М, разброс значений отражает разные способы линеаризации данных. KA, рассчитанные для второго линейного отрезка (избыток антител), были ниже в среднем на два порядка. По-видимому, высокие значения KA (при избытке вирусных частиц) характерны для бивалентного взаимодействия антител с вирусными частицами. В условиях избытка антител реализуются по преимуществу моновалентные взаимодействия, отличающиеся, как известно, меньшей прочностью. Значения KD, полученные для целой вирусной частицы, близки к KD, измеренным на Biacore X в экспериментальной схеме №1.
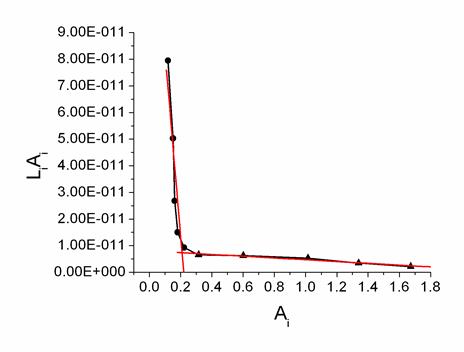
Рис. 2. Линеаризация данных эксперимента по определению методом ИФА константы связывания ВКГ с поликлональными антителами. Расчет Кд проводился по формуле LiAi = Кдх(Ao-Ai), где Li – концентрация антигена (М), Ao – оптическая плотность в отсутствие конкурирующего антигена, Ai – оптическая плотность при концентрации конкурирующего антигена, равной Li
2. Количественная характеристика взаимодействия вирусов растений с антителами методом поверхностного плазмонного резонанса на приборе Biacore X
Для прямого количественного контроля процессов формирования иммунных комплексов применяли регистрацию эффекта поверхностного плазмонного резонанса (ППР) на приборе Biacore (BIAcore X).
Изучение взаимодействия на приборе Biacore X проводили после ковалентной иммобилизации одного из реагентов; механизм иммобилизации во всех случаях основывался на образовании пептидной связи между NH2-группами вируса или антител и СООН-группами модифицированного карбоксиметилированного декстрана на поверхности чипа. Непосредственно перед этапом иммобилизации проводили процедуру преконцентрации, определяя буфер, в котором должен вводиться иммобилизуемый реагент. Иммобилизуемый реагент вводили в буферных растворах с разным значением рН. При использовании 10 мМ цитратного буфера с рН 5,0 получен максимальный сигнал, что свидетельствует об оптимальном балансе зарядов между поверхностью чипа и молекулами антител. Таким образом, обеспечивается необходимое условие для ковалентной иммобилизации – положительно заряженный реагент приближается к отрицательно заряженной поверхности карбоксиметилированного декстранового матрикса.
Для изучения взаимодействия антител с вирусами на приборе Biacore X были использованы две экспериментальные схемы. Первая схема предполагает получение равновесных констант на этапе введения вирусных частиц, после стадии связывания специфических антител с антивидовыми. На рис. 3 приведены концентрационные зависимости взаимодействия ПАт с ВТМ, ХВК и ВКГ. Получены значения равновесной константы (KD) (в расчете на моль вирусных частиц) для ВКГ и ПАт – 1,55∙10-12 М (χ2 = 3,76) и для ВТМ и ПАт – 7,31∙10-12 М (χ2 = 2,47). При этом кинетические константы ассоциации составляли 2,7∙107 (ВКГ) и 7,8∙106 (ВТМ) М-1с-1, диссоциации – 4,2∙10-5 (ВКГ) и 5,7∙10-5 (ВТМ) с-1. Однако схема №1 малоинформативная в условиях плотной посадки антивидовых антител на поверхность чипа (что необходимо для получения регистрируемого сигнала) и больших размеров вирусных частиц. Из-за поливалентного характера взаимодействия с вирусной частицей в этой системе иммобилизованные Fab-фрагменты, антитела и поливалентные структуры на основе антител будут слабо отличаться по аффинности.

Б
Рис. 3. Концентрационные зависимости взаимодействия поликлональных антител против ХВК (в растворе). Кривые 1-5 соответствуют концентрациям ХВК 60, 50, 20, 10, 1 мкг/мл. Все измерения проводились в HEPES-P буфере
Во второй схеме была реализована возможность регулировать уровень взаимодействующих вирусных частиц на поверхности чипа и использовать в каждом цикле вирусы в нативном состоянии – не подвергавшиеся воздействию агрессивных сред. К недостаткам данной схемы следует отнести длительность цикла. Преимущества второй схемы:
- отсутствие влияния эффекта прямой ковалентной иммобилизации вируса на кинетику связывания с препаратами антител;
- уменьшение диффузионных ограничений при взаимодействии антител в растворе;
- возможность контролировать количество иммобилизованного вируса.
Для МАт к ВШС (1D5B1, 2H2F6, 2F12E8) и ХВК (3G4, 1A5) были получены следующие значения Кд (при расчете на моль антител): 1,46∙10-8 M (1D5B1), 1,73∙10-8 M (2H2F6), 5,54∙10-7 M (2F12E8), 1,01∙10-9 M (3G4), 3,09∙10-8 M (1A5). Таким образом, МАт к ХВК и МАт 1D5B1 и 2H2F6 были сходными по аффинности, МАт 2F12E8 характеризовались меньшим сродством к ВШС.
3. Аналитические характеристики иммуноферментной системы на основе взаимодействия вирусов растений с антителами
Для полученных калибровочных кривых конкурентного ИФА вычисляли IC50 (концентрация антигена, вызывающая 50%-ное ингибирование связывания антител) и IC10 (10%-ное ингибирование, рассматриваемое применительно к системам конкурентного ИФА как предел достоверного обнаружения антигена).
На рис. 4 приведены кривые конкурентного формата ИФА для ХВК и антител, специфичных к нему. Как видно, предел обнаружения (IC10) в конкурентном ИФА, полученный для ПАт и МАт к ХВК, отличается не более чем в три раза.

Рис. 4. Градуировочные кривые конкурентного ИФА для ХВК с поли- (1) и моноклональными антителами (1A5 – 2 и 3G4 – 3)

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.

Обзор
Фотография жизнерадостного молотоголового крылана, потенциального переносчика вируса Эбола.
Автор
Редакторы

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Рисунок 1. Информационный плакат о вирусе Эбола.
Геморрагическая лихорадка Эбола — острая вирусная болезнь с высокой заразностью, которая характеризуется развитием тромбогеморрагического синдрома. Он выражается в снижении числа лейкоцитов (белых кровяных тел, частично отвечающих за иммунитет) у больного и, как следствие, — в уменьшении сопротивляемости организма инфекции; а затем и в снижении количества тромбоцитов, что приводит к нарушению свертываемости крови и, нередко, нарушению целостности сосудистой стенки и кровоизлияниям.
Вирус Эболы (рис. 1, 2) вызывает тяжелое заболевание с острым течением, которое обладает близкой к абсолютной летальностью в отсутствие лечения и средней — порядка 60% от всех заболевших — для пациентов, получающих симптоматическое лечение [1]. Распространяясь через физиологические жидкости больных или умерших людей и животных, а также через загрязненные биологическим материалом предметы, болезнь быстро поражает членов одной семьи или деревни после проявления симптомов инфекции. Низкая плотность населения в Африке — один из немногих естественных барьеров для передачи болезни, но представьте только потенциальную активность этого потрясающего патогена в городских условиях развитых стран! Вирус также разносится естественными носителями, обитателями влажных тропических лесов — крыланами (рис. 3), очаровательными летучими мышами, употребляемыми местными жителями в пищу.
Рисунок 2. Схема структуры вируса Эбола с изображением вирусной РНК и относительным расположением участков, кодирующих его элементы.
Рисунок 3. Крылан молотоголовый, естественный носитель вируса Эболы.
На первом этапе, наступающем через 6–10 дней после контакта с зараженным материалом [2], заболевшие (рис. 4) испытывают симптомы, схожие с другими распространенными в тропических странах заболеваниями, такими как малярия, тифоидная лихорадка (брюшной тиф) и менингит. А именно, у больного наблюдаются повышенная утомляемость, слабость, лихорадка с повышением температуры свыше 38 о С и боли в теле. Спустя еще некоторое время проявляются симптомы обыкновенных кишечных инфекций — тошнота, боли в животе, рвота и диарея.
Рисунок 4. Две медсестры около кровати с больным лихорадкой Эбола. Позднее пациент скончался.
Настоящий ад для заболевших начинается примерно через неделю после проявления первых характерных симптомов. До этого момента, без возможности сделать ПЦР-тест, геморрагическую лихорадку Эбола невозможно обнаружить.
Q-ПЦР (или количественная полимеразная цепная реакция ) — метод молекулярной биологии, позволяющий создать копии определенного фрагмента ДНК из исходного образца, повысив его содержание в пробе на несколько порядков. Он применяется с целью увеличения количества РНК вирусных частиц в пробе и их последующего детектирования посредством взаимодействия с флуоресцентным красителем и регистрации излучения оптическими системами.
Через неделю после проявления первых симптомов лихорадки у больных начинается стадия обильных кровотечений. Вирус Эбола вызывает некоторое снижение свертываемости крови, что в условиях жизни африканских народов в естественном ареале распространения инфекции может провоцировать сильные кровотечения в желудочно-кишечном тракте из-за особенностей слизистых оболочек тонкого и толстого кишечника в десяти процентах случаев, а обильное кровотечение из прочих слизистых — практически в каждом втором. Это приводит к наличию крови в рвоте, кашле и стуле, что многократно повышает заразность заболевания [4].
Как же трактовать частоту появления кровоизлияний? С точки зрения чистой статистики, одна десятая численности — небольшое количество, однако это потенциальные три сотни человек при многотысячной вспышке, подобной той, что была последней в ДРК на текущий момент, которые могут истекать кровью на улице, загрязнять предметы зараженной кровью и разносить инфекцию по округе. Слоняясь в умирающих деревнях, они могут неумышленно распространить вирус на людей, остановившихся с целью помочь и облегчить страдания кажущегося раненным измученного африканца. Инкубационный период болезни вполне может позволить таким туристам покинуть очаг эпидемии.
Именно этот обзор привлек внимание и вызвал оправданное беспокойство нескольких групп эпидемиологов, в том числе американских, к опасности заболевания, возбудитель которого был быстро отнесен к первой группе патогенности.
Рисунок 5. Карта распространения вируса Эбола во время вспышки в 2013–2016 годах.
Текущая обстановка в регионах распространения заболевания остается напряженной: вспышка 2018–2019 годов окончилась при поддержке экспериментальных вакцин как на основе модифицированной ДНК, содержащей гены нуклеопротеинов и гликопротеинов вируса Эболы, так и посредством наиболее свежих на тот момент разработок — векторных вакцин на основе рекомбинантных вирусов .
Параллельно с этим больным оказывалась симптоматическая медицинская помощь в полевых госпиталях и предоставление гуманитарной помощи для находящихся на карантине пострадавших стран. К несчастью, испытания и лечение больных сопровождались вооруженными нападениями на госпитали из-за продолжающейся гражданской войны в ДРК, что неоднократно подрывало миссию медиков и поиск эффективного лечения заболевания и тестирования противовирусных препаратов [8].
Что же такое Инмазеб?
Данный трехкомпонентный препарат состоит из натуральных человеческих специфических антител, которые взаимодействует с гликопротеинами вируса Эбола и блокируют его внедрение в клетки человека, что способствует снижению скорости репликации вирусных частиц и уменьшает тяжесть течения заболевания [10]. В сочетании с имеющимися протоколами лечения болезни, вызываемой вирусом Эбола, это значительно увеличивает эффективность терапии.
Антитела — это крупные глобулярные белки плазмы крови, выделяемые плазматическими клетками иммунной системы и предназначенные для нейтрализации клеток патогенов (бактерий, грибов, многоклеточных паразитов) и вирусов, а также белковых ядов и некоторых других чужеродных веществ. Каждое антитело распознает уникальный элемент патогена, отсутствующий в самом организме, — антиген, а в пределах данного антигена — определенный его участок. Связываясь с антигенами на поверхности патогенов, антитела могут либо непосредственно нейтрализовать их, либо привлекать другие компоненты иммунной системы, чтобы уничтожить чужеродные клетки или вирусные частицы.
Для нейтрализации перечисленных выше патогенов организмом вырабатывается смесь антител, направленных на специфическое связывание с инородными веществами, однако в ряде случаев, а именно — при создании медицинских препаратов узкого спектра действия требуется выделить один компонент из настоящего сонма различных белков, продуцируемых клетками иммунной системы с весьма ограниченным сроком жизни.
Рисунок 6. Строение и типы антител с указанием структурно значимых участков.
О потенциально успешном применении моноклональных антител сообщалось во время ранних клинических препарата ZMapp для лечения лихорадки Эбола [16], и хотя его эффективность не была полностью подтверждена, именно усилия создателей данного лекарственного средства и несколько спасенных жизней показали один из возможных путей борьбы с данной инфекцией. Так начались поиски эффективного типа антител для подавления или ослабления вируса с целью облегчения течения болезни и ее лечения.
Впервые препарат REGN-EB3 был применен в качестве экспериментального лечения во время вспышки заирского эболавируса в 2018 году как на взрослых пациентах, так и на детях параллельно с проведением третьей части клинических испытаний препарата [17]. Согласно данным предварительных исследований, рекомендуемая дозировка для каждого компонента препарата составила 50 мг/кг, однако по завершении вспышки и сбора данных рекомендуемая дозировка была поднята до 100 мг/кг. Препарат разводят перед применением и однократно вводят пациенту внутривенно [18].
Научная сторона исследований
Препарат REGN-EB3, состоящий из антител атолтивимаб (REGN3470), мафтивимаб (REGN3479) и одесивимаб (REGN3471), показал высокое сродство к гликопротеинам вируса Эболы как in silico — при моделировании его активности путем молекулярного докинга, — так и in vivo — при испытании на животных и на людях. Данные электронной микроскопии показали, что при одновременном применении трех типов антител, их связывание с гликопротеином происходит на различных участках, что полностью изменяет свойства белка [18].
Антитела группы атолтивимабов и мафтивимабов успешно нейтрализовали псевдовирусные частицы (клетки, снабженные гликопротеинами вируса Эболы) при сравнительно небольших концентрациях в крови, однако применение одного одесивимаба имело несколько меньший эффект, несмотря на его наибольшее сродство к белковой структуре антигена. Одновременное применение препарата, содержащего все три группы антител, показало полную защиту подопытных животных от летального исхода на пятый, восьмой и одиннадцатый день течения болезни в сравнении с контрольной группой, которой препарат не вводили [18], [19]. Последовательное изучение влияния дозировок препарата на эффективность лечения показало, что минимальная эффективная доза в 100 мг/кг является наименьшей для лучшего контроля за симптомами инфекции [19].
В ходе клинических испытаний препарата, проведенных во время вспышки 2018–2019 годов в ДРК, было обнаружено снижение средней летальности с 50 до 27% и уменьшение общей вирулентности патогена в ходе мутаций в естественной среде обитания, что, несомненно, показывает эффективность препарата в лечении заболевания, однако все еще предполагает комбинированную терапию для достижения наилучшего результата с минимальным количеством летальных исходов.
Обнаруженные во время клинических испытаний побочные эффекты от применения препарата REGN-EB3 включали в себя лихорадку, озноб, тахикардию, учащенное дыхание и другие симптомы (рис. 6), характерные для геморрагической лихорадки Эбола средней тяжести. Полное описание свойств и особенностей представлено на странице 177 опубликованного отчета [9].
Дальнейшие планы
Согласно данным Национальной библиотеки медицины США, протокол клинических испытаний NCT03576690 был одобрен к проведению 14 октября 2020 года, и по настоящее время проводится проверка препарата для лечения болезни, вызываемой заирским эболавирусом, в рамках расширенных клинических испытаний. К исследованиям допускаются люди всех возрастов и полов, которые имеют положительный результат ПЦР-теста и не обладают противопоказаниями к применению представленного протокола лечения геморрагической лихорадки Эбола. Также стоит отметить разрешение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США на включение в перечень допущенных до тестирования субъектов беременных женщин, инфицированных вирусом Эбола.
Несмотря на наличие вакцины от болезни, вызываемой вирусом Эбола у многих стран мира, считается, что ей необходимы дополнительные клинические испытания на людях. Параллельно с этим проводятся расширенные клинические исследования препарата моноклональных антител для терапии больных людей. Всё вместе это отражает стремление ученых к созданию не только средств для предотвращения поражения людей этим смертельно опасным вирусом, но и способов лечения для лиц в зоне риска, а именно — жителей Западной Африки, находящихся далеко от пунктов медицинской помощи. Создание единого комплекса мер по противодействию лихорадке Эбола может стать одним из ключей, необходимых жителям африканских республик для дальнейшего развития в неблагоприятных условиях жизни.
Добиться ответа

Чувствительность и специфичность — основные характеристики систем, уточнил директор центра Genetico Артур Исаев.

Случаи, когда у переболевшего есть антитела только к участкам S-белка или только к частям N-белка, скорее исключения из правила. Обычно, если человек встретился с коронавирусом, у него появляются антитела к его разным участкам.
Тесту — время
Даже если человек перенес COVID-19, антитела к моменту тестирования могли уже исчезнуть. Поэтому существует примерный промежуток времени, когда рекомендуют сдавать анализ. Впрочем, даже его соблюдение полностью не гарантирует правильного результата. Слишком индивидуальна реакция организма на COVID-19.

В России открылось производство комплектов для отбора биоматериала в соответствии с рекомендациями Минздрава и ВОЗ
Однако некоторые специалисты уверены, что этот анализ непоказателен.
Антитело не для тела
Не все антитела к SARS-CoV-2 могут нейтрализовать вирус, также обратили внимание специалисты.
— Например, нуклеокапсидные защитить не способны. Они направлены против внутренней структуры вируса и не могут помешать его проникновению в клетку, — сообщил Артур Исаев. — Зато антитела к участку S-белка, так называемому RBD-антигену, как раз защищают от вторжения SARS-CoV-2. Впрочем, не стоит забывать о Т-клеточном иммунитете — он тоже защищает организм.
Читайте также:

