Экспериментальные модели токсического гепатита
Обновлено: 24.04.2024
Экспериментальные модели токсического гепатита вызывали внутрижелудочным и интраперитонеальным введением раствора тетрахлорметана. Для оценки тяжести поражения печени были применены биохимический и морфологический методы исследования. На основании полученных данных на обеих моделях подтвержден токсический гепатит. Наиболее тяжелые поражения печени возникают при интраперитонеальном введении тетрахлорметана. Внутрижелудочное введение тетрахлорметана позволяет снизить уровень летальности (до 10 %), избежать нарушения целостности кожных покровов и уменьшить проявление болевого синдрома у животных.
Ключевые слова
Об авторах
Список литературы
1. Журавлева Л. В. Сравнительная характеристика гепатопротекторных средств - ключ к рациональному применению / Л. В. Журавлева, Е. М. Кривоносова // Современная гастроэнтерология. - 2013. - № 4 (72). - С. 93-101.
2. Кучерявый Ю. А. Гепатопротекторы : рациональные аспекты применения : пособие для врачей / Ю. А. Кучерявый, С. В. Морозов. - М. : ФортеПринт , 2012. - 36 с.
3. Руководство по проведению доклинических исследований лекарственных средств / Под ред. А. Н. Миронова. - М. : Гриф и К, 2012. - Ч. 1. - 944 с.
4. Bigoniya P. A comprehensive review of different liver toxicants used in experimental pharmacology / P. Bigoniya, C. S. Singh, A. Shukla // Int. J. Pharm. Sci. and Drug Res. - 2009. - Vol. 1 (3). - P. 125-135.
5. Патоморфоз и современная эволюция профессиональных и производственно обусловленных заболеваний / И. О. Маринкин, Е. Л. Потеряева, Л. А. Шпагина, А. Я. Поляков // Медицина труда и промышленная экология. - 2010. - № 8. - С. 1-6.
6. Особенности распределения хондроитинсульфатов и коллагена в области триад и центральных вен в зависимости от морфологических изменений в печени при персистенции бактериальной инфекции / И. П. Жураковский, М. Г. Пустоветова, С. А. Архипов, Т. А. Кунц, М. В. Битхаева, И. О. Маринкин // Кубанский научный медицинский вестник. - 2011. - № 4. - С. 79-83.
7. Активация митохондриального пути апоптоза гепатоцитов при персистенции бактериальной инфекции / И. П. Жураковский, С. А. Архипов, М. Г. Пустоветова, Т. А. Кунц, М. В. Битхаева, И. О. Маринкин // Забайкальский медицинский вестник. - 2011. - № 2. - С. 125-131.
8. Особенности развития фиброза печени на фоне формирования синдрома дистрофическидегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе / И. П. Жураковский, С. А. Архипов, М. Г. Пустоветова, Т. А. Кунц, М. В. Битхаева, И. О. Маринкин // Сибирский медицинский журнал (г. Томск). - 2011. - Т. 26, № 3-2. - С. 140-143.

The review focuses on the role of antioxidants of pyrimidine patterns in overcoming hepatotoxicity of persistent organic pollutants. Special attention is paid to oxymethyluracil (5-hydroxy-6-methyluracil). The experimental results of studies on antioxidant properties and hepatoprotective effects of 6-methyluracil derivatives and their complex compounds with succinate, ascorbate, fumarate, glutathione and acetylcysteine using the liver damage models induced by chlorinated hydrocarbons and PCB-containing agents “sovtol-1” and “sovol” have been summarized. According to the intensity of hepatoprotective effects oxymethyluracil does not yield to the hepatoprotector “silimarine” using the models of liver damage caused by tetrachlormethane, PCB-containing agent “sovtol-1” and surpasses it in liver damage models induced by dichloromethane and the combination of “sovtol-1” + ethanol.
Гепатотоксичность – это свойство химических веществ, действуя на организм немеханическим путем, вызывать структурно-функциональные нарушения печени [24,69]. Гепатотоксичностью обладают природные соединения, продуцируемые растениями, грибами, микроорганизмами, минералы, продукты химической и фармацевтической промышленности, отходы этих видов производственной деятельности, однако лишь некоторые из числа перечисленных, к которым порог чувствительности печени существенно ниже чем других органов и систем условно могут быть названы гепатотоксикантами [69,90]. Наиболее важное токсикологическое значение имеют хлорированные углеводороды и полихлорированные бифенилы.
Высокая чувствительность печени к химическим соединениям определяется несколькими обстоятельствами.
Во-первых, печень – это первый орган, стоящий на пути ксенобиотика, резорбировавшегося во внутренние среды организма. Во-вторых, печень – это основной орган, ответственный за метаболизм чужеродных веществ. Поскольку биопревращение ксенобиотика сопряжено с образованием высоко реакционноспособных промежуточных продуктов и инициацией свободнорадикальных процессов, в ходе метаболизма весьма вероятно повреждение органа.
Проведение гигиенических мероприятий позволило существенно оздоровить условия труда на производстве, поэтому случаи острых токсических поражений печени редки. Однако подострое и хроническое поражение печени отмечают достаточно часто [47,90].
Изменения со стороны органа у лиц, подвергшихся воздействию токсиканта, могут быть трудно диагностируемы. Рутинные методы исследования порой оказываются недостаточно чувствительными, чтобы выявить неблагоприятный эффект от длительного действия производственного токсиканта.
В таких случаях патологию логично выявить только с помощью специальных методов диагностики. Поэтому гепатотоксическое действие может развиваться постепенно, в течение нескольких месяцев и даже лет, при этом оставаясь нераспознанным [26].
Клинические проявления токсических поражений печени многообразны – от бессимптомных кратковременных изменений биохимических тестов до длительной желтухи и тяжелой печеночной недостаточности. Литература, посвященная тому вопросу, подтверждает сложность проблемы из-за разнообразия клинического материала [24,88,89], а также из-за взаимосвязанности патологических процессов у одного и того же пациента, особенностей генетического полиморфизма ферментов метаболизма ксенобиотиков и связанных с этим вариантов фармакологического ответа [32,88].
Молекулярной основой генетического полиморфизма является наличие мутантных аллелей генов. В организме человека полиморфными являются гены цитохром-зависимых монооксигенов [СУР 4505]: СУР ½, СУР 2А6, СУР 2С9, СУР2Д6, СУР2Е [26]. Основными осложнениями гепатотоксичности являются: гепатопатии, токсические гепатиты, фиброз и цирроз печени [18,99]. Чаще других встречаются токсические гепатопатии (повышение активности аминотрансфераз, фосфатаз, гипербилирубинемия) [13,41].
Морфологические проявления гепатотоксичности вариабельны и, как правило, характеризуются гепатоцеллюлярными и холестатическими нарушениями [24,26]. Структурными маркерами гепатотоксичности являются центральный (метаболический) и перисинусоидальный фиброз, центролобулярные некрозы, мелкокапельная жировая дистрофия гепатоцитов и интрагепатоцеллюлярный холестаз [13,18]. Различают следующие морфологические варианты поражения печени: некроз гепатоцитов I зоны ацинуса; митохондриальные цитопатии; фиброз; стеатогепатит; поражение сосудов; паренхиматозно-канальцевый холестаз; внутрипротоковый холестаз; склерозирующий холангит [1,13,18]. Механизмы гепатотоксичности галогенированных углеводородов связывают с мембраноповреждающим эффектом, который приводит к расстройству функционирования каскада митохондриальных и микросомальных ферментов, участвующих в поддержании гомеостаза клетки, ее репарации и элиминации ксенобиотиков [7,24,26] (рисунок).
С учетом современной структуры этиологических факторов, инициирующих развитие острых токсических нарушений печени преобладают этанол и лекарственные препараты [38,77]. В то же время, промышленные токсиканты так же являются самыми распространенными факторами токсического поражения печени у людей [26,47]. Наибольшее значение с токсикологической точки зрения имеют хлорированные углеводороды – тетрахлорметан (ТХМ) и дихлорэтан (ДХЭ). [47].
Механизмы гепатотоксичности ТХМ и ДХЭ связывают с прямым ингибирующим влиянием на клеточные мембраны и мультиферментную систему цитохрома Р-450 зависимых монооксигенез, основная функция которой заключается в превращении гидрофобных липофильных молекул в их полярные водорастворимые аналоги. Образующиеся метаболиты превращаются в еще более полярные и легко экскретируемые соединения при участии форменных систем II фазы биотрансформации: глутатион-S-трансферазы, глутатионпероксидазы, сульфотрансферазы, эпоксигидролазы, УДФ – глюкуронилтрансферазы, глутатионредуктазы и др. [7,24,26,58].
При участии цитохрома Р-450 в ходе монооксигенирования ксенобиотиков образуются реактивные метаболиты, реализующие специфические эффекты, в то же время осуществляется выведение токсических продуктов из организма путем реакции конъюгирования.

Принципиальная схема патогенного действия галогенированных углеводородов с учетом свободно-радикального механизма повреждения
На основании этих представлений сформировано положение о том, что подавление монооксигеназ, участвующих в биотрансформации ксенобиотиков снижает их биологическую активность не только за счет индукции резистентности, но и в результате неблагоприятного воздействия на метаболические превращения [1,7,24]. Ингибирование монооксигеназ сопровождается увеличением проявлений их токсического действия [1,7,26]. В результате развивается печеночная недостаточность со снижением детоксицирующей функции печени, что способствует поддержанию в крови высоких концентраций ксенобиотиков и их активированных метаболитов – так формируется порочный круг органных поражений.
Независимо от повреждающего фактора: ТХМ или ДХЭ, одним из первых звеньев цепочки патологических нарушений (токсогенеза) является мембраноповреждающий эффект, который приводит к расстройству функционирования каскада микросомальных и митохондриальных ферментов, участвующих в поддержании гомеостаза клетки, ее репарации и элиминации ксенобиотиков (или их метаболитов) [65].
Следующим этапом становится нарушение энергообразования в клетке, и как следствие, избыточное образование свободных радикалов, что в свою очередь приводит к двум типичным интегральным механизмам повреждения и гибели клеток: гипоксическому и свободнорадикальному некробиозу. Возникший порочный круг не дает возможности гепатоцитам реализовать механизмы естественной цитопротекции [24,41,65]. С точки зрения фармакологической коррекции, весьма существенной помощью для клеток печени являются два основных принципа:
1) восстановление энергетического обеспечения (энергокоррекция).
2) антиоксидантная цитопротекция.
Таким образом, несмотря на различные этиологические факторы при остром токсическом поражении печени, имеет место цитолиз, обусловленный начальными механизмами гипоксического и свободнорадикального некробиоза [65].
Влияние глицирризиновой кислоты на окислительный статус клетки возможен и через регуляцию активности монооксигеназной системы. В литературе имеются данные о вероятности реализации антиоксидантного эффекта тритерпеноидов и на геномном уровне. В частности, показано снижение в гепатоцитах мРНК СУР2Е1 – главного прооксидантного фермента цитохрома Р-450- под влиянием 18β – глицирризиновой кислоты [18]. Принципиальная возможность антиоксидантного действия на геномном уровне недавно установлена нами и для оксиметилурацила [34].
Комплексное соединение оксиметилурацила содержащее сукцинат натрия способствовало восстановлению белоксинтезирующей функции печени благодаря мембраностабилизирующему действию, что доказывается оценкой состояния системы ПОЛ-АОС [63,69,70].
Коррекция (ограничение) гепатотоксичности экотоксикантов антиоксидантами также являются актуальной научной задачей. Арсенал таких средств достаточно широк и представлен природными и синтетическими антиоксидантами [1,10,16,26,32].
Среди последних важное значение приобретают производные пиримидина – синтез, безопасность, доступность и биологическая активность которых определили их широкое применение в медицинской практике. [21,22,23,29,30,71].
В меньшей степени исследованы другие антиоксиданты пиримидиновой структуры – 5-аминоурацил, 5-амино-6-метилурацил, 5-гидрокси-1,3,6-триметилурацил, а также комплексные соединения производных 5-гидрокси-6-метилурацила с полифункциональными карбоновыми кислотами – янтарной, фумаровой, аскорбиновой, лимонной, также проявляющими антиоксидантную активность [22,55,56,63].
В фармакологической коррекции токсических повреждений, вызванных свободнорадикальными процессами, успех в изыскании эффективных антиоксидантов может быть достигнут лишь при условии выяснения характера прооксидантного действия ядов, природы необходимого при этом антиоксидантного воздействия и учета общих механизмов токсичности. Только при таком подходе эти препараты могут быть причислены к истинным средствам патогенетической терапии. Накопленный опыт свидетельствует о чрезвычайной сложности этой проблемы. К химическим веществам, обладающим антиоксидантной активностью, относится огромное число соединений. Механизмы их антиоксидантного действия весьма разнообразны. Часть из них устраняет убыль природных антиоксидантов. Так действуют α-токоферол, тиолы, каротиноиды. Некоторые из них активируют супероксиддисмутазу, стимулируя тем самым перевод высокотоксического супероксидного анионрадикала в менее токсичную перекись водорода. Применение таких антиоксидантов целесообразно при интоксикациях ядами, угнетающими активность супероксиддисмутазы. Другие антиоксиданты осуществляют свой эффект, взаимодействуя с теми или иными активными формами кислорода. Наконец, многочисленные антиоксиданты обладают в той или иной степени комплексообразующими свойствами и, взаимодействуя с микроэлементами, тормозят их биокаталитическое действие, угнетая активность ряда ферментов [8,19,21,31,57,58,59,60].
Антиоксидантные эффекты производных пиримидина при различных формах токсического процесса
Булекбаева Л.Э. 1 Ерлан А.Е. 1 Рыспекова Ш.О. 2 Джусипбекова Б.А. 2 Алпысбаева К.К. 2 Артыкбаева У.С. 2
Статья посвящена исследованию морфологических свойств крови и лимфы, реогепатографии и уровень кровоснабжении сосудов у крыс. При экспериментальном токсическом гепатите у крыс лимфатическая система вовлекается в патологический процесс. Возрастает уровень тромбогенных процессов не только в крови, но и в лимфе. Изменение реогепатографии обуславливаются нарушением оттока в паренхиме, изменением эластичности сосудов печени и развитием артериовенозных шунтов.

2. Забродский П.Ф., Германчук В.Т. Влияние тетрахлорметана на показатели иммунной системы // Бюлл. экспер. биол. и мед. – 2004. – № 1. – С. 56–57.
3. Камалов Ю.Р., Северов М.В., Олейникова Е.Б. Значение ультразвукового исследования вен портальной системы для выявления синдрома портальной гипертензии у больных циррозом печени.// Тез.1-го съезда Ассоциации специалистов ультразвуковой диагностики в медицине. – М., 1991. – С. 96.
4. Клишина И.М. Влияние гомогената трутеновых личинок на уровень белка и нуклеиновых кислот в условиях токсической гепатопатии // Матер. 55-ой регион. конф. по фармации, фармакологии и подготовка кадров. – Пятигорск, 2000. – С. 195–196.
5. Копылова Л.Е., Саркова Е.В., Асташов В.В. Лимфатический регион печени матери и потомства при беременности, осложненной действием экотоксикантов.// Бюлл. СО РАМН. – 2008. – № 5. – С. 38–43.
6. Кунцевич Г.И., Скуба Н.Д., Белолапотко Е.А. Роль комплексного ультразвукового исследования в дифференциальной диагностике очаговых образований печени. Методические рекомендации. – М., 1997. – C. 45.
7. Юрова Е.Г., Асташов В.В., Казаков О.В. Структура брыжеечных лимфатических узлов у крыс с хроническим токсическим гепатитом и в условиях его коррекции лазерным излучением и фитосорбционными комплексами // В кн.: Проблемы экспериментальной клинической и профилактической лимфологии. – Новосибирск, 2002. – С. 389–391.
8. Raom R., Kuman K.V et. al. Влияние фруктозы на активность синтезы оксид азота под действием CCl4 // Indian J. Exp. Biol. – 2001. – V. 39, № 1. – P. 68–69.
9. Zhang J., Zong Ch., Li D., Zhan R. Взаимосвязь между локальной ренин-ангиотензин-альдестероновой системой и фиброзом печени крыс // Word. Chin. J. Dig. – 2002. – V. 10, № 4. – P. 397–400.
У крыс после введения внутрибрюшинно CCl4 (100 мкг/кг) через 24 часа развивался выраженный гепатит. Отмечено снижение активности синтеза оксида азота в эндотелиальных и гладкомышечных клетках кровеносных сосудов [8]. Острое отравление тетрахлорметаном per os крыс в дозе 0,75 ЛД50 через 4 суток вызывало снижение основных гуморальных и клеточных иммунных реакций [2].
При хроническом токсическом гепатите крыс, вызванном введением 4-х хлористого углерода, наблюдалось увеличение паракортикальной зоны в брыжеечных лимфатических узлах, что свидетельствует, по мнению авторов, об усилении иммунного ответа по гуморальному типу [7].
После трехкратного введения 50 % масляного раствора CCl4 через день крысам отмечено снижение в печени нуклеиновых кислот на 16 % и общего белка на 18 % по сравнению с показателями интактных животных [4].
Хроническая интоксикация животных тетрахлорметаном вызывала выраженные дистрофические и воспалительные изменения в печени и в регионарных лимфатических узлах. При беременности у самок и у потомства эти изменения сохранялись, но были выражены меньше. Авторы считают, что в этих условиях у животных лучше сохранялась дренажно-детоксикационная функция лимфатической системы [5]. Радиоиммунным методом установлено увеличение содержания ренина, ангиотензина I и II, альдестерона и активности ангиотензин-конвертирующего фермента при токсическом гепатите, вызванным введением CCl4 крысам [9].
В последние годы среди неинвазивных методов диагностики хронического гепатита и портальной гипертензии важное место отводится ультразвуковым исследованиям [7, 1].
Материалы и методы исследования
Эксперименты проведены на 102 половозрелых белых лабораторных крысах-самцах линии Вистар, массой 180-250 гр. Для создания модели токсического гепатита использовали 50 % масляный раствор четыреххлористого углерода (CCl4), который вводился внутрибрюшинно (0,3 мг/кг) один раз в течение 3 суток через день. Наличие токсического гепатита у крыс было подтверждено гистологическими и биохимическими исследованиями.
Острые опыты проводились на 2 группах крыс: 1-я группа крыс – контрольная (24 интактных крыс) и 2-я группа – это крысы с моделью токсического гепатита (78 крыс) с соблюдением основных принципов Хельсинской конвенции о гуманном отношении к лабораторным животным. Через 15 суток после интоксикации крыс 4-х хлористым углеродом под эфирным наркозом прижизненно регистрировали лимфоток из грудного и кишечного лимфатического сосуда.
Морфологический состав крови у крыс с токсическим гепатитом изучали на гематологическом анализаторе SYSMEXKX-219 (Япония). Время свертывания крови и лимфы определяли по Сухареву, вязкость – на вискозиметре ВК-4, рН – на анализаторе OSMETECHOPTITMССА (США).
Определение морфологического состава лимфы проводили в камере Горяева с сеткой Бюркера. Определяли число лейкоцитов, лейкоцитарную формулу – в сухих мазках лимфы, окрашенных по методу С.П. Романовского. Для изучения гистологических препаратов использовали световой микроскоп Leica – DМ-1000.
Полученный материал обработан на компьютере вариационно-статистическим методом с использованием критерия Стьюдента.
Результаты исследования и их обсуждение
Результаты реогепатографического исследование у крыс контрольных группы представляли собой чередующие систолические волны достаточной амплитуды, с закругленной вершиной и диастолическим подъемом. Скорость быстрого кровенаполнения составляла в контроле 1,02 ± 0,06 Ом/с, скорость медленного кровенаполнения 0,15 ± 0,02 Ом/с. На фоне токсического гепатита наблюдали, что форма кривой характеризовалась появлением заостренной и зазубренной, а в некоторых случаях платообразной вершины.
Результаты исследований на крысах с токсическим гепатитом показали противоречивые данные, в одних случаях наблюдали увеличение амплитуды систолической волны на 65 %.Скорость быстрого кровенаполнения составляла 6,06 ± 0,5 Ом/с, а медленного кровенаполнения – 4,05 ± 0,02 Ом/с. В других случаях наблюдали уменьшение амплитуды диастолической и систолической волны на 45 %, с одновременным уменьшением скорости быстрого кровенаполнения до 0,70 ± 0,02 Ом/с, но возрастала скорость медленного кровенаполнения (рисунок).
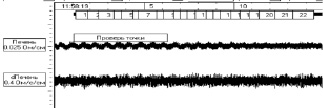
а) реогепатограмма контрольной группыу крыс
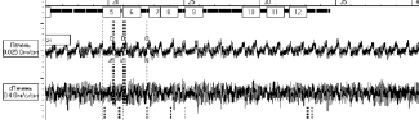
б) реогепатограмма на фоне токсического гепатита у крыс
Кривая реогепатограммы у крыс с контрольной группой и на фоне токсического гепатита
По мнению некоторых авторов, изменение кривой реогепатограммы происходит разнонаправлено, но, в основном, зависит от этиологии заболеваниях [9]. При вирусной этиологии происходит снижение амплитуды систолической волны, при токсическом гепатите происходит обратный эффект т.е. идет увеличение амплитуды систолической волны.
Изучение скорости кровотока методом лазерной ультразвуковой доплерографии у крыс на фоне хронической затравки СCl4 показало, что скорость линейного кровотока в воротной вене снижалась, а в печеночной артерии скорость кровотока повышалась по сравнению с контрольной группой. Пульсационный индекс и индекс периферического сопротивления уменьшались в воротной вене и в печеночной артерии на 25 % .Изменение этих показателей указывает на наличие нарушения гемодинамики печени на фоне токсического гепатита у крыс и начальным формированием проявлений портальной гипертензии (таблица).

В данной статье рассматриваются оценки фармакотерапевтической эффективности
лекарственных средств разных фармакотерапевтических групп на экспериментальной
модели токсического гепатита. Использовался метод двухэтапного фармакологического
скрининга. Основные выводы: из иммуномодуляторов не обнаружено препаратов
ухудшающих состояние печени на фоне токсического гепатита, комбинация эссенциальных
фосфолипидов и глицирризиновой кислоты обладает существенно более значимой
гепатопротективной активностью, в сравнении с эффективностью компонентов этой
комбинации, применённых по отдельности, ряд представителей группы адаптогенов
иммуностимулирующий эффект которых является лишь одним из компонентов их действия,
обладают более выраженной гепатопротективной активностью по сравнению со
специализированными иммуномодуляторами
Ключевые слова
Об авторах
Ахмед Набил Тауки
В Н Федоров
Ярославская государственная медицинская академия
З А Куница
Ярославская государственная медицинская академия
Н А Смирнов
Ярославская государственная медицинская академия
Н В Кочнева
Ярославская государственная медицинская академия
A N Taouk
V N Fiodorov
Z A Kunitsa
N A Smirnov
N V Kotshneva
Список литературы
- Буеверов А.О. Место гепатопротекторов в лечении заболеваний печени / А.О. Буеверов // Болезни органов пищеварения. -2001. - №2. - С.16-18.
- Скворцов В.В. Пероксидация липидов и антиоксидантная система в гепатологии / В.В.Скворцов // Гепатология. - 2003. - №3. - С. 7-13
- Фёдоров В.Н. Биохимические маркеры тяжести воспалительного процесса и хронизации при парентеральных гепатитах / В.Н. Фёдоров, И.Г. Ситников, М.С. Бохонов // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. - 2006. - Т. 16, №1.- С. 40.
- Шахгильдян И.В. Парентеральные вирусные гепатиты (эпидемиология, диагностика, профилактика) / И.В.Шахгильдян, Г.Г. Онищенко, И.М Михайлов. - М.: ГОУ ВУНМЦ МЗ РФ, 2003. - 384 с.
- Ситников И.Г. Фармакотерапевтическая эффективность гепатопротективных лекарственных средств при парентеральных вирусных гепатитах / И.Г. Ситников, А.А. Шошин, В.Н.Фёдоров // Инфекционные болезни. - 2005.- Т.3, №3. - С. 12-17
- Гуськова Т.А. Оценка безопасности лекарственных средств на стадии доклинического изучения / Т.А. Гуськова // Хим.- фармац. журн. - 1990. - №7. - С.10-15
- Блюм Х.Е. Гепатит С: современное состояние проблемы / Х.Е. Блюм // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. - 2005. - № 1. - С. 20- 25.
© Тауки А.Н., Федоров В.Н., Куница З.А., Смирнов Н.А., Кочнева Н.В., Taouk A.N., Fiodorov V.N., Kunitsa Z.A., Smirnov N.A., Kotshneva N.V., 2010
Эта статья доступна по лицензии Creative Commons Attribution 4.0 International License.
Читайте также:

