Энцефалитный менингит у вич инфицированных
Обновлено: 17.04.2024
Менингоэнцефалит - заболевание нейроинфекционной природы, которое протекает с сочетанным поражением мозгового вещества и оболочек.
Основными причинами развития менингоэнцефалита у взрослых являются:
- Попадания возбудителя (вирусов, бактерий, простейших, патогенных грибов) в носоглотку. Заражение происходит воздушно-капельным и алиментарным способами (через загрязненную пищу, воду). Проникновение в головной мозг осуществляется гематогенным путём, в результате чего возникают воспалительные изменения в тканях, приводящие к развитию менингоэнцефалита;
- Укусы насекомых. Трансмиссивный путь передачи является основным для ряда вирусных менингоэнцефалитов и энцефалитов, таких как японский комариный энцефалит, клещевой энцефалит, энцефалит Сент-Луис). При укусе возбудитель проникает в кровоток и заносится в церебральные ткани, таким образом провоцируя заболевание;
- Наличие различных инфекций в организме. Гематогенное распространение бактериальных инфекций осуществляется при наличии туберкулёзных (туберкулезный менингоэнцефалит), сифилитических очагов, гнойных процессов в околоносовых пазухах, челюстно-лицевой области, при хроническом гнойном отите. Вирусный менингоэнцефалит может возникнуть в результате осложнения ОРВИ;
- Черепно-мозговые травмы. Инфицирование контактным путем происходит вследствие открытой травмы с нарушением целостности черепных костей. По статистике, посттравматический менингоэнцефалит наблюдается у 1,5-4% пациентов с черепно-мозговой травмой;
- Вакцинация. Введение живой вакцины при наличии ослабленного иммунитета опасно развитием инфекционного процесса в организме. Проникновение возбудителей происходит через гематоэнцефалический барьер, что приводит к появлению менингоэнцефалита;
- Наличие иммунодефицита;
- Незрелость системы иммунитета.

Менингоэнцефалит: симптомы у взрослых
Клиническая картина состоит из общеинфекционных, менингеальных, очаговых и ликворно-гипертензионных симптомов. Наиболее типичными симптомами являются:
- Повышение температуры тела;
- Общее недомогание;
- Отсутствие аппетита;
- Высыпания на кожных покровах;
- Ликворная гипертензия (сильная головная боль, тошнота, рвота, не приносящая облегчения);
- Расстройство сознания (сонливость\ возбуждение, нарушение ориентации в месте и пространстве, возможно кома);
- Менингеальный синдром (повышенная чувствительность на свет, звук, прикосновениям, гипертонус задних мышц шеи, мышц-сгибателей конечностей, судороги, сильная головная боль);
- Гемипарезы (неполный паралич);
- Сенсомоторная афазия (утрата речи);
- Гиперкинезы (непроизвольные движения);
- Мозжечковый синдром (расстройство координации движения);
- Вестибулярная атаксия (нарушение походки и координации);
- Когнитивные нарушения (снижение умственной деятельности, памяти);
- Глазодвигательные и зрительные расстройства (при поражениях черепно-мозговых нервов) – двоение, косоглазие, ограничение подвижности и т.д.;
- Перекос лица, опущение век;
- Снижение слуха;
- Нарушения глотания;
- Дизартрия (нарушение речевого аппарата).
Менингоэнцефалит: код по МКБ 10
МКБ-10 представляет собой нормативный документ с общепринятой статистической классификацией медицинских диагнозов, которая используется в здравоохранении.
По международной классификации менингоэнцефалит входит в состав следующих кодов:
- G04.2 — Бактериальный менингоэнцефалит и менингомиелит, не классифицированный в других рубриках;
- G05 — Энцефалит, миелит и энцефаломиелит при болезнях, классифицированных в других рубриках. Включены: менингоэнцефалит и менингомиелит.
Гнойный менингоэнцефалит
Гнойный менингоэнцефалит — это нейроинфекционное заболевание, характеризующееся поражением мозговой ткани и всех оболочек головного мозга (твердой, мягкая и паутинная). Клинически заболевание проявляется интоксикационным, общемозговым и менингеальным синдромами. Диагноз верифицируется в результате проведения:
- тщательного неврологического осмотра;
- МРТ/КТ головного мозга;
- исследования ликвора (люмбальная пункция);
- лабораторной диагностики.
Лечение гнойного менингоэнцефалита базируется на проведении этиотропной (антибиотики, антивирусные, противогрибковые, противопаразитарные фармакологические препараты) в комбинации с патогенетической и симптоматической терапиями.
Инфицирование возможно в следующих случаях:
- Попадания возбудителя в носоглотку воздушно-капельным либо алиментарным путем. Возбудитель проникает в полость черепа через кровь, провоцирует воспалительные изменения поражённых тканей, приводящие к развитию гнойного менингоэнцефалита;
- Укуса насекомого. Трансмиссивный путь (через укус) передачи характерен для ряда вирусных менингоэнцефалитов и энцефалитов (японского комариного энцефалита, клещевого энцефалита, энцефалита Сент-Луис);
- Наличия инфекционных заболеваний в организме. При наличии туберкулёзных, сифилитических очагов, хронического гнойного отита, гнойных процессов челюстно-лицевой области, околоносовых пазух существует большая вероятность распространение бактериальной инфекции гематогенным путем. Вирусный менингоэнцефалит может возникнуть как осложнение отдельных ОРВИ;
- Черепно-мозговой травмы. При открытой травме с нарушением целостности костей черепа инфицирование происходит контактным путём;
- Вакцинации. Введение живой вакцины на фоне ослабленного иммунитета может спровоцировать развитие инфекционного процесса. Поствакцинальное осложнение с проникновением возбудителей через гематоэнцефалический барьер приводит к возникновению менингоэнцефалита.
Не всегда при попадании возбудителя в организм человека развивается заболевание. Причинами, способствующими возникновению болезни, считают ослабленное состояние организма, наличие первичного или вторичного иммунодефицита, незрелость системы иммунитета.
На сегодняшний день, врачи-неврологи подразделяют менингоэнцефалит на различные типы по нескольким критериям: этиологии, характеру морфологических изменений и типу течения. По этиологии различают следующие виды энцефалита:
- Вирусный - возбудителями могут стать вирусы гриппа, простого герпеса, кори, бешенства, цитомегаловирус, энтеровирусы. Преобладает серозный характер воспалительных изменений;
- Бактериальный – возбудителями могут стать стрепто-, менинго-, пневмококки, клебсиелла, гемофильная палочка. Воспаление имеет гнойный характер воспалительных изменений;
- Протозойный - встречается крайне редко. Инфекционными агентами являются амебы, токсоплазмы и другие простейшие;
- Грибковый – преимущественно наблюдается у иммунокомпрометированных лиц. Может диагностироваться в рамках нейроСПИДа.
Клиническая картина гнойного менингоэнцефалита характеризуется интоксикационным, ликворно-гипертензионным, менингеальным, очаговым синдромами. Типичными признаками инфекции являются:
- повышение температуры тела;
- недомогание;
- отсутствие аппетита;
- усталость;
- вялость;
- апатия;
- головные боли, миалгия, артралгия.
Не исключено появление высыпаний на кожных покровах. Ликворная гипертензия проявляется как интенсивная головная боль, тошнота, не приносящая облегчение рвотой. Быстро нарастающее повышение внутричерепного давления приводит к снижению уровня сознания, вплоть до комы.
Диагностика менингоэнцефалита
Диагностика пациентов начинается со сбора анамнеза жизни и болезни, врач узнает о текущей или недавно перенесенной инфекционной болезни, наличие в анамнезе черепно-мозговых травм, факта вакцинации, укусов насекомых и т. п. Дальнейшие диагностические манипуляции заключаются в следующем:
- Неврологический осмотр. Выявляются менингеальные симптомы, оценивается состояние сознания пациента, очаговый неврологический статус. Полученные данные будут говорить о том, вовлечены ли в патологический процесс оболочки мозга и вещество;
- Лабораторные исследования. Для бактериального менингоэнцефалита будут характерны лейкоцитоз и ускоренная СОЭ. Также для определения возбудителя проводят посев крови на стерильность и ПЦР-анализ;
- Компьютерная и магнитно-резонансная томография. Позволяют оценить состояние головного мозга, выявить утолщение и уплотнение церебральных оболочек, изменения мозговых тканей. При наличии паразитов, на снимках будут визуализироваться гетерогенные круглые очаги с кольцевидным усилением по периферии;
- Люмбальная пункция. С её помощью исследуется спинномозговая жидкость, которая при гнойном воспалении будет мутной и иметь осадок в виде хлопьев, при серозном поражении — прозрачная, геморрагическом — с примесью крови;
- Стереотаксическая биопсия головного мозга. Позволяет диагностировать паразитарный менингоэнцефалит, исключить злокачественный процесс.
Лечение менингоэнцефалита в Москве
Терапия в Юсуповской больницы проводится наилучшими специалистами, которые применяют комплексный подход в лечении менингоэнцефалита. Лечение проходит в условиях отделения реанимации или интенсивной терапии и включает в себя этиотропные, патогенетические, а также симптоматические компоненты. Средствами, применяемые врачами Юсуповской больницы являются:
- Антибиотики. Чаще всего назначаются цефалоспорины в сочетании с ампициллином. Коррекция терапии ведется с учетом чувствительности выделенной флоры;
- Противовирусные препараты. Антивирусное лечение комбинируется с введением препаратов интерферона;
- Противогрибковые средства. В основном назначают амфотерицин В и флуконазол. При необходимости используют их сочетание;
- Антипаразитарные препараты. Применяются вместе с противогрибковыми средствами или антибиотиками.
В борьбе с церебральным отёком применяют:
- Мочегонные препараты;
- Глюкокортикостероиды.
- Для поддержания жизнедеятельности нейронов используют нейропротекторы и нейрометаболические препараты.
Симптоматическая терапия включает:
- Сердечно-сосудистые препараты;
- Оксигенотерапия;
- Искусственная вентиляция легких;
- Противосудорожные средства;
- Антипиретики;
- Психотропные препараты.
В Юсуповской больницы помимо лечения заболевания, занимаются реабилитацией пациентов, которая направлена на максимально быстрое восстановление нарушенных нервных функций.
Реабилитационные мероприятия включают в себя:
- Массаж;
- Лечебная физкультура;
- Акупунктура.
Медицинский персонал больницы с удовольствие поможет Вам с решением любых вопросов. На сайте Юсуповской больницы Вы можете ознакомиться с ценами на услуги, а также узнать больше о менингоэнцефалите и отзывах пациентов, прошедших курс терапии.
За свое непродолжительное существование Юсуповская больница может похвастаться отменной репутаций, а также огромным количеством благодарных пациентов. Записаться на прием или консультацию Вы можете по телефону.
Грибковый менингит — поражение мягкой и твёрдой мозговых оболочек грибковой инфекцией с развитием воспалительных изменений. Клиническая картина характеризуется подострым/хроническим течением с повышением температуры, головной болью, сонливостью, слабой выраженностью оболочечных симптомов. Диагностировать грибковый менингит позволяет неврологический осмотр, проведение люмбальной пункции, анализ цереброспинальной жидкости, выявление возбудителя в крови и ликворе. Основу лечения составляют противогрибковые фармпрепараты, применяющиеся в качестве монотерапии, комбинированного и антирецидивного лечения.
МКБ-10
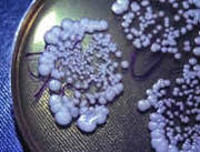
Общие сведения
Грибковый (микотический) менингит – редкая форма инфекционного поражения церебральных оболочек. Патология встречается повсеместно, уровень заболеваемости одинаков для лиц обоих полов. Грибковый менингит поражает преимущественно иммунокомпрометированных пациентов и людей, находящихся в эндемичных зонах распространения возбудителей. Среди больных СПИДом грибковый криптококковый менингит диагностируется в 6-13% случаев. В эндемических областях выявляется большое количество инфицированных грибком, однако лишь у 1% возникает диссеминация возбудителя, которая в 35% случаев сопровождается поражением мозговых оболочек.

Причины грибкового менингита
Возбудителями заболевания являются различные патогенные и условно патогенные грибы. Проникновение в организм осуществляется воздушно-капельным (при вдыхании грибковых спор), алиментарным (при употреблении обсеменённой спорами пищи, воды) путями. Больной человек не является источником инфекции для окружающих. Самыми часто встречающимися возбудителями менингита грибковой этиологии выступают:
- Криптококки. Наиболее распространенный возбудитель — C. Neoformans. Выделяется в окружающую среду с птичьим помётом, присутствует на овощах, фруктах, в почве. Заражение происходит с пищей, при вдыхании частичек пыли со спорами. Подавляющее число случаев заболевания представляют больные СПИДом.
- Кандиды. Относятся к естественной флоре человеческого организма. Вызывают развитие инфекционных заболеваний только на фоне иммунодефицита. Обусловленные этими грибами менингиты составляют 15% всех кандидозных поражений ЦНС.
- Кокцидии. Среди возбудителей кокцидиоза наиболее распространён С. Immitis. Микоз наблюдается в эндемичных регионах США, Южной и Центральной Америки. Поражение оболочек мозга происходит на фоне диссеминированной инфекции чаще у пожилых, беременных, больных с иммунной супрессией.
В группу риска развития микотического менингита любой этиологии попадают лица с иммунодефицитными состояниями: новорожденные, больные ВИЧ-инфекцией, перенёсшие цитостатическую терапию по поводу трансплантации органа, онкозаболевания, пациенты с ХПН, сахарным диабетом, алкоголизмом, заболеваниями крови, лица старше 60 лет.
Патогенез
Попав в организм, возбудитель сталкивается с реакцией защитных иммунологических факторов, препятствующих развитию инфекции. На фоне сниженного иммунного ответа грибковые споры не уничтожаются, током крови разносятся в различные органы и ткани, где происходит развитие возбудителя. Занос спор в оболочки мозга становится возможным в связи с повышенной проницаемостью гематоэнцефалического барьера, в норме обеспечивающего защиту мозговых тканей от проникновения циркулирующих в крови крупных молекул, в том числе различных инфекционных агентов.
Грибковый менингит сопровождается серозным воспалительным процессом. Происходит утолщение, помутнение оболочечных тканей, их поверхность приобретает мелкобугристый характер. Отмечаются петехиальные кровоизлияния. Воспалительный процесс может перейти на церебральное вещество с развитием энцефалита, на оболочки спинного мозга.
Классификация
В практической неврологии применяется разделение микотического поражения оболочек в зависимости от его уточнённой этиологии, особенностей клинического течения. В соответствии с видом возбудителя различают криптококковый, кандидозный, кокцидиозный, гистоплазменный, аспергиллёзный менингит. По течению заболевания грибковый менингит классифицируют на:
- Острый — характерно внезапное появление, быстрое развитие симптоматики. Встречается редко, преимущественно при кандидозной этиологии.
- Подострый — отличается замедленным дебютом с постепенно прогрессирующим нарастанием симптомов. Самый распространённый вариант. Впоследствии может переходить в хроническую форму.
- Хронический — симптоматика наблюдается более 4-х недель. Выраженность клинических проявлений умеренная.
Симптомы грибкового менингита
Начало заболевания обычно подострое (реже – острое), последующее течение хроническое. Основными симптомами становятся интенсивная головная боль (цефалгия), рвота, подъём температуры, анорексия, сонливость. У ряда пациентов цефалгия протекает с повторными, не приносящими облегчения рвотами. Температура тела держится на уровне 37,2-37,9 градусов, иногда достигает фебрильных значений. Отмечается потеря аппетита, возможно отвращение к пище. Больной вялый, много спит, быстро утомляется, выглядит заторможенным. Наблюдается повышенная чувствительность к свету. Возможны судорожные пароксизмы, беспокойство, расстройства сознания, очаговая симптоматика.
Отличительной особенностью является слабая выраженность менингеального синдрома, иногда — его полное отсутствие. Менингеальный симптомокомплекс — типичный признак поражения оболочек, включает напряжённость (ригидность) мышц затылка, специфическую позу больного, общую гиперестезию, тонические феномены, выявляемые в ходе осмотра. При подостром и хроническом течении грибковый менингит может не сопровождаться менингеальными симптомами, что значительно затрудняет диагностику.
Осложнения
В 40% случаев грибковый менингит протекает с внутричерепной гипертензией, усугубляющей цефалгию и вызывающей тошноту, рвоту. При распространении инфекционного процесса на спинальные оболочки возникает корешковый синдром, признаки поражения спинного мозга: периферические и центральные парезы, расстройства чувствительности. Переход инфекционно-воспалительного процесса на церебральные ткани сопровождается развитием очаговой симптоматики, тяжёлых нарушений сознания. Грибковый энцефалит опасен возникновением отёка головного мозга, комы, летальным исходом заболевания.
Диагностика
Диагностические сложности обусловлены стёртой симптоматикой, отсутствием ярко выраженного менингеального синдрома, наличием иммуносупрессии, затрудняющей иммунологическую диагностику заболевания. Постановка диагноза осуществляется с помощью следующих исследований:
- Неврологический осмотр.Невролог обращает внимание на наличие и степень выраженности менингеальной симптоматики, оценивает уровень сознания, выявляет очаговый неврологический дефицит, признаки поражения спинного мозга (если таковые имеются).
- Люмбальная пункция. Позволяет определить ликворное давление, оценить цвет, степень прозрачности ликвора. Последующее исследование цереброспинальной жидкости подтверждает лимфоцитарный плеоцитоз, уровень которого зависит от вида возбудителя, стадии болезни. Микроскопия мазков выявляет наличие нитей гриба в 50% случаев.
- МРТ головного мозга. Необходима для исключения сопутствующих церебральных поражений: туберкулёза, токсоплазмоза. Смешанная грибково-бактериальная, протозойно-грибковая инфекция встречается у иммунокомпрометированных больных.
- Лабораторные анализы. Направлены на верификацию возбудителя, определение его чувствительности к антимикотическим препаратам. Посев крови на стерильность, микробиологическое исследование ликвора позволяют исключить бактериальную этиологию, обнаружить рост грибковых колоний. Иммуноферментный анализ ликвора на наличие антимикотических антител по своей специфичности приближается к 100%, однако при иммунодефицитных состояниях может давать ложноотрицательные результаты.
Дифференциальная диагностика проводится с бактериальным менингитом, туберкулёзным менингитом, вирусным поражением оболочек. В ряде случаев требуется дифференцировка с менингиомой, абсцессом головного мозга, церебральной опухолью.
Лечение грибкового менингита
Основу терапии составляет применение антимикотических фармпрепаратов. До получения результатов определения чувствительности лечение проводится эмпирически, затем — с учётом полученных данных. Используются следующие варианты терапии:
- Монотерапия. Осуществляется путём медленного внутривенного капельного введения. При криптококковой этиологии, жизнеугрожающем кандидозном менингите до получения данных о чувствительности кокцидий показан амфотерицин В. В других случаях хорошо зарекомендовал себя флуконазол. При наличии показаний возможно интратекальное введение препарата посредством люмбальной или вентрикулярной пункции. Фармакотерапия осуществляется длительно (1,5-2,5 мес.) до полной санации ликвора.
- Комбинированное лечение. Проводится амфотерицином в сочетании с флуконазолом, флуцитозином. Данная разновидность терапии считается эффективной у пациентов с криптококковой инфекцией без сопутствующей клиники ВИЧ. Оптимальная комбинация препаратов пока не найдена.
- Противорецидивная терапия. Необходима для профилактики рецидива болезни даже в случае полной санации ликвора от возбудителя. Препаратом выбора выступает флуконазол.
Параллельно проводится симптоматическая терапия. Купирование рвоты достигается применением противорвотных средств, внутричерепное давление снижается мочегонными препаратами, лечение судорожного синдрома проводится антиконвульсантами.
Прогноз и профилактика
До внедрения в медицинскую практику амфотерицина грибковый менингит в 100% случаев приводил к летальному исходу. Сейчас своевременно начатая, правильно подобранная терапия позволяет сохранить пациенту жизнь, добиться его выздоровления. Прогноз болезни зависит от возраста, состояния иммунной системы, своевременности терапии, скорости санации ликвора в ответ на проводимое лечение. Рецидивирующий грибковый менингит наблюдается в 40% случаев. В случае выздоровления возможны остаточные явления в виде стойкого повышения интракраниального давления, эпилепсии, нарушений когнитивной сферы.
У 50% выживших новорожденных отмечается гидроцефалия, у 56% – задержка психического развития, что обусловлено самим заболеванием и токсическим побочным эффектом антимикотиков. Первичные профилактические мероприятия заключаются в осуществлении мер по укреплению иммунитета, предупреждению распространения ВИЧ. Вторичная профилактика сводится к мониторингу санации цереброспинальной жидкости, адекватному противорецидивному лечению.
Что такое Оппортунистические заболевания нервной системы при ВИЧ-инфекции -
Что провоцирует / Причины Оппортунического заболевания нервной системы при ВИЧ-инфекции:
Патогенез (что происходит?) во время Оппортунического заболевания нервной системы при ВИЧ-инфекции:
Симптомы Оппортунического заболевания нервной системы при ВИЧ-инфекции:
При прогрессирующей мультифокальной лейкоэнцефалопатии отмечается клинические проявления многоочагового поражения белого вещества головного мозга в виде гемипарезов и гемигипестезий, гемианопсий, статической и динамической атаксии, которые могут сопровождаться снижением интеллекта, припадками. Симптомы медленно неуклонно прогрессируют до полной обездвиженности больных. Причиной этой энцефалопатии является паповавирус JC, действующий одновременно с ВИЧ. Помимо очагов демиелинизации, патогномонично выявление глиальных клеток с характерными включениями вокруг областей разрушения миелина. Эффективного лечения при этом заболевании нет. Прогноз неблагоприятный, так как максимальная продолжительность жизни после появления первых симптомов не превышает 2 мес.
Церебральный токсоплазмоз является следствием реактивации латентной инфекции мозга внутриклеточным паразитом Toxoplasma gondii. Клиническая картина обусловлена локализацией и активностью воспалительного процесса. Специфичных клинических симптомов этого энцефалита нет. При томографии часто отмечаются множественные билатеральные кольцевые очаги, хотя эти изменения также не являются специфичными.
Точный диагноз может быть поставлен на основе данных о выявлении этого возбудителя различными методами в образцах биопсии. В некоторых случаях диагноз подтверждается косвенно, если состояние больного улучшается после назначения специфических препаратов (пириметамин, сульфадиазин и др.).
Криптококковые менингиты вызываются грибом Cryptococcusneofomans. Этот менингит, как правило, характеризуется выраженным менингеальным и общемозговым синдромами. Диагноз устанавливается при посеве цереброспинальной жидкости на криптококк. У многих больных это заболевание является первым проявлением перехода из стадии латентного вирусоно сительств а в стадию СПИДа. Специфическое лечение (амфотерицин В) приводит к регрессу симптоматики.
Практически не поддаетсялечению тяжелая мультифокальная полирадикулоневропатия, вызываемая цитомегаловирусом . Этот синдром, как правило, сопровождается другими проявлениями инфекции: пневмониями, колитами, ритинитами и др.
Реактивация латентной инфекции, вызванной Micobacteriumtuberculosis, приводит к развитию туберкулезного менингита , абсцессов мозга . Тяжелые диффузные энцефалиты у больных СПИДом могут быть вызваны вирусами , Herpessimplexи Varicellazoster. У 5 % больных СПИДом могут выявляться первичная лимфома ЦНС (преимущественно В-типа, в генезе которой большое значение имеет инфекция вирусом Эпштейна– Барра) и саркома Капоши иногда приводящая к развитию внутримозговых кровоизлияний. Первичная лимфома ЦНС – специфичное для СПИДа проявление. Пролиферируют обычно атипичные лимфоциты. Опухоль распространяется периваскулярно, а клиническая картина зависит от локализации и объема опухоли.
Диагностика Оппортунического заболевания нервной системы при ВИЧ-инфекции:
Диагноз оппортунистической инфекции часто верифицируется только ретроспективно при ответе на специфическую терапию, подозрение может возникать при анализе неспецифических клинических симптомов, данных компьютерной и МР-томографии и основываться на серологических исследованиях или данных биопсии.
Лечение Оппортунического заболевания нервной системы при ВИЧ-инфекции:
Помимо борьбы с непосредственно ретровирусом, проводится специфическое лечение того или иного инфекционного заболевания, развивающегося на фоне иммунодефицита. Активно используются комбинации иммуномодуляторов и противовирусных препаратов. Например, рекомбинантный альфа-интерферон (дозы от 3 000 000 до 54 000 000 МЕ) самостоятельно или в комбинации с ретровиром или винбластином используют при лечении саркомы Капоши. Среди противовирусных средств для лечения оппортунистических вирусных инфекций наиболее эффективным считается ацикловир – аналог пуринового нуклеозида, который после превращения в организме человека в трифосфат ацикловира ингибирует биосинтез ДНК вируса. Вирусная форма фермента тимидинкиназы (точка приложения ацикловира) связывается с препаратом в 1 000 000 раз быстрее, чем фермент человека. Чаще используют внутривенные введения: по 5–10 мг/кг через 8 ч 5–10 дней в зависимости от тяжести поражения. Побочные эффекты достаточно выражены, особенно опасна кристаллурия, наблюдаемая чаще при внутривенном введении, поэтому препарат вводят медленно в течение часа на фоне обильного питья, что следует учитывать при лечении энцефалитов с отеком мозга. Реже используется видарабин – аналог пуринового нуклеозида, который ингибирует ДНК-полимеразу, т.е. этот препарат также эффективен только против ДНК-содержащих вирусов. Используется преимущественно внутривенный способ введения в течение 12 ч. При использовании видарабина возможны следующие побочные реакции: паркинсоноподобный тремор, атаксия, миоклонии, галлюцинации и дезориентация, при увеличении дозы возможна панцитопения. Противовирусные препараты в тяжелых случаях сочетают с плазмаферезом. В некоторых случаях эффективно сочетание противовирусных препаратов с интерферонами.
При грибковых инфекциях, в частности криптококковых менингитах и гистоплазмозе, чаще используют амфотерицин В. Этот полиеновый антибиотик связывается со специфическим белком мембраны оболочки грибов и простейших, деформируя ее, что приводит к выходу калия и ферментов и соответственно гибели клетки. Чаще используют внутривенно по 0,1 мг в 1 мл 5 % раствора глюкозы, может быть эффективным эндолюмбальное введение. Препарат высокотоксичен, наиболее опасно нарушение функции почек. Поэтому использовать его рекомендуют только при полной уверенности в серологически подтвержденном диагнозе.
При токсоплазмозе ЦНС используют сочетание хлоридина (пириметамина) и сульфаниламидов короткого действия (сульфазин, сульфадиазин, сульфадимезин). Эти препараты влияют на обмен фолиевой кислоты, оказывая совместное бактерицидное действие. При туберкулезных поражениях используются обычные дозировки противотуберкулезных препаратов. Предпочтение отдается хорошо проникающему через ГЭБ изониазиду (300 мг в день peros), реже используют рифампицин (600 мг в день peros) и стрептомицин (0,75 г внутримышечно 6 раз в день). Лимфома ЦНС поддается агрессивной радиационной терапии, без которой смерть больного может наступить в течение 2 нед. Медикаментозное лечение больных нейроСПИДом должно сочетаться с полноценным питанием для полдержания массы тела, вопросы питания должны быть рассмотрены уже при обнаружении позитивной реакции на ВИЧ. Некоторые виды диет с низким содержанием белка могут быть опасны для таких больных, так как подавляется гуморальный иммунитет.
Профилактика Оппортунического заболевания нервной системы при ВИЧ-инфекции:
К каким докторам следует обращаться если у Вас Оппортунистические заболевания нервной системы при ВИЧ-инфекции:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Оппортунического заболевания нервной системы при ВИЧ-инфекции, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Что провоцирует / Причины Токсоплазмозного энцефалита:
Возбудитель - Toxoplasma gondii относится к простейшим. Тип Protozoa. Подтип Sporozoa (обычно образуют споры; реснички, жгутики или псевдоподии отсутствуют). Класс Telosporea (имеется фаза полового размножения). Подкласс Coccidea (трофозоиты располагаются внутриклеточно, имеют "верхушечный комплекс"). Отряд Eucoccideia (жизненный цикл включает чередование бесполого - шизогония и полового размножения - спорогония). Подотряд Eimeriina (половая стадия в эпителии кишки у позвоночных животных; один хозяин или чередование двух хозяев; спорозоиты находятся в "споре"). Вид Toxoplasma gondii. Существует в трех основных формах: трофозоиты (эндозоиты), цисты и ооцисты. Трофозоиты имеют размеры 4-7 мкм в длину и 2-4 мкм в ширину, по форме напоминают полумесяц, хорошо окрашиваются по Романовскому. Они размножаются внутриклеточно во всех клетках млекопитающих за исключением безъядерных (эритроциты) и обнаруживаются в тканях в острой стадии инфекции. Скопление трофозоитов внутри одной клетки называют псевдоцистой. На трофозоиты активно воздействуют различные химиопрепараты (хлоридин, сульфаниламиды, макролиды и др.), они нестойки вне клетки и во внешней среде, быстро погибают при высушивании, прогревании, под влиянием дезинфицирующих средств.
Цисты формируются в организме хозяина, имеют собственную плотную оболочку. Размеры их до 100 мкм, внутри содержится 3000-5000 паразитов и более. Через плотную оболочку цист не проникают ни антитела, ни лекарственные препараты. Они очень устойчивы к различным воздействиям и в организме хозяина сохраняются десятки лет. Большая часть их локализуется в скелетных мышцах, миокарде, центральной нервной системе.
Ооцисты представляют собой образования овальной формы диаметром 10-12 мкм. Они формируются в слизистой оболочке тонкой кишки некоторых представителей семейства кошачьих и выделяются с испражнениями. Сроки появления ооцист в испражнениях кошки зависят от характера инфицирования и составляют от 3 до 24 дней. Экскреции продолжаются от 7 до 20 дней, за сутки с испражнениями может выделяться до 10 млн ооцист. Споруляция в выделенных фекалиях происходит через 2-3 дня (при температуре 24°С); она не реализуется при температуре ниже 4°С и выше 37°С. Ооцисты при благоприятных условиях сохраняются во внешней среде до 1 года и более. Именно они играют основную роль в передаче инфекции.
Культивируются токсоплазмы путем заражения лабораторных животных (белые мыши, морские свинки, кролики, хомяки), в развивающихся куриных эмбрионах, а также в культуре тканей. Имеются различные штаммы токсоплазм, некоторые из них отличаются высокой вирулентностью (штамм RH) и быстро приводят к гибели лабораторных животных, другие - маловирулентные (авирулентные) обычно не вызывают заметных клинических проявлений болезни.
Патогенез (что происходит?) во время Токсоплазмозного энцефалита:
Воротами инфекции чаще служат органы пищеварения, хотя известны случаи внутрилабораторных заражений высоковирулентными штаммами токсоплазм при повреждении кожи (пипеткой или шприцем с культурой токсоплазм). Внедрение возбудителя происходит в нижних отделах тонкой кишки, затем с током лимфы токсоплазмы достигают регионарных (мезентериальных) лимфатических узлов. Здесь развиваются воспалительные изменения с формированием инфекционных гранулем, напоминающих по клеточному составу туберкулезные или бруцеллезные гранулемы. Мезентериальные лимфатические узлы значительно увеличиваются. Затем токсоплазмы попадают в кровь, разносятся по всему организму и фиксируются в различных органах и тканях (печень, селезенка, лимфатические узлы, нервная система, глаза, миокард, скелетные мышцы). В этих органах образуются скопления паразитов в виде цист, которые могут сохраняться в организме десятки лет и даже пожизненно. В местах фиксации возникают воспалительные очаги, а в некоторых органах (нервная система, скелетные мышцы) - очажки некроза, в которых затем откладываются соли кальция и образуются кальцинаты.
В результате жизнедеятельности паразита и выделения антигенов и аллергенов наступает аллергическая перестройка организма (по типу реакций гиперчувствительности замедленного типа) и вырабатываются антитела, которые выявляются в различных иммунных реакциях (РСК, реакция с красителем Сэбина-Фельдмана, РПГА, ИФА и др.). В развитии иммунитета большое значение имеют как клеточные, так и гуморальные факторы. Наличие антител предохраняет от нового заражения даже высоковирулентными штаммами токсоплазм и обусловливает бессимптомное (латентное) течение токсоплазмоза у большинства инфицированных лиц. При ослаблении защитных сил организма и снижении напряженности иммунитета может наступить обострение заболевания (переход латентной формы в манифестную).
Обострение хронического токсоплазмоза, как правило, провоцируется интеркуррентными заболеваниями (грипп, ОРЗ, пневмонии и др.) и может наблюдаться иногда спустя длительное время (до 10-20 лет) после инфицирования. Описаны обострения с развитием тяжелого токсоплазмозного энцефалита после лечения лиц с латентным токсоплазмозом цитостатиками и иммунодепрессантами. В последние годы важное значение приобрела проблема генерализации латентного токсоплазмоза у ВИЧ-инфицированных. В этих случаях токсоплазмоз приобретает острое злокачественное течение с развитием некротического локализованного или диффузного менингоэнцефалита, в процесс вовлекаются глаза и многие органы (сердце, печень, легкие). На фоне развернутой картины СПИДа наслоившееся обострение (генерализация токсоплазмоза) может приводить к гибели больных.
Основная роль в развитии токсоплазмоза у лиц с иммуносупрессией отводится нарушениям продукции цитокинов. Показано, что при развитии токсоплазмоза на фоне ВИЧ-инфекции резко снижается как концентрация сывороточного гамма-интерферона, так и его способность активировать макрофаги. К факторам защиты относят интерлейкин-12, ФНО-, CD-8+, к факторам, способствующим генерализации заболевания - интрелейкины-4, -6, -10.
В патогенезе манифестных форм хронического токсоплазмоза основную роль играет развитие реакций гиперчувствительности замедленного типа к антигенам токсоплазм и продуктам их жизнедеятельности.
Симптомы Токсоплазмозного энцефалита:
Токсоплазмозный энцефалит служит основной причиной заболеваемости и смертности у больных со СПИДом. Заболеваемость токсоплазмозным энцефалитом среди больных этой категории, имеющих антитела к токсоплазмам, колебалась от 6 до 12%. На основании этого полагают, что имелось приблизительно 170 случаев токсоплазмозного энцефалита среди 7000 больных СПИДом, о которых сообщалось в 1984 г., а развитие еще 150 случаев ожидается среди 7000 больных, которые должны заболеть СПИДом по прогнозу на 1985 г.
Частота случаев токсоплазмозного энцефалита у больных со СПИДом и энцефалитом, как сообщалось, колебалась от 25 до 80%. Диагноз токсоплазменного энцефалита следует иметь в виду у лиц с заболеванием центральной нервной системы, не относящихся к группе риска по СПИДу, так как гетеросексуальная передача вируса лейкоза Т-клеток человека (HTLV III) приводит к развитию СПИДа у лиц, не относящихся к типичным группам повышенного риска.
К внешним признакам и симптомам токсоплазменного энцефалита у больных со СПИДом относят озноб, лихорадку, головную боль, припадки, депрессию и неврологические нарушения; эти проявления могут возникать в сочетании с хориоретинитом. У большинства больных со СПИДом и токсоплазмозным энцефалитом в сыворотке отсутствуют специфические антитела, указывающие на наличие острого токсоплазмоза. Демонстрация повышения титра антител к токсоплазмам в спинномозговой жидкости, но не в сыворотке свидетельствует о токсоплазмозном энцефалите у больных со СПИДом.
Диагностика Токсоплазмозного энцефалита:
В спинномозговой жидкости выявляют плеоцитоз, повышение содержания белка и гипогликорахию; в препаратах из центрифугата спинномозговой жидкости могут быть обнаружены тахизоиты. При исследовании спинномозговой жидкости (или тканей мозга) на наличие вирусов методами культивирования необходимо тщательно контролировать клеточные культуры с целью обнаружения токсоплазм, также способных вызывать формирование бляшек или обширные цитопатические эффекты. Клеточные культуры могут быть окрашены красителем Гимзы.
При компьютерной томографии головного мозга наблюдаются признаки диффузного энцефалита и/или одного или нескольких очагов объемного поражения. Внутривенное введение контрастного вещества может выявить кольцевидные, узелковые, мишеневидные поражения в коре или белом веществе, при этом отмечается тенденция к локализации этих поражений глубоко в пределах базальных ганглиев. В начальной фазе инфекционного процесса отклонения от нормы на сканограммах головного мозга выявляются не всегда; иногда первые признаки нарушений впервые могут появиться спустя несколько недель после заражения.
Исследования с задержкой в 1 ч с двойной дозой контрастного вещества помогают выявить поражения, неразличимые на простых сканограммах. При возможности следует произвести биопсию пораженных участков головного мозга, обнаруженных на сканограммах, так как дифференциальная диагностика этих поражений включает энцефалиты, вызываемые грибками родов Candida и Aspergillus, микобактериями и Cryptococcus neoformans, равно как и многоочаговую лейкоэнцефалопатию и лимфому.
При стандартных методах окраски токсоплазмы обнаруживаются только в 50% биоптатов головного мозга от больных с токсоплазмозным энцефалитом. Однако при использовании специфических иммуногистологических методов окрашивания тахизоиты, цисты и/или антигены токсоплазм обнаруживают в биоптатах, полученных от большинства зараженных больных.
Если у больных СПИДом появляются неврологические признаки или симптомы, а на сканограмме головного мозга очаговых изменений не выявляется, однако отмечается положительный тест Сейбина-Фельдмана или высокий уровень IgG в реакции непрямой флюоресценции антител (НФА), целесообразно проведение пробного лечения токсоплазмозного энцефалита. Если при компьютерной томографии на сканограммах выявляются очаговые нарушения, антитела к токсоплазмам, а проведение биопсии затруднено локализацией очагов поражения или клиническим состоянием больного, следует начать предварительное лечение токсоплазмоза.
В подобных случаях положительный эффект от проводимого лечения, наблюдающийся в течение первых 7- 10 дней, подтверждает диагноз токсоплазмозного энцефалита. Если лечение осуществляли с применением кортикостероидов, признаки улучшения, выявленные рентгенографическими методами, не обеспечивают надежного свидетельства в пользу терапевтического эффекта.
Лечение Токсоплазмозного энцефалита:
При установлении диагноза энцефалита больной должен быть госпитализирован в специализированное (инфекционное) или неврологическое отделение. Назначают строгий постельный режим. Больной нуждается в постоянном наблюдении.
На догоспитальном этапе показано применение дегидратационных средств (лазикс, диакарб).
При выраженных менингеальных и энцефалитических симптомах (сильная головная боль, боль в мышцах, токсикоз, рвота, очаговые симптомы) вводят изотонический раствор натрия хлорида, раствор Рингера-Локка. Одновременно подкожно или внутримышечно вводят витамины группы В, аскорбиновую кислоту (не менее 1,5 г в сутки).
Если стандартная схема лечения с применением хлоридина (по 25 мг в сутки), трисульфапиримидина (по 6 - 8 г) или сульфадизина неэффективна, суточную дозу хлоридина следует увеличить до 50 мг. В случае развития у больного неблагоприятной реакции на сульфаниламидный препарат рекомендуется использовать только пириметамин в дозе 50 мг в сутки. Необходимо применять фолиевую кислоту в дозе до 15 мг в сутки, особенно когда отмечается депрессия костного мозга в результате воздействия хлоридина. Однако если депрессия костного мозга у больных со СПИДом обусловлена иммунными механизмами, профилактический прием фолиевой кислоты не устраняет лейкопению.
Профилактика Токсоплазмозного энцефалита:
Меры по профилактике инвазии включают вмешательство в цикл передачи, и их соблюдение особенно важно для больных с иммунодефицитом и серонегативных беременных женщин. Очень важно, чтобы больные из групп риска знали о том, как можно избежать заражения цистами (плохая кулинарная обработка мяса) и спорулированными ооцистами (при контактах с домашними кошками).
Для уничтожения цист мясо следует прогревать до 60°С или замораживать при - 20°С. (Бытовые морозильные камеры не способны создавать и поддерживать такую температуру.) После приготовления пищи из сырого мяса руки следует тщательно мыть; необходимо также мыть фрукты и овощи, которые могут быть загрязнены ооцистами. Обработка продуктов сухим жаром (66°С) или кипящей водой делает ооцисты неинфективными. Следует избегать контактов с экскрементами кошек.
Данных, позволяющих дать четкие рекомендации относительно использования цельной крови, переливания лейкоцитов или трансплантации органов в случае обнаружения у донора антител против токсоплазм нет. Вместе с тем не следует использовать кровь или продукты крови, полученные от лиц с наличием антител против токсоплазм, для переливания больным с иммуносупрессией, а органы для трансплантации серонегативным реципиентам следует брать от лиц с отрицательными серологическим реакциями на токсоплазмоз.
К каким докторам следует обращаться если у Вас Токсоплазмозный энцефалит:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Токсоплазмозного энцефалита, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Читайте также:

